Способ получения 1-алкокси-1-фенилэтанов
Иллюстрации
Показать всеИзобретение относится к способу получения 1-алкокси-1-фенилэтанов формулы I
где R=СН3, С2Н5, n-С3Н7, n-С4Н9, n-C5H11, n-С6Н13, n-C7H15, n-C8H17, n-C9H19, n-C10H21, которые могут быть использованы в качестве пластифицирующих агентов в хлорсодержащих полимерах, а также в качестве компонента катализаторов в процессах полимеризации и соолигомеризации олефинов. Способ заключается в каталитическом взаимодействии стирола со спиртами нормального строения ROH, где R - такое же, как указано выше, при температуре 80-120°С. При этом в качестве катализатора используют цеолит Beta в Н-форме, реакцию проводят при мольном соотношении стирол: спирт, составляющем 1:1-3, и количестве катализатора 5-10 мас.% в расчете на реакционную смесь. Способ позволяет получить целевые продукты с высоким выходом. 1 табл.
Реферат
Изобретение относится к области органической химии, в частности к способу получения 1-алкокси-1-фенилэтанов общей формулы I:
где R=СН3, С2Н5, n-С3Н7, n-С4Н9, n-C5Н11, n-С6Н13, n-C7H15, n-C8H17, n-С9Н19, n-C10H21.
Соединения АrСН(СН3)ОR (где R, например, алкил-, алкенил-, арил-, алкарил- и циклоалифатические группа) обладают высокой термической стабильностью и могут быть использованы в качестве пластифицирующих агентов в хлорсодержащих полимерах [Пат. США №2575444]. Эфиры I (где R=СН3, C2H5) предложено применять в качестве компонента катализаторов в процессах полимеризации и соолигомеризации олефинов [Пат. США №4762898]. Установлено, что 1-этокси-1-фенилэтан более эффективен, чем хлорбензолы, в качестве инсектицида для защиты от моли [Пат. Японии №57062202].
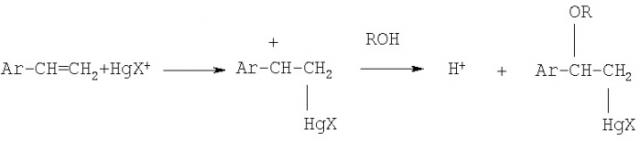
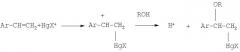
В работах [H.C.Brown, J.T.Kurek, M.H.Rei, K.L.Thomson // J.Org.Chem. 1984. 49. 2551-2557; H.C.Brown, J.T.Kurek, M.H.Rei, K.L.Thomson // J.Org.Chem. 1985. 50. 1171-1174] описано получение 1-алкокси-1-фенилэтанов реакцией алкоксимеркурирования-демеркурирования стирола в спиртах ROH (где R=Me, Et, i-Pr, t-Bu). Алкоксимеркурирование осуществляется различными ртутными солями (Hg(OAc)2, Hg(CF3COO)2, Hg(NO3)2 и др.) при 22°С. Последующее демеркурирование проводят in situ щелочным раствором NaBH4:
Конверсия стирола максимальна в случае взаимодействия с метиловым спиртом (до 99%); с изопропиловым и трет-бутиловым спиртами конверсия стирола ниже и составляет 40-90%, кроме того, наряду с эфиром образуется спирт АrСН(СH3)ОН.
Недостатками этого способа является многостадийность, использование в качестве катализатора высокотоксичных солей ртути. Кроме того, процесс проводят с использованием больших количеств щелочи (NaOH), в результате чего образуются значительные объемы стоков.
В патенте [Пат. США №2248518] описано получение 1-алкокси-1-фенилэтанов взаимодействием стирола со спиртами в присутствии кислот (Н2SO4, НСlO4, CICH2COOH) в растворе изопропилбензола:
где R=СН3, С2Н5, i-С3Н7, n-C4Н9.
Реакцию проводят при температуре от 50 до 150°С в автоклаве (в случае метанола и этанола) или в колбе. Концентрация катализатора составляет не более 5%, время реакции 6-10 часов. Сложность осуществления данной реакции состоит в том, что в присутствии кислотных катализаторов с высокой скоростью протекает олигомеризация стирола. Авторы отмечают, что параллельно с эфирами образуется значительное количество олигомеров стирола. Для уменьшения выхода олигомеров предложено использовать ингибитор полимеризации - пирогаллол. Конверсия стирола составляет 50-90%, выходы эфиров 60-80%.
К недостаткам способа относится: невысокие выходы эфиров; необходимость стадий нейтрализации кислотного катализатора, отмывки и осушки реакционной массы; использование растворителя, который необходимо регенерировать - по окончании реакции; большая длительность реакции.
Наиболее близким к предлагаемому изобретению является описанный в [S.P.Verevkin, A.Heintz // J.Chem.Eng.Data. - 2001. - 46. - №4. - Р.984-990] способ получения алкилфенилэтиловых эфиров взаимодействием стирола со спиртами нормального строения - метиловым, этиловым, пропиловым, бутиловым - в присутствии катионообменной смолы Amberiyst-15 в Н-форме. Реакцию проводили в жидкой фазе при температурах 70-150°С, количество катализатора составляет 10 мас.%. В опытах с максимальным выходом эфира (77-87 мол.%) конверсия стирола составляла 78-87 мол.%.
К недостаткам этого способа можно отнести недостаточно высокую активность катализатора в реакции получения эфиров стирола. Кроме того, известна низкая термическая стабильность катионообменных смол при повышенных температурах (120-150°С).
Задачей настоящего изобретения является увеличение выхода 1-алкокси-1-фенилэтанов.
Это достигается тем, что способ получения 1-алкокси-1-фенилэтанов формулы С6Н5СН(СН3)ОR (R=СН3, С2Н5, n-С3Н7, n-С4H9, n-С5Н11, n-С6Н13, n-C7H15, n-C8H17, n-C9H19, n-C10H21) взаимодействием стирола со спиртами нормального строения ROH (R=СН3, C2H5, n-С3Н7, n-С4Н9, n-C5H11, n-С6Н13, n-C7H15, n-C8H17, n-C9H19, n-C10H21) в присутствии кислотных катализаторов осуществляют согласно изобретению в присутствии цеолита Beta в Н-форме. Реакцию проводят при мольном соотношении стирол: спирт =1:1÷3, температуре 80÷120°С и количестве катализатора 5÷10 мас.% (в расчете на реакционную смесь).
После окончания реакции катализатор отделяют фильтрованием. Его можно использовать многократно без потери активности. Полученные 1-алкокси-1-фенилэтаны выделяют из реакционной массы вакуумной перегонкой.
Сравнительный анализ заявляемого решения с прототипом показывает, что заявляемый способ отличается от прототипа тем, что взаимодействие стирола с н-спиртами проводят в присутствии цеолита Beta в Н-форме. Процесс этерификации осуществляют при мольном соотношении стирол: спирт =1:1÷3, температуре 80÷120°С и количестве катализатора 5÷10 мас.% (в расчете на реакционную смесь). Конверсия стирола составляет 80,7÷93,7 мол.%, селективность образования 1-алкокси-1-фенилэтанов - 90,0÷100 мол.%, димеров стирола - 0÷10,0 мол.%.
В указанных условиях олигомеры стирола или вообще не образуются, или присутствуют в небольших количествах (не более 10,0 мол.%). Максимальная степень олигомеризации стирола (n) составляет 2. Тримеры и более высокомолекулярные соединения отсутствуют.
Цеолит типа Beta - это алюмосиликатный материал с типичной элементарной ячейкой, описанной формулой Na8(AlO2)8(SiO2)40·24H2O и четкой кристаллической структурой. Относится к высококремнеземным цеолитам. Пористая структура цеолита Beta представляет собой трехмерную систему соединенных между собой прямолинейных каналов двух видов, образованных 12-членными кольцами с диаметром входного окна 0,55×0,55 нм и 0,64×0,75 нм.
По своим физико-химическим свойствам цеолит типа Beta близок к пентасилам и так же, как пентасилы, отличается высокой химической и термической стабильностью, однородностью каталитически активных центров внутри каналов цеолита.
Цеолит типа Beta выпускается в промышленном масштабе. Используется в составе цеолитсодержащих катализаторов для некоторых нефтехимических и химических процессов, например среднетемпературной изомеризации бензиновых фракций [М.А.Порублев. Освоение промышленных технологий производства новых катализаторов нефтепереработки и нефтехимии // Катализ в промышленности. 2001. №3, с.41-45]. Сообщается также о разработке метода получения алкилата (высокооктанового компонента бензинов) алкилированием изобутана изобутиленом в присутствии цеолита Beta [А.А.Кубасов. Цеолиты в катализе сегодня и завтра // Соросовский образовательный журнал. 2000. т.6, №6, с.44-51]. Известно использование цеолита Beta для синтеза димеров стирола [Пат. РФ №2317969, 2006; пат. РФ №2322429, 2006].
Использование цеолита Beta для синтеза 1-алкокси-1-фенилэтанов не известно.
Предлагаемый способ осуществляют следующим образом.
Катализатор цеолит типа Beta в NН4-форме синтезирован в ОАО «Ангарский завод катализаторов и органического синтеза» по ДК 04-21303-008-2004. Мольное отношение SiO2/Аl2O3 составляет 18; степень кристалличности более 85%. Для перевода его в Н-форму катализатор прокаливают в атмосфере воздуха при 540°С в течение 4 ч. Взаимодействие стирола со спиртами проводят в термостатированных металлических автоклавах или стеклянных реакторах. В автоклав (колбу) загружают стирол и спирт в мольном соотношении 1:1÷3, катализатор - цеолит Beta, в количестве 5-10 мас.% (на реакционную массу). Реакцию проводят при постоянном перемешивании при температуре 80-120°С в течение 1-3 ч. После окончания реакции фильтрованием отделяют катализатор. Реакционную массу разгоняют в вакууме. Анализ реакционной массы и продуктов осуществляют методом ГЖХ на хроматографе марки HRGS 5300 Mega Series "Carlo Erba" с пламенно-ионизационным детектором (капиллярная колонка 25 м, фаза SE-30, программирование температуры от 50 до 280°С со скоростью подъема 8°С/мин, температура детектора 250°С, температура испарителя 300°С, газ-носитель - гелий, 30 мл/мин).
Предлагаемый способ иллюстрируется следующими примерами (табл.1).
ПРИМЕР 1. В автоклав загружают 5,7 мл (0,05 моль) стирола и 4,0 мл (0,10 моль) метилового спирта, 0,84 г цеолита Beta. Автоклав помещают в термостат. Реакцию проводят при постоянном перемешивании при температуре 110°С в течение 3 ч. Реакционную массу отфильтровывают от катализатора и разделяют вакуумной разгонкой. Получают 5,5 г продукта I (R=СН3). Конверсия стирола составляет 83,5 мол.%, димеры стирола отсутствуют, селективность по 1-метокси-1-фенилэтану - 100% (т.кип. 78,6°С/50 мм рт.ст.; спектр ЯМР 1Н (δ, м.д.): 1.36 (d, 3, СН3), 3.18 (s, 3, ОСН3), 4.17 (q, 1, CH), 7.3 (m, 5, ArH); спектр ЯМР 13С (J, м.д.): 19.00 (С-10), 55.67 (С-9), 69.00 (С-7), 125.51-127.32 (С-2-6), 144.05 (С-1)).
ПРИМЕР 2. В термостатируемую колбу загружают 5,7 мл (0,05 моль) стирола и 4,6 мл (0,05 моль) бутилового спирта, 0,45 г цеолита Beta. Реакцию проводят при постоянном перемешивании при температуре 120°С в течение 1 ч. Реакционную массу отфильтровывают от катализатора и разделяют вакуумной разгонкой. Получают 8,2 г продукта I (R=n-С4Н9). Конверсия стирола составляет 93,5 мол.%, селективность по 1-бутокси-1-фенилэтану - 97,1% (т.кип. 95,1°С/10 мм рт.ст.; спектр ЯМР 1H (δ, м.д.): 0.86 (t, 3, СН3), 1.33 (m, 2, CH;2), 1.35 (m, 2, CH2), 1.45 (d, 3, СН3), 3.42 (q, 2, OCH2), 4.30 (q, 1, CH), 7.3 (m, 5, ArH); спектр ЯМР 13С (δ, м.д.): 13.78 (С-12), 18.90 (С-11), 21.15 (С-13), 32.65 (С-10), 69.75 (С-7), 72.86 (С-9), 24.19 (С-12), 124.97-127.04 (С-2-6), 143.03 (С-1)).
ПРИМЕРЫ 3-4. Аналогично примеру 1. Условия и результаты примеров представлены в таблице 1.
ПРИМЕРЫ 5-11. Аналогично примеру 2. Условия и результаты примеров представлены в таблице 1.
| Таблица 1Взаимодействие стирола со спиртами в присутствии цеолита Beta | ||||||||
| Пример | Спирт | Условия реакции | Конверсия стирола, мол.% | Селективность, % | ||||
| [kt], мас.% | стирол: спирт, моль | T, °С | τ, ч | |||||
| эфир | димеры стирола | |||||||
| 3 | С2Н5OН | 10 | 1:2 | 110 | 3 | 84,0 | 100 | 0 |
| 4 | С3Н7OН | 10 | 1:2 | 110 | 2 | 85,1 | 100 | 0 |
| 5 | С4H9ОН | 10 | 1:3 | 80 | 2 | 91,7 | 97,5 | 2,5 |
| 6 | С5Н11ОН | 5 | 1:2 | 110 | 1 | 93,2 | 96,3 | 3,7 |
| 7 | С6Н13ОН | 10 | 1:2 | 120 | 1 | 93,7 | 95,8 | 4,2 |
| 8 | C7H15OH | 10 | 1:2,5 | 110 | 1 | 90,1 | 95,0 | 5,0 |
| 9 | C8H17OH | 10 | 1:2,5 | 110 | 2 | 81,4 | 92,1 | 7,9 |
| 10 | С9Н19OН | 10 | 1:2,5 | 110 | 2 | 81,0 | 91,8 | 8,2 |
| 11 | C10H21OH | 10 | 1:2,5 | 110 | 2 | 80,7 | 90,0 | 10,0 |
Способ получения 1-алкокси-1-фенилэтанов формулы I где R=СН3, С2Н5, n-С3Н7, n-С4Н9, n-С5Н11, n-С6Н13, n-C7H15, n-C8H17, n-C9H19, n-С10Н21, каталитическим взаимодействием стирола со спиртами нормального строения ROH, где R - такое же, как указано выше, при температуре 80-120°С, отличающийся тем, что в качестве катализатора используют цеолит Beta в Н-форме, реакцию проводят при мольном соотношении стирол:спирт, составляющем 1:1-3, и количестве катализатора 5-10 мас.% в расчете на реакционную смесь.