Антитела против рецептора fc riib и их применение
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описано выделенное анти-FcγRIIB/анти-FcεRIα биспецифическое антитело, неспособное к перекрестному связыванию с FcγRIIA человека. Предложены способы ингибирования иммунного ответа у млекопитающего, подавления выброса гистамина, связанного с иммунным ответом у млекопитающего, и лечения, включающие введение описанного биспецифического антитела. Представлены композиция для подавления активности FcεRI в выделенных клетках млекопитающих, композиция, используемая для активации FcγRIIB в выделенных клетках млекопитающих, экспрессирующих FcγRIIB, путем совместной агрегации FcγRIIB с FcεRIα и композиция, использующаяся для ингибирования экспрессии рецептора FcεRI в выделенных клетках, содержащие в качестве активного вещества описанное антитело. Изобретение позволяет получать биспецифические анти-FcγRIIB/анти-FcεRIα антитела. 14 н. и 35 з.п. ф-лы, 65 ил., 2 табл.
Реферат
Настоящее изобретение относится к заявке, не являющейся временно зарегистрированной в соответствии с 37 CFR § 1.53 (b) (1), по которой испрашивается приоритет в соответствии с 35 U.C.S. § 119 (e) серийной заявки на патент США № 60/606851, поданной 2 сентября 2005 года, полное содержание которой приведено в настоящем описании в качестве ссылки в полном объеме.
Область техники, к которой относится изобретение
Настоящее изобретение относится к антителам, которые предпочтительно связываются с FcγRIIB человека в сравнении с FcγRIIA человека, а также к применению указанных антител.
Предпосылки создания изобретения
Антитело связывается с антигеном и нейтрализует его, предотвращая его связывание с эндогенной мишенью (например, рецептором или лигандом) или индуцируя эффекторные ответы, которые приводят к удалению антигена. Для эффективного удаления и/или разрушения чужеродных антигенов в организме антитело должно обладать как высокой аффинностью к антигену, так и эффекторными функциями. Антитела, обладающие специфичностью (такие как, например, биспецифические антитела), могут использоватся для опосредования комплементарных или синергических ответов на множественные антигены.
Эффекторные функции антитела опосредованы Fc-участком антитела. Эффекторные функции подразделяются на две категории: (1) эффекторные функции, которые проявляются после связывания антитела с антигеном (указанные функции включают участие комплементного каскада или клеток, несущих Fc-рецептор (FcR)); и (2) эффекторные функции, которые работают независимо от связывания с антигеном (такого рода функции определяют персистентный характер антитела в кровотоке и его способность проходить через клеточные барьеры путем трансцитоза) (см., например, Ward and Ghetie, 1995, Therapeutic Immunology 2:77-94). Взаимодействия антител и комплексов антитело-антиген с клетками иммунной системы вызывают такие ответы, как, например, антителоопосредованная клеточная цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC) (см. обзор Daërоn, 1997, Annu. Rev. Immunol. 15:203-234; Ward et al., выше; Ravetch et al., 1991, Annu. Rev. Immunol. 9: 457-492; и Ravetch et al., 2000, Science 290: 84-89).
Поскольку Fc-рецепторы опосредуют эффекторную функцию антитела посредством связывания с Fc-участком соответствующего рецептору антитела, FcR определяются по их специфичности к иммуноглобулиновым изотипам: Fc-рецепторы, специфичные для IgG антител, обозначаются как FcγR; Fc-рецепторы, специфичные для IgE антител, обозначаются как FcεR; Fc-рецепторы, специфичные для IgA антител, обозначаются как FcαR и т.п.
Идентифицированы три подкласса FcγR: FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16). Каждый подкласс FcγR кодируется двумя или тремя генами, которые подвергаются альтернативному РНК-сплайсингу, что ведет к образованию множественных транскриптов и определяет наличие большого разнообразия изоформ FcγR. Три гена, кодирующих молекулы FcγRI подкласса (FcγRIa, FcγRIb и FcγRIc), сгруппированы в кластер на участке 1q21.1 длинного плеча хромосомы 1; гены, кодирующие изоформы FcγRII (FcγRIIa, FcγRIIb и FcγRIIc), локализованы на участке 1q23-24; и два гена, кодирующие изоформы FcγRIII человека (FcγRIIIa и FcγRIIIb), сгруппированы в кластер на участке 1q22. FcγRIIc формируется в результате неравного генетического перекреста между FcγRIIA и FcγRIIB и состоит из внеклеточного участка FcγRIIB и цитоплазматического участка FcγRIIA.
FcγRIIA кодирует трансмембранный рецептор FcγRIIA1. Альтернативный сплайсинг РНК приводит к образованию FcγRIIA2, который не содержит трансмембранный участок. Аллельные варианты гена FcγRIIA определяют возможность появления высокоотзывчивых молекул (HR) или низкоотзывчивых молекул (LR), которые отличаются по своей способности связываться с IgG. Молекулы HR и LR FcγRIIA отличаются двумя аминокислотами, соответствующими положениям 27 и 131. FcγRIIB кодирует сплайсинговые варианты FcγRIIB1, FcγRIIB2 и FcγRIIB3. FcγRIIB1 и FcγRIIB2 отличаются вставкой из 19 аминокислот в цитоплазматическом домене FcγRIIB1; FcγRIIB3 идентичен FcγRIIB2, но не содержит информацию для предположительного сайта сигнала расщепления пептидазой.
Рецепторы также различаются по их аффинности относительно IgG. FcγRI обладают высокой аффинностью к IgG; значение Ka = 108-109 M-1 (Ravetch et al., 2001, Annu. Rev. Immunol. 19: 275-290) и могут связываться с мономерным IgG. Тогда как FcγRII и FcγRIII демонстрируют относительно слабую аффинность в отношении мономерного IgG, Ka≤107 M-1 (Ravetch et al., выше) и эффективно взаимодействуют только с многомерными иммунными комплексами. Различные подтипы FcγR экспрессируются на разных типах клеток (см. обзор Ravetch J.V. et al., Annu. Rev. Immunol. 9: 457-492). Например, только FcγRIIIA экспрессируется на NK-клетках. Связывание антител с указанным рецептором приводит к появлению ADCC активности, характерной для NK-клеток. FcγRIIIB человека обнаружен только на нейтрофилах, тогда как FcγRIIIA обнаружен на макрофагах, моноцитах, природных клетках-киллерах (NK) и в субпопуляции T-клеток. С другой стороны, рецепторы FcγRII с низкой аффинностью для мономерного IgG представляют собой наиболее широко распространенные FcR, которые обычно экспрессируются совместно на одних и тех же клетках. FcγRII (кодируемый CD32) экспрессируется в значительной степени на В-клетках, моноцитах, ганулоцитах, тучных клетках и тромбоцитах, тогда как некоторые T-клетки экспрессируют рецептор на меньших уровнях (Mantzioris, B. X. Ravetch et al., 1993, J. Immunol. 150: 5175-5184; и Zola, H. et al., 2000, J. Biol. Regul. Homeost. Agents, 14: 311-316). Например, рецептор FcγRII человека встречается преимущественно на B-клетках, миелоидных клетках и тучных клетках (Ravetch J. V. et al., 2000, Science 290: 84-89).
Изоформы FcγRIIA и FcγRIIB содержат очень близкие внеклеточные домены (идентичность аминокислотной последовательности составляет примерно 92%), но различаются своими цитоплазматическими участками, что приводит к их функциональным различиям, определяющим их как «активирующие рецепторы» (FcγRIIA) и «ингибирующие рецепторы» (FcγRIIB). Рецепторы FcγRI и FcγRIII также функционируют в качестве активирующих рецепторов. Указанные активирующие рецепторы несут в цитоплазматическом домене тирозинсодержащий мотив активации иммунорецептора из 19 аминокислот (ITAM). ITAM последовательности запускают активацию семейств тирозинкиназ src и syk, которые, в свою очередь, активируют множество клеточных медиаторов, таких как киназы P13K, PLCγ и Tec. В результате таких стадий активации повышается внутриклеточное высвобождение кальция из эндоплазматического ретикулюма и открывается сопряженный с данной функцией кальциевый канал, образуя тем самым длительный кальциевый ответ. Указанные потоки кальция важны для экзоцитоза гранулярного содержимого, стимуляции фагоцитоза, ответов по типу ADCC и для активации специфических ядерных факторов транскрипции.
Клеточные ответы, опосредованные активацией FcγR, регулируются ингибирующим рецептором FcγRIIB при поддержании периферической толерантности за счет регуляции порогов активации ответа и в конечном счете терминации IgG-опосредованной стимуляции эффектора (Ravetch J.V. et al., Annu. Rev. Immunol. 19: 275-290 (2001)). Такая регуляция инициируется сшиванием активирующих рецепторов с ингибирующими рецепторами FcγRIIB через антиген-IgG-антительный иммунный комплекс (см., например, Ravetch J.V. et al., 2000, выше). Сшивка с ITAM-содержащим активирующим рецептором ведет к фосфорилированию тирозина в пределах тирозинсодержащего мотива ингибирования иммунорецептора из 13 аминокислот (ITIM) в цитоплазматическом домене FcγRIIB. Такая «активация»
FcγRIIB инициирует рекрутмент специфической SH-2-содержащей инозитполифосфат-5-фосфатазы (SHIP). SHIP катализирует гидролиз мембранного инозитлипида PIP3, препятствуя тем самым активации киназ PLCγ и Tec и устраняя длительный кальциевый поток, опосредованный потоком кальция через капацитанс-сопряженный канал. Тогда как FcγRIIB выполняет отрицательную регуляцию ITAM-содержащих активирующих рецепторов (Daërоn, M. et al., Immunity. 3: 635-646), было показано, что он оказывает отрицательную регуляцию тирозинкиназного рецептора (RTK) c-kit в процессе контроля RTK-опосредованной клеточной пролиферации (Malbec, О. et al., 1999, J. Immunol. 162: 4424-4429).
Антитела, которые связываются с рецепторами FcγRII, описаны в литературе (Looney et al., (1986) J. Immunol. 136: 1641-1647; Zipf et al., (1983) J. Immunol. 131: 3064-3072; Pulford et al., (1986) Immunology 57: 71-76: Greenman et al., (1991), Mol. Immunol. 28: 1243-1254; Ierino et al., (1993) J. Immunol. 150: 1794-1803; Weinrich et al., (1996) Hybridoma, 15: 109-116; Sonderman et al., (1999) Biochemistry, 38: 8469-8477; Lyden, T. W. et al., (2001) J. Immunol. 3882-3889; а также международная публикация № WO 2004/016750, опубликованная 26 февраля 2004 года). Высокоаффинный рецептор IgER1, FcεRI, вовлечен в сигнальный путь индуцированного антигеном высвобождения гистамина при связывании IgE, например, в ходе аллергической реакции (von Bubnoff, D. et al., (2003) Clinical & Experimental Dermatology. 28(2): 184-187). Было показано, что рецепторы FcγRIIB взаимодействуют с FcεRI и ингибируют его активность через домен FcγRIIB ITIM (Daeron, M. et al., (1995) J. Clin. Invest. 95: 577-585; Malbec, O. et al., (1998) J. Immunol 169: 1647-1658); и Tam, S. W. et al., (2004) Allergy 59: 772-780). Антитела, которые специфически связываются с FcγRIIB человека, необходимы не только для исследовательских целей, но также для влияния на активность FcγRIIB и FcεRI при лечении заболеваний.
Краткое описание сущности изобретения
Настоящее изобретение относится к антигенсвязывающему полипептиду или антителу, которые селективно связываются с FcγRIIB человека. Антигенсвязывающий полипептид или антитело по настоящему изобретению связываются с FcγRIIB человека со значительно более высокой аффинностью, чем с другими FcγR человека, и в некоторых вариантах осуществления они по существу не способны к перекрестной реакции с FcγRIIA человека.
В некоторых вариантах осуществления антигенсвязывающий полипептид или антитело по настоящему изобретению, которые селективно связываются с FcγRIIB человека, содержат по меньшей мере один или несколько CDR (гипервариабельные участки) SEQ ID NO: 1, 2, 3, 4, 5 и 6, а в других вариантах осуществления включает CDR тяжелой цепи SEQ ID No: 1, 2 и 3 и/или CDR легкой цепи SEQ ID No: 4, 5 и 6. В других вариантах осуществления антитело по настоящему изобретению включает один или несколько CDR, которые представляют собой вариант одного или нескольких CDR из SEQ ID No: 1, 2, 3, 4, 5 и 6, где по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичен аминокислотной последовательности одного или нескольких CDR SEQ ID NO: 1, 2, 3, 4, 5 и 6. В других вариантах осуществления вариант антигенсвязывающего полипептида или антитела связывается с FcγRIIB с аффинностью, находящейся в пределах от ниже примерно в 10 раз до примерно по меньшей мере в 2 раза, по меньшей мере в 3 раза, по меньшей мере в 5 раз, по меньшей мере в 10 раз, по меньшей мере в 50 раз выше аффинности антитела 5А6 в отношении FcγRIIB, при этом оно по существу не способно к перекрестной реакции с FcγRIIA человека. В других вариантах осуществления антигенсвязывающий полипептид или антитело по настоящему изобретению включает вариабельный домен тяжелой цепи SEQ ID NO: 7 и/или вариабельный домен легкой цепи SEQ ID NO: 8.
В некоторых вариантах осуществления антигенсвязывающий полипептид или антитело по настоящему изобретению представляет собой моноклональное антитело, химерное антитело или гуманизированное антитело, или фрагмент моноклонального, химерного или гуманизированного антитела. В некоторых вариантах осуществления антигенсвязывающий полипептид или антитело по настоящему изобретению, включающий моноклональное, химерное или гуманизированное или полиспецифичные антитела или их фрагменты, получают из антитела, продуцируемого гибридомной клеточной линией с номером доступа в АТСС PTA-4614.
Антигенсвязывающие полипептиды или антитела по настоящему изобретению вводят с терапевтическими антителами или химиотерапевтическими агентами в способах лечения заболевания или расстройства, которое подвергается лечению терапевтическим антителом или химиотерапевтическим агентом.
Настоящее изобретение относится к выделенным биспецифическим антителам, содержащим антитело или антигенсвязывающий полипептид, который селективно связывается с FcγRIIB, включая описанные выше, и второе антитело или антигенсвязывающий полипептид, которые специфически связываются с активирующим рецептором, таким как FcεRI. В некоторых вариантах осуществления биспецифические антитела содержат вариант шарнирной области тяжелой цепи, неспособный к образованию дисульфидной связи между тяжелыми цепями.
Биспецифические антитела по настоящему изобретению можно использовать в способах ингибирования иммунных ответов и подавления высвобождения гистамина, например, связанного с аллергией, астмой и воспалением. В некоторых вариантах осуществления настоящего изобретения биспецифические антитела по настоящему изобретению можно использовать для активации рецептора FcγRIIB в клетках млекопитающих путем совместной агрегации рецептора FcγRIIB с активирующим рецептором в клетке. В некоторых вариантах осуществления клетки млекопитающего представляют собой клетки человека; в других вариантах осуществления клетки человека представляют Т-клетки, В-клетки, тучные клетки, базофилы, антигенпрезентирующие клетки, макрофаги и/или моноциты. В тех вариантах осуществления изобретения, в которых происходит ингибирование белка, опосредованного ITIM, такое ингибирование обычно затрагивает Т-клетки, В-клетки, тучные клетки, базофилы и антигенпрезентирующие клетки. В тех вариантах осуществления изобретения, когда ингибирование опосредовано FcγRIIB, такое ингибирование обычно затрагивает тучные клетки, базофилы, антигенпрезентирующие клетки, моноциты, макрофаги и В-клетки. В некоторых вариантах осуществления настоящего изобретения описываемые в нем биспецифические антитела используются для инактивации, ингибирования активности или для отрицательной регуляции экспрессии рецептора FcεRI. В тех вариантах осуществления, в которых FcεRI ингибируется или подвергается отрицательной регуляции, ингибирование или отрицательная регуляция в типичном случае происходит в тучных клетках, базофилах и антигенпрезентирующих клетках млекопитающего.
В одном из аспектов настоящее изобретение относится к композиции, содержащей выделенное анти-huFcγRIIB/анти-huFcεRI биспецифическое антитело в фармацевтическом носителе. В другом варианте осуществления настоящее изобретение относится к композиции, содержащей выделенное анти-huFcγRIIB/анти-huFcεRI биспецифическое антитело и выделенное анти-IgE антитело. Используемое соотношение биспецифического антитела анти-huFcγRIIB/анти-huFcεRI к анти-IgE антителу в объединенной композиции может быть определено известным способом для каждого пациента. Обычно это соотношение изменяется от примерно 0,01:1 до примерно 100:1. Антитела в композиции могут быть моноклональными, человеческими, гуманизированными или химерными.
В другом аспекте настоящее изобретение относится к терапевтическому способу лечения иммунного расстройства млекопитающего путем введения анти-huFcγRIIB/анти-huFcεRI биспецифического антитела. В одном из вариантов осуществления млекопитающее представляет собой пациента человека, такого как пациент, нуждающийся в лечении аллергического расстройства, астмы и/или воспаления. В другом варианте осуществления терапевтический способ также включает введение млекопитающему, страдающему иммунным расстройством, аллергией или астмой, нуждающемуся в ингибировании высвобождения гистамина, анти-huFcγRIIB/анти-huFcεRI биспецифического антитела по настоящему изобретению. В еще одном из вариантов осуществления анти-huFcγRIIB/анти-huFcεRI биспецифическое антитело по настоящему изобретению вводят в сочетании с анти-IgE антителом, где указанное введение может быть разделено некоторым интервалом времени или может быть одновременным. В одном из вариантов осуществления анти-IgE антитело представляет собой моноклональное антитело. В еще одном из вариантов осуществления анти-IgE антитело представляет собой Xolair®. В еще одном из вариантов осуществления биспецифическое антитело вводят в сочетании с анти-IgE антителом в качестве составной части терапевтического способа лечения имеющегося иммунного расстройства (например, в составе терапевтического режима), где биспецифическое антитело вводят отдельно (не в одно и то же время) от анти-IgE антитела. В другом варианте осуществления биспецифическое антитело по настоящему изобретению и анти-IgE антитело вводят в одно и то же время. Используемое отношение биспецифического антитела анти-huFcγRIIB/анти-huFcεRI к анти-IgE антителу при комбинированном введении (где введение осуществляют в раздельные периоды времени или в одно и то же время) может быть легко определено для каждого пациента. Для целей настоящего изобретения указанное соотношение может составлять от примерно 0,01:1 до примерно 100:1, и в каждом конкретном случае для конкретного пациента используемое соотношение определяют в рамках данного диапазона. Используемое соотношение может представлять, например, 0,05:1, 0,1:1, 0,5:1, 1:1, 1:0,5, 1:0,1 и 1:0,05, и не исключается такое значение используемого соотношения, которое может быть определено стандартными клиническими методами.
Настоящее изобретение, кроме того, относится к выделенной нуклеиновой кислоте, кодирующей антитело, вектор или клетку-хозяин, содержащую указанную нуклеиновую кислоту, к способу получения антитела, в котором предусмотрено культивирование клетки-хозяина и, необязательно, в котором также предусмотрено выделение антитела из культуры клеток-хозяев (например, из клетки-хозяина или культуральной среды, содержащей клетки-хозяева).
Краткое описание чертежей
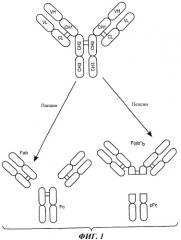
На фиг.1 схематически изображен нативный IgG. Дисульфидные связи показаны жирной линией между доменами CH1 и CL и двумя доменами CH2. V обозначает вариабельный домен; C обозначает константный домен; L обозначает легкую цепь и H обозначает тяжелую цепь.
На фиг.2А проиллюстрировано выравнивание предпочтительных аминокислотных последовательностей FcγRIIA человека (SEQ ID NO: 9); FcγRIIB2 человека (SEQ ID NO: 10). На фиг.2В показана аминокислотная последовательность FcγRIIB1 (SEQ ID NO: 11).
На фиг.3 проиллюстрировано выравнивание нативной последовательности Fc-участка антитела человека. Приведенные последовательности представляют собой нативную последовательность IgG1 человека (SEQ ID NO: 31), не относящуюся к А-аллотипу; нативную последовательность IgG2 человека (SEQ ID NO: 32); нативную последовательность IgG3 человека (SEQ ID NO: 33); и нативную последовательность IgG4 человека (SEQ ID NO: 34).
На фиг.4 показана диаграмма, иллюстрирующая относительную степень связывания антител с GST-huFcγRIIB в сравнении со слитыми белками GST-huFcγRIIA и GST-huFcγRIII.
На фиг.5 проиллюстрирована специфичность связывания путем выявления иммунофлуоросцентного связывания антител с клетками CHO, экспрессирующими GPI-huFcγRIIB, в сравнении с клетками CHO, экспрессирующими GPI-huFcγRIIA.
На фиг.6-9 представлены кривые аффинности связывания, относящиеся к связыванию разных анти-FcγRII (CD32) МАт с GST-huFcγRIIB, GST-huFcγRIIA(Н131) или GST-huFcγRIIA(R131).
На фиг.10 показаны аминокислотные последовательности легкой и тяжелой цепей моноклонального антитела 5А6.2.1.
На фиг.11-15 показано, что 5А6 не блокирует связывание гексамера E27-IgE с huFcγRIIA, а 5А6 блокирует связывание гексамера E27-IgE с huFcγRIIB.
На фиг.16 проиллюстрирован непрямой иммунофлуоресцентный анализ связывания 5А6 MAb на нативной линии эритролейкоза К562, экспрессирующей FcγRIIA (ATCC № CCL-243).
На фиг.17 продемонстрированы эффекты перекрестного связывания FcγRIIB с активированными рецепторами, выявляемые на основе количественного определения уровня блокирования высвобождения гистамина.
На фиг.18 показаны результаты анти-Fab вестерн-блоттинга для оценки экспрессии компонентов антител p5A6.11.Knob (knob анти-FcγRIIB) и p22E7.11.Hole (hole анти-FcεRI).
На фиг.19 показаны результаты анти-Fc вестерн-блоттинга для оценки экспрессии компонентов антител p5A6.11.Knob (knob анти-FcγRIIB) и p22E7.11.Hole (hole анти-FcεRI).
На фиг.20 показаны результаты анти-Fab вестерн-блоттинга для оценки экспрессии компонентов антител с последовательностями дикого типа или с вариантными последовательностями шарнирной области.
На фиг.21 показаны результаты анти-Fc вестерн-блоттинга для оценки экспрессии компонентов антител с последовательностью дикого типа или с вариантными последовательностями шарнирной области.
На фиг.22 показан результат анализа методом изоэлектрофокусирования 5A6Knob, 22E7Hole, смеси 5A6Knob и 22E7Hole при комнатной температуре и смеси, нагретой до 50°C в течение 5 минут.
На фиг.23 показаны результаты анализа проходящей фракции через аффинную колонку с FcγRIIB для биспецифического антитела 5A6Knob/22E7Hole и антител 22E7Hole и 5A6Knob.
На фиг.24 показаны результаты анализа методом изоэлектрофокусирования смеси 5A6Knob, 22E7Hole и смеси 5A6Knob и 22E7Hole, нагретой до температуры 50°С в течение 10 минут.
На фиг.25 показана последовательность нуклеиновой кислоты (SEQ ID NO: 35), кодирующая промотор щелочной фосфатазы (phoA), STII сигнальную последовательность и полностью (вариабельный и константный домены) легкую цепь антитела 5A6.
На фиг.26 показана последовательность нуклеиновой кислоты (SEQ ID NO: 36), кодирующая промотор щелочной фосфатазы (phoA), сигнальную последовательность STII и полностью (вариабельный и константный домены) легкую цепь антитела 22E7.
На фиг.27 показана последовательность нуклеиновой кислоты (SEQ ID NO: 37), кодирующая последние 3 аминокислоты в сигнальной последовательности STII и примерно 119 аминокислот из вариабельного домена тяжелой цепи антитела 5A6 мыши.
На фиг.28 показана последовательность нуклеиновой кислоты (SEQ ID NO: 38), кодирующая последние 3 аминокислоты в сигнальной последовательности STII и примерно 123 аминокислоты из вариабельного домена тяжелой цепи антитела 22E7 мыши.
На фиг.29 и 30 показаны результаты анализа ELISA, иллюстрирующие двойную связывающую специфичность бесшарнирного биспецифического антитела 5А6/22Е7.
На фиг.31-33 показаны результаты определения по методу ELISA, демонстрирующие способность биспецифического антитела 5А6/22Е7 образовывать перекрестные связи huFcγRIIB с FcεRI.
На фиг.34 приведен график данных анализа ELISA уровня высвобождения гистамина, демонстрирующий блокирование антиген-индуцированного высвобождения гистамина в клетках RBL-huFcεRI+FcγRIIB1 при проведении предварительной инкубации биспецифического антитела 5А6/22Е7 с huFcεRI ECD и huFcγRIIB ECD.
На фиг.35 приведены графики данных FACS уровней связывания биспецифического антитела 5А6/22Е7 в присутствии huFcεRI ECD и huFcγRIIB ECD с клетками RBL-huFcεRI+FcγRIIB1.
На фиг.36 приведен график, иллюстрирующий по данным тестирования методом ELISA уровень высвобождения гистамина в клетках RBL-huFcεRI+FcγRIIB2 при проведении предварительной инкубации биспецифического антитела 5А6/22Е7 с huFcεRI ECD и huFcγRIIB ECD.
На фиг.37 показаны графики, иллюстрирующие по данным тестирования FACS уровни связывания биспецифического антитела 5А6/22Е7 в присутствии huFcεRI ECD и huFcγRIIB ECD с клетками RBL-huFcεRI+FcγRIIB2.
На фиг.38 приведены графики, построенные на основе результатов анализа FACS, которые иллюстрируют блокирование связывания биспецифического антитела 5А6/22Е7 с клетками RBL huFcεRI в присутствии huFcεRI ECD, huFcγRIIB ECD или обоих ECD.
На фиг.39 приведены графики, построенные на основе результатов анализа FACS, которые иллюстрируют блокирование связывания биспецифического антитела 5А6/22Е7 с клетками RBL huFcγRIIB в присутствии huFcεRI ECD, huFcγRIIB ECD или обоих ECD.
На фиг.40 приведены графики, построенные на основе результатов анализа FACS, которые иллюстрируют блокирование связывания биспецифического антитела 5А6/22Е7 с клетками RBL huFcεRI+FcγRIIB1 в присутствии huFcεRI ECD, huFcγRIIB ECD или обоих ECD.
На фиг.41 приведены графики, построенные на основе результатов анализа FACS, которые иллюстрируют блокирование связывания биспецифического антитела 5А6/22Е7 с клетками RBL huFcεRI+FcγRIIB2 в присутствии huFcεRI ECD, huFcγRIIB ECD или обоих ECD.
На фиг.42 приведен график, построенный на основе результатов тестирования высвобождения гистамина анализом ELISA, который демонстрирует ингибирование антиген-индуцированного высвобождения гистамина в клетках RBL huFcεRI+FcγRIIB1 в присутствии биспецифического антитела 5А6/22Е7 в субнасыщающих концентрациях.
На фиг.43 показаны результаты анализа методом проточной цитометрии связывания биспецифического антитела 5А6/22Е7 с клетками RBL huFcεRI+FcγRIIB1.
На фиг.44 показан график результатов анализа ELISA по высвобождению гистамина, который демонстрирует ингибирование индуцированного антигеном высвобождения гистамина в клетках RBL huFcεRI+FcγRIIB2 в присутствии биспецифического антитела 5А6/22Е7 в субнасыщающих концентрациях.
На фиг.45 показаны результаты анализа методом проточной цитометрии связывания биспецифического антитела 5А6/22Е7 с клетками RBL huFcεRI+FcγRIIB2.
На фиг.46А и 46В показаны результаты анализа проточной цитометрии данных титрования при определении связывания биспецифического антитела 5А6/22Е7 с клетками RBL huFcεRI, клетками RBL FcγRIIB, клетками RBL huFcεRI+huFcγRIIB1 и клетками RBL huFcε+FcγRIIB2.
На фиг.47 показан график, иллюстрирующий уровни биспецифического антитела, выявляемые методом ELISA в культуральных клеточных средах в случае клеток RBL FcεRI, клеток RBL FcεRI+FcγRIIB1 и клеток RBL FcεRI+FcγRIIB2 в течение семи дней после обработки IgE в присутствии или в отсутствие биспецифического антитела, которые указывают на то, что истощения по антителам не происходит.
На фиг.48 показан график, иллюстрирующий уровни IgE, выявляемые методом ELISA в клеточных культуральных средах для клеток RBL FcεRI, клеток RBL FcεRI+FcγRIIB1 и клеток RBL FcεRI+FcγRIIB2 в течение семи дней после обработки IgE, в присутствии или в отсутствие биспецифического антитела, которые указывают на то, что истощения по антителам не происходит.
На фиг.49 и 50 представлены результаты анализа проточной цитометрии IgE-индуцированной позитивной регуляции поверхностной экспрессии FcεRI в клетках RBL FcεRI.
На фиг.51 и 52 представлены результаты анализа проточной цитометрии IgE-индуцированной позитивной регуляции поверхностной экспрессии FcεRI в клетках RBL FcεRI+FcγRIIB1.
На фиг.53 и 54 представлены результаты анализа проточной цитометрии IgE-индуцированной позитивной регуляции поверхностной экспрессии FcεRI в клетках RBL FcεRI+FcγRIIB2.
На фиг.55 представлены результаты анализа проточной цитометрии, демонстрирующие эффект биспецифического антитела в направлении отрицательной регуляции поверхностной экспрессии FcεRI в клетках RBL FcεRI после удаления IgE.
На фиг.56 представлены результаты анализа проточной цитометрии, демонстрирующие эффект биспецифического антитела в направлении отрицательной регуляции поверхностной экспрессии FcεRI в клетках RBL FcεRI+FcγRIIB1 после удаления IgE.
На фиг.57 представлены результаты анализа проточной цитометрии, демонстрирующие эффект биспецифического антитела в направлении отрицательной регуляции поверхностной экспрессии FcεRI в клетках RBL FcεRI+FcγRIIB2 после удаления IgE.
На фиг.58-61 показаны результаты анализа методом RT-ПЦР экспрессии мРНК huFcεRIα, FcγRIIB1, FcγRIIB2, huRPL19 (контроль) и FcεRIα крысы в тучных клетках RBL huFcεRI (обозначенных как huFcERIa), клетках RBL huFcεRI+FcγRIIB1 (обозначенных как huFcGRIIb1) и клетках RBL huFcεRI+FcγRIIB2 (обозначенных как huFcGRIIb2) и в базофилах человека от трех разных доноров.
На фиг.62 представлены результаты анализа, в рамках которого анти-IgE-индуцированное высвобождение гистамина в первичных базофилах человека ингибируется анти-FcγRIIB-анти-FcεRI биспецифическим антителом 5А6/22Е7.
На фиг.63 представлены в графическом виде результаты анализа проточной цитометрии, демонстрирующие эффект биспецифического антитела на отрицательную регуляцию IgE-индуцированной поверхностной экспрессии FcεRI в клетках RBL FcεRI+FcγRIIB2 в том случае, когда анти-FcγRIIB-анти-FcεRI биспецифическое антитело 5А6/22Е7 добавляют на нулевой день, третий день и четвертый день.
На фиг.64 представлены результаты тестирований, в которых IgE/антигениндуцированное высвобождение цитокина в клетках RBL FcεRI+FcγRIIB2 ингибируется анти-FcγRIIB-анти-FcεRI биспецифическим антителом 5А6/22Е7. На каждой диаграмме: антиген/IgE, один (NP(11)-OVA+IgE) - темно-серые прямоугольники; антиген/IgE + биспецифическое антитело (NP(11)-OVA+IgE+BsAb) - светло-серые прямоугольники.
На фиг.65 представлены результаты тестирований, в которых IgE/антигениндуцированная каскадная стимуляция арахидоновой кислотой в клетках RBL FcεRI+FcγRIIB1 ингибируется анти-FcγRIIB-анти-FcεRI биспецифическим антителом 5А6/22Е7.
Подробное описание изобретения
I. Определения
Аллергия относится к определенной группе заболеваний, при которых иммунные ответы на антигены окружающей среды вызывают воспаление ткани и дисфункцию органов. Аллергеном может быть любой антиген, который вызывает аллергию. Например, им может выступать сама антигенная молекула или ее источник, так как, например, пыльца, перхоть животных, яд насекомых или пищевой продукт. IgE играет центральную роль в аллергических расстройствах. Высокоаффинные рецепторы IgE (FcεRI) локализованы на тучных клетках и в базофилах, которые служат в качестве антигенных мишеней, стимулирующих дальнейшее высвобождение медиаторов воспаления, продуцирующих многие проявления аллергического заболевания.
IgE-опосредованное воспаление происходит в том случае, когда антиген связывается с антителами IgE, которые занимают рецептор FcεRI на тучных клетках. В течение нескольких минут такое приводит к дегрануляции тучных клеток, которые высвобождают некоторые уже сформированные медиаторы. Затем дегранулированная клетка начинает синтезировать и высвобождать дополнительные медиаторы de novo. Результатом является двухфазный ответ: первоначальный быстрый эффект на кровеносные сосуды, гладкие мышцы и железистую секрецию (быстрая гиперчувствительность), за которой следует позже, через несколько часов, клеточная инфильтрация в вовлеченный в реакцию сайт. IgE-опосредованное воспаление представляет собой механизм, лежащий в основе атопической аллергии (такой как сенная лихорадка, астма и атопический дерматит), системных анафилактических реакций и аллергической крапивницы. В норме оно может выполнять функцию первой линии иммунологической защиты, поскольку вызывает быстрое спазмирование сосудов, облегчает поступление циркулирующих растворимых факторов и клеток в место контакта с антигеном. Многие из наиболее разрушительных свойств аллергического заболевания связаны с действием хемоаттриктирующих лейкоцитов.
Термины «антитело» и иммуноглобулин используются взаимозаменяемо в широком смысле и включают моноклональные антитела (то есть полноразмерные антитела или интактные моноклональные антитела), поликлональные антитела, полиспецифичные антитела (например, биспецифичные антитела, при условии, что они обрадают желательной биологической активностью) и могут также включать некоторые фрагменты антител (как будет далее описано более подробно), такие как антигенсвязывающиеся полипептиды, где указанные полипептиды могут быть фрагментами антител. В одном из вариантов антитела и иммуноглобулины по настоящему изобретению содержат сниженное (меньшее) количество дисульфибных связей. В одном из вариантов антитела и иммуноглобулины по настоящему изобретению включают шарнирную область, в которой по меньшей мере один цистеиновый остаток делают неспособным формировать дисульфидную связь, где дисульфидная связь, предпочтительно, является межмолекулярной, предпочтительно, между двумя тяжелыми цепями. Цистеин шарнирной области можно сделать неспособным формировать дисульфидные связи с помощью любого из большого числа подходящих методов, известных в данной области, ряд из них приведен в настоящем описании и которые включают, но ими не ограничиваются, делецию цистеинового остатка или замещение цистеинового остатка другой аминокислотой.
Антитела (иммуноглобулины) можно распределить на разные классы, в зависимости от аминокислотной последовательности константных доменов тяжелой цепи. Было описано пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM. Они могут быть дополнительно подразделены на подклассы (изотипы), например, IgG-1, IgG-2, IgA-1, IgA-2 и т.п. Константные домены тяжелой цепи, соответствующие каждому классу иммуноглобулинов, обозначают как α, δ, ε, γ и µ для IgA, D, E, G и M соответственно. Субъединичные структуры и трехмерные конфигурации представителей разных классов иммуноглобулинов хорошо известны и описаны, например, в работе Abbas et al., 2000, Cellular and Mol. Immunology, 4th ed. Антитело может быть частью более крупной слитой молекулы, сформированной посредством ковалентной или нековалентной ассоциации антитела с одним или несколькими другими белками или пептидами.
Термины «полноразмерное антитело», «интактное антитело» и «все антитело» используются в настоящем описании взаимозаменяемо и относятся к антителу в его по существу интактной форме, а не к фрагментам антител. В частности, указанные термины относятся к антителу с тяжелой цепью, содержащей Fc-участки. Вариант антитела по настоящему изобретению может представлять собой полноразмерное антитело. Полноразмерное антитело может быть человеческим, гуманизированным, химерным и/или созревшим по аффинности.
«Созревшее по аффинности» антитело представляет собой антитело, содержащее одно или несколько изменений в одном или нескольких CDR, что приводит к повышению аффинности антитела в отношении антигена, в сравнении с исходным антителом, которое не содержит такое(ие) изменение(ия). Предпочтительно, созревшие по аффинности антитела обладают наномолярной, даже пикомолярной аффинностью для мишеневого антигена. Созревшие по аффинности антитела могут быть получены известными процедурами. См., например, работу Marks et al., 1992, Biotechnology 10: 779-783, где описывается созревание по аффинности путем перегруппировки вариабельного домена тяжелой цепи (VH) и вариабельного домена легкой цепи (VL). Случайный мутагенез CDR и/или остатков каркасной области также описан в литературе: например, Barbas, et al., 1994, Proc. Natl. Acad. Sci. USA 91: 3809-3813; Shier et al., 1995, Gene 169: 147-155: Yelton et al., 1995, J. Immunol. 155: 1994-2004; Jackson et al., 1995, J. Immunol. 154(7): 3310-9; и Hawkins et al., 1992, J. Mol. Biol. 226: 889-896.
«Антитело-агонист» представляет собой антитело, которое связывается и активирует антиген, такой как рецептор. В основном способность к активации рецептора у агониста-антитела, по меньшей мере качественно, аналогична (и по существу может быть количественно аналогична) нативному лиганду-агонисту рецептора.
Термин «фрагменты антитела» включает лишь часть интактного антитела, где указанная часть сохраняет по меньшей мере одну или может сохранять большинство или все функции, связанные с частью, которая присутствует в интактном антителе. Фрагмент антитела по настоящему изобретению может включать достаточную часть константного участка для димеризации (или полимеризации) тяжелых цепей, которые обладают сниженной способностью к образованию дисульфидной связи, например, в том случае, когда по меньшей мере один из цистеинов шарнирной области, в норме участвующих в образовании дисульфидной связи между тяжелыми цепями, изменен, как приведено в настоящем описании. В одном из вариантов осуществления фрагмент антитела включает антигенсвязывающий сайт или вариабельные домены интактного антитела и, таким образом, сохраняет способность связываться с антигеном. В другом варианте осуществления фрагмент антитела, например фрагмент, который включает Fc-участок, сохраняет по меньшей мере одну из биологических функций, которые в норме связаны с участком Fc, в случае его присутствия в интактном антителе, такую как FcRn-связывание, модуляция периода полувыведения антитела, ADCC функция и/или связывание с комплементом (например, в том случае, когда антитело имеет профиль гликозилирования, необходимый для ADCC функции или связывания комплемента). Примеры фрагментов антитела включают линейные антитела, одноцепочечные молекулы антител и полиспецифические антитела, образованные из антительных фрагментов.
Термины «антителоопосредованная клеточная цитотоксичность» и «ADCC» относятся к клеточной реакции, при которой неспецифические цитотоксические клетки, которые экспрессируют FcR (такие как природные клетки-киллеры (NK), нейтрофилы и макрофаги), распознают связанное на клетке-мишени антитело и впоследствии вызывают лизис клетки-мишени. NK-клетки, как первичные клетки для ADCC, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках описана в таблице 3 на странице 464 Ravetch et al., 1991, Annu. Rev. Immunol. 9: 457-92. Для оценки ADCC активности интересующей молекулы может быть проведен тест на ADCC in vitro, такой как тест, описанный в патентах США 5500362 или 5821337. Эффекторные клетки, которые могут использоваться в таких анализах, включают мононуклеарные клетки периферической крови (МКПК) и п