Имидазопиразины в качестве ингибиторов тирозинкиназ
Иллюстрации
Показать всеНастоящее изобретение относится к новым имидазопиразинам формулы (I), где Q1 и R1 имеют значения, указанные в формуле изобретения, и их фармацевтически приемлемым солям, обладающим ингибирующей активностью в отношении фермента IGF-1R и подходящими для лечения и/или профилактики различных заболеваний и состояний, которые восприимчивы к лечению ингибированием тирозинкиназы. 12 н. и 15 з.п. ф-лы, 2 табл.
Реферат
Уровень техники
Настоящее изобретение относится к новым имидазопиразинам, их солям и содержащим их композициям. В частности, настоящее изобретение относится к имидазопиразинам как новым ингибиторам тирозинкиназ, которые ингибируют ферменты тирозинкиназы в организме животных, в том числе у людей, и которые пригодны для лечения и/или профилактики различных заболеваний и состояний, таких как рак.
Фосфорилтрансферазы являются большим семейством ферментов, которые переносят содержащие фосфор группы от одного субстрата к другому. Киназы являются классом ферментов, которые функционируют в катализе переноса фосфорила. Фосфорилированием обычно является реакция переноса фосфатной группы от АТФ к белковому субстрату. Почти все киназы содержат одинаковый каталитический домен из 250-300 аминокислот. Протеинкиназы, по меньшей мере, 400 которых являются идентифицированными, составляют самое большое подсемейство структурно родственных фосфорилтрансфераз и являются ответственными за регуляцию большого числа процессов трансдукции сигналов в клетке. Протеинкиназы можно классифицировать по семействам на основе субстратов, которые они фосфорилируют (например, протеинтирозин, протеинсерин/треонин и так далее). Идентифицированы мотивы последовательностей протеинкиназ, которые обычно соответствуют каждому из семейств этих киназ. Липидкиназы (например, Р13К) образуют отдельную группу киназ со структурной аналогией с протеинкиназами.
«Домен киназы» имеется в ряде полипептидов, которые выполняют различные функции. Такие полипептиды включают в себя, например, трансмембранные рецепторы, связанные с внутриклеточными рецепторами полипептиды, цитоплазматические локализованные полипептиды, ядерные локализованные полипептиды и субклеточные локализованные полипептиды. Активность протеинкиназ может регулироваться различными механизмами, и любой отдельный белок может регулироваться более чем одним механизмом. Такие механизмы включают в себя, например, аутофосфорилирование, трансфосфорилирование другими киназами, взаимодействия белок-белок, взаимодействия белок-липид, взаимодействия белок-полинуклеотид, связывание лиганда и послетрансляционную модификацию.
Фосфорилирование белков-мишеней имеет место в ответ на различные внеклеточные сигналы (гормоны, нейротрансмиттеры, факторы роста и дифференциации и так далее), события клеточного цикла, стрессы окружающих условий или пищевые стрессы и так далее. Протеин- и липидкиназы регулируют многие процессы различных клеток присоединением фосфатных групп к мишеням, таким как белки или липиды. Такие клеточные процессы включают в себя, например, пролиферацию, рост, дифференциацию, метаболизм, события клеточного цикла, апоптоз, подвижность, транскрипцию, трансляцию и другие процессы передачи сигналов. Киназа, катализированная фосфорилированием, действует в качестве средства молекулярных включений/выключений для модуляции или регуляции биологической функцией белка-мишени. Таким образом, протеин- и липидкиназы могут функционировать в путях передачи сигналов, чтобы активировать, или инактивировать, или модулировать активность (либо непосредственно, или косвенно) мишени. Эти мишени могут включать в себя, например, метаболические ферменты, регуляторные белки, рецепторы, цитоскелетные белки, ионные каналы, или насосы, или факторы транскрипции.
Частичный список протеинкиназ включает в себя abl, AKT, bcr-abl, Blk, Brk, Btk, c-kit, c-met, c-src, CDK1, CDK2, CDK3, CDK4, CDK5, CDK6, CDK7, CDK8, CDK9, CDK10, cRafl, CSFir, CSK, EGFR, ErbB2, ErB3, ErbB4, Erk, Fak, fes, FGFR1, FGFR2, FGFR3, FGFR4, FGFR5, Fgr, flt-1, Fps, Frk, Fyn, Hck, IGF-1R, INS-R, Jak, KDR, Lck, Lyn, MEK, p38, PDGFR, PIK, PKC, PYK2, ron, tie, tie2, TRK, Yes и Zap70. Таким образом, протеинкиназы представляют собой большое семейство белков, которые играют центральную роль в регуляции большого числа клеточных процессов, поддерживая регуляцию на протяжении клеточной функции. Неконтролируемая передача сигнала вследствие нарушенной регуляции фосфорилирования белка предполагается в ряде заболеваний и патологических состояний, включающих, например, воспаление, рак, аллергию/астму, заболевание и состояния иммунной системы, заболевание и состояния центральной нервной системы (ЦНС), сердечно-сосудистое заболевание, дерматологическое заболеваний и развитие кровеносных сосудов (ангиогенез).
Начальный интерес к протеинкиназам в качестве фармакологических мишеней был стимулирован открытиями, что многие вирусные онкогены кодируют структурно модифицированные клеточные протеинкиназы с конститутивной ферментативной активностью. Одним ранним примером был вирус саркомы Рауса (RSV) или вирус птичьей саркомы (ASV), который вызывает очень злокачественные опухоли одного и того же типа или саркомы у инфицированных птиц. Затем нарушенная активность протеинкиназ, являющаяся результатом различных механизмов, принимает участие в патофизиологии ряда важных нарушений у человека, включающих в себя, например, рак, состояния ЦНС и иммунологически родственных заболеваний. Разработка селективных ингибиторов протеинкиназ, которые могут блокировать патологии и/или симптомы заболеваний, являющиеся результатов аберрантной активности протеинкиназы, становится, следовательно, важной терапевтической целью.
Протеинтирозинкиназы (РТКs) являются ферментами, которые катализируют фосфорилирование специфических остатков тирозина в клеточных белках. Такие посттрансляционные модификации субстратных белков, часто самих ферментов, действуют в качестве молекулярного переключателя, регулирующего пролиферацию, активацию или дифференциацию клеток (см. обзор Schlessinger and Ullrich, 1992, Neuron 9:383-391). Абберантную или чрезмерную активность РТК наблюдали при многих патологических состояниях, включающих в себя доброкачественные и злокачественные пролиферативные нарушения, а также заболевания, являющиеся результатом нежелательной активации иммунной системы (например, аутоиммунных нарушений), отторжение трансплантата и гомологичную болезнь. Кроме того, специфичные для эндотелиальных клеток рецепторные РТК, такие как KDR и Tie-2, опосредуют ангиогенный процесс и, таким образом, принимают участие в обеспечении развития раковых заболеваний и других заболеваний, включающих в себя нежелательную васкуляризацию (например, диабетическую ретинопатию, хороидальную реваскуларизацию вследствие связанной с возрастом дегенерации желтого пятна, псориаз, артрит, ретролетальную фиброплазию, младенческие гемангиомы).
Тирозинкиназы могут быть рецепторного типа (имеющие внеклеточные, трансмембранные и внутриклеточные домены) или нерецепторного типа (являющиеся полностью внутриклеточными). Рецепторные тирозинкиназы (RTKs) включают в себя большое семейство трансмембранных рецепторов, по меньшей мере, с девятнадцатью различными подсемействами RTK, имеющими различные биологические активности. Семейство RTK включает в себя рецепторы, которые являются решающими для роста и дифференциации различных типов клеток (Yarden and Ullrich, Ann. Rev. Biochem. 57:433-478, 1988; Ullrich and Schlessinger, Cell 61:243-254, 1990). Присущая функция RTKs активируется при связывании лиганда, которое приводит к фосфорилированию рецептора и многих клеточных субстратов и затем к различным клеточным реакциям (Ullrich & Schlessinger, 1990, Cell 61:203-212). Таким образом, опосредованная RTK трансдукция сигнала инициируется внеклеточным взаимодействием со специфическим фактором роста (лигандом), обычно с последующей димеризацией рецептора, стимуляцией присущей активности протеинтирозинкиназы и трансфосфорилированием рецептора. Посредством этого создаются сайты связывания для молекул трансдукции внутриклеточного сигнала и это приводит к образованию комплексов с разнообразными цитоплазматическими молекулами передачи сигнала, которые содействуют присущей клеточной реакции, такой как деление, дифференциация клеток, метаболические действия и изменения во внеклеточном микроокружении (см. Schlessinger and Ullrich, 1992, Neuron 9:1-20).
Белки с доменом SHA (гомология-2 src) или фосфотирозинсвязывающим (РТВ) доменом связывают активированные рецепторы тирозинкиназы и их субстраты с высоким сродством к сигналами размножения в клетки. Оба из этих доменов распознают фосфотирозин. (Fantl et al., 1992, Cell 69:4-13-423; Songyang et al., 1994, Mol. Cell. Biol. 14:2777-2785; Songyang et al., 1993, Cell 72:767-778; and Koch et al., 1991, Science 252:66Z-618 Shoelson, Curr Opin. Chem. Biol. (1997), 1(2), 227-234; Cowburn, Curr Opin. Struct. Biol. (1997), 7(6), 835-838.) Было идентифицировано несколько внутриклеточных субстратных белков, которые ассоциируются с RTKs. Их можно разделить на две основные группы: (1) субстраты, которые имеют каталитический домен, и (2) субстраты, у которых отсутствует такой домен, но которые служат в качестве адаптеров и ассоциируются с каталитически активными молекулами (Songyang et al., 1993, Cell 72:767-778). Специфичность взаимодействий между рецепторами или белками и доменами SH2 или РТВ их субстратов определяется аминокислотными остатками, непосредственно окружающими остаток фосфорилированного тирозина. Например, различия в связывающем сродстве между доменами SID и аминокислотными последовательностями, окружающими остатки фосфотирозина на определенных рецепторах, коррелируют с наблюдаемыми различиями в их профилях фосфорилирования субстрата (Songyang et al.,1993,Cell 72:767-778). Наблюдения позволяют предположить, что функция каждой рецепторной тирозинкиназы определяется не только ее характером экспрессии и доступностью лиганда, но также рядом путей, находящихся далее по ходу трансдукции их сигнала, которые активируются определенным рецептором, а также согласованием во времени и продолжительностью этих стимулов. Таким образом, фосфорилирование обеспечивает важную регуляторную стадию, которая определяет селективность путей передачи сигналов, рекрутируемых рецепторами специфического фактора роста, а также рецепторами фактора дифференциации.
Было предположено, что несколько рецепторных тирозинкиназ, таких как FGFR-1, PDGFR, Tie-2 и c-Met, и факторы роста, которые связываются с ними, играют роль в ангиогенезе, хотя некоторые могут стимулировать ангиогенез непосредственно (Mustonen and Alitalo, J. Cell Biol. 129:895-898, 1995). Одна такая рецепторная тирозинкиназа, известная как «киназа 1 плодной печени» (FLK-1), является членом подкласса RTKs типа III. FLK-1 человека известна, так же как «рецептор, содержащий инсертированный домен киназы» (KDR) (Terman et al., Oncogene 6:1677-83,1991). Ее называют также «рецептором 2 фактора роста васкулярных эндотелиальных клеток» (VEGFR-2), так как она связывает фактор роста васкулярных эндотелиальных клеток с большим сродством. Мышиную версию FLK-1/VEGFR-2 обозначают также NYK. (Oelrichs et al., Oncogene 8(1):11-15, 1993.) Многочисленные исследования (такие как исследования, описанные Millauer et al., supra), позволяют предположить, что VEGF и FLK-1/KDR/VEGFR-2 являются парой лиганд-рецептор, которая играет важную роль в пролиферации васкулярных эндотелиальных клеток (образование и развитие сосудов), и образовании, и развитии кровеносных сосудов (ангиогенез). Согласно этому, VEGF играет роль в стимуляции как нормального, так и патологического ангиогенеза (Jakeman et al., Endocrinology 133:848-859, 1993; Kolch et al., Breast Cancer Research and Treatment 36: 139-155, 1995; Ferrara et al., Endocrine Reviews 18(1); 4-25, 1997; Ferrara et al., Regulation of Angiogenesis (ed. L D. Goldberg and E.M. Rosen), 209-232, 1997). Кроме того, VEGF участвует в регуляции и повышении васкулярной проницаемости (Connolly et al., 1, Biol. Chem. 264: 20017-20024, 1989; Brown et al., Regulation of Angiogenesis (ed. LD. Goldberg and E.M. Rosen), 233-269, 1997).
Другой RTK подкласса типа III, относящийся к FLK-1/KDR (DeVries at al., Science 255:989-991, 1992, Shibuya et al., Oncogene 5:519-524, 1990), является “fms-подобной тирозинкиназой-I” (Flt-1), называемой также «рецептором 1 фактора роста васкулярных эндотелиальных клеток» (VEGFR-1). Члены подсемейств FLK-1/KDR/VEGFR-2 и Flt-1/VEGPR-1 экспрессируются главным образом на эндотелиальных клетках. Эти члены подкласса специфически стимулируются членами семейства VEGF лигандов (Klagsbum and D'Amore, Cytokine & Growth Factor Reviews 7: 259270, 1996). VEGF связывается с Flt-1 с более высоким сродством, чем с FLK-1/KDR, и является митогенным по отношению к васкулярным эндотелиальным клеткам (Terman et al., 1992, supra; Mustonen et al. supra; DeVries et al., supra). Считается, что Flt-1 является существенной для эндотелиальной организации во время васкулярного развития. Экспрессия Flt-1 ассоциируется с ранним васкулярным развитием в мышиных эмбрионах и с образованием новых сосудов во время заживления раны (Mustonen and Alitalo, supra). Экспрессия Flt-1 в моноцитах, остеокластах и остеобластах, а также в тканях взрослых особей, например, клубочках почек, предполагает дополнительную функцию для этого рецептора, которая не связана с ростом клеток (Mustonen and Alitalo, supra).
Фактор роста плаценты (P1GF) имеет аминокислотную последовательность, которая проявляет значительную гомологию с последовательностью VEGF (Park et al., 1, Biol. Chem. 269:25646-54, 1994; Maglione et al. Oncogene 8:925-31, 1993). Как в случае VEGF, различные виды P1GF являются результатом альтернативного сплайсинга мРНК, и этот белок существует в димерной форме (Park et al., supra). P1GF-1 и P1GF-2 связываются с Flt-1 с высоким сродством, и P1GF-2 также авидно связывается с нейропилином-1 (Migdal et al., 1. Biol. Chem. 273 (35):22272-22278), но не связывается ни с одним из FLK-1/KDR (Park et al., supra). Описано, что P1GF потенцирует как васкулярную проницаемость, так и митогенное действие VEGF на эндотелиальные клетки, когда VEGF присутствует при низких концентрациях (подразумевается, что вследствие образования гетеродимера) (Park et al., supra).
Считается, что VEGF-B играет роль в регуляции деградации внеклеточного матрикса, адгезии клеток и миграции посредством модуляции экспрессии и активности активатора плазминогена урокиназного типа и ингибитора 1 активатора плазминогена (Pepper et al., Proc. Natl. Acad. Sci. U.S.A. (1998), 95(20):11709-11714).
VEGF-C может также связывать KDR/VEGFR-2 и стимулировать пролиферацию и миграцию эндотелиальных клеток in vitro и развитие кровеносных сосудов на моделях in vivo (Lymboussaki et al., Am. J. Pathol. (1998), 153(2):395-403; Witzenbichler et al., Am. J. Pathol. (1998), 153(2), 381-394). Трансгенная сверхэкспрессия VEGF-C вызывает пролиферацию и развитие только лимфатических сосудов, тогда как на кровеносные сосуды она не влияет. В отличие от VEGF, экспрессия VEGF-С не индуцируется гипоксией (Ristimaki et al., J. Biol. Chem. (1998), 273(14), 8413-8418).
Описано, что структурно сходный с VEGF-С VEGF-D связывается, по меньшей мере, с двумя VEGFR, VEGF-3/Flt-4 и KDR/VEGF-2 и активирует их. Он первоначально клонируется в качестве c-fos-индуцируемого митогена для фибробластов и наиболее обычно экспрессируется в мезенхимальных клетках легких и кожи (Achen et al.,Proc. Natl. Acad. Sci. U.S.A. (1998), 95(2), 548-553 и ссылки в этой публикации). Утверждается, что VEGF, VEGF-С и VEGF-D индуцируют увеличение в васкулярной проницаемости in vivo в анализе Miles при инъекции в кожную ткань (РСТ/US97/14696; WO98/07832, Witzenbichler et al., supra). Физиологическая роль и значение этих лигандов в модуляции васкулярной гиперпроницаемости и эндотелиальных реакций в тканях, когда они экспрессируются, остается неопределенной.
Tie-2 (TEK) является членом недавно открытого семейства специфичных для эндотелиальных клеток RTК, принимающих участие в критических ангиогенных процессах, таких как разветвление, развитие, коррекция, созревание и стабильность сосудов. Tie-2 является первой RTK млекопитающих, для которой идентифицированы как лиганды-агонисты (например, ангиопоиэтин1 (“Angl”), которая стимулирует аутофосфорилирование рецептора и трансдукцию сигнала), так и лиганды-антагонисты (например, ангиопоиэтин2 (“Ang2”)). Современная модель позволяет предположить, что стимуляция киназы Tie-2 лигандом Ang1 непосредственно принимает участие в разветвлении, развитии и отрастании новых сосудов и рекрутинге и взаимодействии периэндотелиальных поддерживающих клеток, важных в сохранении целостности и индуцировании состояния покоя сосудов. Отсутствие стимуляции Tie-2 посредством Ang1 или ингибирование аутофосфорилирования Tie-2 посредством Ang2, который продуцируется с высокими уровнями у сайтов васкулярного регресса, может вызвать потерю в васкулярной структуре и контактов матриксов, приводящую к гибели эндотелиальных клеток, особенно, в отсутствие стимулов роста/выживания. Недавно значительная позитивная регуляция экспрессии Tie-2 была обнаружена в васкулярном синовиальном паннусе суставов при артрите у людей, что согласуется с ее ролью при нежелательном образовании новых сосудов, позволяя предположить, что Tie-2 играет роль в развитии ревматоидного артрита. Точковые мутации, продуцирующие конститутивные активированные формы Tie-2, идентифицировали в связи с нарушениями типа венозной мальформации у человека. Ингибиторы Tie-2, следовательно, являются применимыми при лечении таких заболеваний и при других состояниях с нежелательным образованием новых сосудов.
Нерецепторные тирозинкиназы представляют собой совокупность клеточных ферментов, у которых не имеются внеклеточные и трансмембранные последовательности (см. Bohlen, 1993, Oncogene 8:2025-2031). Было идентифицировано больше двадцати четырех индивидуальных нерецепторных тирозинкиназ, включающих в себя одиннадцать (11) подсемейств (Src, Frk, Btk, Csk, Ab1, Zap70, Fes/Fps, Fak, Jak, Ack и LIMK). Подсемейство Src нерецепторных тирозинкиназ состоит из большого числа PTК и включает в себя Src, Yes, Fyn, Lyn, Lck, Blk, Hck, Fgr и Yrk. Подсемейство Src ферментов связано с онкогенезом и иммунными реакциями.
Plk-1 является серин/треонинкиназой, которая является важным регулятором развития клеточного цикла. Она играет решающие роли в сборке и динамической функции аппарата митотического веретена. Было обнаружено, что Plk-1 и родственные киназы принимают непосредственное участие в активации и инактивации других регуляторов клеточного цикла, таких как циклинзависимые киназы. Высокие уровни экспрессии Plk-1 связаны с активностями пролиферации клеток. Ее часто обнаруживают в злокачественных опухолях различного происхождения. Предполагается, что ингибиторы Plk-1 блокируют пролиферацию раковых клеток нарушением процессов, включающих в себя митотические веретена и нежелательно активированные циклинзависимые киназы.
Cdc2(cdk1)/циклин В является другим ферментом серин/треонинкиназ, который принадлежит к семейству циклинзависимых киназ (cdks). Эти ферменты принимают участие в критических переходах между различными фазами развития клеточного цикла. Считается, что неконтролируемая пролиферация клеток, отличительный признак рака, зависит от повышенных активностей cdk в этих клетках. Потеря контроля над регуляцией cdk является частым случаем при гиперпролиферативных заболеваниях и раке (Pines, Current Opinion in cell Biology, 4:144-148 (1992); Lees, Current Opinion in Cell Biology, 7:773-780(1995); Hunter and Pines, Cell, 79:573-582(1994)). Ингибирование повышенных активностей cdk в раковых клетках ингибиторами cdc2/циклин В-киназы может подавлять пролиферацию и может восстанавливать нормальный контроль развития клеточного цикла.
Злокачественные клетки связаны с потерей контроля над одним или несколькими элементами клеточного цикла. Эти элементы простираются от рецепторов поверхности клеток до регуляторов транскрипции и трансляции, включая инсулиноподобные факторы роста, инсулиновый фактор-1 роста (IGF-1), инсулиновый фактор-2 роста (IGF-2). [M.J. Ellis, “The Insulin-Like Growth Factor Network and Breast Cancer”, Breast Cancer, Molecular Genetics, Pathogenesis and Therapeutics, Humana Press 1999.] Система инсулиновых факторов роста состоит из семейств лигандов, связывающих инсулиновый фактор роста белков и рецепторов.
Основной физиологической ролью системы IGF-1 является стимуляция нормального роста и регенерации, сверхэкспрессированный IGF-1R может стимулировать митогенез и активировать лигандозависимую неопластическую трансформацию. Кроме того, IGF-1R играет важную роль в создании и поддержании злокачественного фенотипа.
IGF-1R существует в виде гетеродимера с несколькими дисульфидными мостиками. Каталитический сайт и АТФ-связывающий сайт тирозинкиназы расположены на цитоплазматической части бета-субъединицы. В отличие от рецептора эпидермального фактора роста (EGF), никакие мутантные онкогенные формы IGF-1R не были идентифицированы. Однако было показано, что несколько онкогенов оказывают влияние на экспрессию IGF-1 и IGF-1R. Показана корреляция между снижением экспрессии IGF-1R и резистентностью к трансформации. Воздействие клеток на мРНК, антисмысловую в отношении РНК IGF-1R, предотвращает рост на мягком агаре нескольких опухолевых клеточных линий человека.
Апоптоз является повсеместным физиологическим процессом, применяемым для элиминирования поврежденных или нежелательных клеток в многоклеточных организмах. Считается, что нарушение регуляции апоптоза принимает участие в патогенезе многих заболеваний человека. Отсутствие гибели апоптотических клеток предполагается при различных раковых заболеваниях, а также аутоиммунных нарушениях. Наоборот, повышенный апоптоз связывают с различными заболеваниями, включающими в себя потерю клеток, такими как нейродегенеративные нарушения и СПИД. Как таковые, регуляторы апоптоза стали важной терапевтической мишенью. Теперь установлено, что основным способом выживания опухоли является ее способность избежать апоптоз. IGF-1R подавляет развитие в апоптоз как in vivo, так и in vitro. Обнаружено также, что снижение уровня IGF-1R ниже уровней природного типа вызывает апоптоз опухолевых клеток in vivo. Оказывается, что способность нарушения индуцирования апоптоза IGF-1R является пониженной в нормальных, неонкогенных клетках.
Нежелательно высокая активность протеинкиназ предполагается при многих заболеваниях, являющихся результатом аномальной клеточной функции. Она может возникать либо непосредственным, либо косвенным образом повреждением механизмов присущей регуляции для киназы, относящейся к мутации, сверхэкспрессии или нежелательной активации фермента, или сверхпродуцированием, или недостаточным продуцированием цитокинов или факторов роста, также принимающих участие в трансдукции сигналов киназы до или после по ходу процесса передачи сигнала. Во всех этих случаях можно ожидать, что селективное ингибирование действия киназы имеет благотворное действие.
Рецептор инсулиноподобного фактора роста типа 1 (IGF-1R) является трансмембранной RTK, которая связывается в основном с IGF-1, но также с IGF-II и инсулином с более низким сродством. Связывание IGF-1 с его рецептором приводит к олигомеризации рецептора, активации тирозинкиназы, межмолекулярному аутофосфорилированию рецептора и фосфорилированию клеточных субстратов (основными субстратами являются IRS1 и Shc). Активированный лигандом IGF-1R индуцирует митогенную активность в нормальных клетках и играет важную роль при аномальном росте.
Несколько клинических публикаций подчеркивают важную роль пути IGF-1 в развитии опухолей человека: 1) сверхэкспрессию IGF-1R часто обнаруживают в различных опухолях (молочной железы, толстой кишки, легких, саркоме) и часто связывают ее с агрессивным фенотипом, 2) высокие концентрации циркулирующего IGF-1 убедительно коррелируют с риском рака простаты, легкого и молочной железы. Кроме того, IGF-1R требуется для создания и сохранения трансформированного фенотипа in vitro и in vivo (Baserga R. Exp. Cell. Res., 1999, 253, 1-6). Киназная активность IGF-1R является существенной для трансформирующей активности нескольких онкогенов: EGFR, PDGFR, антигена SV40 T, активированного Ras, Raf и v-Src. Экспрессия IGF-1R в нормальных фибробластах индуцирует неопластические фенотипы, которые могут затем образовывать опухоли in vivo. Экспрессия IGF-1R играет важную роль в «безъякорном» росте. Обнаружено также, что IGF-1R защищает клетки от апоптоза, индуцированного химиотерапией, излучением и цитокинами. Наоборот, обнаружено, что ингибирование эндогенного IGF-1R доминантным негативным IGF-1R, образованием тройной спирали или вектором антисмысловой экспрессии подавляет перерождающую активность in vitro и рост опухоли на животных моделях.
Обнаружено, что многие из тирозинкиназ, независимо от того, являются ли они RTK или нерецепторной тирозинкиназой, принимают участие в клеточных путях передачи сигнала, принимающих участие в многочисленных патогенных условиях, включающих в себя рак, псориаз и другие гиперпролиферативные нарушения или гипериммунные реакции. Поэтому продолжается проведение многих исследований по ингибированию киназ, вовлеченных в опосредование или поддержание патологических состояний, для лечения таких заболеваний. Примеры такого исследования киназ включают в себя, например, (1) ингибирование с-Src (Brickell, Critical Reviews in Oncogenesis, 3:401-406 (1992); Courtneidge, Seminars in Cancer Biology, 5:236-246 (1994), raf (Powis, Pharmacology & Therapeutics, 62:57-95 (1994)) и циклинзависимых киназ (CDKs) 1, 2 и 4 при раке cancer (Pines, Current Opinion in Cell Biology, 4:144-148 (1992); Lees, Current Opinion in Cell Biology, 7:173-7S0 (1995); Hunter and Pines, Cell, 79:573-582 (1994)), (2) ингибирование киназы CDK2 или PDGF-R при стенозе (Buchdunger et al., Proceedigs of the National Academy of Science USA, 92:2258-2262 (1995)), (3) ингибирование киназ CDK5 и GSK3 при болезни Альцгеймера (Hosoi et al., Journal of Biochemistry (Tokyo), 117:741-749 (1995); Aplin et al., Journal of Neurochemistry, 67:699-707 (1996), (4) ингибирование киназы с-Src при остеопорозе (Tanaka et al., Nature, 383:528-531 (1996), (5) ингибирование киназы GSK-3 при диабете типа 2 (Borthwick et al., Biochemical & Biophysical Research Communications, 210:738-745 (1995)), (6) ингибирование киназы р38 при воспалении (Badger et al., The Journal of Pharmacology and Experimental Therapeutics, 279:1453-1461 (1996)), (7) ингибирование киназ VEGF-R 1-3 и TIE-1 и -2 при заболеваниях, которые включают в себя развитие кровеносных сосудов (Shawver et al., Drug Discovery Today, 2:50-63 (1997)), (8) ингибирование киназы UL97 при вирусных инфекциях (He et al., Journal of Virology, 71:405-411 (1997)), (9) ингибированием киназы CSF-1R при костных и гемопоэтических заболеваниях (Myers et al., Bioorganic & Medicinal Chemistry Letters, 7:421-424 (1997)) и (10) ингибирование киназы Lck при аутоиммунных заболеваниях и отторжении трансплантата (Myers et al., Bioorganic & Medicinal Chemistry Letters, 7:417-420 (1997)).
Ингибиторы некоторых киназ могут быть применимыми при лечении заболеваний, при которых киназа не является ошибочно регулированной, но тем не менее она является важной для сохранения патологического состояния. В этом случае ингибирование активности киназы может служить либо в качестве лечения, либо в качестве временного облегчения или ослабления при таких заболеваниях. Например, многие вирусы, такие как вирус папилломы человека, нарушают клеточный цикл и заставляют клетки переходить в S-фазу клеточного цикла (Vousden, FASEB Journal, 7:8720879 (1993)). Препятствие клеткам для вступления в синтез ДНК после вирусной инфекции ингибированием важных, инициирующих S-фазу активностей, таких как CDK2, может нарушить вирусный жизненный цикл предотвращением репликации вируса. Такой же самый принцип можно применять для защиты нормальных клеток организма от токсичности цикл-специфических химиотерапевтических агентов (Stone et al., Cancer Research, 56:3199-3202 (1996); Kohn et al., Journal of Cellular Biochemistry, 54:44-452 (1994)). Ингибирование CDK 2 или 4 может предотвратить продвижение в цикл в нормальных клетках и ограничить токсичность цитотоксических средств, которые действуют в S-фазе, G2 или митозе.
Кроме того, было также обнаружено, что активность ферментов CDK2/циклин Е регулирует NF-kB. Ингибирование активности CDK2 стимулирует экспрессию NF-kB-зависимого гена, случай, опосредованный путем взаимодействий с соактиватором р300 (Perkins et al., science, 275:523-527 (1997)). NF-kB регулирует гены, которые принимают участие в воспалительных реакциях (такие как гены гемопоэтических факторов роста, хемокинов и молекул адгезии лейкоцитов) (Baeuerle and Henkel, Annual Review of Immunology, 12:141-179 (1994)) и могут принимать участие в подавлении апоптотических сигналов в клетке (Beg and Baltimore, Science, 274:782-784 (1996); Wang et al., Science, 274:784-787 (1996); Van Antwerp et al., Science, 274:787-789 (1996)). Таким образом, ингибирование CDK2 может подавлять апоптоз, индуцированный цитотоксическими лекарственными средствами, посредством механизма, который включает в себя участие NF-kB, и может быть применимо, когда регуляция NF-kB играет роль в этиологии заболевания.
Следующим примером пригодности ингибирования киназ являются грибковые инфекции: аспергиллез является обычной инфекцией у пациентов с ослабленной иммунной системой (Armstrong, Clinical Infectious Disease, 16: 1-7 (1993)). Ингибирование киназ Aspergillus Cdc2/CDC28 или Nim A (Osmani et al., EMBO Journal, 10:2669-2679 (1991); Osmani et al., Cell, 67:283-291 (1991)) может вызвать подавление развития или гибель грибов, что позволяет эффективно лечить эти инфекции.
Следовательно, желательной является идентификация эффективных маленьких соединений, которые специфически ингибируют трансдукцию сигнала и клеточную пролиферацию модуляцией активности рецепторной и нерецепторной тирозин- и серин/треонинкиназ, для регуляции и модуляции аномальной или нежелательной клеточной пролиферации, дифференциации или метаболизма. В частности, может быть полезной идентификация методов и соединений, которые специфически ингибируют функцию тирозинкиназы, которая является важной для ангиогенных процессов или образования васкулярной гиперпроницаемости, приводящей к отеку, асцитам, выпотам, экссудатам и макромолекулярной транссудации и матриксному отложению, а также связанных с ними нарушениям.
Ввиду важности PTKs для контроля, регуляции и модуляции клеточной пролиферации и заболеваний и нарушений, связанных с аномальной клеточной пролиферацией, много попыток было предпринято для нахождения ингибиторов рецепторных и нерецепторных тирозинкиназ с применением различных подходов, включающих в себя применение видоизмененных лигандов (патенте США 4966849), растворимых рецепторов и антител (публикация Международной патентной заявки № WO 94/10202; Kendall & Thomas, 1994, Proc. Natl. Acad. Sci 90:10705-09; Kim et al., 1993, Nature 362:841-844), лигандов РНК (Jellinek, et al., Biochemistry 33:1045056; Takano, et al., 1993, Mol Bio. Cell 4:358A; Kinsella, et al., 1992, Exp. Cell Res. 199:56-62; Wright, et al., 1992,1. Cellular Phys. 152:448-57) и ингибиторов тирозинкиназы (публикации Международных патентных заявок №№ 94/03427; WO 92/21660; WO 91/15495; WО 94/14808; патент США № 5330992; Mariani, et al., 1994, Froc. Am. Assoc. Cancer Res. 35:2268).
Позднее были предприняты попытки нахождения маленьких молекул, которые действуют как ингибиторы тирозинкиназы. Бисарильные соединения, моноциклические, бициклические или гетероциклические арильные соединения (публикация Международной патентной заявки № WO 92/20642) и производные виниленазаиндола (публикация Международной патентной заявки № WO 94/14808) были описаны в общем как ингибиторы тирозинкиназы. Стирилсоединения (патент США № 5217999), стирилзамещенные пиридильные соединения (патент США № 5302606), некоторые производные хиназолина (заявка на Европейский патент № 0566266 А1; Expert Opin. Ther. Pat. (1998), 8(4): 475-478), селоноиндолы и селениды (публикация Международной патентной заявки № WO 94/03427), трициклические полигидроксильные соединения (публикация Международной патентной заявки № WO 92/21660) и производные бензилфосфоновой кислоты (публикация Международной патентной заявки № WO 91/15495) были описаны как соединения для применения в качестве ингибиторов тирозинкиназы при лечении рака. Анилиноциннолины (РСТ WO97/34876) и соединения, являющиеся производными хиназолина (публикация Международной патентной заявки № WO 97/22596; публикация Международной патентной заявки № WO 97/42187), были описаны в качестве ингибиторов развития кровеносных сосудов и васкулярной проницаемости. Производные бис(индолилмалеимида) были описаны как ингибирующие определенные изоформы серин/треонинкиназы РКС, функция трансдукции сигналов которых связана с измененной васкулярной проницаемостью при связанных с VEGF заболеваниях (публикации Международных патентных заявок №№ WO 97/40830 и WO 97/40831).
IGF-1R играет важную роль в клеточном делении, развитии и метаболизме и в своем активированном состоянии играет роль в онкогенезе и подавлении опоптоза. Известно, что IGF-1R сверхэкспрессируется в ряде раковых клеточных линий (сверхэкспрессия IGF-1R связана с акромегалией и раком простаты). В противоположность этому обнаружено, что регуляция по типу отрицательной связи экспрессии IGF-1R приводит к ингибированию онкогенеза и повышенному апоптозу клеток опухоли.
В публикациях Международных патентных заявок №№ WO 03/018021 и WO 03/018022 описаны пиримидины для лечения связанных с IGR-1R заболеваний, в публикациях Международных патентных заявок №№ WO 02/102804 и WO 02/102805 описаны циклолигнаны и циклолигнаны в качестве ингибиторов IGF-1R, в публикации Международной патентной заявки № WO 02/092599 описаны пирролопиримидины для лечения заболевания, которое поддается лечению ингибированием тирозинкиназы IGF-1R, в публикации Международной патентной заявки № WO 01/72751 описаны пирролопиримидины в качестве ингибиторов тирозинкиназы. В публикации Международной патентной заявки № WO 00/71129 описаны пирролотриазиновые ингибиторы киназ. В публикации Международной патентной заявки № WO 97/28161 описаны пирроло[2,3-d]пиримидины и их применение в качестве ингибиторов тирозинкиназы.
Parrizas et al. описали тирфостины с ингибирующей IGF-1R активностью in vitro и in vivo (Endocrinology, 138:1427-1433 (1997)) и в публикация Международной патентной заявки № WO 00/35455 описаны гетероариларилмочевины в качестве ингибиторов IGF-1R. В публикации Международной патентной заявки № WO 03/048133 описаны производные пиримидина в качестве модуляторов IGF-1R. В публикации Международной патентной заявки № WO 03/024967 описаны химические соединения с ингибирующими действиями в отношении протеинкиназ. В публикации Международной патентной заявки № WO 03/068265 описаны методы и композиции для лечения гиперпролиферативных состояний. В публикации Международной патентной заявки № WO 00/17203 описаны пирролопиримидины в качестве ингибиторов протеинкиназ. В публикации заявки на патент Японии № JP 07/133280 описано производное цефема, его получение и антимикробная композиция. A. Albert et al., Journal of the Chemical Society, 11:1540-1547 (1970) описали исследования птеридина и птеридинов, не замещенных в 4-положении, синтез их из пиразинов через образование 3,4-дигидроптеридинов. A. Albert et al., Chem. Biol. Pteridines Proc. Int. Symp., 4th, 4: 1-5 (1969) описали синтез птеридинов (не замещенных в 4-положении) из пиразинов через образование 3,4-дигидроптеридинов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
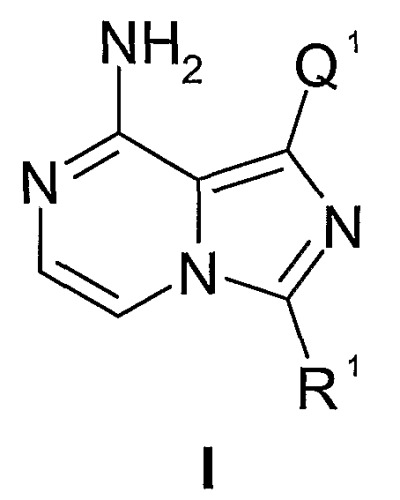
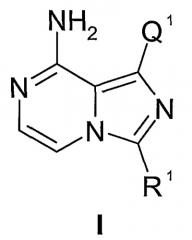
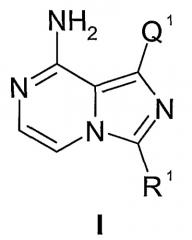
Настоящее изобретение относится к соединениям формулы I:
или их фармацевтически приемлемым солям. Соединения формулы I ингибируют фермент IGF-1R и являются применимыми для лечения и/или профилактики различных заболеваний и состояний, которые поддаются лечению ингибированием IGF-1R. Соединения данного изобретения являются применимыми в качестве ингибиторов серин/треонин- и тирозинкиназ. В частности, соединения данного изобретения являются применимыми в качестве ингибиторов тирозинкиназ, которые являются важными при гиперпролиферативных заболеваниях, особенно раке.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединению формулы I:
или его фармацевтически приемлемой соли, где
Q1 представляет собой арил1, гетероарил1, циклоалкил, гетероциклил, циклоалкенил или гетероциклоалкенил, любой из которых необязательно замещен одним-пятью независимыми заместителями G1;
R1 представляет собой алкил, циклоалкил, бициклоалкил, арил, гетероарил, аралкил, гетероаралкил, гетероциклил или гетеробициклоалкил, любой из которых необязательно замещен одним или несколькими независимыми заместителями G11;
G1 и G41 представляют собой, каждый независимо, галоген, оксо, -CF3, -OCF3, -OR2, -NR2R3(R3a)j1, -C(O)R2, -CO2R2, -CONR2R3, -NO2, -CN, -S(O)j1R2, -SO2NR2R3, NR2(C=O)R3, NR2(C=O)OR3, NR2(C=O)NR2R3, NR2S(O)j1R3, -(C=S)OR2, -(C=O)SR2, -NR2(C=NR3)NR2aR3a, -NR2(C=NR3)OR2a, -NR2(C=NR3)SR3a, -O(C=O)OR2, -O(C=O)NR2R3, -O(C=O)SR2, -S(C=O)OR2, -S(C=O)NR2R3, C0-10алкил, C2-10алкенил, C2-10алкинил, C1-10алкоксиC1-10алкил, C1-10алкоксиC2-10алкенил, C1-10алкоксиC2-10алкинил, C1-10алкилтиоC1-10алкил, C1-10алкилтиоC2-10алкенил, C1-10алкилтиоC2-10алкинил, циклоС3-8алкил, циклоС3-8алкенил, циклоС3-8алкилС1-10алкил, циклоС3-8алкенилС1-10алкил, циклоС3-8алкилС2-10алкенил, циклоС3-8алкенилС2-10алкенил, циклоС3-8алкилС2-10алкинил, циклоС3-8алкенилС2-10алкинил, гетероциклил-С0-10алкил, гетероциклил-С2-10алкенил или гетероциклил-С2-10алкинил, любой из которых необязательно замещен одним или несколькими независимыми заместителями из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333(R333a)j1a, -C(O)R222, -CO2R222, -CONR222R333, -NO2, -CN, -S(O)j1aR222, -SO2NR222R333, NR222(C=O)R333, NR222(C=O)OR333, NR222(C=O)NR222R333, NR222S(O)j1aR333, -(C=S)OR222, -(C=O)SR222, -NR222(C=NR333)NR222aR333a, -NR222(C=NR333)OR222a, -NR222(C=NR333)SR333a, -O(C=O)OR222, -O(C=O)NR222R333, -O(C=O)SR222, -S(C=O)OR222