Напитки с пониженным содержанием проламина и способы их получения
Иллюстрации
Показать всеИзобретение относится к биотехнологии и пищевой промышленности и касается способа получения напитка, основы напитка, концентрата напитка, имеющих пониженное содержание проламина. Способ предусматривает следующие стадии: а) взаимодействие напитка или предшественника напитка с трансглутаминазами с получением модифицированного проламина; б) по меньшей мере частичное удаление модифицированного проламина. Изобретение позволяет эффективно получать напитки с пониженным содержанием проламина. 4 н. и 10 з.п. ф-лы, 3 ил., 1 табл.
Реферат
Настоящее изобретение относится к напиткам, имеющим пониженное содержание проламина, и способам их получения.
Проламины (глютен) представляют собой группу белков, растворимых в этаноле из различных видов злаков, и носят название глиадины в пшенице, гордеины в ячмене, секалины во ржи и авенины в овсе. Несмотря на структурные различия в первичных последовательностях, проламины также часто носят название глутенов или глиадинов вне зависимости от того, выделены ли они из пшеницы или из других видов злаков. Большое число видов злаков, которые применяют при производстве продуктов питания и напитков, содержат проламины, частично в значительных количествах. В качестве примера, при производстве напитков здесь могут быть упомянуты: все типы пива и смешанных напитков на основе пива, безалкогольные напитки на основе солода (например, солодовое пиво), солодовый кофе или кофе на основе хлебных злаков. При ежегодном потреблении на душу населения около 80 литров, пиво остается одним из наиболее потребляемых в Европе напитков. В качестве альтернативы, смешанные напитки на основе пива и так называемые инновационные напитки, обладающие дополнительными преимуществами, переживают растущую популярность среди молодого поколения. С этой точки зрения и из-за ценных с точки зрения физиологии ингредиентов, хорошие шансы на рынке прогнозируют для напитков на основе исходных материалов злаков. Однако, поскольку все указанные напитки всегда содержат проламины (глютен) в различных концентрациях, потребление подобных напитков категорически запрещено больным целиакией.
Целиакия или глютеновая энтеропатия представляет собой хроническое аутоиммунное заболевание, которое обусловлено определенными белками злаков (проламины, глютен) у генетически предрасположенных пациентов. У больных целиакией синдромы кишечной мальабсорбции из-за обширных повреждений слизистой тонкого кишечника, вызванных действием глютена, наблюдаются в большинстве случаев уже на первом или втором году жизни. У подавляющего большинства пациентов экспрессируются так называемые HLA-DQ2 и/или HLA-DQ8 молекулы. С точки зрения современной науки предполагается, что пролиферация Т-лимфоцитов индуцируется взаимодействием определенных глиадиновых молекул с HLA-DQ2/HLA-DQ8 антигенами. Указанный чрезмерный иммунный ответ отражается в причинной взаимосвязи с дегенерацией слизистой тонкого кишечника. Если действие глютена продолжается, эпителиальная регенерация становится недостаточной, вызывая атрофию ворсинок тонкого кишечника и пониженную способность к всасыванию, нулевой рост, дистрофию, мышечную ионную недостаточность, стул с неприятным запахом; существует даже вероятность злокачественных сарком. Дополнительные симптомы включают депрессию и анемию.
Поскольку в настоящее время не существует лекарственных препаратов, которые приводят к излечению глютеновой энтеропатии/ целиакии, единственно возможная терапия состоит в пожизненном отказе от содержащих глютены пищевых продуктов. Хотя для промышленных стран ранее предполагался коэффициент заболеваемости 1:1200, в настоящее время установлена распространенность от 1:100 до 1:200, за счет активного исследования и улучшенной возможности диагностики, так что можно считать, что целиакия представляет собой одно из наиболее часто встречаемых хронических кишечных заболеваний в странах Запада.
Герпетиформный дерматит или болезнь Дюринга представляет собой папуловезикулярный дерматоз (папулы = узлы; везикулы = мелкие волдыри), характеризующийся сильным зудом. Пациенты, страдающие от болезни Дюринга, также имеют в 24% случаев целиакию, даже если обычные симптомы последнего заболевания часто могут отсутствовать. В биопсии тонкого кишечника у вплоть до 85% пациентов с герпетиформным дерматитом наблюдаются изменения со значительной атрофией кишечных ворсинок, типичной для целиакии. Таким образом, пациентов, страдающих от гепертиформного дерматита Дюринга, необходимо исследовать на целиакию. В таких случаях безглютеновая диета, в большинстве случаев, приводит к исчезновению кожных повреждений в течение продолжительного времени.
При селекции или разведении пищевых злаков в течение продолжительного времени добивались высокого содержания белка и, таким образом, высокого содержания глютена по двум причинам.
По сравнению с крахмалом и другими полисахаридами белок представляет собой более ценный компонент с точки зрения физиологии пищеварения и глютен важен для некоторых технологических характеристик при обработке злаков. Так, например, содержание и структура глютена важны для необходимых физико-химических характеристик, таких как эластичность, газоудерживающие характеристики, клейкость или ферментативная стабильность теста.
Исходя из этого, во всех важных видах злаков, таких как пшеница, рожь, ячмень, а также полба, невызревшая полба, айнкорн, эмер, камут, тритикале, булгур и овес, содержатся проламины, которые делают полученные из них пищевые продукты и напитки непригодными для употребления пациентами с целиакией.
Если для напитков используют виды проламинсодержащих зерновых, в большинстве случаев следует считать, что в продукте также присутствуют глиадины, т.е. содержатся в количествах, которые препятствуют потреблению больными целиакией. Как использование злаков, не содержащих глиадины (гречка, рис, просо и т.д.), так и контроль при обработке в ходе получения напитка, который обеспечивает в общем отделение белков, в большинстве случаев невозможны по множеству причин. Дополнительно к доступности исходных продуктов, которая не всегда гарантирована, такие напитки в большинстве случаев имеют измененные органолептические характеристики, такие как вкус или ощущение во рту. Также физико-химические характеристики, такие как вспенивание и стабильность пены, в большинстве случаев не достигают обычных параметров, ожидаемых потребителем. Другая проблема состоит в риске загрязнения исходных продуктов/промежуточных продуктов, не содержащих глиадина, исходными продуктами/промежуточными продуктами, содержащими глиадин, в ходе получения, перевозки, хранения и обработки.
ЕР 0949329 А1 описывает пиво, не содержащее глютена, сбраживаемое из гречки и гидролизованного кукурузного крахмала при использования амилолитических ферментов и глюканазы.
В качестве альтернативы исследовательская активность в настоящее время направлена на разработку генетически измененных сортов злаков, которые не способны продуцировать глиадины. Разработки все еще находятся на ранней стадии и в настоящее время невозможно предсказать будут ли и когда эти растения будут культивировать коммерчески, смогут ли исходные материалы, получаемые из них, в дальнейшем применяться для процессов сбраживания, и какое признание потребителя получат такие генетически модифицированные сорта злаков в конечном счете.
С этой точки зрения практически все получаемые напитки на основе обычных видов злаков содержат определяемые количества глиадинов и их содержание особенно высоко в пиве, для получения которого используют ячмень или пшеницу.
Сшивающие ферменты представляют собой ферменты, которые могут образовывать ковалентные связи в белках или между белками и другими веществами, такими как углеводы, фенолы и, таким образом, вызывать образование белковых агрегатов, в некоторых случаях с участием других веществ. Типичные представители представляют собой трансглутаминазы, пероксидазы, гексозоксидазы, тирозиназы и лакказы, см. также Thalmann C.R. & Lötzbeyer T. 2002: Enzymatic cross-linking of proteins with tyrosinase. Eur. Food Res. Technol. 214: 276-281; патент США 6358543 (Method of improving the properties of a flour dough, flour dough improving composition and improved food products), Boeriu C.G., Oudgenoeg G., Spekking W.T., Berendsen L.B., Vancon L., Boumans H. Gruppen H., van Berkel W.J., Laane C., Voragen A.G. 2004, Horseradish peroxidase-catalyzed cross-linking of feruloylated arabinoxylans with beta-casein. J Agric. Food Chem., Oct. 20, 2004, 52(21): 6633-9.
Трансглутаминазы (белок-глутамин: амин-γ-глутамилтрансфераза; Е.С. 2.3.2.13) катализируют образование стабильного сшивания между белками. При указанном катализе γ-карбоксиамидную функцию глутаминовой боковой цепи переводят в ε-аминогруппу лизиновых остатков с высвобождением аммониевых ионов (Folk and Finlayson, Adv. Protein Chem., 31, 1-133 (1977)).
Образованная изопептидная связь также выдерживает гидролиз протеазами и расщепляется физиологически только после полного расщепления белков γ-глутамиламинциклотрансферазой и γ-глутамилтрансферазой (Fink et al., Proc. Natl. Acad. Sci. USA 77, 4564-4568 (1980), Seguro et al.; J. Agric. Food Chem. 43; 1977-1981 (1995)).
Для технических применений особенно пригодна бактериальная трансглутаминаза Streptomyces mobaraensis. Бактериальную трансглутаминазу выделяют из непатогенного и нетоксичного Streptomyces mobaraensis. Согласно Управлению по контролю за продуктами и лекарствами США (FDA) указанное получение трансглутаминазы (Tgase) получило оценку как «признанное безвредным» (GRAS) (GRN 000095). Благодаря низкой стоимости ее производства, ее широкому диапазону субстратов и высокой скорости реакции, указанный фермент предназначен для промышленных применений в пищевой промышленности. В качестве примеров могут быть упомянуты сшивание мяса, рыбы, сыра, молока, сывороточных белков молока, белков сои и белков пшеницы для достижения улучшенной структуры, более высокой вязкости или приятного ощущения во рту. Таким образом, за счет использования трансглутаминазы стала возможной разработка новых пищевых продуктов (Yokoyama et al., Appl. Microbiol. Biotechnol. 64, 447-454 (2004)).
WO 02/051873 описывает способ получения очищенного крахмала из растительных исходных материалов, содержащих белок, под действием сшивающих агентов, например трансглутаминазы. После того, как белки, присутствующие в исходном материале или дополнительно добавленные, сшили трансглутаминазой, стало возможным более легкое отделение крахмала от белкового каркаса.
ЕР 1190624 А2 описывает способы улучшения качества теста с низким содержанием пшеницы с точки зрения технологии выпекания при помощи трансглутаминазы. За счет использования фермента, помимо прочего, могут быть достигнуты повышенные характеристики газоудержания, пониженная клейкость теста, а также улучшенная ферментативная стабильность.
US 6106887 описывает способ получения модифицированных типов муки из злаков при использовании трансглутаминазы в ходе процессов сбора и перемалывания.
ЕР 0760209 А1 описывает использование трансглутаминазы для получения хлебопекарных продуктов, имеющих многослойную структуру.
WO 01/65948 описывает получение белка, полученного под действием трансглутаминазы из белка пшеницы (глютен) и белка сыворотки молока и имеющего улучшенные технологические свойства, такие как характеристика эмульгирования, характеристика желирования и характеристика связывания воды.
Предмет настоящего изобретения состоит в преодолении упомянутых недостатков и проблем предшествующего уровня техники, особенно в обеспечении способа получения напитков с пониженным содержанием проламина и сходных продуктов.
Указанную цель достигают при помощи способа получения напитка, основы напитка, концентрата напитка или добавки к напитку, имеющих пониженное содержание проламина, из исходных проламин-содержащих материалов, предусматривающего следующие стадии:
а) взаимодействие напитка или предшественника напитка с сшивающими ферментами с получением модифицированного проламина;
б) по меньшей мере частичное удаление модифицированного проламина.
Пригодные исходные проламинсодержащие материалы в частности включают пшеницу, зерновые, такие как рожь, овес, ячмень, полбу, невызревшую полбу, айнкорн, эмер, тритикале, булгур, камут или их смеси.
Пригодные сшивающие ферменты включают, особенно такие, которые относятся к классам ферментов трансглутаминаз (ЕС 2.3.2.13), пероксидаз (ЕС 1.11.1.7) гексозоксидаз (ЕС 1.1.3.5), тирозиназ (ЕС 1.14.18.1), лакказ (ЕС 1.10.3.2), белок-дисульфидизомераз (ЕС 5.3.4.1) и их комбинациям.
Особенно предпочтительные сшивающие ферменты включают бактериальные траснглутаминазы, особенно Ca2+-независимые трансглутаминазы из Streptomyces mobaraensis.
«Проламины» в терминах настоящей заявки включают растворимые в этаноле белки из видов злаков, которые также называют глютеном, глиадинами, гордеинами, секалинами или авенинами.
«Напиток» обозначает пищевой продукт, который можно потреблять в жидкой форме.
«Основа напитка» или «концентрат напитка» обозначает предшественник для получения пищевого продукта в твердой или в жидкой форме, который можно потреблять в качестве пищевого продукта после дополнительной обработки.
Согласно способу по изобретению содержание проламина в напитках, концентратах напитков или в предшественниках напитков может быть уменьшено, при этом физико-химические свойства напитка изменяются настолько мало, насколько это возможно.
Например, обработка трансглутаминазой согласно настоящему изобретению может быть использована для получения пива, органолептические и физико-химические свойства которого сходны со свойствами обычного пива. Особенно это относится к характеристикам пенообразования и стабильности пены, плотности, цвету, содержанию экстракта, степени ферментации или единицам горечи.
Количество применяемого фермента зависит от получения фермента и может изменяться в широких пределах. Оно зависит от содержания проламина в используемых исходных материалах и промежуточных продуктах, от времени реакции, температуры реакции, значения рН и т.д., как известно специалистам, работающим с ферментами.
При получении напитка из злаков, особенно при получении пива, практически все стадии способа позволяют добавлять трансглутаминазу согласно изобретению без значительных затрат времени и стоимости. Как правило, за указанными стадиями следуют стадии инактивации нагреванием, фильтрации и центрифугирования, что позволяет полностью инактивировать активность фермента и по меньшей мере частично выделить модифицированные проламины.
Согласно изобретению напитки, которые могут быть получены, выбирают из группы, состоящей из алкогольного пива, пива с пониженным содержанием алкоголя, безалкогольного пива, солодового пива, смешанных напитков на основе пива, лимонадов, безалкогольных напитков, напитков на основе фруктового сока, эмульсионных напитков, смешанных напитков на основе фруктового сока и их смесей.
В рамках способа можно осуществлять добавление белков и белковых гидролизатов, одобренных для пищевых продуктов, таких как желатин, молоко и сывороточные белки, к напитку, предшественнику напитка перед, в течение или после взаимодействия с сшивающими ферментами.
Для удаления модифицированного проламина пригодны обычные способы выделения, такие как фильтрация, центрифугирование, осаждение или просеивание. Часто технологические стадии из производства напитка могут быть использованы одновременно для выделения модифицированного проламина.
Ферменты могут быть использованы в очищенной форме или в форме, в которой они были получены, например, в виде экстракта из сочетающегося с пищевыми продуктами организма.
В одном из вариантов осуществления указанное взаимодействие с сшивающими ферментами может быть осуществлено путем добавления микроорганизмов, которые рекомбинантно продуцируют сшивающие ферменты. В частности, в качестве указанных микроорганизмов пригодны дрожжи. В качестве альтернативы, в рамках способа также возможно, чтобы сшивающие ферменты уже были рекомбинантно экспрессированы в злаках и затем входили в контакт с проламинами.
Выбор условий способа может быть установлен специалистом в адаптации производственного способа. Специалист знает, что скорость конверсии ферментативной реакции обычно увеличивается с увеличением количества фермента или с повышением температуры. Низкие температуры требуют больших количеств или более продолжительного времени реакции. При более высоких температурах достаточно меньших количеств или более короткого времени действия.
Обычно взаимодействие напитка или предшественника напитка с сшивающими ферментами осуществляется в течение от примерно 10 мин до 24 часов. Обычно температура составляет от 5 до 50°С.
В одном из вариантов осуществления способа, после указанного взаимодействия следует стадия инактивации ферментов, особенно тепловая обработка.
Изобретение дополнительно относится к напитку, основе напитка, концентрату напитка или добавке к напитку, получаемых способом согласно изобретению и к пищевому продукту, который содержит указанную основу напитка или концентрат напитка, например, в форме йогурта, смешанного напитка на основе молока или диетического напитка с содержанием злаков, или порошку для получения напитка.
Согласно изобретению при использовании способа уменьшается содержание проламина в напитке. Предпочтительно содержание проламина после обработки ниже 500 ч/млн, более предпочтительно, ниже 100 ч/млн, еще более предпочтительно, ниже 50 ч/млн и, наиболее предпочтительно, ниже 20 ч/млн. Количество ниже 20 ч/млн пригодно для употребления больными целиакией и больными герпетиформным дерматитом и может рассматриваться как «не содержащее глутен».
Изобретение дополнительно относится к использованию сшивающих ферментов для модификации проламина в напитках, основах напитков или в концентратах напитков, полученных из проламин-содержащих зерновых.
Способ согласно изобретению приводит к получению напитка, который, благодаря своему пониженному содержанию проламина, характеризуется большей приемлемостью для пациентов, страдающих от целиакии и/или герпетиформного дерматита. Неожиданно соответствующие напитки также характеризуются улучшенными физико-химическими характеристиками, особенно с точки зрения стабильности к помутнению (коллоидная стабильность).
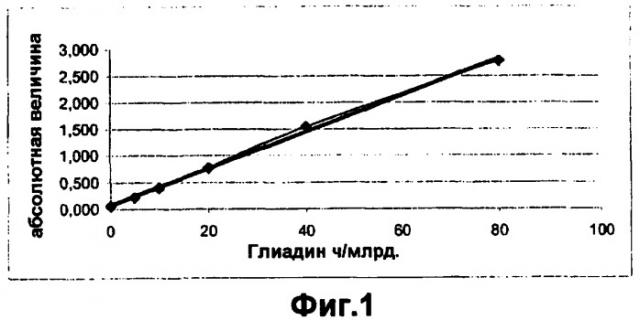
Фиг.1 - график с калибрационной прямой для определения концентрации глиадина в образце.
Фиг.2а - график уменьшения глютена в пиве Хефевайзен (Hefeweizen) (2 часа, 37°С) как функцию концентрации фермента.
Фиг.2b - график уменьшения глютена в пиве Хефевайзен (Hefeweizen) (1 ед./мл, 37°С) как функцию времени.
Фиг.2с показывает уменьшение глютена в пиве Хефевайзен (Hefeweizen) (25 ед./мл, 2 часа) как функцию температуры.
Фиг.3 показывает схему, относящуюся к возможному добавлению трансглутаминазы в ходе получения пива.
Изобретение далее будет проиллюстрировано следующими неограничивающими примерами.
Примеры
1) Определение содержания глиадина в продуктах
Аналитическое определение глиадинов в исходных продуктах, промежуточных продуктах и конечных напитках устанавливали при использовании глиадинового теста RIDASCREEN®, иммуноферментным сэндвич-анализом для количественного определения глиадинов из пшеницы и родственных проламинов из ржи и ячменя в пищевых продуктах. С пределом определения 1,5 ч/млн, указанный набор для анализа представляет собой золотой стандарт аналитических тестовых систем.
Принцип теста основан на реакции антиген-антитело. Ячейки планшеты для микротитрования покрыты специфическими антителами против глиадинов. При добавлении стандартного глиадина или содержащего глиадин образца образуется комплекс антитело-антиген, который определяют на следующей стадии при использовании второго антитела, которое связано с ферментом пероксидазой. Определение проводят при добавлении субстрата пероксида мочевины, а также хромогена (тетраметилбензидин). Фермент, связанный с антителом, превращает бесцветный хромоген в голубой конечный продукт. Добавление стоп-реагента (H2SO4) приводит к изменению цвета с голубого на желтый. Измерения проводят фотометрией при 450 нм в спектрофотометре для прочтения планшетов для микротитрования. Концентрацию глиадина в мкг/кг (ч/млрд), которая соответствует экстинции образца, определяют по калибровочной кривой и из нее рассчитывают действительное содержание глутена в образце, сравнить с Фиг.1.
2) Удаление глиадинов из пива Вайзенбир (Weizenbier) путем добавления трансглутаминаз
2а) Зависимость от концентрации фермента
В 2 мл реакционном сосуде инкубировали 40 мкл каждого из препаратов фермента с различной трансглутаминазной активностью с 1960 мкл пива при 37°С в течение 2 ч. После истечения времени инкубации ферментную активность инактивировали в течение 10 мин при 100°С. Содержание глутена в растворах определяли способом, как описано в Примере 1. Фиг.2а показывает содержание определяемых глиадинов как функции от концентрации фермента.
2b) Зависимость от времени инкубирования
В 2 мл реакционном сосуде инкубировали 40 мкл каждого из препаратов фермента с трансглутаминазной активностью 1 ед./мл с 1960 мкл пива при 37°С. После истечения времени инкубации, ферментную активность инактивировали в течение 10 мин при 100°С. Содержание глутена в растворах определяли способом, как описано в Примере 1. Фиг.2b показывает содержание определяемых глиадинов как функции от времени инкубации.
2c) Зависимость от температуры
В 2 мл реакционном сосуде инкубировали 40 мкл каждого из препаратов фермента с трансглутаминазной активностью 25 ед./мл с 1960 мкл пива в течение 2 ч при различных температурах. После истечения времени инкубации ферментную активность инактивировали в течение 10 мин при 100°С. Содержание глутена в растворах определяли способом, как описано в Примере 1. Фиг.2с показывает содержание определяемых глиадинов как функции от температуры инкубации.
3) Получение пива, не содержащего глиадина
Проводили эксперименты согласно стандартному способу сбраживания. Десять кг сусла перемалывали и доводили до температуры затирания с 40 л воды для пивоварения. После стандартного способа затирания с 40 л промывочной воды проводили фильтрацию до объема 75 л сусла. Последующее кипячение сусла проводили в течение от 60 до 90 минут с добавлением хмеля и последующим периодом выдерживания в устройстве вихревого потока в течение от 20 до 30 минут. За этим следует отделение горячего осадка и сусло охлаждали до температуры введения дрожжей, 6°С, при помощи пластинчатого охладителя. Для брожения использовали дрожжи низового брожения для пива типа пильзенского пива. Брожение проводили в резервуарах в течение 6 дней. Затем дрожжи отделяли от зеленого пива, которое откачивали через сифон в резервуар Корнелиуса для дображивания и хранения. После от 20 до 30 дней пиво фильтровали, бутилировали и пастеризовали.
3а) Действие трансглутаминазы на различные промежуточные продукты в ходе способа брожения
Фиг.3 схематически иллюстрирует способ брожения пива типа пильзенского пива и иллюстративно показывает применение трансглутаминазы в различных стадиях способа.
3b) Действие трансглутаминазы на различные сорта коммерчески доступного пива
Поскольку дополнительно к ячменному солоду для получения пива Вайзенбир (Weizenbier) также используется пшеничный солод, сорта полученного из него пива имеют очень высокое содержание глутена, которое может часто достигать значений очевидно >1000 ч/млн. Таблица показывает примеры применения трансглутаминазы для удаления глиадина из различных сортов коммерчески доступного пива. В обрабатываемых сортах пива после 24 часов обработки при комнатной температуре глиадины не были обнаружены.
| Таблица | ||
| Пиво | Сорт | Концентрация глутена [ч/млн] |
| 1 | Вайзенбир, светлое | 1500 |
| 2 | Вайзенбир, светлое | 1725 |
| 3 | Вайзенбир, темное | 360 |
| 4 | Пильзен | 170 |
| 5 | Пильзен | 590 |
| 6 | Пильзен, безалкогольное | 40 |
4) Получение солодовой основы, не содержащей глиадина, для основ напитка
В 1 л теплой воды растворяли 30 г солодового экстракта, имеющего содержание сухого вещества 80 брикс при от 40 до 50°С при интенсивном перемешивании. Затем добавляли от 100 до 1000 ед. трансглутаминазы на литр смеси и все перемешивали при 50°С в течение 1 ч. Нерастворимые компоненты затем удаляли при помощи фильтрации или разделения. Солодовая основа, не содержащая глиадина, может быть составлена в основу с исходными продуктами, обычными для производства напитков (например, сок, эмульсии, стабилизаторы, кислоты, углеводы, вкусовые вещества, эссенции, красители, заменители сахара) и ингредиентами (минералы, витамины, функциональные ингредиенты) при использовании известных технологических стадий, таких как гомогенизация и пастеризация.
5) Получение напитка, не содержащего глиадинов
Для получения напитка на солодовой основе, не содержащего глиадинов, солодовую основу, обработанную согласно изобретению, согласно примеру 4, смешивали с 0,3% лимонной эссенцией, 0,4% лимонной кислотой и примерно 8% сахара, бутилировали и подвергали стадии пастеризации.
1. Способ получения напитка, основы напитка или концентрата напитка, имеющих пониженное содержание проламина, из исходных проламинсодержащих материалов, включающий следующие стадии:а) взаимодействие напитка или предшественника напитка с сшивающими ферментами с получением модифицированного проламина;б) по меньшей мере частичное удаление модифицированного проламина, причем указанные сшивающие ферменты являются трансглутаминазами.
2. Способ по п.1, в котором указанный сшивающий фермент представляет собой бактериальные траснглутаминазы, особенно Са2+-независимые трансглутаминазы из Streptoverticillium mobaraense.
3. Способ по п.1 или 2, в котором зерновые, такие как рожь, овес, ячмень, полба, невызревшая полба, айнкорн, эмер, тритикале, булгур, камут, другие проламинсодержащие исходные материалы или их смеси, используют в качестве исходных проламинсодержащих материалов.
4. Способ по любому из пп.1-3, в котором указанный напиток выбирают из группы, состоящей из алкогольного пива, пива с пониженным содержанием алкоголя, безалкогольного пива, солодового пива, смешанных напитков на основе пива, лимонадов, безалкогольных напитков, напитков на основе фруктового сока, эмульсионных напитков, смешанных напитков на основе фруктового сока, питьевых йогуртов, диетических напитков, содержащих зерновые, и их смесей.
5. Способ по любому из пп.1-4, в котором указанные белки и белковые гидролизаты, одобренные для пищевых продуктов, такие как желатин, молоко и сывороточные белки, добавляют к напитку, предшественнику напитка перед, в течение или после указанного взаимодействия с сшивающими ферментами.
6. Способ по любому из пп.1-5, в котором для указанного по меньшей мере частичного удаления модифицированного проламина используют традиционные способы выделения, такие как фильтрация, центрифугирование, осаждение или просеивание.
7. Способ по любому из пп.1-6, в котором указанное взаимодействие со сшивающими ферментами осуществляют путем добавления микроорганизмов и/или злаков, причем указанные микроорганизмы или зерновые рекомбинантно продуцируют сшивающие ферменты.
8. Способ по любому из пп.1-7, в котором указанный микроорганизм представляет собой дрожжи.
9. Способ по любому из пп.1-8, в котором инактивацию указанных сшивающих ферментов осуществляют после указанного контактирования, особенно путем тепловой обработки.
10. Напиток, основа напитка или концентрат напитка, полученные способом по любому из пп.1-8.
11. Напиток, основа напитка или концентрат напитка по п.11, которые получены из исходных проламинсодержащих материалов, имеющих содержание проламина ≤20 ч/млн.
12. Пищевой продукт, содержащий основу напитка или концентрат напитка по п.11.
13. Пищевой продукт по п.12, который получен из исходных проламинсодержащих материалов, имеющих содержание проламина ≤20 ч/млн.
14. Применение трансглутаминаз для модификации проламина в напитках, основах напитка или концентратах напитка, изготовленных из проламинсодержащих злаков.