Лекарственные составы с контролируемым высвобождением, основанные на блок-сополимерах
Иллюстрации
Показать всеИзобретение раскрывает фармацевтическую композицию для контролируемого высвобождения относительно токсичных активных соединений, в особенности биоактивных протеинов из класса интерферонов. Композиция содержит биоразлагаемый блок-сополимер, состоящий из поли(этиленгликоль)терефталата (ПЭГТ) в количестве от 50 до 95% вес. и поли(бутилентерефталата) (ПБТ). Композиция может быть представлена в виде инъекционных микрочастиц, инъекционной жидкости, обладающей способностью самостоятельного гелеобразования или твердого имплантата. Кроме того, изобретение предлагает фармацевтический набор, включающий упомянутую композицию, способы приготовления композиции и фармацевтические варианты ее применения. Изобретение обеспечивает первоначальное высвобождение в течение 4 часов не более приблизительно 10% включенного количества одного или более альфа-интерферонов и, по меньшей мере, 80% одного или более альфа-интерферонов высвобождается в мономерной неагрегированной форме. 30 з.п. ф-лы, 2 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к фармацевтическим составам для контролируемого высвобождения активных соединений. Эти составы существуют в виде полимерных микрочастиц, гелей in-situ или твердых имплантатов. Они основаны на биоразлагаемых полимерах и особенно полезны для контролируемой доставки в ткани лечебных протеинов или пептидов. Кроме того, изобретение относится к полимерным микрочастицам, включенным в упомянутые составы и к методам изготовления таких частиц. В дополнительных аспектах изобретение относится к фармацевтическим наборам, которые включают упомянутые составы, и к использованию таких наборов.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Парентеральные лекарственные формы, обладающие способностью медленно выделять лекарство, были созданы в ответ на потребность в улучшении терапевтического использования лекарственных веществ, которые из-за их физико-химических свойств нельзя вводить оральным путем и которые имеют относительно короткий период полувыведения, что заставляет делать частые инъекции. Частые инъекции неудобны для больных, а если их делают врачи или медицинские сестры, то это обходится довольно дорого. Ощущения дискомфорта и боли могут привести к нарушению дисциплины больных в выполнении врачебного назначения и поставить под угрозу успех лечения.
Число лекарственных веществ, которые нельзя вводить в организм удобным оральным способом, неизбежно возрастает, главным образом, вследствие новейших достижений биотехнологических исследований в области фармакологии, приведших к появлению множества мощных пептидных и белковых лекарств. Возможно, за исключением некоторых мелких пептидов, эти соединения довольно нестабильны в желудочно-кишечной среде, а также, что еще более важно, слишком велики и гидрофильны как молекулы, чтобы всасываться через слизистую оболочку кишечника в достаточном количестве. Для некоторых из веществ с такими свойствами разрабатываются инъекционные или имплантируемые рецептуры с контролируемым высвобождением, позволяющие уменьшить частоту введения доз, то есть снижающие дискомфорт для больных, что приводит к повышению дисциплины и увеличению вероятности конечного успеха терапии.
Парентеральные лекарственные формы с контролируемым высвобождением обычно выпускаются в виде макроскопических твердых одиночных или множественных имплантатов (например, полимерных стержней и вафельных пластинок), взвесей микрочастиц, а в последние годы также и гелей, включая гели, образующиеся in-situ. Твердые имплантаты с загруженными лекарствами выпускаются в виде неразлагающихся полимерных, керамических или металлических устройств, которые необходимо удалять хирургическим путем после определенного периода воздействия лекарства, или в виде биоразлагаемых полимерных форм, которые не требуют удаления из организма. Примером не разрушающегося имплантата служит устройство Viadur® компании Байер, которое высвобождает пептидное лекарство лейпролид в течение одного года. Примером биологически разрушающегося имплантата служит Zoladex® компании AstraZeneca, представляющий собой полимерный стержень, способный высвобождать пептидное лекарство госелерин в течение одного или трех месяцев, соответственно.
Вскоре после появления на рынке первых биоразлагаемых имплантатов стали выпускаться микрочастицы с контролируемым высвобождением, например, депонированные лекарственные формы Lupron® от компании Takeda, которые высвобождают лейпролид в течение одного, трех и четырех месяцев, соответственно. Для того чтобы ввести такие микрочастицы через инъекцию, их надо суспендировать в водном носителе. Однако по соображениям стабильности депонированные микрочастицы нельзя длительно хранить в виде водной суспензии, а надо восстанавливать из сухого порошка непосредственно перед применением.
Различные конструкции микрочастиц с загрузкой лекарств и методы их приготовления описаны в публикации E. Mathiowitz et al., Microencapsulation (Микрокапсулирование), в книге: Encyclopedia of Controlled Drug Delivery (Энциклопедия контролируемой доставки лекарств в организм) (под редакцией E. Mathiowitz), Vol. 2, p. 493-546, John Wiley & Sons (1999), которая упоминается здесь в качестве ссылки.
Для осуществления инъекций систем доставки лекарств через особо тонкие иглы, создающие повышенный комфорт для больного, ученые, занимающиеся проблемой доставки лекарств, в последние годы начали разрабатывать инъекционные гели, способные образовывать подкожные или внутримышечные депо. В одной из концепций создаются лекарственные формы в виде гелей, обладающие высокой способностью к разжижению при сдвиге и тиксотропностью. Прикладывая к этим гелям усилие сдвига перед введением в организм, можно существенно снизить их вязкость, что позволяет выполнить инъекцию относительно небольшой иглой, причем после введения геля его прочность медленно восстанавливается. В соответствии с другой концепцией создаются жидкие лекарственные композиции, которые после введения в организм образуют гели в ответ на изменения окружающей среды, в частности, pH, температуры и ионной силы. Согласно третьему подходу в организм посредством инъекции вводят жидкие полимерные лекарства, содержащие безводный растворитель. После введения растворитель диффундирует, уходя из места инъекции, что приводит к преципитации полимерных частиц или к образованию геля.
Подробное обсуждение биологически разлагающихся инъекционных гелей представлено в публикации A. Hatefi et al., Journal of Controlled Release 80 (2002), 9-28, которая упоминается здесь для ссылки.
Терапевтическая полезность разных полимерных носителей для контролируемого высвобождения лекарственных веществ, особенно полимеров и сополимеров молочной кислоты и гликолевой кислоты, была продемонстрирована для нескольких активных соединений, в частности лейпролида, гозерелина, бусерелина и трипторелина, - все они представляют собой пептиды с очень большим терапевтическим индексом, т.е. с весьма малой токсичностью даже в дозах, намного превышающих терапевтически эффективные концентрации. В отличие от этого, для хуже переносимых активных соединений, например эритропоэтинов и интерферонов, когда необходима точно контролируемая доставка, позволяющая достичь лечебного эффекта без неприемлемых побочных эффектов, лекарственные формы с контролируемым высвобождением разрабатывались с гораздо меньшим успехом. Основная трудность заключается в том, что биоразлагаемые полимерные носители, которые успешно использовались раньше, очевидно, неспособны обеспечить профиль высвобождения нулевого или близкого к нулевому порядка. Вместо этого при введении в организм они создают весьма нежелательное начальное взрывное высвобождение. Более того, аутокаталитический распад полимеров и сополимеров молочной кислоты и гликолевой кислоты также может приводить к эффектам демпинга дозы на более поздних стадиях высвобождения лекарства. С другой стороны, другие новые полимеры, которые обсуждались как улучшенные носители для контролируемого высвобождения лекарственных соединений, не имеют профиля безопасности, характерного для поли(лактидов) и поли(гликолидов).
Таким образом, существует потребность в новых полимерных системах доставки с доказанной биологической совместимостью, которые в то же время способны лучше контролировать высвобождение относительно токсичных терапевтических соединений, чем прежние носители.
Поэтому цель изобретения состоит в том, чтобы удовлетворить потребность в новых лекарственных составах с контролируемым высвобождением, содержащих один или более полимерных носителей с очень хорошей биологической совместимостью, а также относительно токсичное лекарственное соединение, которое вводят в организм неоральным способом, например, протеин.
Еще одна цель изобретения - обеспечить пользователей микрочастицами, имплантатами и гелевыми композициями, содержащими активное соединение, которое высвобождается с контролируемой скоростью. Кроме того, цель изобретения - обеспечить пользователей наборами, которые содержат такие лекарственные композиции, и рекомендациями по их фармацевтическому применению. Другие цели и возможности применения данного изобретения станут очевидными на основе последующего описания и пунктов формулы изобретения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение предусматривает фармацевтическую композицию для контролируемого высвобождения интерферонов. Точнее говоря, лекарственная композиция, предлагаемая изобретением, включает биоразлагаемый полимер и активное соединение, выбираемое из группы интерферонов. Биоразлагаемый полимер это блок-сополимер, состоящий из поли(этиленгликоль)терефталата (ПЭГТ) и поли(бутилентерефталата) (ПБТ). Предпочтительное активное соединение это интерферон, выбираемый из семейства альфа-интерферонов.
В другом варианте композиция, предлагаемая изобретением, создана таким образом, что содержит микрочастицы с блок-сополимером и, по меньшей мере, с некоторой частью интерферона, включенного в состав лекарства. Такая композиция особенно полезна как парентеральная лекарственная форма с контролируемым высвобождением, которую можно вводить в организм посредством внутримышечных или подкожных инъекций.
В другом варианте изобретение предусматривает фармацевтический набор, состоящий из первого и второго герметичных отделений, причем первое отделение содержит упомянутую лекарственную композицию на основе микрочастиц, главным образом, в сухом виде, а второе отделение содержит жидкий водный носитель для восстановления композиции в виде инъекционной суспензии микрочастиц.
В другом варианте лекарственная композиция, предлагаемая изобретением, имеет форму твердого имплантата.
Другие варианты реализации изобретения включают методы изготовления фармацевтической композиции и способы ее фармацевтического использования.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
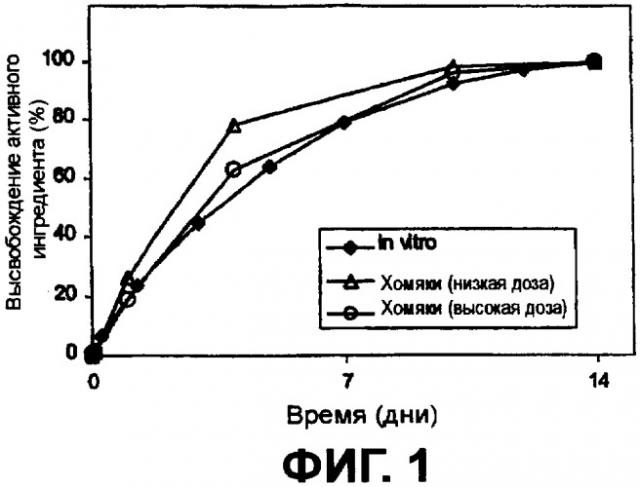
Фиг.1 наглядно представляет высвобождение интерферона из частиц сополимера in vitro и у хомяков.
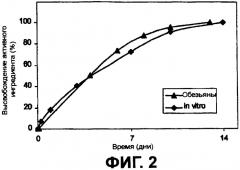
Фиг.2 наглядно представляет высвобождение интерферона из частиц сополимера in vitro и у обезьян.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В процессе открытия, приведшего к данному изобретению, было установлено, что многие из полимеров, которые предполагались как агенты для контролируемого высвобождения активных соединений, в частности полимеры молочной и/или гликолевой кислоты, не очень хорошо подходят для доставки относительно токсичных активных соединений, в частности интерферонов. В особенности необходимо отметить то, что характер высвобождения выглядит плохо контролируемым, особенно, если полимеры сформированы в виде микрочастиц или гелей. Например, при использовании традиционных полимерных носителей, по-видимому, трудно избежать так называемого взрывного высвобождения, то есть быстрого выброса значительной части включенного в лекарственный состав активного соединения вскоре после введения. В зависимости от терапевтического индекса соответствующего активного соединения такое взрывное высвобождение может вызвать у больных довольно выраженные токсические эффекты.
В отличие от этого, неожиданно было обнаружено, что блок-сополимеры ПЭГТ и ПБТ способны инкорпорировать и высвобождать интерфероны (вышеупомянутые соединения) контролируемым образом лучше, при этом с незначительным или практически отсутствующим взрывным эффектом, что будет обсуждаться далее в этом описании.
Следовательно, данное изобретение предлагает фармацевтическую композицию для контролируемого высвобождения, включающую биоразлагаемый полимер и активное соединение, выбираемое из группы интерферонов, причем биоразлагаемый полимер представляет собой блок-сополимер, состоящий из поли(этиленгликоль)терефталата (ПЭГТ) и поли(бутилентерефталата) (ПБТ).
Изобретателями также было обнаружено, что описанные выше блок-полимеры могут образовывать удивительно удобную матрицу для инкорпорирования интерферонов и их последующего контролируемого высвобождения. Особенно важно, что они могут инкорпорировать интерфероны в большом количестве без потери их биологической активности.
Другой довод в пользу особой пригодности указанных сополимеров заключается в том, что они способны контролировать высвобождение инкорпорированных интерферонов в широком диапазоне профилей, что можно считать весьма желательным в зависимости от конкретного варианта терапевтического применения. Полимерный носитель может быть создан в разных формах, например, в виде микрочастиц, пленок, гелей и твердых имплантатов, а также в широком диапазоне молекулярного веса и степеней гидрофильности, что наряду с геометрической структурой конкретной формы или созданного на ее основе лекарственного состава позволяет достичь разной продолжительности высвобождения интерферона и разных по типу профилей его высвобождения.
Фармацевтическая композиция определяется как состав, который типично используется в лечебных или диагностических целях или для поддержания хорошего состояния здоровья и профилактики заболеваний. Если одни фармацевтические композиции созданы и составлены для немедленного высвобождения инкорпорированных активных соединений, то другие обладают свойством контролируемого высвобождения активного вещества, что придает лекарству пролонгированное действие и длительную эффективность. Для описания разных типов контролируемого высвобождения было предложено несколько терминов. В этом документе термин контролируемое высвобождение включает любое высвобождение активного соединения, в частности, задержанное высвобождение, пролонгированное высвобождение, константное высвобождение или высвобождение нулевого порядка, растянутое высвобождение, непрерывное высвобождение, медленное высвобождение, двухфазное высвобождение и т.д.
Композиция содержит в своем составе биоразлагаемый полимер. В соответствии с терминологией IUPAC (Международного союза теоретической и прикладной химии) полимер определяется как вещество, состоящее из макромолекул. В свою очередь, макромолекула это молекула с высокой относительной молекулярной массой, строение которой, главным образом, представляет собой множественное повторение однотипных структурных единиц. Однако в общеязыковом смысле различие между полимером и макромолекулами, из которых он состоит, проводится не всегда. Это также справедливо и для данного текста, в котором признаки, строго говоря, присущие полимеру, могут приписываться макромолекулам.
Подверженность биологическому распаду можно определить как способность вещества разрушаться химически в физиологических условиях, в физиологической окружающей среде или под воздействием ферментов. В контексте изобретения предпочтительно, чтобы полимер, подверженный биологическому распаду (биоразлагаемый полимер), разрушался в физиологической окружающей среде, то есть в физиологических жидкостях при температуре тела (даже при отсутствии ферментов), в том смысле, что существенный распад полимера должен происходить в течение часов, дней, недель, месяцев или лет. В распаде полимера могут участвовать разные химические механизмы, включая гидролиз и/или окисление. Во избежание неверных толкований надо отметить, что подверженность биологическому распаду вовсе не означает, что полимер должен распадаться на соответствующие мономерные единицы. Важно понимать, что процесс распада ведет к возникновению растворимых видов молекул, которые могут выводиться из организма в процессах почечной или печеночной экскреции. В данном изобретении полимер является носителем активного соединения и контролирует его высвобождение.
Кроме того, биоразлагаемый полимер, выбирается из группы блок-сополимеров, которые состоят из поли(этиленгликоль)терефталата (ПЭГТ) и поли(бутилен)-терефталата (ПБТ). Сополимер определяется как полимер, полученный из мономеров более чем одного вида. В блок-сополимере (или блок-полимере) составные макромолекулы содержат смежные блоки, структурно отличающиеся друг от друга, иначе говоря, смежные блоки содержат структурные единицы, полученные из разных видов мономера или из одного и того же вида мономера, но с разным составом или разной последовательностью распределения структурных единиц. Блок можно определить как часть макромолекулы, содержащую множество структурных единиц, которые обладают, по меньшей мере, одним признаком, отсутствующим в соседних частях.
Многие блок-сополимеры, содержащие ПЭГТ и ПБТ, были описаны в прототипах, например, J. M. Bezemer et al. (J. Control Release 1999, 62 (3), 393-405; J. Biomed. Mater. Res. 2000, 52 (1), 8-17; J. Control Release 2000, 66 (2-3), 307-320; J. Control Release 2000, 67 (2-3), 249-260; J. Control Release 2000, 67 (2-3), 233-248; J. Control Release 2000, 64 (1-3), 179-192), R. Dijkhuizen-Radersma et al. (Biomate-rials 2002, 23 (24), 4719-4729; J. Biomed. Mater. Res. 2004, 71A (1), 118; Biomate-rials 2002, 23 (6), 1527-1536; Pharm. Res. 2004, 21 (3), 484-491; Int. J. Pharm. 2002, 248 (1-2), 229-237; Eur. J. Pharm. Biopharm. 2002, 54 (1), 89-93) и J. Sohier et al. (J. Control Release 2003, 87 (1-3), 57-68; Eur. J. Pharm. Biopharm. 2003, 55 (2), 221-228), а также в патентных заявках WO 93/21858, EP 0 830 859 A2 и EP 1 090 928 Al, причем все эти документы включены в данное описание во всей полноте.
Можно понимать, что эти сополимеры состоят из повторяющихся блоков гидрофильного поли(этиленгликоля) (ПЭГ) и гидрофобного поли(бутилентерефталата) (ПБТ). Эти сложные полиэфиры, состоящие из простых полиэфиров, в типичном случае получают поликонденсацией ПЭГ, бутандиола и диметил-терефталата. Альтернативное понимание заключается в том, что они состоят из повторяющихся блоков поли(этиленгликоль)терефталата (ПЭГТ) и ПБТ. Такие сополимеры обычно обладают свойствами термопластичных эластомеров. В водной среде они образуют гидрогели или подобные им полимерные сети, в которых цепочки полимера имеют не химические, а физические перекрестные связи. Полагают, что перекрестные связи являются результатом ассоциации "твердых" сегментов ПБТ в кристаллические домены, тогда как аморфные части, состоящие из "мягких" сегментов ПЭГ и отчасти ПБТ, обусловливают разбухание в воде. В отличие от химических перекрестных связей эти физические перекрестные связи носят обратимый характер и могут разрываться при повышении температуры или в соответствующих растворителях.
В соответствии с изобретением активное соединение выбирается из группы интерферонов. Интерфероны представляют собой семейство протеинов природного происхождения, извлекаемых из клеток человека и вовлеченных в разные функции иммунной системы, в частности в борьбу с вирусными инфекциями. Некоторые интерфероны были разработаны в виде фармацевтических продуктов и в настоящее время выпускаются как продукты генной инженерии для использования при лечении лейкозов, гепатита, рассеянного склероза и других тяжелых болезней.
В отличие от некоторых других активных пептидов и протеинов, успешно введенных в лекарственные продукты с контролируемым высвобождением, интерфероны имеют относительно малый терапевтический индекс. Иначе говоря, они проявляют существенную токсичность на уровне, превышающем терапевтически эффективную концентрацию. Поэтому для достижения лечебного эффекта без неприемлемых побочных эффектов необходимо обеспечить их точно контролируемую доставку в организм.
Один из основных классов интерферонов - это альфа-интерфероны (альфа-ИФН или α-ИФН). Альфа-интерфероны включают множество природных и модифицированных протеинов со сходными молекулярным весом и функциональностью (см. D. J. A. Crommelin et al., Pharmaceutical Biotechnology, Harwood Academic Publishers (1997), 219-222). Одним из главных источников происхождения этих протеинов у человека являются лейкоциты. Известны, по меньшей мере, 23 разных природных подтипа и несколько модифицированных вариантов альфа-ИФН, а некоторые из них выпускаются в виде фармацевтических продуктов. Например, разработана и выпускается в промышленных масштабах смесь нескольких подтипов природных альфа-ИФН, извлеченных из инфицированных лейкоцитов человека. В настоящее время самыми важными членами группы альфа-ИФН считаются рекомбинантные варианты альфа-ИФН-2a и альфа-ИФН-2b. Еще один рекомбинантный альфа-ИФН, используемый в терапевтической практике, это ИФН-альфакон-1.
Основная функция этих интерферонов заключается в повышающей регуляции иммунной системы, в частности, в стимуляции иммунных клеток, способных распознавать и прямым или косвенным образом разрушать раковые клетки и вирусы. К терапевтическим показаниям для использования альфа-интерферонов относятся (хронический) гепатит B, (хронический) гепатит C, лейкоз с волосковыми клетками, (хронический) миелолейкоз, множественная миелома, фолликулярная лимфома, карциноидная опухоль, злокачественная меланома, бородавки гениталий, карцинома мочевого пузыря, карцинома шейки матки, почечно-клеточный рак (гипернефрома), папилломатоз гортани, грибовидный микоз (фунгоидная гранулема, болезнь Алибера), остроконечная кондилома, ТОРС (атипичная пневмония) и (связанная со СПИДом) саркома Капоши. Фактически, в настоящее время в соответствии с данным изобретением наиболее предпочтительно, чтобы активное соединение был выбрано из группы альфа-интерферонов.
Альфа-интерфероны природного происхождения имеют молекулярную массу от 19 до 26 кДа и состоят из белков с длиной цепочки 156-166 аминокислот и 172 аминокислоты. Все альфа-ИФН обладают общим регионом консервативной последовательности между позициями аминокислот 115-151, тогда как аминоконцевые последовательности варьируются. Многие подтипы альфа-ИФН отличаются по своим последовательностям только в одной или двух позициях. Природные варианты также включают протеины, усеченные на 10 аминокислот на карбоксиконцевом участке.
Другой большой класс интерферонов - это бета-интерфероны (бета-ИФН), а самыми важными представителями этого класса в терапии являются бета-ИФН-1a и бета-ИФН-1b. Эти интерфероны используются, например, при лечении определенных форм рассеянного склероза, особенно, рецидивирующих форм рассеянного склероза, замедляя процесс накопления физической инвалидности и снижая частоту клинических обострений. Больные с рассеянным склерозом, у которых была продемонстрирована эффективность этих средств, включают лиц, перенесших первый клинический эпизод болезни и проявляющих на МРТ (магнитно-резонансных томограммах) характерные признаки рассеянного склероза.
Еще один класс интерферонов, имеющих терапевтическое значение, это гамма-интерфероны (гамма-ИФН). Эти интерфероны обладают противовирусной, антипролиферативной и иммуномодулирующей активностью. Один представитель гамма-интерферонов, гамма-ИФН-1b, в настоящее время выпускается на рынок для лечения тяжелых инфекций при хронических гранулематозах.
В последние годы были открыты и описаны некоторые дополнительные классы интерферонов, включая эпсилон-ИФН, каппа-ИФН и лямбда-ИФН (см. Kontsek et al., Acta Virol. 2003;47(4):201-15).
Согласно данному изобретению особенно хорошими свойствами обладает фармацевтическая композиция, в которой интерферон выбирается из группы альфа-интерферонов, предпочтительно, из группы, включающей альфа-ИФН, альфа-ИФН-2a, альфа-ИФН-2b, ИФН-альфакон-1, пегилированный альфа-ИФН-2a, пегилированный альфа-ИФН-2b, усеченный альфа-ИФН-2a, усеченный альфа-ИФН-2b, гибридные белки из альфа-ИФН и альбумина и их функциональные производные. В этом контексте альфа-интерферон также может представлять собой смесь разных вариантов альфа-интерферона, в частности, смесь природных альфа-интерферонов, которые трудно или не нужно разделять и очищать. Интерферон можно экстрагировать из живых организмов, изолированных клеток или клеточных культур. Для получения нужного интерферона клетки и/или организмы, из которых этот интерферон будет получен, могут быть модифицированы, например, инфекцией.
В соответствии с данным изобретением особенно хорошими свойствами обладает композиция, в которой интерферон представляет собой рекомбинантный продукт, полученный из генетически сконструированных клеток или организмов, причем эти клетки или организмы предпочтительно выбираются из клеток или организмов млекопитающих, насекомых, бактерий, дрожжей, грибов и высших растений.
Один из самых пригодных интерферонов для реализации преимуществ данного изобретения это усеченный вариант альфа-ИФН-2b или, по выбору, смесь, состоящая из более чем одного усеченного варианта альфа-ИФН-2b. Например, при помощи современных методов генной инженерии можно создать молекулы с аминокислотной последовательностью альфа-ИФН-2b, в которой удалены последние 5-10 аминокислот на N-конце. В другом варианте реализации изобретения предпочтительны такие разновидности альфа-ИФН-2b, которые укорочены на 7-8 N-концевых аминокислот.
Предпочтительно, чтобы композиция, предлагаемая данным изобретением, проявляла высвобождение активного соединения, по меньшей мере, на протяжении 7-дневного периода. Более предпочтительно, чтобы высвобождение интерферона происходило, по меньшей мере, 10 дней или, по меньшей мере, 14 дней. В других вариантах реализации изобретения высвобождение происходит на протяжении, по меньшей мере, 3 недель, 4 недель, 6 недель и 2 месяцев, соответственно. В настоящее время наиболее предпочтительным считается высвобождение на протяжении периода времени от 10 дней до 1 месяца. Разновидность выбираемого полимера и дополнительные специальные характеристики, необходимые для достижения необходимой длительности высвобождения, по меньшей мере, частично зависят от выбранной конструкции лекарственной формы, что будет более подробно описано ниже.
Изобретение также связано с фармацевтической композицией для контролируемого высвобождения, которая содержит биоразлагаемый полимер, а также одно или более активных соединений, выбираемых из группы интерферонов, причем, по меньшей мере, 80% вес. активного соединения в расчете на общий вес активного соединения высвобождается в мономерной (не агрегированной) форме. В соответствии с этим вариантом реализации изобретения биоразлагаемый полимер, предпочтительно, но не обязательно, представляет собой блок-сополимер, соответствующий данному здесь определению, состоящий из поли(этиленгликоль)терефталата (ПЭГТ) и поли(бутилентерефталата) (ПБТ). Изобретателями было обнаружено, что описанные выше блок-полимеры могут образовывать удивительно удобную матрицу для инкорпорирования интерферонов и их последующего контролируемого высвобождения. Особенно важно, что они могут инкорпорировать большое количество интерферонов без потери их биологической активности, причем сохраняют инкорпорированные интерфероны в мономерном (не агрегированном) состоянии. Это свойство особенно важно, поскольку известно, что интерфероны чувствительны к разным полимерам и режимам обработки, будучи чрезвычайно склонными к агрегации, которая часто сопровождается их инактивацией. В отличие от этого, использование описанных здесь блок-полимеров в качестве носителей интерферонов, возможно, позволяет достичь того, что большая часть инкорпорированного интерферона высвобождается в мономерной форме.
Предпочтительно, чтобы разновидность полимера и режим обработки выбирались таким образом, чтобы обеспечить высвобождение, по меньшей мере, 80% активного ингредиента, т.е., интерферона в мономерной (не агрегированной) форме. Еще более предпочтительно, чтобы в виде мономеров высвобождалось около 90% интерферона или, согласно другим вариантам реализации изобретения, около 95%, 97% и 98%, соответственно. Эти процентные показатели соответствуют весовым отношениям в расчете на общий вес инкорпорированного активного ингредиента.
Другие предпочтительные варианты композиций в соответствии с данным изобретением описаны ниже.
Разовая доза композиции, то есть количество композиции, которое вводится в организм за один раз, предпочтительно, содержит такое количество активного соединения, которое эквивалентно 1 миллиону международных единиц (1 ММЕ) соответствующего интерферона. Точное количество инкорпорированного интерферона, разумеется, зависит от профиля высвобождения в данной композиции и от того, получает ли конкретный больной ежедневные или еженедельные дозы лекарства.
В одном из вариантов реализации изобретения композиция адаптирована для высвобождения, по меньшей мере, 5 ММЕ интерферона в течение 14 дней, имея в виду первые 14 дней после введения дозы лекарства. В другом варианте реализации изобретения доза интерферона составляет приблизительно от 10 до 150 ММЕ, а период высвобождения составляет примерно от 10 дней до 1 месяца, особенно предпочтительно, около 14 дней. Также предпочтительна композиция, которая содержит и высвобождает в указанный период времени дозу интерферона приблизительно от 20 до 100 ММЕ. Такие композиции особенно предпочтительны, если активный ингредиент это альфа-интерферон, в частности, альфа-ИФН-2b или его производные.
В расчете на средний день в течение периода высвобождения интерферона после введения дозы лекарства композиция, предпочтительно, адаптирована для высвобождения соответствующего интерферона в количестве приблизительно от 0,5 до 20 ММЕ либо от 1 до 10 ММЕ. В зависимости от очертаний профиля высвобождения возможно, чтобы количество активного ингредиента, высвобождаемое в первый день после введения дозы лекарства, превышало 10 или 20 ММЕ, однако среднесуточное высвобождение интерферона за весь период должно оставаться в предпочтительном диапазоне.
Фармацевтическая композиция, предлагаемая данным изобретением, может быть создана, составлена и изготовлена так, чтобы она была пригодна для многих вариантов терапевтического использования и способов применения, в частности, местного, орального, ректального, вагинального или глазного введения в организм, однако предпочтительным способом введения считается парентеральный. В том смысле, в котором этот термин используется здесь, парентеральное введение включает любой инвазивный способ введения, в частности, внутрикожный, подкожный, внутримышечный, локально-региональный, интратуморальный, интраперитонеальный, интерстициальный, интралезионный (внутрь участка повреждения), а также, несколько менее предпочтительно в контексте данного изобретения, внутривенный, внутриартериальный и т.д. Весьма предпочтительными способами введения лекарственной композиции являются подкожная и внутримышечная инъекция или имплантация.
Пригодность для парентерального введения означает, в частности, что композиция, предпочтительно, стерильна и соответствует требованиям действующих фармакопей в отношении содержания эндотоксинов, осмотического давления и т.д. Наполнители, преимущественно, выбираются из числа безопасных и переносимых при парентеральном введении. В следующем аспекте изобретения фармацевтическая композиция составляется таким образом, чтобы она была относительно изотонической (или изоосмотической), например, в диапазоне приблизительно от 150 до 500 мОсмоль/кг (mOsmol/kg), предпочтительно, в диапазоне приблизительно от 250 до 400 мОсмоль/кг. Кроме того, показатель pH композиции должен находиться приблизительно в физиологическом диапазоне во избежание боли и местных реакций непереносимости при инъекциях. Предпочтительно, чтобы показатель pH композиции находился в диапазоне приблизительно от 4 до 8,5 и еще более предпочтительно - от 5,0 до 7,5.
Композиция, предлагаемая данным изобретением, может быть создана и составлена таким образом, чтобы она содержала микрочастицы, которые, в свою очередь, содержат биоразлагаемый блок-сополимер и активное соединение или, по меньшей мере, значительную фракцию активного соединения, представленного в этой композиции. В данном случае лекарственная форма упомянутой композиции, которая вводится в организм, представляет собой типичную инъекционную суспензию, состоящую из микрочастиц и связывающего их жидкого носителя.
В контексте изобретения микрочастицы необходимо понимать как твердые или полутвердые частицы, имеющие диаметр порядка 0,1-500 мкм, независимо от их формы или внутренней структуры. Например, микрочастицы могут также заключать в себе микросферы и микрокапсулы. В более предпочтительном варианте реализации изобретения микрочастицы имеют диаметр приблизительно от 1 до 300 мкм. Кроме того, было обнаружено, что желательные характеристики высвобождения лучше всего достигаются, если интерфероны инкорпорированы в микрочастицы, основанные на блок-сополимерах ПЭГТ/ПБТ со среднеобъемным диаметром порядка 25-200 мкм при измерении по методу фотонной корреляционной спектроскопии. Выбор микрочастиц такого размера также позволяет хорошо набирать их суспензию в шприц для проведения простой и удобной внутримышечной или подкожной инъекции.
В пределах этого диапазона размеров можно дополнительно оптимизировать диаметр микрочастиц для введения специфических продуктов или аккомодации к специфическим интерферонам. Например, в случае применения дополнительно усеченных альфа-интерферона-2a и альфа-интерферона-2b считается наиболее предпочтительным выбор микрочастиц со средне-объемным диаметром порядка 30-175 мкм. В других предпочтительных вариантах средний диаметр микрочастиц находится в диапазоне приблизительно от 50 до 150 мкм.
Предпочтительно, чтобы микрочастицы имели относительно низкую пористость. Особенно важно отметить обнаруженный изобретателями факт, что желательный профиль контролируемого высвобождения альфа-интерферонов поддерживается лучше всего, если удается в значительной степени избежать наличия в микрочастицах крупных пор. В этом контексте крупные поры можно определить как поры с диаметром порядка 5 мкм и более. Таким образом, в одном из предпочтительных вариантов реализации изобретения большинство микрочастиц практически не имеют пор с диаметром 5 мкм и более. В другом варианте большинство микрочастиц практически не имеют пор с диаметром 2 мкм и более.
Дополнительно (необязательно) микрочастицы могут быть покрыты слоем полимера, не содержащего лекарственного вещества. Такой вариант может быть полезен для предупреждения начального взрывного высвобождения инкорпорированного активного соединения или даже для достижения заранее определенного времени задержки перед началом его высвобождения, если это желательно.
Микрочастицы основаны на блок-сополимере ПЭГТ и ПБТ, который используется в качестве носителя и агента контролируемого высвобождения. Однако было обнаружено, что не все сополимеры ПЭГТ и ПБТ одинаково полезны для изготовления микрочастиц, способных осуществлять контролируемое высвобождение всех интерферонов. Кроме того, при выборе блок-сополимера важно учитывать намеченное время высвобождения или длительность лечебного эффекта активного вещества. Применительно к альфа-интерферонам было обнаружено, что сополимер, предпочтительно, должен содержать приблизительно от 50% до 95% вес. ПЭГТ и от 5%
до 50% вес. ПБТ. В другом варианте реализации изобретения сополимер содержит приблизительно от 70% до 95% вес. ПЭБТ. В соответствии еще с одним предпочтительным вариантом реализации изобретения сополимер содержит приблизительно от 70 до 85% вес. ПЭГТ.
Важным параметром для дальнейшего уточнения химического состава сополимера является молекулярный вес сегментов ПЭГ в компоненте ПЭГТ. Было обнаружено, что альфа-интерфероны очень легко инкорпорируются в микрочастицы сополимера, для которых профиль высвобождения можно отрегулировать в необходимом диапазоне при среднем молекулярном весе ПЭГ приблизительно от 600 до 3000. Еще предпочтительнее, чтобы средний молекулярный вес ПЭГ составлял приблизительно от 1000 до 2000.
Выбор среднего молекулярного веса ПЭГ также может быть сопряжен с особым вниманием к среднему размеру микрочастиц. Если, например, по соображениям технологии выбираются частицы относительно маленького размера, в частности менее 100 мкм и даже менее 75 мкм, предпочтительно остановить выбор на блок-полимере с относительно низкой степенью гидрофильности, т.е. имеющем относительно низкий средний молекулярный вес ПЭГ (около 1500 и менее или около 1000 и менее), особенно, если желательная продолжительность высвобождения составляет две недели и более. В альтернативном или дополнительном варианте низкой степени гидрофильности также можно достичь выбором относительно низкого