Способ получения производных 4-(1н-индол-3-ил)-бут-3-ен-2-она
Иллюстрации
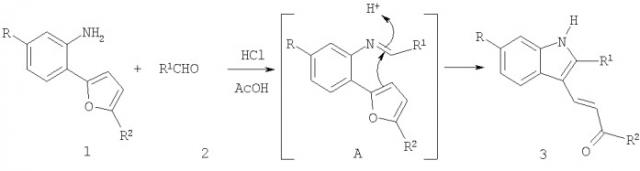
Показать всеИзобретение относится к способу получения новых производных 4-(1Н-индол-3-ил)-бут-3-ен-2-она общей формулы 3:
которые могут быть использованы в синтезе новых препаратов фармацевтического и сельскохозяйственного назначения. Способ заключается в том, что 2-алкил-5-(2-амино-4-алкилфенил)-фураны 1 перемешивают в уксусной кислоте с ароматическими и гетероароматическими альдегидами 2 в эквимольном соотношении, при температуре 35°С в течение 40 мин в присутствии 0,01 мл соляной кислоты. 3 табл.
Реферат
Изобретение относится к области органической химии - синтезу гетероциклических соединений - производных 4-(1H-индол-3-ил)-бут-3-ен-2-она, которые могут быть использованы в синтезе новых препаратов фармацевтического и сельскохозяйственного назначения.
Изобретение относится к разработке способа получения производных 4-(1Н-индол-3-ил)-бут-3-ен-2-она общей формулы 3, которые могут быть использованы в синтезе противораковых препаратов - аналогов алкалоида муррапанина [Guo, X.; Hu, W.; Cheng, S.; Wang, L.; Chang, J. Synth. Comm., 2006, 36, 781; Wu, T., Liou, M., Lee, С. Tetrahedron Lett. 1989, 30, 6649].
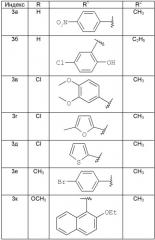
3а-к
| Индекс | R | R1 | R2 |
| 3а | Н | СН3 | |
| 3б | H | C2H5 | |
| 3в | Cl | СН3 | |
| 3г | Cl | СН3 | |
| 3д | Cl | СН3 | |
| 3е | СН3 | СН3 | |
| 3к | ОСН3 | СН3 |
В литературе описаны различные подходы к синтезу производных 4-(1H-индол-3-ил)-бут-3-ен-2-она. Как правило, исходные соединения уже содержат готовый индольный фрагмент, к которому в дальнейшем достраивается цепочка бут-3-ен-2-она. Так, при альдольной конденсации 3-формилиндола и ацетона в присутствии водного раствора NaOH получают соответствующие 4-(1H-индол-3-ил)-бут-3-ен-2-оны [Paul, S., Gupta, M. Synth. Comm., 2005, 35, 213; Guo, X., Hu, W., Cheng, S., Wang, L., Chang, J. Synth. Comm., 2006, 36, 781; Caballero, E., Longieras, N., Zausa, E., del Rey, B., Medarde, M., Tome, F. Tetrahedron Lett., 2001, 42, 7233]. Конденсация 3H-индолов с 4-метоксибут-3-ен-2-оном в водной уксусной кислоте также приводит к формированию 4-(1H-индол-3-ил)-бут-3-ен-2-онного каркаса [Teuber, Н., Schmitt, G. Tetrahedron Lett., 1971, 52, 4911].
Существуют также методы, основанные на построении индольного каркаса. Одним из таких примеров служит реакция циклизации производных 2-алкиниланилинов с алкенами в присутствии палладиевого катализатора, приводящая к производным 4-(1H-индол-3-ил)-бут-3-ен-2-она [Yasuhara, A., Kaneko, M., Sakamoto, Т. Heterocycles, 1998, 48, 1783; Yasuhara, A., Sakamoto, Т., Takeda, Y., Suzuki, N. Chem. Pharm. Bull., 2002, 50, 235].
Недостатками описанных методов являются необходимость применения исходных соединений, содержащих готовый индольный фрагмент, которые, зачастую, могут быть труднодоступными, либо применение дорогостоящих катализаторов на основе палладия.
В основе заявляемого метода лежит реакция электрофильного раскрытия фуранового цикла, подобная описанной в работах [Kusuhara N., Sugano Y., Takagi H., Miyake M., Yamamura K. Chem. Commun., 1997, 1951; Sasabe M., Mouda V., Takagi H., Sugane Т., Во X., Yamamura K. J. Chem., Perkin Trans. 1, 2000, 3786; Butin A.V., Tsiunchik F.A., Abaev V.T., Zavodnik V.E. Synlett, 2008, 8, 1145], в которых показаны реакции внутримолекулярного взаимодействия фурана с электрофильным атомом углерода, приводящие к раскрытию фуранового цикла и, как следствие, образованию конденсированных карбо- и гетероциклических систем.
Техническим результатом является синтез производных 4-(1H-индол-3-ил)-бут-3-ен-2-она 3, основанный на электрофильной рециклизации фуранового цикла, позволяющий расширить номенклатуру потенциально биологически активных веществ, представляющих собой удобные исходные соединения для синтеза аналогов природного алкалоида муррапанина.
Технический результат достигается тем, что перемешивают в уксусной кислоте в эквимольном соотношении доступные 2-алкил-5-(2-амино-4-алкилфенил)-фураны 1 с ароматическими и гетероароматическими альдегидами 2 при температуре 35°С в течение 40 мин в присутствии 0,01 мл соляной кислоты. Алкил-5-(2-амино-4-алкилфенил)-фураны 1 получены по известной методике [Butin, A.V. Tetrahedron Lett. 2006, 47, 4113]. Вероятнее всего образование непредельных производных индола происходит в результате электрофильного раскрытия и последующей рециклизации фуранового кольца промежуточно образующихся иминиемых соединений А.
Температуры плавления, данные элементного анализа и спектральные характеристики 4-(1H-индол-3-ил)-бут-3-ен-2-онов 3а-к приведены в таблице 1.
Полученный технический результат позволяет расширить ряд производных 4-(1H-индол-3-ил)-бут-3-ен-2-онов 3а-к, а тем самым и номенклатуру потенциально биологически активных соединений.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
| Таблица 1 | ||||||||||
| Выходы и физико-химические характеристики 4-(1H-индол-3-ил)-бут-3-ен-2-онов 3 | ||||||||||
| № | Заместители | Вы-ход, % | tпл, °С | Найдено, % | Спектр 1Н ЯМР (DMSO-D6), (δ, м.д. и KCCB, J, Гц) | Спектр 13С ЯМР (DMSO-D6), (δ, м.д.) | ||||
| Вычислено, % | ||||||||||
| R | R1 | R2 | С | Н | N | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 3а | Н | СН3 | 79 | 257-258 | 2.30 (с, 3Н, Me), 6.94 (д, J=15.9 Гц, 1Н, =СН), 7.23-7.28 (м, 1Н, HAr), 7.30-7.35 (м, 1Н, HAr), 7.53-7.55 (м, 1Н, HAr), 7.73 (д, J=15.9 Гц, 1Н, =СН), 7.91 (д, J=9.0 Гц, 2Н, HAr), 8.04-8.06 (м, 1Н, HAr), 8.45 (д, J=9.0 Гц, 2Н, HAr), 12.40 (c, 1H, NH) | 27.9, 110.0, 112.5, 120.9, 121.7, 123.9, 124.0, 124.1 (2С), 125.7, 130.5 (2С), 135.8, 137.3, 137.4, 140.4, 147.2, 197.5 | ||||
| 3б | Н | С2Н5 | 70 | 208-209 | 1.02 (т, J=7.4 Гц, 3Н, Me), 2.60 (кв, J=7.4 Гц, 2Н, CH2), 6.84 (д, J=15.9 Гц, 1Н, =СН), 7.08 (д, J=8.7 Гц, 1Н, HAr), 7.18-7.28 (м, 2Н, HAr), 7.33 (д, J=2.4 Гц, 1Н, HAr), 7.41 (дд, J=2.4, 8.7 Гц, 1Н, HAr), 7.45-7.48 (м,1Н, HAr), 7.58 (д, J=15.9 Гц, 1Н, =СН), 7.98-8.01 (м, 1Н, HAr), 10.33 (s, 1Н, ОН), 11.98 (с, 1Н, NH) | 8.5, 33.8, 109.5, 112.1, 117.8, 119.9, 120.2, 120.5, 121.1, 122.4, 122.7, 125.3, 130.2, 131.2, 136.1, 136.8, 140.1, 154.5, 199.7 | ||||
| 3в | С1 | СН3 | 76 | 237-238 | 2.27 (с, 3Н, Me), 3.86 (с, 6Н, ОМе), 6.84 (д, J=16.2 Гц, 1Н, =СН), 7.13-7.23 (м, 4Н, HAr), 7.47 (д, J=1.8 Гц, 1Н, HAr), 7.77 (д, J=16.2 Гц, 1Н, =СН), 7.98 (д, J=8.4 Гц, 1Н, HAr), 12.18(c, 1H, NH) | 27.8, 55.7 (2С), 107.8, 111.5, 111.9, 112.5, 121.4, 121.8, 122.4, 122.6, 122.9, 124.7, 127.3, 136.5, 137.2, 144.8, 148.9, 149.8, 197.2 | ||||
| 3г | С1 | СН3 | 80 | 267-268 | 2.34 (с, 3Н, Me), 2.43 (с, 3Н, Me), 6.39 (д, J=3.3 Гц, 1Н, HFur), 6.80 (д, J=16.2 Гц, 1Н, =СН), 6.98 (д, J=3.3 Гц, 1Н, HFur), 7.17 (дд, J=2.1, 8.7 Гц, 1Н, HAr), 7.43 (д, J=2.1 Гц, 1Н, HAr), 7.93 (д, J=8.7 Гц, 1Н, HAr), 8.17 (д, J=16.2 Гц, 1Н, =СН), 12.17 (с, 1Н, NH) | 13.5, 27.4, 107.4, 108.8, 111.4, 112.5, 121.5,121.9, 123.5, 124.4, 127.7, 133.3, 135.9, 137.7, 144.2, 154.1, 197.4 |
| Продолжение таблицы 1 | ||||||||||
| 3д | Cl | СН3 | 75 | 237-238 | 2.32 (с, 3Н, Me), 6.87 (д, J=16.2 Гц, 1Н, =CH), 7.21 (дд, J=1.8, 8.4 Гц, 1Н, HAr), 7.33 (д, J=5.1 Гц, 1Н, HTh), 7.47 (д, J=1.8 Гц, 1Н, HAr), 7.56 (дд, J=1.2, 3.0 Гц, 1Н, HTh), 7.87 (дд, J=1.2, 5,4 Гц, 1Н, HTh), 7.96 (д, J=16.2 Гц, 1Н, =СН), 7.98 (д, J=8.7 Гц, 1Н, HAr), 12.29 (c, 1H, NH) | 27.9, 108.7, 111.6, 121.6, 121.9, 123.7, 124.5, 127.9, 128.5, 128.7, 129.4, 131.4, 135.3, 137.3, 137.5, 197.3 | ||||
| 3е | СН3 | СН3 | 74 | 266-267 | 2.26 (с, 3Н, Me), 2.44 (с, 3Н, Me), 6.85 (д, J=16.2 Гц, 1Н, =СН), 7.06 (дд, J=1.5, 8.1 Гц, 1Н, HAr), 7.28 (д, J=1.5 Гц, 1Н, HAr), 7.55 (д, J=8.4 Гц, 2Н, НAr), 7.67 (д, J=16.2 Гц, 1Н, =СН), 7.79 (д, J=8.4 Гц, 2Н, HAr), 7.87 (д, J=8.1 Гц, 1H, HAr), 12.06 (c, 1H, NH) | 21.3, 27.9, 108.6, 112.0, 120.4, 122.5, 122.6, 123.1, 123.6, 130.3, 131.3 (2С), 131.9 (2С), 132.7, 136.5, 137.4, 141.9, 197.2 | ||||
| 3к | ОСН3 | СН3 | 79 | 116-117 | 1.16 (т, J=6.9 Гц, 3Н, Me), 2.07 (с, 3Н, Me), 3.83 (с, 3Н, Me), 4.19 (кв, J=6.9 Гц, 2Н, СН2), 6.67 (д, J=16.2 Гц, 1Н, =СН), 6.88 (дд, J=2.1, 8.6 Гц, 1Н, HAr), 6.92 (д, J=2.1 Гц, 1Н, HAr),7.19 (д, J=16.2 Гц, 1Н, =СН), 7.23-7.28 (м, 1Н, HAr), 7.38-7.45 (м, 2Н, HAr), 7.63 (д, J=9.0 Гц, 1Н, HAr), 7.92 (д, J=8.6 Гц, 1Н, HAr), 7.95-8.01 (м, 1Н, HAr), 8.15 (д, J=9.0 Гц, 1Н, HAr), 11.89 (с, 1Н, NH) | 14.8, 27.9, 55.3, 64.5, 95.1, 110.6, 110.7, 115.1, 119.6, 120.4, 121.0, 123.9, 124.2, 127.4, 128.2, 128.3, 128.4, 131.4, 133.8, 136.7, 138.2, 138.6, 154.9, 156.2, 196,8 |
Примеры осуществления заявляемого способа получения 4-(2-[4-нитрофенил]-1H-индол-3-ил)-бут-3-ен-2-она 3а.
Пример 1.
Смесь 0.5 г (3 ммоль) 2-метил-5-(2-аминофенил)-фурана 1а, 0.45 г (3 ммоль) 4-нитробензальдегида, 10 мл уксусной кислоты и 0,01 мл соляной кислоты перемешивают при 35°С в течение 40 мин. Затем реакционную смесь выливают в 100 мл воды, нейтрализуют NaHCO3, экстрагируют этилацетатом (3×15 мл), объединенные органические фракции сушат сульфатом натрия, отфильтровывают с активированным углем и упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент CH2Cl2/гексан (1:4), до выхода верхней примесей, при этом целевой продукт остается в верхнем слое силикагеля, далее элюент ацетон. Перекристаллизовывают из смеси ацетон/этанол. Выход 79% (0.72 г).
Тпл.=257-258°С.
Найдено для С18Н14N2О3, %: С, 70.47; Н 4.51; N 9.31.
Вычислено: С, 70.58; Н 4.61; N 9.15.
Спектр 1Н ЯМР (DMSO-D6), (δ, м.д. и КССВ, J, Гц): 2.30 (с, 3Н, СН3), 6.94 (д, 1Н, J=16.2 Гц, =СН), 7.23-7.28 (м, 1Н, HAr), 7.30-7.36 (м, 1Н, HAr), 7.53-7.55 (м, 1Н, HAr), 7.73 (д, J=16.2 Гц, 1Н, =СН), 7.91 (д, J=8.9 Гц, 2Н, HAr), 8.04-8.06 (м, 1Н, HAr), 8.45 (д, J=8.9 Гц, 2Н, HAr).
Спектр 13С ЯМР (DMSO-D6), (δ, м. д.): 27.9, 110.0, 112.5, 120.9, 121.7, 123.9, 124.0, 124.1 (2С), 125.7, 130.5 (2С), 135.8, 137.3, 137.4, 140.4, 147.2, 197.5.
Пример 2.
Смесь 0.5 г (3 ммоль) 2-метил-5-(2-аминофенил)-фурана 1a, 0.45 г (3 ммоль) 4-нитробензальдегида, 10 мл уксусной кислоты и 0,01 мл кислоты перемешивают при 35°С в течение 8 часов. Затем реакционную смесь выливают в 100 мл воды, нейтрализуют NaHCO3, экстрагируют этилацетатом (3×15 мл), объединенные органические фракции сушат сульфатом натрия, отфильтровывают с активированным углем и упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент CH2Cl2/гексан (1:4), до выхода верхней примесей, при этом целевой продукт остается в верхнем слое силикагеля, далее элюент ацетон. Перекристаллизовывают из смеси ацетон/этанол. Выход 60% (0.55 г).
Пример 3.
Смесь 0.5 г (3 ммоль) 2-метил-5-(2-аминофенил)-фурана 1а, 0.45 г (3 ммоль) 4-нитробензальдегида, 10 мл уксусной кислоты и 0,01 мл соляной кислоты перемешивают при 60°С в течение 40 мин. Затем реакционную смесь выливают в 100 мл воды, нейтрализуют NaHCO3, экстрагируют этилацетатом (3×15 мл), объединенные органические фракции сушат сульфатом натрия, отфильтровывают с активированным углем и упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент CH2Cl2/гексан (1:4), до выхода верхней примесей, при этом целевой продукт остается в верхнем слое силикагеля, далее элюент ацетон. Перекристаллизовывают из смеси ацетон/этанол. Выход 67% (0.62 г).
Пример 4.
Смесь 0.5 г (3 ммоль) 2-метил-5-(2-аминофенил)-фурана 1а, 0.45 г (3 ммоль) 4-нитробензальдегида, 10 мл уксусной кислоты и 0,01 мл соляной кислоты кипятят в течение 10 мин. Затем реакционную смесь выливают в 100 мл воды, нейтрализуют NаНСО3, экстрагируют этилацетатом (3×15 мл), объединенные органические фракции сушат сульфатом натрия, отфильтровывают с активированным углем и упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент CH2Cl2/гексан (1:4), до выхода верхней примесей, при этом целевой продукт остается в верхнем слое силикагеля, далее элюент ацетон. Перекристаллизовывают из смеси ацетон/этанол. Выход 40% (0.37 г).
Пример 5.
Смесь 0.5 г (3 ммоль) 2-метил-5-(2-аминофенил)-фурана 1а, 0.45 г (3 ммоль) 4-нитробензальдегида, 10 мл уксусной кислоты и 0,01 мл соляной кислоты перемешивают при 15°С в течение 40 мин. Затем реакционную смесь выливают в 100 мл воды, нейтрализуют NаНСО3, экстрагируют этилацетатом (3×15 мл), объединенные органические фракции сушат сульфатом натрия, отфильтровывают с активированным углем и упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент CH2Cl2/гексан (1:4), до выхода верхней примесей, при этом целевой продукт остается в верхнем слое силикагеля, далее элюент ацетон. Перекристаллизовывают из смеси ацетон/этанол. Выход 15% (0.14 г).
В таблице 2 приведены данные о влиянии времени реакции и температуры реакционной смеси на выход 4-(2-[4-нитрофенил]-1H-индол-3-ил)-бут-3-ен-2-она 3а (примеры 1-5).
| Таблица 2 | |||
| Влияние реакционных условий на выход 4-(2-[4-нитрофенил]-1H-индол-3-ил)-бут-3-ен-2-она 3а | |||
| Пример | Температура, °С | Время реакции | Выход, % |
| 1 | 35 | 40 мин | 84 |
| 2 | 35 | 8 часов | 60 |
| 3 | 60 | 40 мин | 67 |
| 4 | кипячение | 10 мин | 40 |
| 5 | 15 | 40 мин | 15 |
Как видно из таблицы 2, оптимальным условием синтеза целевого продукта 4-(1H-индол-3-ил)-бут-3-ен-2-она 3 является перемешивание в уксусной кислоте 2-алкил-5-(2-амино-4-алкилфенил)-фуранов 1 с альдегидами 2 при температуре 35°С в течение 40 мин, в присутствии 0,01 мл соляной кислоты.
Более продолжительное время реакции, так же как и увеличении температуры реакционной смеси, сопровождается сильным осмолением и, как следствие, снижением выхода целевого продукта.
Проведение реакции при температуре ниже 35°С не позволяет провести полную конверсию исходных соединений, и выход 4-(1H-индол-3-ил)-бут-3-ен-2-она 3 не превышает 15%.
Заявляемым способом получен ряд производных 4-(1H-индол-3-ил)-бут-3-ен-2-она 3а-к.
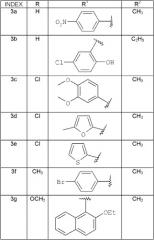
Способ получения производных 4-(1Н-индол-3-ил)-бут-3-ен-2-онов общей формулы 3 3а-к
| Индекс | R | R1 | R2 |
| 3а | H | СН3 | |
| 3б | H | С2Н5 | |
| 3в | Cl | СН3 | |
| 3г | Cl | СН3 | |
| 3д | Cl | СН3 | |
| 3е | СН3 | СН3 | |
| 3к | ОСН3 | СН3 |