Нестероидные модуляторы глюкокортикоидных рецепторов
Иллюстрации
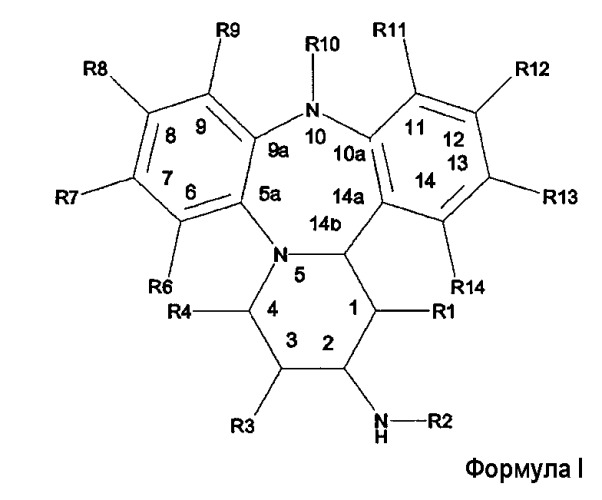
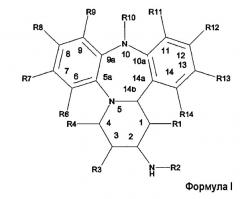
Показать всеОписываются новые производные дибензо[b,f]пиридо[1,2-d][1,4] диазепинила общей формулы I:
или их фармацевтически приемлемые соли (значения радикалов приведены в формуле изобретения), которые являются модуляторами рецепторов глюкокортикоидов и могут найти применение при лечении иммунологических и воспалительных заболеваний. 4 н. и 7 з.п. ф-лы.
Реферат
Изобретение относится к соединениям, модулирующим рецепторы глюкокортикоидов, и к их применению в терапии.
Внутриклеточные рецепторы - это класс структурно родственных белков, вовлеченных в регуляцию генов белков. Стероидные рецепторы являются подклассом таких рецепторов, включающим рецептор глюкокортикоидов (GR), рецептор прогестерона (PR), рецептор андрогена (AR), рецептор эстрогена (ER) и рецептор минералокортикоида (MR). Для регуляции генов такими рецепторами или факторами требуются внутриклеточный рецептор и соответствующий лиганд, который способен селективно связываться с рецептором таким образом, чтобы это влияло на транскрипцию генов.
Существующие модуляторы глюкокортикоидных рецепторов (глюкокортикоиды), такие как преднизолон и другие, являются очень эффективными противовоспалительными агентами, используемыми при более чем 100 синдромах в области ревматологии, гематологии, пульмонологии, дерматологии, гастроэнтерологии, эндокринологии, неврологии, нефрологии. Подвергающиеся лечению заболевания включают ревматоидный артрит (RA), воспалительные заболевания кишечника (IBD), волчанку, аллергию, астму, псориаз и множество других (J.D Baxter, Advances in Internal Medicine 45; 317-349; 2000). Предполагают, что противовоспалительные эффекты этих соединений опосредованы ингибированием экспрессии провоспалительных медиаторов, таких как молекулы адгезии, цитокины, хемокины и ферменты, согласно механизму, включающему взаимодействие лиганд-связанного GR с транскрипционными факторами. Этот механизм известен как трансрепрессия (M. Karin, Cell 93; 487-490; 1998).
Использование имеющихся стероидных глюкокортикоидов сопровождается метаболическими и прочими побочными эффектами (например, диабетом, повышенным кровяным давлением, остеопорозом, атрофией мышечной ткани и т.д.). Предполагается, что часть этих побочных эффектов опосредована прямым взаимодействием лиганд-связанного GR с глюкокортикоидзависимыми элементами (GRE) в ДНК таргетных генов и последующей индукцией экспрессии генов (J.D Baxter, Advances in Internal Medicine 45; 317-349; 2000; M. Karin, Cell 93; 487-490; 1998). Другая часть этих побочных эффектов может быть обусловлена кросс-реактивностью к другим стероидным рецепторам, таким как рецептор минералокортикоида (MR) или прогестерона (PR).
Нестероидные глюкокортикоиды не имеют сходства в молекулярной структуре со стероидами, и, таким образом, можно предположить также различия в физико-химических свойствах, параметрах фармакокинетики (PK), распределении в тканях (например, ЦНС по сравнению с периферической нервной системой) и, важнее, нестероидные глюкокортикоиды могут не иметь/иметь низкую кросс-реактивность с другими стероидными рецепторами или могут не иметь/иметь меньшие метаболические и другие побочные эффекты.
Настоящее изобретение представляет нестероидные соединения, модулирующие активность рецепторов глюкокортикоидов. Особенно, настоящее изобретение представляет высокоаффинные нестероидные соединения для взаимодействия с GR, демонстрирующие противовоспалительные эффекты in vitro и in vivo. В соответствии с настоящим изобретением предоставляются соединения, имеющие общую формулу I, или их пролекарственные формы, или их фармацевтически приемлемые соли.
Настоящее изобретение представляет нестероидные соединения, модулирующие активность рецепторов глюкокортикоидов. Особенно, настоящее изобретение представляет высокоаффинные соединения, которые являются агонистами, частичными агонистами или антагонистами рецепторов глюкокортикоидов. В соответствии с настоящим изобретением представляются соединения, имеющие общую формулу I
или их фармацевтически приемлемые соли.
В этой формуле R-группы имеют следующие значения:
R1 представляет собой Н или (1-4С)алкил;
R2 представляет собой -С(О)R15 или -S(O)2R15;
R3 представляет собой H, (1-4C)алкил или -OR16;
R4 представляет собой H, (1-4C)алкил или -OR16;
R6 представляет собой H или -C(H)NOR16;
R7 представляет собой H или галоген, циано-;
(1-6С)алкил, (2-6С)алкенил или (2-6С)алкинил, причем все три указанные группы необязательно замещены OH, галогеном или NH2;
-С(Н)NOR16, -OR16, -C(O)R16 или -C(O)OR16;
R8 представляет собой H, циано-, галоген, нитро-;
(1-6С)алкил, (2-6С)алкенил, (2-6С)алкинил или -О(1-6С)алкил, причем все указанные группы необязательно замещены амино, гидрокси или галогеном;
(гетеро)арил, необязательно замещенный циано-, галогеном, (1-4С)алкилом, (1-4С)алкокси, (1-4С)алкокси(1-4С)алкилом;
-C(H)NOR16, -C(O)NHR17, -C(O)R18, -C(O)OR19, -NHC(O)R20, -NHS(O)2R21 или -C(1-4C)алкилNOR21;
R9 представляет собой Н, галоген, циано- или (1-4С)алкил, необязательно замещенный галогеном;
R10 представляет собой Н или (1-4С)алкил;
R11 представляет собой H;
R12 представляет собой Н, циано или (1-4С)алкил;
R13 представляет собой Н, (1-4С)алкил, галоген или формил;
R14 представляет собой Н, галоген, циано-, (1-4С)алкил, (2-6С)алкенил, C(O)R21 или (гетеро)арил;
R15 представляет собой H;
(1-6С)алкил, (2-6С)алкенил, (2-6С)алкинил, -O(2-6C)алкил, -О(2-6С)алкенил или О(2-6С)алкинил, причем все указанные группы необязательно замещены одним или более ОН, галогеном, циано- или (гетеро)арилом;
(гетеро)арил, необязательно замещенный (1-4С)алкилом, галогеном, циано-, нитро- или амино-; NH2, (ди)(1-4С)алкиламино, (1-4С)алкил(1-4С)алкоксиамин, (1-4С)алкилтио(1-4С)алкил или (1-4С)алкокси(1-4С)алкил;
R16 представляет собой Н, (1-6С)алкил, (2-6С)алкенил или (2-6С)алкинил;
R17 представляет собой H,
(1-6С)алкил, необязательно замещенный галогеном, (1-4С)алкокси или (гетеро)арилом, необязательно замещенным галогеном, (1-4С)алкилом или (1-4С)алкокси;
(3-6С)циклоалкил или
(гетеро)арил, необязательно замещенный галогеном, (1-4С)алкилом или (1-4С)алкокси;
R18 представляет собой H, NH2, -C(O)R21 или (1-4С)алкил, необязательно замещенный ОН, галогеном, циано- или -S(1-4C)алкилом;
R19 представляет собой Н или (1-6С)алкил, необязательно замещенный ОН или галогеном;
R20 представляет собой H,
(1-6С)алкил или (2-6С)алкенил, которые необязательно замещены галогеном, О(1-6С) алкилом, (гетеро)арилом, необязательно замещенным (1-4С)алкилом или галогеном;
(3-6С)циклоалкил (1-6С)алкокси; (1-6С)алкенилокси; или (гетеро)арил, необязательно замещенный (1-4С)алкилом, NH2, -NH(1-6С)алкилом или -NH(гетеро)арилом;
и
R21 представляет собой Н или (1-6С)алкил.
Так, было обнаружено, что вышеупомянутый класс соединений, соответствующих формуле I, или их фармацевтически приемлемые соли имеют активность модуляторов рецепторов глюкокортикоидов.
Термин «(1-6С)алкил», как использовано в определении изобретения, означает разветвленную или неразветвленную алкильную группу, состоящую из 1-6 атомов углерода, например, метил, этил, пропил, изопропил, бутил, втор-бутил и трет-бутил, пентил и гексил. Предпочтителен (1-4С)алкил.
Термин «(1-4С)алкил», как использовано в определении изобретения, означает разветвленную или неразветвленную алкильную группу, состоящую из 1-4 атомов углерода, например, метил, этил, пропил, изопропил, бутил, втор-бутил и трет-бутил. Предпочтительны метил и этил. Наиболее предпочтителен метил.
Термин «(3-6С)циклоалкил» означает циклическую алкильную группу, состоящую из 3-6 атомов углерода.
Термин «галоген» означает фтор, хлор, бром или йод.
Термин «(2-6С)алкенил» означает разветвленную или неразветвленную алкенильную группу, состоящую из 2-6 атомов углерода, такую как этенил, 2-бутенил, пентенил и гексенил. Предпочтителен (2-4C)циклоалкенил.
Термин «(2-4C)алкенил» означает разветвленную или неразветвленную алкенильную группу, состоящую из 2-4 атомов углерода, такую как этенил и 2-бутенил.
Термин «(2-6С)алкинил» означает разветвленную или неразветвленную алкинильную группу, состоящую из 2-6 атомов углерода, такую как этинил, пропинил, бутилил, пентинил и гексинил. Предпочтителен (2-4С)алкинил.
Термин «(2-4С)алкинил» означает разветвленную или неразветвленную алкинильную группу, состоящую из 2-4 атомов углерода, такую как этинил и пропинил.
Термин «-О(1-6С)алкил» означает (1-6С)алкокси, где (1-6С)алкил имеет вышеуказанное значение.
Термин «-О(2-6С)алкенил» означает (2-6С)алкенилокси, где (2-6С)алкенил имеет вышеуказанное значение.
Термин «-О(2-6С)алкинил» означает (2-6С)алкинилокси, где (2-6С)алкинил имеет вышеуказанное значение.
Термин «(1-4С)алкилокси» означает алкилоксигруппу, состоящую из 1-4 атомов углерода, в которой алкильная часть имеет вышеуказанное значение; (1-2С)алкилоксигруппы предпочтительны.
Термин «(1-4С)алкокси(1-4)алкил» означает (1-4С)алкокси, присоединенный к (1-4С)алкильной группе; обе группы имеют ранее определенные значения.
Термин «(ди)(1-4С)алкиламино» означает аминокомпонент с по меньшей мере одним, необязательно двумя, атомами водорода, замещенным на (1-4С)алкильную группу, как определено ранее.
Термин «-S(1-4C)алкил» означает (1-4С)алкилтиогруппу, где (1-4С)алкильная группа имеет ранее определенное значение.
Термин «(1-4С)алкилтио(1-4С)алкил» означает (1-4С)алкилтиогруппу, присоединенную к (1-4С)алкильной группе; обе группы имеют ранее определенные значения.
Термин «арил» означает 6-членную кольцевую ароматическую систему.
Термин «гетероарил» означает 5- или 6-членную кольцевую ароматическую систему, содержащую по меньшей мере один гетероатом, выбираемый из группы, состоящей из N, O и S в 5-членном кольце и N - в 6-членном кольце, таком как пиридил, пиримидил, тетразол или тиадиазол.
Термин «(гетеро)арил» означает арил или гетероарил, как ранее обозначено.
Термин «фармацевтически приемлемая соль» представляет те соли, которые являются, с точки зрения специалиста в области медицины, подходящими для использования в контакте с тканями человека или низших животных без излишней токсичности, раздражения, аллергических реакций и подобного, и соответствуют разумному отношению «польза/риск». Фармацевтически приемлемые соли хорошо известны в соответствующей области. Они могут быть получены в процессе окончательного выделения и очистки соединений изобретения, или отдельно в реакции свободной основной функции с подходящими неорганическими кислотами, такими как соляная кислота, фосфорная кислота или серная кислота, или органическими кислотами, такими как, например, аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и им подобные. Кислотная функция может использоваться в реакции с органическими или неорганическими основаниями, такими как гидроксид натрия, гидроксид калия или гидроксид лития.
Соединения настоящего изобретения обладают по меньшей мере двумя хиральными атомами и могут, таким образом, быть получены в виде чистых энантиомеров или смеси энантиомеров, или смеси диастереомеров. Методы получения чистых энантиомеров известны в данной области, например, кристаллизация солей, полученных из оптически активных кислот и рацемических смесей, или хроматография на хиральных колонках. Для разделения диастереомеров могут быть использованы обычные или обращеннофазные колонки.
Изобретение также касается соединений, соответствующих формуле I, где R7 представляет собой H, галоген или -OR16.
Изобретение также касается соединений, соответствующих формуле I, где R2 представляет собой С(O)R15.
В еще другом аспекте изобретение касается соединений, соответствующих формуле I, где R7 представляет собой H.
Изобретение далее касается тех соединений, где R10 в формуле I является метилом.
Изобретение также касается тех соединений, где R4 в формуле I представляет собой Н или (1-4С)алкил.
Другой аспект изобретения касается соединений, соответствующих формуле I, где R16 представляет собой Н или (1-6С)алкил.
В другом аспекте изобретение касается соединений, где R14 представляет собой (1-4С)алкил.
В еще другом аспекте изобретение касается соединений, где R15 представляет собой (1-4)алкил, необязательно замещенный галогеном, циано-, нитро- или амино.
В еще другом аспекте изобретение касается соединений, где R15 представляет собой (1-4)алкил, необязательно замещенный галогеном.
В еще другом аспекте изобретение касается соединений формулы I, где R15 представляет собой трифторметил или (гетеро)арил, необязательно замещенный (1-4)алкилом.
Изобретение также касается соединений формулы I, где R15 представляет собой (гетеро)арил, необязательно замещенный (1-4С)алкилом.
В дальнейшем аспекте R21 в соединениях, соответствующих формуле I, представляет собой (1-4С)алкил.
Изобретение также касается соединений, соответствующих формуле I, где R8 представляет собой Н, галоген, циано-, нитро, -C(O)R18, -NHC(O)R20 или (гетеро)арил, необязательно замещенный циано-, (1-4С)алкилом, (1-4С)алкокси, (1-4С)алкокси(1-4С)алкилом или (гетеро)арилом.
Изобретение также касается соединений, соответствующих формуле I, где R8 представляет собой H, галоген, циано-, нитро, -C(O)R18, -NHC(O)R20 или (гетеро)арил, необязательно замещенный циано-, (1-4С)алкилом, (1-4С)алкокси, (1-4С)алкокси(1-4С)алкилом.
Изобретение, более того, касается тех соединений, где R8 представляет собой H, циано-, пиридил- или нитро.
В другом аспекте изобретение касается соединений, где R8 представляет собой циано-, пиридил- или нитро. Изобретение также касается соединений, где R8 представляет собой циано.
В еще одном аспекте изобретение касается соединений, соответствующих формуле I, где R1, R3, R4, R6, R7, R9, R11, R12, R13 и R14 представляют собой Н.
Еще один аспект изобретения касается соединений, где все специфические определения групп R1-R21, определенные здесь выше, объединены в соединении формулы I.
Изобретение также предоставляет соединения, соответствующие формуле I, высоко специфичные к рецепторам глюкокортикоидов. Специфичность может быть определена тестированием соединений, как описано далее для рецепторов глюкокортикоидов, для других хорошо известных рецепторов, таких как рецептор прогестерона, рецептор андрогена, рецептор минералкортикоидов или рецептор эстрогена.
Синтез
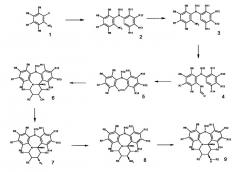
Последовательность стадий путем синтеза соединений данного изобретения описана на схеме 1.
Соединения настоящего изобретения могут быть получены путем, во-первых, сочетания 2-галогеннитроарилов общей структуры 1, где Х имеет ранее определенное для галогенов значение, с производными (N-алкил)анилина.
Вышеупомянутую реакцию обычно проводят при повышенной температуре в присутствии карбоната калия и в присутствии или в отсутствие органического растворителя. 2-галогеннитроарилы общей структуры 1 либо являются коммерчески доступными или легко получаются синтетическим путем, хорошо известным из литературы. Эта реакция описана в литературе G.W. Rewcastle, et al. J. Med. Chem., 30, 1987, 843. Альтернативно эти реакции могут быть проведены в присутствии карбоната цезия, ацетата палладия и BINAP для получения аналогичных продуктов.
Схема 1
Соединения общей структуры 2 могут затем быть восстановлены для получения соединений общей структуры 3.
Вышеупомянутую реакцию обычно проводят при температуре окружающей среды в присутствии хлорида олова(II) в органических растворителях с последующей обработкой гидроксидом.
Соединения общей структуры 3 затем могут быть N-формилированы для получения соединений общей структуры 4.
Вышеупомянутую реакцию обычно проводят при кипячении в муравьиной кислоте с обратным холодильником без использования какого-либо органического растворителя.
Соединения общей формулы 4 могут затем подвергаться реакции замыкания цикла для образования кольца С и получения трициклических соединений общей структуры 5.
Вышеупомянутую реакцию обычно проводят при температуре окружающей среды в присутствии пентахлорида фосфора, с использованием органических растворителей. Альтернативно эти реакции могут быть проведены в присутствии полифосфорной кислоты и трихлорида оксида фосфора (V) без использования каких-либо органических растворителей для получения желаемого продукта.
Соединения общей структуры 5 могут затем подвергаться реакции типа гетеро-Дильса-Альдера для формирования пиперинового кольца и получения тетрациклических соединений. Эти соединения могут быть затем восстановлены in situ для получения тетрациклических спиртов общей структуры 6, получаемых в основном в транс-конфигурации.
Реакцию Дильса-Альдера обычно проводят при пониженной температуре в присутствии либо триметил[(1-метилен-2-пропенил)окси]силана, триметил[(1-метилен-2-бутенил)окси]силана, либо [(3-метокси-1-метилен-2-пропенил)окси]триметилсилана (диена Данишевского) и трифторметансульфоната иттербия при использовании органического растворителя. Эти сырые продукты могут затем быть восстановлены при температуре окружающей среды в присутствии борогидрида натрия с использованием органического растворителя.
Соединения общей структуры 6 могут затем подвергаться реакции при условиях Мицунобу для получения азидных соединений общей структуры 7.
Вышеупомянутую реакцию обычно проводят при температуре окружающей среды в присутствии трифенилфосфина, диизопропилазодикарбоксилата и дифенилфосфорилазида с использованием органического растворителя.
Соединения общей структуры 7 могут быть затем восстановлены для получения свободных аминосоединений общей структуры 8. Эту реакцию обычно проводят при температуре окружающей среды в присутствии трифенилфосфина и воды с использованием органического растворителя. Эти соединения могут быть затем конденсированы посредством обычных процедур с производными карбоновых кислот (кислотами, хлорангидридами или эфирами кислот) для получения амидных продуктов 9.
Соединения 6, 8 и 9 являются ключевыми промежуточными соединениями при образовании всех остальных описанных здесь соединений. Функционализация этих ключевых промежуточных соединений может быть осуществлена путем выбора подходящих исходных веществ или галогенированием, нитрованием, формилованием и т.д. и модифицирована далее при помощи описываемых методов (например, методов Бухвальда, Сузуки, Стилле, ароматического замещения и т.д.) для получения желаемого соединения 9 с желаемой цис-стехиометрией.
Соединения настоящего изобретения имеют по меньшей мере два стереогенных атомов углерода и могут, таким образом, быть получены как чистые энантиомеры, смесь энантиомеров или смесь диастереоизомеров. Как правило, их выделяют в виде смеси энантиомеров. Диастереоизомеры могут быть разделены при использовании обычной или обращеннофазовой хроматографии. Методы получения чистых энантиомеров хорошо известны в соответствующей области, например, в хроматографии с использованием хиральных колонок.
Биологическая активность
Методы определения связывания с рецепторами, так же как и исследования биологической активности соединений in vitro и in vivo, хорошо известны. В целом экспрессируемый рецептор обрабатывают тестируемым соединением, после чего измеряют связывание, стимулирование или ингибирование функционального ответа.
Для измерения связывания может быть использован изолированный цитозоль, содержащий экспрессированный GR. Также могут быть использованы радиоактивно или флуоресцентно меченные соединения. В качестве контрольного соединения может быть использован природный гормон или иные связывающиеся с рецептором соединения. В качестве альтернативы может также применяться метод конкурентного связывания. Эти подходы для определения связывания могут быть либо разработаны на месте, либо заказаны в виде коммерчески доступных исследований (китов). Экспериментальные методики определения способности к связыванию (аффинности) хорошо известны в области техники.
Для отбора модуляторов GR способность связывания соединений с рецептором должна быть ниже 10-5 М. Более предпочтительна аффинность <10-7 М и, наиболее предпочтительна, аффинность <10-8 М.
Для измерения функционального ответа изолированная ДНК, содержащая кодирующий рецептор глюкокортикоидов ген, предпочтительно рецептор человека, экспрессируется в подходящей линии клеток, например, линии клеток человеческой остеобластомы U2OS.
Методы получения клеточной линии, экспрессирующей рекомбинантный рецептор глюкокортикоидов, хорошо известны в области техники. Экспрессия рецептора осуществляется при экспрессии ДНК, кодирующей желаемый белок. На данный момент все методики сайт-направленного мутагенеза, лигирования дополнительных последовательностей, ПЦР и конструирования подходящей экспрессионной системы хорошо известны в области техники. Полноразмерная ДНК или ее фрагменты, кодирующие желаемый белок, могут быть сконструированы синтетически при использовании стандартных твердофазных методов, предпочтительно для включения рестрикционых сайтов для облегчения лигирования. Подходящие контрольные элементы для транскрипции и трансляции включенных кодирующих последовательностей могут быть вставлены в кодирующие последовательности ДНК. Как хорошо известно, на данный момент доступны экспрессионные системы, сочетающиеся с широким спектром организмов-хозяев: прокариотических систем, таких как бактерии, эукариотических систем, таких как дрожжи, растительные клетки, клетки насекомых, клетки млекопитающих, клетки птиц и им подобные.
In vitro, для линии человеческих клеток, стабильно трансфицированных ДНК GR человека, может быть моделировано воспаление, что стимулирует секрецию цитокинов, хемокинов и других воспалительных медиаторов. Противовоспалительный эффект соединений может быть оценен количественно при измерении воспалительного ответа в этих линиях клеток. EC50 может быть рассчитано и для тестируемого соединения, и для контрольного соединения, такого как преднизолон, при исследовании кривой зависимости ответа от полной дозы вещества. Значение EC50 можно сравнить со значением EC50 для преднизолона, полученным в том же клеточном анализе. Предпочтительно, соединения имеют значения EC50, сопоставимые со значением EC50, полученным для преднизолона. Более предпочтительно, значения EC50 ниже полученных для преднизолона.
Специалист в данной области поймет, что желаемое значение EC50 зависит от тестируемого соединения. Например, соединение со значением EC50, меньшим, чем 10-5 М, в целом, рассматривается в качестве кандидата для селекции лекарства. Предпочтительно, это значение меньше, чем 10-7 М. Однако соединение, которое имеет более высокое значение EC50, но селективно для определенного типа рецепторов, может быть даже лучшим кандидатом.
In vivo, противовоспалительный эффект соединений может быть исследован на мышах, которым вводили липополисахарид (LPS). Соединения могут быть введены системно во время или после введения LPS. Противовоспалительный эффект может быть количественно оценен как ингибирование в сыворотке крови мышей LPS-индуцированного TNFα или любого другого воспалительного цитокина или хемокина (S.R. Hyde & R.E. McCallum, Infection and Immunity, 60; 976-982 (1992)). Способность ингибировать развитие артрита может быть исследована на мышиной модели артрита, индуцированного коллагеном 2-го типа - (CIA) как способность ингибирования набухания конечностей (D.E. Trentham et al. J. exp. Med. 146; 857-868 (1997)) или на других моделях артрита.
Изобретение также относится к фармацевтическим композициям, содержащим соединения или их соли, имеющие общую формулу I. Так, соединения, соответствующие формуле I, могут быть использованы в терапии.
Подходящие пути введения соединений формулы I или их фармацевтически приемлемых солей, также обозначенные здесь как активные компоненты, представляют собой внутримышечные инъекции, подкожные инъекции, внутривенные инъекции или внутрибрюшинные инъекции, пероральное или интраназальное введение. Предпочтительно, соединения могут быть введены перорально. Точная доза и режим применения активного компонента или фармацевтических композиций на его основе будут обязательно зависеть от желаемого эффекта, которого требуется достичь (например, лечение астмы, R.A, I.B.D), и могут варьировать для индивидуальных соединений, пути введения и возраста, и состояния индивидуального субъекта, которому должно быть введено лекарственное средство. В целом терапевтически эффективная ежедневная доза составляет от примерно 0,001 мг до примерно 15 мг/кг массы тела в день для каждого соединения изобретения; предпочтительно, от примерно 0,01 мг до примерно 10 мг/кг массы тела в день; и, более предпочтительно, от примерно 0,1 до примерно 1,5 мг/кг массы тела в день. Определенная степень обычной оптимизации дозы может требоваться для определения оптимального уровня и режима дозирования.
Дальнейший аспект изобретения относится к применению соединений, соответствующих формуле I или их фармакологически приемлемых солей, или их сольватов для изготовления лекарственного средства для всех заболеваний, где требуется модуляция рецепторов глюкокортикоидов, то есть в области ревматологии, гематологии, пульмонологии, дерматологии, гастроэнтерологии, эндокринологии, неврологии или нефрологии, которые на данный момент поддаются лечению стероидными глюкокортикоидами, такими как преднизолон. Наиболее предпочтительна область ревматологии, в особенности, например, ревматоидный артрит.
Так, соединения настоящего изобретения модулируют активность рецептора глюкокортикоидов, и они могут быть использованы при лечении иммунологических и воспалительных заболеваний. В особенности, соединения могут быть использованы для лечения ревматических заболеваний, таких как ревматоидный артрит, юношеский артрит и анкилозирующий спондилит, дерматологические заболевания, включая псориаз и пузырчатку, аллергические заболевания, включая аллергический ринит, атопический дерматит, контактный дерматит, легочные состояния, включая астму и хроническое обструктивное заболевание легких, и другие иммунные и воспалительные заболевания, включая болезнь Крона, неспецифический язвенный колит, системную красную волчанку, аутоиммунный хронический активный гепатит, остеоартрит, тендинит и бурсит. Кроме того, соединения могут быть использованы для предотвращения отторжения органов после трансплантации.
Более конкретно соединения могут быть использованы для лечения ревматоидного артрита, псориаза, астмы и хронического обструктивного заболевания легких, болезни Крона или неспецифического язвенного колита, и соединения могут быть использованы для предотвращения отторжения органов послетрансплантации.
Так, соединения по изобретению могут быть использованы при лечении этих заболеваний, то есть всех заболеваний, где пациенту требуется модуляция рецептора глюкокортикоидов.
Примеры
Пример 1
NB: Нумерация в примерах относится к схеме 1, где R1, R3, R4, R6-R9=Н, R10=Me, R11-R14=H, если не обозначено иначе.
Пример 1
Цис-2,2,2-трифтор-N-(8-формил-1,2,3,4,10,14b-гексагидро-10-метилдибензо[b,f]пиридо[1,2-d][1,4]диазепин-2-ил)ацетамид (9:R2-CF3-C(O)-; R8=CH(O)-)
Перемешиваемый раствор 2-бромнитробензола (1) (301 г, 1,5 моль) и N-метиланилина (176,5 г, 1,65 моль) в толуоле (2,5 л) дегазировали пропусканием N2 в течение 15 минут. Затем добавляли при перемешивании карбонат цезия (537 г, 1,65 моль), Pd(OAC)2 (973 мг, 4,3 ммоль) и рац-BINAP (15,1 г, 24,3 ммоль), реакционную смесь нагревали до 85°С и выдерживали в течение 20 часов. Реакцию останавливали H2O и промывали органический слой с 6М НСl, затем H2O и, наконец, насыщенным рассолом, после чего обезвоживали (Na2SO4). Органическую фазу концентрировали при пониженном давлении, и сырой продукт очищали с помощью колоночной хроматографии на силикагеле для получения (2) (341 г, 99%). Данные (m/z)=229 (M+H)+.
К перемешиваемому раствору соединения (2) (100 г, 0,5 моль) в этаноле (1 л) добавляли SnCl2·2H2O (451 г, 2,0 моль) и смесь перемешивали при температуре окружающей среды в течение ночи. Спиртовой раствор разделяли на 4 части и каждую выливали в 6М NaOH в H2O (1 л). Смесь перемешивали до обесцвечивания раствора, после чего продукт экстрагировали EtOAc. Органические фазы объединяли и промывали насыщенным рассолом, после чего обезвоживали (Na2SO4). Органическую фазу концентрировали при пониженном давлении и сырой продукт очищали с помощью колоночной хроматографии на силикагеле для получения (3) (78 г, 79%). Данные: (m/z)=199 (M+H)+.
Перемешиваемый раствор соединения (3) (78 г, 0,39 моль) в муравьиной кислоте (500 мл) кипятили с обратным холодильником и выдерживали в течение 20 часов. Муравьиную кислоту удаляли при пониженном давлении, полученное масло растворяли в EtOAC. Органический слой промывали раствором NаНСО3, затем Н2О и, наконец, насыщенным рассолом, после чего обезвоживали (Na2SO4). Органическую фазу концентрировали при пониженном давлении и сырой продукт очищали с помощью колоночной хроматографии на силикагеле для получения (4) (61 г, 69%). Данные: (m/z)=227 (M+H)+.
К перемешиваемому раствору соединения (4) (61 г, 270 ммоль) в DCM (500 мл) частями добавляли PCl5 (56,3 г, 270 ммоль). Реакционную смесь перемешивали в течение 1 часа при температуре окружающей среды, после чего выливали в раствор МаНСО3 в Н2О (1 л). рН реакционной смеси доводили твердым NaHСО3 до основных значений по лакмусовой бумаге. Органическую фазу отделяли и концентрировали при пониженном давлении. Полученное масло растворяли в Et2O. Затем добавляли 6М раствор НСl в H2O, после чего смесь перемешивали в течение 30 минут. Водную фазу отделяли, органическую фазу дважды промывали 6М раствором НСl в Н2О. Водные фракции объединяли, промывали Et2O, после чего нейтрализовали. Продукт экстрагировали EtOAc и промывали насыщенным рассолом, обезвоживали (Na2SO4) и концентрировали при пониженном давлении. Сырой продукт очищали колоночной хроматографией на силикагеле для получения (5) (30 г, 54%). Данные: (m/z)=209 (М+Н)+.
Перемешиваемый раствор вещества (5) (30 г, 144 ммоль) в толуоле (350 мл) охлаждали до 0°С, после чего добавляли диен Данишевского (28,4 г, 144 ммоль) и Yb(OTf)3 (4,47 г, 7,2 ммоль). Раствор оставляли нагреваться до комнатной температуры и перемешивали в течение 2 часов. Реакцию останавливали 0,1 М НСl в Н2О. Добавляли воду и экстрагировали продукт толуолом. Органическую фазу промывали насыщенным рассолом, обезвоживали (Na2SO4), затем концентрировали при пониженном давлении для получения 10,14b-дигидро-10-метил-дибензо[b,f]пиридо[1,2-d][1,4]диазепин-2(1Н)она (47 г, сырой). Это соединение суспендировали в этаноле (1 л), затем добавляли NaBH4 (21,8 г, 576 ммоль) и реакционную смесь перемешивали в течение 8 часов при температуре окружающей среды. Органическую фазу частично выпаривали при пониженном давлении, полученную суспензию выливали в насыщенный раствор NH4Cl в Н2О, после чего экстрагировали EtOAc. Органическую фазу промывали насыщенным раствором, обезвоживали (Na2SO4) и концентрировали при пониженном давлении. Сырой продукт очищали колоночной хроматографией на силикагеле для получения (6) (23,4 г, 58%). Данные: (m/z)=281 (М+Н)+.
Перемешиваемый раствор вещества (6) (10,0 г, 35,7 ммоль) и трифенилфосфина (12,2 г, 46,4 ммоль) в безводном ТГФ (150 мл) охлаждали до 0°С и по каплям добавляли диизопропилазодикарбоксилат (9,2 мл, 46,4 ммоль). По каплям добавляли дифенилфосфорилазид (10,0 мл, 46,4 ммоль), после чего снимали охлаждение. Реакционную смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и сырой продукт очищали колоночной хроматографией на силикагеле для получения (7) (13,1 г, 100%). Данные: (m/z)=306 (M+H)+.
К перемешиваемому раствору вещества (7) (10,9 г, 35,7 ммоль) и трифенилфосфина (13,4 г, 51,1 ммоль) в ТГФ (150 мл)добавляли Н2О (2 мл). Реакционную смесь затем перемешивали в течение 24 часов при температуре окружающей среды, после чего концентрировали при пониженном давлении для получения (8) (35 г, сырое). Данные: (m/z)=280 (M+H)+.
Неочищенное вещество (8) растворяли в МеОН (400 мл), перемешивали, затем добавляли триэтиламин (19,4 мл, 140 ммоль) и этилтрифторацетат (20,9 мл, 175 ммоль) и нагревали реакционную смесь до 50°С в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, затем очищали колоночной хроматографией на силикагеле для получения цис-2,2,2-трифтор-N-(1,2,3,4,10,14b-гексагидро-10-метилдибензо[b,f]пиридо[1,2-d][1,4]диазепин-2-ил)ацетамида (9:R2=СF3-С(О)-) (5,7 г, 58% для двух стадий). Данные: (m/z)=376 (M+H)+.
Оксалил хлорид (436 мкл, 5 ммоль) осторожно добавляли по каплям, при перемешивании, к ДМФ (0,5 мл) при 0°С и выдерживали в течение 25 минут. Раствор цис-2,2,2-трифтор-N-(1,2,3,4,10,14b-гексагидро-10-метилдибензо[b,f]пиридо[1,2-d][1,4]диазепин-2-ил)ацетамида (9:R2=СF3-С(О)-) (400 мг, 1,07 ммоль) в ДМФ (2 мл) добавляли по каплям к полученной суспензии, реакционную смесь нагревали до 80° и выдерживали в течение 1,5 часов. Реакцию охлаждали до температуры окружающей среды и останавливали добавлением по каплям раствора NаНСО3 в H2O. Продукт экстрагировали EtOAc, обезвоживали (Na2SO4) и концентрировали при пониженном давлении. Затем сырой продукт очищали колоночной хроматографией на силикагеле для получения цис-2,2,2-трифтор-N-(8-формил-1,2,3,4,10,14b-гексагидро-10-метилдибензо[b,f]пиридо[1,2-d][1,4]диазепин-2-ил)ацетамида (9:R2=СF3-С(O)-; R8=CHO) (130 мг, 30%). Данные: (m/z)=404 (М+Н)+. [При хроматографии также получается цис-2,2,2-трифтор-N-(6-формил-1,2,3,4,10,14b-гексагидро-10-метилдибензо[b, f]пиридо[1,2-d][1,4]диазепин-2-ил)ацетамид (9:R2=СF3-С(О)-; R6=CH(O)-) (45 мг, 10%). Данные: (m/z)=404 (М+Н)+.]
Пример 2
Цис-2,2,2-трифтор-N-(1,2,3,4,10,14b-гексагидро-10-метил 8-нитродибензо[b,f]пиридо[1,2-d][1,4]диазепин-2-ил)ацетамид (9:R2=СF3-C(O)-; R8=NO2-)
Перемешиваемый раствор TFAA (188 мкл, 1,33 ммоль) и TBAN (406 мг, 1,33 ммоль) в DCM (5 мл) охлаждали до 0°С и перемешивали в течение 20 минут, после чего по каплям добавляли к раствору вещества (9:R2=СF3-С(О)-) (250 мг, 0,67 ммоль) в DCM (5 мл). Реакционную смесь перемешивали в течение 1,5 часов при 0°С, затем останавливали (при 0°С) раствором NaHСО3 в H2O. Органическую фазу отделяли и промывали Н2О, затем насыщенным рассолом, затем обезвоживали (РЕ-фильтр) и концентрировали при пониженном давлении. Сырой продукт очищали колоночной хроматографией на силикагеле для получения цис-2,2,2-трифтор-N-(1,2,3,4,10,14b-гексагидро-10-метил-8-нитродибензо[b,f]пиридо[1,2-d][1,4]диазепин-2-ил)ацетамида (9: R2=CF3-C(О)-; R8=NO2-) (110 мг, 42%). Данные: (m/z)=421 (М+Н)+.
Пример 3
Цис-N-(8-циано-1,2,3,4,10,14b-гексагидро-10-метилдибензо[b,f]пиридо[1,2-d][1,4]диазепин-2-ил)-2,2,2-трифторацетамид (9:R2=CF3-C(O)-; R8=CN)
Перемешиваемый раствор (6) (12,7 г, 45,4 ммоль) в ацетоне (175 мл) охлаждали до 0°С и по частям добавляли N-бромсукцинимид (10,4 г, 58,4 ммоль). Раствор оставляли нагреваться до температуры окружающей среды и перемешивали в течение 3 часов. Затем реакцию останавливали раствором NaHCO3 в Н2О и экстрагировали продукт EtOAc. Органическую фазу промывали насыщенным рассолом, обезвоживали (Na2SO4) и концентрировали при пониженном давлении. Сырой продукт очищали колоночной хроматографией на силикагеле для получения вещества (6:R8=Br) (11,0 г, 67%). Данные: (m/z)=360 (M+H)+.
(7:R8=Br). Это соединение было получено аналогично способу, описанному в примере 1 (см. ниже). Продукт не очищали и использовали на следующей стадии как таковой. Данные: (m/z)=385 (M+H)+.
(9:R2=CF3-C(О)-; R8=Br). Это соединение было получено аналогично способу, описанному в примере 1 (35% для трех стадий). Данные: (m/z)=455 (M+H)+.
Раствор вещества (9:R2=CF3-С(О)-; R8=Br) (2 г, 4,4 ммоль) и CuCN (1 г, 11 ммоль) был дегазован при пропускании азота в течение 0,5 часов. Реакционную смесь затем нагревали до 200°С и поддерживали при этой температуре в течение 4 часов при перемешивании. Реакцию остана