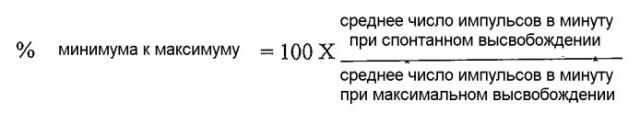Анализ антителозависимой клеточной цитотоксичности
Иллюстрации
Показать всеИзобретение относится к медицине и касается способа анализа антителозависимой клеточной цитотоксичности (ADCC). Изобретение обеспечивает простоту и безопасность по сравнению с анализом, требующим использование меченных клеток, увеличенную чувствительность в сравнении со стандартным анализом ADCC и возможность осуществления способа в реальном времени. 10 н. и 32 з.п. ф-лы, 10 ил.
Реферат
Данная заявка притязает на приоритет предварительной заявки на патент США с порядковым номером 60/756301, поданной 4 января 2006 г.
ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к способу анализа антителозависимой клеточной цитотоксичности (ADCC) и, в некоторых вариантах осуществления, относится к способам, которые позволяют проводить анализ ADCC в реальном времени без необходимости использования меченых клеток.
УРОВЕНЬ ТЕХНИКИ
ADCC представляет собой компонент иммунной реакции, при которой антитела IgG связываются с антигенами на поверхности патогенных или образующих опухоль клеток-мишеней, которые определяются ими для разрушения эффекторными NK-клетками. Эффекторные клетки, несущие рецептор к Fc-гамма (FcγR), распознают и связываются с Fc-областью антител, связавшихся с клеткой-мишенью. Антитела, таким образом, придают специфичность уничтожению клеток-мишеней, что опосредовано эффекторными клетками, образующими мост между двумя типами клеток и впоследствии высвобождающими литические гранулы.
Некоторые терапевтические антитела осуществляют свою биологическую активность, стимулируя ADCC. Например, герцептин®, гуманизированное антитело, используемое для лечения рака молочной железы, активирует ADCC, связываясь с антигеном HER-2 на поверхности раковых клеток. Подобным образом, ритуксан®, химерное антитело, используемое для лечения неходжкинской лимфомы, активирует ADCC, связываясь с антигенами CD20 на поверхности клеток лимфомы.
Технологии для определения, индуцирует ли антитело ADCC, как правило, включают в себя мечение клеток-мишеней радиоактивным веществом, таким как Cr51, или флуоресцентным красителем, таким как кальцеин AM. Меченые клетки инкубируют с антителом и эффекторными клетками, такими как NK-клетки или PBMC, и разрушение клеток-мишеней посредством ADCC обнаруживают по выходу радиоактивности или флуоресценции. Мечение клеток-мишеней в таких видах анализа требует отделения прилипающих клеток для мечения. После мечения анализ проводят с клетками-мишенями в суспензии, что не является нормальным состоянием для прилипающих клеток. Кроме того, степень опосредованного ADCC разрушения клетки, в общем случае, определяется только в один момент времени через несколько часов после смешивания клеток-мишеней с эффекторными клетками и антителом. Был разработан анализ без использования меток, в котором разрушение клеток определяли, измеряя высвобождение лактатдегидрогеназы (LDH) из цитоплазмы лизированных клеток в несодержащей клетки надосадочной жидкости. Тем не менее, способ определения LDH не является анализом в реальном времени и не различает гибель клеток-мишеней и гибель эффекторных клеток, поскольку оба типа клеток высвобождают LDH при лизисе.
Принимая во внимание терапевтические продукты антител, которые в настоящее время присутствуют на рынке или на стадии разработки, существует необходимость в анализах in vitro, которые позволяют определить ADCC активность антител. В особенности, существует необходимость в высокопроизводительном анализе ADCC без использования меток, который позволит осуществлять мониторинг ADCC в реальном времени и который не требует отделения прилипающих клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящей заявке предлагаются способы анализа ADCC in vitro. В способах не используются метки, или требуется сниженное количество меток, и, таким образом, они являются более простыми и более безопасно выполняемыми, чем анализ, требующий использование меченых клеток. В некоторых вариантах осуществления способы также осуществляют с прилипающими клетками, а не с клетками в суспензии. В дополнение, способы можно осуществлять в реальном времени, позволяя отслеживать кинетику реакций ADCC так, что можно сравнивать кинетику ADCC различных антител. Предлагаемые здесь способы также более чувствительны, чем стандартный анализ ADCC, что позволяет определять незначительные различия в кинетике ADCC различных антител. Дополнительно, в некоторых вариантах осуществления простота предлагаемых здесь способов означает, что они быстрее, чем стандартный анализ ADCC, и также обладают возможностью оптимизации для высокопроизводительного скрининга активности ADCC.
Предлагаемые здесь способы включают (a) мониторинг импеданса между электродами на непроводящей подложке, которая способствует росту клеток-мишеней в среде для анализа, и (b) добавление в среду для анализа эффекторных клеток и антитела, которое связывается с клетками-мишенями. Снижение импеданса между электродами на подложке после добавления эффекторных клеток и антитела характерно для ADCC, имеющей место в среде для анализа. Увеличение или отсутствие изменения импеданса между электродами на подложке после добавления эффекторных клеток и антитела может быть характерно для отсутствия действия ADCC в среде для анализа.
В одном аспекте в настоящей заявке уделено особое место способу анализа антителозависимой клеточной цитотоксичности (ADCC), включающему: (a) мониторинг импеданса между электродами на непроводящей подложке, которая способствует росту клеток-мишеней в среде для анализа, и (b) добавление в среду для анализа эффекторных клеток и антитела, которое связывается с клетками-мишенями; причем снижение импеданса между электродами на подложке после добавления эффекторных клеток и антитела характерно для действия ADCC, произошедшего в среде для анализа, и причем увеличение или отсутствие изменения импеданса между электродами на подложке после добавления эффекторных клеток и антитела может быть характерно для отсутствия действия ADCC в среде для анализа. Способ может включать в себя измерение импеданса через определенные промежутки времени. Способ может включать в себя определение клеточного индекса (CI), исходя из каждого измерения импеданса и определения, имеет ли место изменение клеточного индекса, где клеточный индекс получают, исходя из каждого измерения импеданса, по формуле
где Rb(f) и Rcell(f) представляют собой частотнозависимые сопротивления электродов без клеток или при наличии клеток, соответственно, и N представляет собой количество значений частот, при которых измеряют импеданс. Способ можно осуществить, используя систему RT-CES®. Измерения импеданса можно проводить каждые 15 минут.
В способе можно дополнительно высевать клетки-мишени. Клетки-мишени можно высевать за 18-24 часа перед добавлением антитела и эффекторных клеток. Клетки-мишени могут находиться в монослое на подложке. Клетки-мишени можно высевать при плотности в диапазоне от 2 K до 100 K на лунку (например, в диапазоне от 15 K до 25 K на лунку или приблизительно 20 K на лунку). Соотношение эффекторных клеток и клеток-мишеней (E:T) может составлять 25:1. E:T может составлять более чем 10:1, более чем 50:1 или более чем 100:1.
Антитело можно добавлять в концентрации в диапазоне приблизительно от 1 до приблизительно 100 мкг/мл, в диапазоне приблизительно от 1 до приблизительно 50 мкг/мл или в диапазоне приблизительно от 2 до приблизительно 8 мкг/мл. Способ может включать в себя добавление в среду для анализа двух или более антител, которые связываются с клетками-мишенями, трех или более антител, которые связываются с клетками-мишенями, или четырех или более антител, которые связываются с клетками-мишенями. Антитело можно получить от пациента с аутоиммунным нарушением.
Клетки-мишени могут экспрессировать апикальные антигены. Способ может включать в себя предварительную стадию скрининга клеток-мишеней в отношении экспрессии апикального антигена. Клетки-мишени могут представлять собой раковые клетки или зараженные вирусом клетки. Раковые клетки могут происходить из клеточной линии. Раковые клетки могут представлять собой клетки SKBR3 или клетки MG63.
Эффекторные клетки могут включать в себя мононуклеарные клетки периферической крови (PBMC), естественные киллерные (NK) клетки, моноциты, цитотоксические Т-клетки или нейтрофилы. Стадия (b) способа может включать в себя добавление к клеткам-мишеням цельной крови, которую частично обогатили эффекторными клетками. Стадия (b) способа может включать в себя добавление цельной крови к эффекторным клеткам, где цельная кровь содержит эффекторные клетки.
В другом аспекте в настоящей заявке уделено особое место способу скрининга антитела-кандидата на способность индуцировать ADCC против клеток-мишеней, включающему: (a) мониторинг импеданса между электродами на непроводящей подложке, которая способствует росту клеток-мишеней в среде для анализа, и (b) добавление в среду для анализа эффекторных клеток и антитела-кандидата, которое связывается с клетками-мишенями; причем снижение импеданса между электродами на подложке после добавления эффекторных клеток и антитела характерно для способности антитела-кандидата влиять на действие ADCC против клеток-мишеней, и причем увеличение или отсутствие изменения импеданса между электродами на подложке после добавления эффекторных клеток и антитела может быть характерно для неспособности антитела-кандидата влиять на действие ADCC против клеток-мишеней.
В другом аспекте в настоящей заявке уделено особое место способу выявления пациента, страдающего заболеванием, ассоциированным с клетками-мишенями, который подходит для лечения антителом-кандидатом, способу, включающему: (a) мониторинг импеданса между электродами на непроводящей подложке, которая способствует росту клеток-мишеней, ассоциированных с заболеванием, (b) добавление выделенных у пациента PBMC и антитела-кандидата к клеткам-мишеням и (c) определение, имеет ли место изменение импеданса между электродами на подложке после добавления PBMC и антитела, причем снижение импеданса между электродами характерно для пригодности пациента для лечения при помощи антитела, и причем увеличение или отсутствие изменения импеданса между электродами на подложке после добавления PBMC и антитела характерно для непригодности пациента для лечения при помощи антитела.
В еще одном аспекте в настоящей заявке уделено особое место способу скрининга соединения-кандидата в отношении способности модулировать ADCC, включающему: (a) мониторинг импеданса между электродами на непроводящей подложке, которая способствует росту клеток-мишеней в среде для анализа, b) добавление в среду для анализа эффекторных клеток и антитела при наличии и отсутствии соединения-кандидата, причем антитело связывается с клетками-мишенями, и (c) сравнение любого изменения импеданса между электродами на подложке после добавления эффекторных клеток и антитела в присутствии соединения-кандидата с любым изменением импеданса между электродами на подложке после добавления эффекторных клеток и антитела при отсутствии соединения-кандидата, причем изменение импеданса в присутствии соединения-кандидата, которое больше, чем любое изменение импеданса при отсутствии соединения-кандидата, показывает, что соединение-кандидат обладает способностью модулировать ADCC. Соединение, для которого необходимо провести скрининг, может модулировать связанную с аутоиммунными состояниями ADCC.
В настоящей заявке особое место также уделено способу, как описано здесь, который представляет собой высокопроизводительный анализ, где непроводящая подложка состоит из двух или более лунок на микротитровальном планшете, причем каждая лунка содержит, по меньшей мере, два электрода, и мониторинг импеданса между электродами осуществляется в каждой лунке.
В другом аспекте в настоящей заявке уделено особое место анализу контроля качества антитела, включающему: (a) мониторинг импеданса между электродами на непроводящей подложке, которая способствует росту клеток-мишеней в среде для анализа, и (b) добавление эффекторных клеток и антитела в среду для анализа, причем антитело связывается с клетками-мишенями; причем снижение импеданса между электродами на подложке после добавления эффекторных клеток и антитела показывает, что антитело подходит для производства с целью применения при индукции ADCC, и где увеличение или отсутствие изменения импеданса между электродами на подложке после добавления эффекторных клеток и антитела показывает, что антитело не подходит для производства с целью применения при индукции ADCC.
В еще одном аспекте в настоящей заявке уделено особое место анализу контроля качества антитела, включающему: (a) мониторинг импеданса между электродами на непроводящей подложке, которая способствует росту клеток-мишеней в среде для анализа, (b) добавление эффекторных клеток и антитела в среду для анализа, причем антитело связывается с клетками-мишенями, и (c) сравнение любого изменения импеданса между электродами на подложке после добавления эффекторных клеток и антитела с любым изменением импеданса в контрольном образце после добавления эффекторных клеток и антитела; причем снижение импеданса между электродами на подложке после добавления эффекторных клеток и антитела, которое больше, чем любое снижение импеданса для контрольного образца после добавления эффекторных клеток и контрольного антитела, показывает, что антитело подходит для производства с целью применения при индукции ADCC, и причем отсутствие снижения импеданса после добавления эффекторных клеток и антитела, которое больше, чем любое снижение импеданса для контрольного образца после добавления эффекторных клеток и контрольного антитела, показывает, что антитело не подходит для производства с целью применения при индукции ADCC. При анализе контроля качества снижение импеданса после добавления эффекторных клеток и антитела, которое, по меньшей мере, на 25% больше, чем снижение импеданса для контрольного образца после добавления эффекторных клеток и контрольного антитела, может свидетельствовать, что антитело подходит для производства с целью применения при индукции ADCC.
В настоящей заявке особое место также уделено способу скрининга соединения-кандидата в отношении применения в качестве терапевтического средства против аутоиммунного заболевания, включающему: (a) мониторинг импеданса между электродами на непроводящей подложке, которая способствует росту клеток-мишеней в среде для анализа, причем клетки-мишени представляют собой здоровые клетки, (b) добавление в среду для анализа эффекторных клеток и антитела совместно с соединением-кандидатом и без него, причем антитело связывается с клетками-мишенями, и причем эффекторные клетки представляют собой РВМС субъекта, у которого диагностировано аутоиммунное заболевание, и (c) сравнение любого изменения импеданса в присутствии соединения-кандидата с любым изменением импеданса при отсутствии соединения-кандидата, причем снижение импеданса при отсутствии соединения-кандидата, которое больше, чем любое снижение импеданса в присутствии соединения-кандидата, показывает, что соединение-кандидат подходит в качестве терапевтического средства против аутоиммунного заболевания, и причем отсутствие снижения импеданса при отсутствии соединения-кандидата, которое больше, чем любое снижение импеданса в присутствии соединения-кандидата, показывает, что соединение-кандидат не подходит в качестве терапевтического средства против аутоиммунного заболевания.
В другом аспекте в настоящей заявке уделено особое место способу определения, подходит ли антитело-кандидат для лечения субъекта, страдающего аутоиммунным заболеванием, включающему: (a) мониторинг импеданса между электродами на непроводящей подложке, которая способствует росту клеток-мишеней, ассоциированных с аутоиммунным заболеванием, и (b) добавление антитела-кандидата и выделенных у субъекта PBMC к клеткам-мишеням и (c) определение, имеет ли место изменение импеданса между электродами на подложке после добавления PBMC и антитела-кандидата, причем снижение импеданса между электродами показывает, что антитело подходит для лечения субъекта, и причем отсутствие снижения импеданса между электродами показывает, что антитело не подходит для лечения субъекта.
В еще одном аспекте в настоящей заявке уделено особое место способу определения оптимальной концентрации антитела для индукции реакции ADCC, включающему: (a) мониторинг импеданса между электродами на непроводящей подложке, которая способствует росту двух или более образцов клеток-мишеней в среде для анализа, и (b) добавление эффекторных клеток и антитела к двум или более образцам клеток-мишеней, причем антитело связывается с клетками-мишенями, и причем антитело к двум или более образцам клеток-мишеней добавляют в различных концентрациях; причем снижение импеданса между электродами на подложке после добавления эффекторных клеток и антитела характерно для действия ADCC, произошедшего в среде для анализа, и причем концентрация антитела, которая приводит к наибольшему снижению импеданса, как определяют, является оптимальной концентрацией.
В другом аспекте в настоящей заявке уделено особое место способу определения, связывается ли антитело с апикальным антигеном на клетке-мишени, включающему: (a) мониторинг импеданса между электродами на непроводящей подложке, которая способствует росту клеток-мишеней в среде для анализа, и (b) добавление эффекторных клеток и антитела к клеткам-мишеням; причем снижение импеданса между электродами на подложке после добавления эффекторных клеток и антитела показывает, что антитело связывается с апикальным антигеном на клетке-мишени.
Если не определено иным образом, все используемые здесь технические и научные термины имеют то же самое значение, как обычно понимает обычный специалист в данной области техники, к которой принадлежит данное изобретение. Хотя способы и материалы, подобные или эквивалентные описанным здесь способам и материалам, можно использовать для практического применения изобретения, подходящие способы и материалы описаны ниже. Все публикации, заявки на патенты, патенты и другие ссылки, упомянутые здесь, полностью включены в качестве ссылки. В случае спора настоящее описание изобретения, включающее в себя определения, будет использовано для урегулирования. В дополнение, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
Подробности одного или нескольких вариантов осуществления изложены ниже в прилагаемых чертежах и в описании. Другие особенности, цели и преимущества изобретения будут очевидны из описания и чертежей и из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 изображен график, показывающий кривую клеточного индекса с течением времени для клеток SKBR3, которые высевали при последовательных разведениях в 2 раза 40 K, 20 K, 10 K или 5 K на лунку, как указано.
На фиг.2 изображен график, показывающий кривую клеточного индекса с течением времени для высеянных клеток SKBR3, которые через 20 часов обрабатывали дополнительной свежей средой («одни только клетки») или тритоном X-100 («клетки + тритон»), чтобы индуцировать гибель клеток.
На фиг.3 изображен график, показывающий кривую клеточного индекса с течением времени для высеянных клеток SKBR3, которые через 20 часов обрабатывали дополнительной свежей средой («одни только мишени»), герцептином («мишени + герцептин») или контрольными антителами IgG («мишени + IgG»).
На фиг.4 изображен график, показывающий кривую клеточного индекса с течением времени для одних только клеток SKBR3 («мишени») или PBMC («эффекторы»).
На фиг.5 изображен график, показывающий кривую клеточного индекса с течением времени для одних только клеток SKBR3, одних только PBMC или клеток SKBR3, которые обрабатывали PBMC через 20 часов.
На фиг.6 изображен график, показывающий кривую клеточного индекса с течением времени для одних только клеток SKBR3, клеток SKBR3, обработанных PBMC через 20 часов, или клеток SKBR3, обработанных PBMC и герцептином® через 20 часов.
На фиг.7 изображен график, показывающий зависимость от времени лизиса клеток-мишеней SKBR3 (T) посредством эффекторов PBMC (E) при соотношении E:T 50:1 или 12,5:1 в присутствии mAB герцептина® или без него, как указано.
На фиг.8A изображен график, показывающий процент лизиса, определенный с использованием способа, как описано здесь, клеток-мишеней SKBR3, обработанных одним только PBMC, клеток-мишеней SKBR3, обработанных PBMC вдобавок с указанными концентрациями герцептина®, или клеток-мишеней SKBR3, обработанных PBMC вдобавок с контрольным IgG. На фиг.8В изображен график, показывающий процент лизиса, определенный с использованием стандартного анализа с кальцеином AM в отношении клеток-мишеней SKBR3, обработанных одним только PBMC, клеток-мишеней SKBR3, обработанных PBMC вдобавок с указанными концентрациями герцептина®, или клеток-мишеней SKBR3, обработанных PBMC вдобавок с контрольным IgG.
На фиг.9 изображен график, показывающий кривую клеточного индекса с течением времени для клеток SKBR3 и MG63.
На фиг.10А изображен график, показывающий кривую клеточного индекса для клеток MG63, обработанных через 18-20 часов одним только PBMC, PBMC со специфичным для мишени антителом RX1 или PMBC с контрольным антителом IgG. На фиг.10В изображен график, показывающий кривую клеточного индекса для клеток SKBR3, обработанных через 18-20 часов одним только PBMC, PBMC со специфичным для мишени антителом герцептином® или PMBC с контрольным антителом IgG.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
В настоящей заявке предлагаются материалы и способы для определения ADCC посредством измерения импеданса между электродами, расположенными на поверхности, на которую высеяны клетки. Можно использовать любое подходящее устройство для измерения импеданса. В некоторых вариантах осуществления ADCC можно определить, используя устройство, имеющее непроводящую подложку, содержащую множество помещенных на нее матриц электродов, матрицы соединены с анализатором импеданса. Например, ADCC можно определить, используя устройство, содержащее матрицы электродов, помещенные на подложку в нижнем отсеке, нижний отсек отделен от верхнего отсека мембраной. Такое устройство можно также использовать для определения миграции клеток из верхнего отсека в нижний отсек, где прилипание к подложке в нижнем отсеке определяют по увеличению импеданса между электродами на матрицах в нижнем отсеке. Такие устройства описаны, например, в WO2004/010103 и WO2004/010102.
Такие устройства также можно использовать для оценки цитотоксичности соединения на находящиеся в них клетки. Например, соединение можно добавлять к клеткам, растущим на подложке, содержащей электроды, и можно контролировать влияние соединения на импеданс между электродами, при этом снижение импеданса между электродами характерно для гибели клеток. См., например, WO2005/77104 и WO2005/047482. См. также публикацию США № 2005/0112544, в которой описаны способы, которые включают в себя измерение импеданса для оценки клеточной цитотоксичности, вызванной тамоксифеном.
Ни в одной из указанных выше ссылок не описано применение описанных в них устройств для оценки ADCC. В отличие от стандартного анализа цитотоксичности, который просто включает в себя добавление соединения-кандидата к клетке-мишени, анализ ADCC включает в себя добавление (a) антитела, которое связывается с клеткой-мишенью, и (b) эффекторных клеток, которые связываются с антителом. Можно предположить, что измерения импеданса не обеспечивают точных показателей количества клеток-мишеней при анализе ADCC, поскольку можно предположить, что клетки-мишени, эффекторные клетки и антитело прилипают к подложке. Таким образом, считываемый высокий импеданс может иметь место из-за: i) прилипания к подложке клеток-мишеней, так как антитело и эффекторные клетки не индуцируют ADCC, или ii) прилипания к подложке эффекторных клеток и антитела после уничтожения клеток-мишеней посредством ADCC. Следовательно, предполагается, что устройства, такие как описанные выше устройства, не применимы при анализе ADCC.
Как ни удивительно, тем не менее, авторы изобретения обнаружили, что устройства, такие как устройства, описанные в WO2005/77104 и WO2005/047482, можно использовать при анализе ADCC. В частности, авторы изобретения обнаружили, что эффекторные клетки незначительно прилипают к содержащей электроды подложке, и что при подходящих количествах клеток-мишеней, соотношениях эффекторных клеток и клеток-мишеней (E:T) и концентрациях антитела изменения импеданса между электродами на подложке могут обеспечить точные показатели количества клеток-мишеней.
Анализ ADCC посредством определения изменений импеданса между электродами на подложке, на которой растут клетки-мишени, обладает множеством значительных преимуществ по сравнению со стандартными анализами ADCC. В отличие от большинства стандартных видов анализа ADCC в некоторых вариантах осуществления предлагаемые здесь способы не используют меток. В некоторых вариантах осуществления способы не подразумевают использования клеток, меченных радиоактивной или другой меткой, делая проведение анализа более легким и более безопасным, чем анализ, требующий использования меченных клеток. Дополнительно, как обсуждалось выше, в стандартных видах анализа ADCC прилипшие клетки отделяют от поверхности, на которой они растут, с тем, чтобы клетки можно было пометить, и анализ ADCC проводят в суспензии. Поскольку предлагаемые здесь способы не используют меток, нет необходимости в отделении клеток, посредством этого удаляя возможный источник ошибки вследствие нарушения прилипших клеток. Вместо этого анализ ADCC проводят с использованием клеток, прикрепленных к подложке.
В дополнение, в отличие от большинства стандартных видов анализа ADCC в некоторых вариантах осуществления предлагаемые здесь способы позволяют отслеживать количество клеток в реальном времени путем измерения импеданса в различные моменты времени после добавления эффекторных клеток и антитела. Предлагаемые здесь способы, таким образом, позволяют отслеживать кинетику реакции ADCC таким образом, что можно сравнивать кинетики ADCC для различных антител. В некоторых вариантах осуществления способы являются более чувствительными, чем стандартные виды анализа ADCC, позволяя определить небольшие различия в кинетиках ADCC для различных антител. В дополнение, простота предлагаемых здесь способов означает, что они намного быстрее, чем стандартные виды анализа ADCC, и обладают возможностью оптимизации для высокопроизводительного скрининга активности ADCC.
Предлагаемые здесь способы можно осуществить, используя устройство, описанное в WO2004/010102, WO2004/010103, WO2005/077104 или WO2005/047482, или устройство, основанное на данных конструкциях. В некоторых вариантах осуществления предлагаемые здесь способы можно осуществить, используя систему RT-CES®, производимую ACEA Biosciences (Сан-Диего, Калифорния). Система ACEA RT-CES® состоит из трех компонентов: электронного сенсорного анализатора, станции устройства и 16-луночного титровального микропланшета. Очевидно, что незначительные рабочие варианты данной системы находятся в пределах знаний специалиста в данной области техники. Например, устройство может содержать 96-луночный титровальный микропланшет или 256-луночный титровальный микропланшет, а не 16-луночный титровальный микропланшет, чтобы позволить проводить большее количество анализов одновременно.
Сенсорные матрицы с микроэлектродами можно изготовить на стеклянных пластинах, используя литографические микротехнологические способы, и содержащие электроды пластины можно собирать в пластмассовые кассеты, чтобы сформировать содержащие электроды лунки.
Станция устройства может принимать титровальный микропланшет (например, 16-луночный, 256-луночный или 96-луночный титровальный микропланшет) и может допускать электронное переключение любой из лунок в сенсорном анализаторе для измерения импеданса. В процессе работы устройство с культивируемыми клетками в лунках можно соединить со станцией устройства и поместить в инкубатор. Электрические провода могут соединять станцию устройства с сенсорным анализатором. Используя управляющее программное обеспечение RT-CES®, сенсорный анализатор может автоматически выбирать лунки для измерения и может непрерывно проводить измерения импеданса. Данные измерения импеданса из анализатора можно переносить на компьютер, анализировать и обрабатывать при помощи интегрированного программного обеспечения.
Импеданс, измеряемый между электродами в отдельной лунке, обычно зависит от геометрии электрода, ионной концентрации в лунке и от того, прикреплены ли клетки к электродам. В отсутствие клеток импеданс электродов определяется, главным образом, ионной средой на границе электрод/раствор и в основном объеме раствора. В присутствии клеток клетки, прикрепленные к поверхностям электродного датчика, могут изменять локальную ионную среду на границе электрод/раствор, приводя к увеличению импеданса. Чем больше клеток присутствует на электродах, тем больше увеличение импеданса клетка-электрод.
Для того, чтобы определять количество клеток на основе измеряемого импеданса клетка-электрод, параметр, называемый клеточным индексом (CI), получают согласно формуле:
где Rb(f) представляет собой частотнозависимое сопротивление электродов (компонент импеданса) без клеток, Rcell(f) представляет собой частотнозависимое сопротивление электродов при наличии клеток и N представляет собой количество значений частот, при которых измеряют импеданс.
Таким образом, клеточный индекс представляет собой количественную меру клеток в содержащей электроды лунке. При одних и тех же физиологических условиях большее количество клеток, прикрепленных к электродам, приводит к большему значению Rcell(f), приводя к большему значению клеточного индекса.
Предлагаемые здесь способы могут включать в себя измерение импеданса через определенные промежутки времени и определение клеточного индекса из данных измерений импеданса согласно приведенной выше формуле, позволяя таким образом отслеживать реакцию ADCC. Интервалы, при которых проводят измерения импеданса, могут зависеть от того, насколько подробно необходимо отслеживать кинетику реакций. Например, короткие интервалы могут быть предпочтительны, если необходимо отслеживать кинетику ADCC для антитела, которое, как уже известно, индуцирует ADCC, тогда как более длительные интервалы могут быть удовлетворительными, если изначальная цель проведения анализа состоит в том, чтобы установить, может ли данное антитело вообще индуцировать ADCC. Способы могут включать в себя проведение измерений импеданса в моменты времени, такие как, например, каждые 30 минут, каждые 15 минут, каждые 10 минут, каждые 9, 8, 7, 6, 5, 4, 3 или 2 минуты, каждую минуту или чаще, чем каждую минуту.
Описанные здесь способы могут дополнительно включать высевание клеток-мишеней на подложку перед добавлением эффекторных клеток и антитела. Например, клетки-мишени можно высевать на подложку и позволять им расти в течение периода времени перед добавлением эффекторных клеток и антитела. Высевание клеток-мишеней перед добавлением антитела и эффекторных клеток может позволить клеткам-мишеням прикрепиться к подложке и расти, приводя в результате к увеличению импеданса, которое может способствовать определению снижения импеданса после добавления эффекторных клеток и антитела. Тем не менее, клетки-мишени, как правило, не должны перерастать, поскольку клетки-мишени, прикрепленные к подложке, могут стать недоступными для антитела из-за клеток, растущих над ними. В таком случае отсутствовала бы возможность обнаружить ADCC. Необходимо отметить, что проведение экспериментов для определения оптимальной продолжительности времени, за которое клетки-мишени следует высевать перед добавлением эффекторных клеток и антитела, находится в рамках способностей квалифицированного человека. В некоторых вариантах осуществления клетки-мишени можно высевать на подложку за 10-30 часов перед добавлением эффекторных клеток и антитела. Например, клетки-мишени можно высевать на подложку за 18-24 часа (например, 19-21 час) перед добавлением эффекторных клеток и антитела.
Плотность, при которой высевают клетки-мишени, может зависеть от размера клеток и скорости, с которой они растут. Система детектирования типично обладает максимальным порогом, выше которого невозможно определить дальнейший рост клеток. Клетки-мишени, таким образом, следует высевать при плотности, которая находится ниже такого порога, чтобы иметь возможность для определения изменения импеданса, происходящего вследствие гибели клеток. Тем не менее, клетки-мишени также следует высевать при плотности, которая достаточно высока, чтобы позволить клеткам влиять на импеданс во время первоначального периода роста, так чтобы можно было определить любое снижение импеданса после добавления эффекторных клеток и антитела. В некоторых вариантах осуществления клетки-мишени можно высевать при плотности в диапазоне от 2 K до 100 K в стандартную лунку площадью 19,6 мм2 (например, при плотности в диапазоне от 10 K до 60 K в стандартную лунку площадью 19,6 мм2, при плотности в диапазоне от 15 K до 25 K в стандартную лунку площадью 19,6 мм2 или при плотности приблизительно 20 K в стандартную лунку площадью 19,6 мм2).
Продолжительность времени, за которое проводят измерения импеданса, то есть продолжительность анализа, может изменяться в зависимости от периода времени между высеванием клеток-мишеней и добавлением эффекторных клеток и антитела. Снижение импеданса вследствие ADCC, обычно, можно определять в пределах нескольких часов после добавления антитела и эффекторных клеток. В некоторых случаях, тем не менее, может быть необходимым продолжать наблюдать за импедансом в течение периода времени после начала уничтожения клеток посредством ADCC, чтобы определить степень гибели клеток и выяснить, имеет ли место и когда произошел какой-либо повторный рост клеток. Предлагаемые здесь способы, таким образом, могут включать в себя проведение измерений импеданса в течение, без ограничения, 24 часов, 36 часов, 48 часов, 72 часов, 100 часов, 200 часов или более чем 200 часов после высевания клеток-мишеней.
В предлагаемых здесь способах можно использовать любое количество эффекторных клеток и любое количество клеток-мишеней при условии, как обсуждалось выше, что количество клеток-мишеней не настольно высоко, чтобы предотвратить точное определение ADCC. В способах можно использовать большее количество эффекторных клеток, чем клеток-мишеней. Соотношение эффекторных клеток и клеток-мишеней (E:T) может составлять, например, более чем 10:1, более чем 20:1, более чем 50:1, более чем 100:1 или приблизительно 25:1.
Антитело можно добавлять к клеткам-мишеням при любой концентрации. Например, антитело можно добавлять к высеянным клеткам-мишеням при концентрации, например, в диапазоне приблизительно от 1 до приблизительно 1000 мкг/мл, в диапазоне приблизительно от 1 до приблизительно 500 мкг/мл, в диапазоне приблизительно от 1 до приблизительно 100 мкг/мл, в диапазоне приблизительно от 1 до приблизительно 75 мкг/мл, в диапазоне приблизительно от 1 до приблизительно 50 мкг/мл, в диапазоне приблизительно от 1 до приблизительно 25 мкг/мл, в диапазоне приблизительно от 1 до приблизительно 10 мкг/мл, в диапазоне приблизительно от 2 до приблизительно 8 мкг/мл или в диапазоне приблизительно от 4 до приблизительно 6 мкг/мл.
В некоторых вариантах осуществления описанные здесь способы можно использовать для определения оптимальной концентрации антитела, которое индуцирует реакцию ADCC, сравнивая реакцию ADCC, полученную при использовании различных концентраций антитела. Например, способ может включать в себя (a) мониторинг импеданса между электродами на непроводящей подложке, которая способствует росту двух или более (например, двух, трех, четырех, пяти или более чем пяти) образцов клеток-мишеней в среде для анализа, и (b) добавление эффекторных клеток и антитела к двум или более образцам клеток-мишеней, при этом антитело связывается с клетками-мишенями, и причем антитело добавляют в различных концентрациях к двум или более образцам клеток-мишеней; причем снижение импеданса между электродами на подложке после добавления эффекторных клеток и антитела характерно для действия ADCC, произошедшего в среде для анализа, и причем концентрация ант