Фармацевтические композиции, включающие ингибиторы нэп (нейтральной эндопептидазы), ингибиторы эндогенной продуцирующей эндотелин системы и ингибиторы гмг (гидроксиметилглутарил)соа редуктазы
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам и касается фармацевтической композиции, включающей (i) фармакологически эффективные количества каждого из действующих веществ: а) ингибитора нейтральной эндопептидазы, b) ингибитора эндогенной продуцирующей эндотелин системы и с) ингибитора ГМГ (гидроксиметилглутарил) СоА редуктазы, выбранного из группы, включающей аторвастин и симвастатин или любые их физиологически приемлемые соли, сольваты или эфиры, где субкомбинация ингибитора нейтральной эндопептидазы а) и ингибитора эндогенной продуцирующей эндотелин системы (b) является соединением двойного действия, которое способно ингибировать нейтральную эндопептидазу и человеческую растворимую эндопептидазу, которым является даглутрил, и (ii) предпочтительно фармацевтически приемлемые вспомогательные вещества и/или носители, для профилактики или лечения сердечно-сосудистых расстройств у млекопитающих и человека. Также раскрыт набор для профилактики или лечения сердечно-сосудистых расстройств или заболеваний у млекопитающих и человека. Предложенная композиция проявляет синергетический эффект при лечении сердечно-сосудистых заболеваний. 2 н. и 7 з.п. ф-лы, 3 табл.
Реферат
Настоящее изобретение относится к новой комбинированной терапии сердечно-сосудистых заболеваний или патологических состояний с помощью синергетической комбинации по меньшей мере одного ингибитора нейтральной эндопептидазы (НЭП), по меньшей мере одного ингибитора эндогенной продуцирующей эндотелин системы и по меньшей мере одного ингибитора ГМГ СоА редуктазы. Таким образом, настоящее изобретение также относится к новым фармацевтическим композициям, включающим ингибиторы НЭП, ингибиторы эндогенной продуцирующей эндотелин системы и ингибиторы ГМГ СоА редуктазы, к применению указанной фармацевтической композиции для профилактики или лечения сердечно-сосудистых и/или метаболических нарушений или заболеваний у млекопитающих и людей.
Из документа ЕР 0254032 А2 (US 4749688) известно, что ингибиторы НЭП могут снижать артериальное давление при патологических состояниях, при которых ингибиторы ангиотензинпревращающего фермента (АКФ) относительно неэффективны при монотерапии. Кроме того, в этом документе показано, что ингибиторы НЭП можно комбинировать с другими лекарственными средствами, применяющимися для лечения гипертензии, например ингибиторами АКФ, для усиления воздействия этих лекарственных средств. Поэтому описаны фармацевтические композиции, включающие и ингибитор НЭП, и ингибитор АКФ.
Хотя благоприятное воздействие ингибирующих НЭП соединений при лечении или предупреждении сердечно-сосудистых заболеваний, в особенности эссенциальной гипертензии, легочной гипертензии и/или застойной сердечной недостаточности, в настоящее время хорошо изучено, профиль их воздействия при монотерапии все еще характеризуется некоторыми специфическими недостатками.
При застойной сердечной недостаточности вследствие уменьшенного минутного сердечного выброса и повышения периферического сопротивления сосудов наблюдается явление повышенного давления в участке кровеносного русла вследствие затруднения оттока крови в малом легочном круге кровообращения и в самом сердце. Вследствие этого возникает повышенное напряжение стенки сердечной мышцы в области предсердий и полостей сердца. В такой ситуации сердце функционирует как эндокринный орган и вырабатывает и вводит в кровоток, в частности, предсердный натрийуретический пептид (ПНП). Вследствие заметной сосудорасширяющей и натрийуретической/диуретической активности ПНП приводит и к уменьшению периферического сопротивления сосудов, и к уменьшению объема циркулирующей крови. Следствием является заметное уменьшение пред- и постнагрузки. Это образует эндогенный кардиозащитный механизм. Этот позитивный эндогенный механизм ограничен тем, что ПНП обладает лишь небольшим временем существования в плазме. Причиной этого является то, что этот гормон очень быстро разрушается с помощью НЭП. Поэтому фармакологическое ингибирование НЭП повышает уровни ПНП и тем самым стимулирует указанный кардиозащитный механизм.
При застойной сердечной недостаточности вследствие связанного с заболеванием уменьшения минутного сердечного выброса срабатывает рефлекс увеличения периферического сопротивления сосудов. В результате сердечная мышца начинает перекачивать кровь при увеличенной постнагрузке. При патологическом цикле это приводит к увеличенной нагрузке на сердце и дополнительному ухудшению ситуации. Увеличение периферического сопротивления сосудов опосредуется, в частности, вазоактивным пептидом эндотелином. Эндотелин (ЭТ) является самым сильным известным в настоящее время эндогенным сосудосуживающим веществом, и он образуется из предшественника, большого эндотелина (bigЭT) с участием эндотелинпревращающего фермента (ЭКФ). НЭП участвует не только в разрушении ПНП, но и в разрушении ЭТ.
По этим причинам представляется, что комбинация соединений, способных ингибировать НЭП, с соединениями, способными ингибировать эндогенную продуцирующую эндотелин систему, или соединениями, обладающими двойной способностью ингибировать НЭП и эндогенную продуцирующую эндотелин систему, будут еще более полезными для лечения сердечно-сосудистых заболеваний, таких как эссенциальная гипертензия, легочная гипертензия и/или застойная сердечная недостаточность. Вследствие ингибирования эндогенной продуцирующей эндотелин системы предотвращается образование эндотелина и тем самым возникнет противодействие повышению периферического сопротивления сосудов, что приведет к уменьшению нагрузки на сердечную мышцу. Таким образом, ингибирование фермента НЭП, разрушающего ПНП, может привести к повышению содержания ПНП и увеличению длительности воздействия ПНП. Это приведет к усилению опосредуемого ПНП действия кардиозащитного механизма. Однако, поскольку НЭП может также участвовать в разрушении ЭТ, только ингибирование НЭП в дополнение к желательному повышению содержания ПНП также приведет к нежелательному повышению содержания ЭТ. По этой причине особенно желательным считается смешанное воздействие с двойным ингибированием НЭП и эндогенной продуцирующей эндотелин системы, поскольку оно и предотвращает нарушение натрийуретической/диуретической активности ПНП (вследствие блокады НЭП), и одновременно ингибирует образование ЭТ. В результате устраняется сопутствующий нежелательный эффект ингибирования только НЭП (повышение содержания эндотелина).
Ингибиторы ГМГ СоА редуктазы являются активными лекарственными соединениями, которые способны селективно ингибировать фермент 3-гидрокси-3-метилглутарил-кофермент А (ГМГ-СоА) редуктазу, т.е. фермент, осуществляющий катализ превращения ГМГ СоА в мевалонат, которое является лимитирующей стадией пути биосинтеза холестерина. Поэтому известно, что ингибиторы ГМГ СоА редуктазы обладают способностью снижать содержание холестерина, что делает их ценными терапевтическими средствами для лечения сосудистых заболеваний или патологических состояний. В нескольких клинических исследованиях установлено, что уменьшение содержания некоторых форм холестерина у млекопитающего является эффективным способом лечения и предупреждения сердечных приступов, внезапной смерти и стенокардии как у субъектов, обладающих превышающим нормальное содержанием холестерина в кровотоке, так и у тех, которые обладают нормальным содержанием холестерина. Поэтому уменьшение содержания липопротеина низкой плотности (ЛНП) путем введения ингибиторов ГМГ СоА редуктазы в настоящее время является одной из основных задач лечения пациентов, у которых наблюдаются сердечно-сосудистые заболевания или для которых существует риск развития таких заболеваний, как атеросклероз; церебральный инфаркт; ишемическая болезнь сердца; инфаркт миокарда; рестеноз, такой как рестеноз после баллонной ангиопластики; и/или инсульт.
Однако природа сердечно-сосудистых, в частности гипертензивных сосудистых, заболеваний является многофакторной. Например, гипертензия часто сопровождается гиперлипидемией, и оба заболевания считаются основными факторами риска развития заболевания сердца, часто приводящими к неблагоприятным кардиологическим событиям. Такое сочетание факторов риска потенциально обусловлено общим механизмом. Известно, что ишемическая болезнь сердца является многофакторным заболеванием, на частоту и тяжесть которого влияет липидный профиль, наличие диабета и пол субъекта. На частоту также влияет курение и гипертрофия левого желудочка, которые являются следующими по важности после гипертензии. Поэтому для значимого снижения риска ишемической болезни сердца важно воздействовать на весь спектр факторов риска. Например, лечение гипертензии не привело к нормализации заболеваемости вследствие ишемической болезни сердца. Лечение ингибиторами синтеза холестерина пациентов, страдающих и не страдающих ишемической болезнью сердца, снижает риск сердечно-сосудистой заболеваемости и смертности. Кроме того, применение средства в фиксированной комбинации предпочтительно в низкой дозе, потенциально также снижает дозы каждого компонента по сравнению с теми, которые могут потребоваться при монотерапии, что снижает риск зависящих от дозы побочных эффектов и сопутствующих затруднений в соблюдении режима лечения. Кроме того, режим лечения гипертензии пациенты обычно соблюдают лучше, чем режим лечения гиперлипидемии. Поэтому для пациентов было бы предпочтительно использовать комбинированное, предпочтительно с помощью одного лекарственного препарата, лечение обоих этих патологических состояний.
Соединения двойного действия, сочетающие ингибирующее воздействие на НЭП и эндогенную продуцирующую эндотелии систему, т.е. производные бензазепин-, бензоксазепин- и бензотиазепин-N-уксусной кислоты, известны из документа ЕР 0733642 A1 (US 5677297). Другие благоприятные фармакологические характеристики соединений, входящих в объем ЕР 0733642 A1, известны из документов ЕР 0830863 A1 (US 5783573), WO 00/48601 A1 (US 6482820) и WO 01/03699 A1 (US-2003-0040512-A1).
Производные замещенной фосфоновой кислотой бензазепинон-N-уксусной кислоты, оказывающие комбинированное ингибирующее воздействие на НЭП и эндогенную продуцирующую эндотелин систему, раскрыты в документе ЕР 0916679 A1 (=US 5952327).
Амидометилзамещенные производные 1-(карбоксиалкил)-циклопентилкарбониламинобензазепин-N-уксусной кислоты, которые применимы, например, для профилактики и/или лечения сердечно-сосудистых патологических состояний или заболеваний, раскрыты в документе WO 2005/030795 A1.
Из документа WO 02/094176 А2 известно, что некоторые соединения, включая раскрытые в документе ЕР 0733642 А1 и в документе ЕР 0916679 А1, могут ингибировать эндогенную продуцирующую эндотелин систему путем ингибирования металлопротеазы IGS5. Металлопротеаза IGS5 также известна как растворимая эндопептидаза человека (hSEP), и описана, например, в документе WO 02/094176 А2. Кроме того, в WO 02/094176 А2 раскрыто применение соединений, обладающих комбинированной НЭП/hSEP ингибирующей активностью, для профилактики или лечения, в частности, сердечно-сосудистых заболеваний.
В документе WO 99/47138 А1 приведены фармацевтические композиции, включающие ингибитор матричной металлопротеазы и статин, предназначенные для лечения заболеваний сосудов.
В заявке на международный патент WO 2004/082636 описана комбинация антагониста альдостеронового рецептора и ингибитора нейтральной эндопептидазы, в частности, предназначенная для лечения сердечно-сосудистых заболеваний.
В заявке US No. 2004/0092573 раскрыты некоторые ингибиторы ГМГ СоА редуктазы и их комбинации с другими активными средствами.
В заявке на международный патент WO 02/092622 раскрыты некоторые дипептидные производные, которые могу действовать как двойные ингибиторы АКФ и НЭП, а также как ингибиторы эндотелинпревращающего фермента (ЭКФ). Также раскрыта комбинация указанных дипептидных производных, в частности, с ингибиторами ГМГ СоА редуктазы.
Объектом настоящего изобретения является новое комбинированное средство, предназначенное для лечения или облегчения протекания сердечно-сосудистых нарушений или заболеваний, в особенности стенокардии; абдоминального ишемического синдрома; аритмий; атеросклероза; гипертрофии сердца; церебрального инфаркта; ишемий головного мозга; застойной сердечной недостаточности; ишемической болезни сердца; гипертензии, предпочтительно эссенциальной гипертензии, легочной гипертензии, почечной гипертензии и/или гипертензии, связанной с ожирением; инфаркта миокарда; рестеноза и/или инсульта, обладающее повышенной эффективностью и благоприятным профилем безопасности. Другим объектом настоящего изобретения является новое комбинированное средство, предназначенное для лечения или облегчения протекания метаболических нарушений или заболеваний, таких как метаболический синдром или синдром X, предпочтительно, но не ограничиваясь только ими, метаболических нарушений и заболеваний, связанных с ожирением.
Согласно изобретению неожиданно было установлено, что комбинация по меньшей мере одного ингибитора НЭП, по меньшей мере одного ингибитора эндогенной продуцирующей эндотелии системы и дополнительно по меньшей мере одного ингибитора ГМГ СоА редуктазы обеспечивает еще более высокую эффективность лечения или облегчения протекания сердечно-сосудистых нарушений или заболеваний, таких как стенокардия; абдоминальный ишемический синдром; аритмии; атеросклероз; гипертрофия сердца; церебральный инфаркт; ишемии головного мозга; застойная сердечная недостаточность; ишемическая болезнь сердца; гипертензия, предпочтительно эссенциальная гипертензия, легочная гипертензия, почечная гипертензия и/или гипертензия, связанная с ожирением; инфаркт миокарда; рестеноз и/или инсульт, и благоприятный профиль безопасности. Кроме того, указанная комбинация по меньшей мере одного ингибитора НЭП, по меньшей мере одного ингибитора эндогенной продуцирующей эндотелин системы и дополнительно по меньшей мере одного ингибитора ГМГ СоА редуктазы обеспечивает еще более высокую эффективность лечения или облегчения протекания метаболических нарушений или заболеваний, таких как метаболический синдром или синдром X, предпочтительно, но не ограничиваясь только ими, метаболических нарушений и заболеваний, связанных с ожирением.
Поэтому первым объектом настоящего изобретения являются фармацевтические композиции, включающие фармакологически эффективные количества каждого из следующих веществ:
a) по меньшей мере одного ингибитора НЭП в качестве первого активного средства,
b) по меньшей мере одного ингибитора эндогенной продуцирующей эндотелин системы в качестве второго активного средства и
c) по меньшей мере одного ингибитора ГМГ СоА редуктазы в качестве третьего активного средства.
Фармацевтические композиции, предлагаемые в настоящем изобретении, могут дополнительно и предпочтительно включать обычные фармацевтически приемлемые вспомогательные вещества и/или носители.
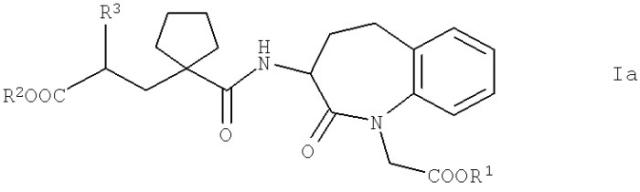
В фармацевтических композициях, предлагаемых в настоящем изобретении, субкомбинация по меньшей мере одного ингибитора НЭП (а) и по меньшей мере одного ингибитора эндогенной продуцирующей эндотелин системы (b) может предпочтительно быть образована с помощью соединения двойного действия общей формулы I
в которой R1 обозначает водород или группу, образующую биологически лабильный эфир карбоновой кислоты;
А обозначает группу, выбранную из подгрупп (а)
в которой R2 обозначает водород или группу, образующую биологически лабильный эфир карбоновой кислоты, и
R3 обозначает фенил-С1-С4-алкильную группу, которая необязательно может быть замещена по фенильному кольцу С1-С4-алкилом, С1-С4-алкоксигруппой или галогеном; или нафтил-С1-С4-алкильную группу; или (b)
в которой R4 обозначает водород или группу, образующую биологически лабильный эфир фосфоновой кислоты, и
R5 обозначает водород или группу, образующую биологически лабильный эфир фосфоновой кислоты; или (с)
в которой R6 обозначает водород или группу, образующую биологически лабильный эфир
карбоновой кислоты,
R7 обозначает водород, С1-С4-алкил или С1-С4-гидроксиалкил, гидроксигруппа которого необязательно этерифицирована С2-С4-алканоилом или аминокислотным остатком, и
R8 обозначает С1-С4-алкил; С1-С4-алкокси-С1-С4-алкил; С1-С4-гидроксиалкил, который необязательно замещен второй гидроксигруппой, и все гидроксигруппы которого необязательно этерифицированы С2-С4-алканоилом или аминокислотным остатком; (С0-С4-алкил)2амино-С1-С6-алкил; С3-С7-циклоалкил; С3-С7-циклоалкил-С1-С4-алкил; фенил-С1-С4-алкил, фенильная группа которого необязательно 1-2 замещена С1-С4-алкилом, С1-С4-алкоксигруппой и/или галогеном; нафтил-С1-С4-алкил; С3-С6-оксоалкил; фенилкарбонилметил, фенильная группа которого необязательно 1-2 замещена С1-С4-алкилом, С1-С4-алкоксигруппой и/или галогеном, или 2-оксоазепанил, или R7 и R8 совместно обозначают С4-С7-алкилен, метиленовые группы которого необязательно 1-2 замещены карбонилом, азотом, кислородом и/или серой и который необязательно замещен одной гидроксигруппой, которая необязательно этерифицирована С2-С4-алканоилом или аминокислотным остатком; С1-С4-алкил; С1-С4-гидроксиалкил, гидроксигруппа которого необязательно этерифицирована С2-С4-алканоилом или аминокислотным остатком; фенил или бензил,
и/или физиологически совместимых солей кислот формулы I и/или физиологически совместимых солей присоединения с кислотами соединений формулы Iс.
Если заместители в соединениях формулы I представляют собой или содержат С1-С4-алкильные группы, то они могут быть линейными или разветвленными. Если группы, образующие биологически лабильный эфир в соединениях формулы I представляют собой или содержат низшие алкильные группы, то они могут быть линейными или разветвленными и обычно содержат от 1 до 4 атомов углерода. Если заместители содержат галоген, то особенно предпочтительными являются фтор, хлор или бром, более предпочтительно фтор или хлор. Если заместители содержат С2-С4-алканоил, то он может быть линейным или разветвленным. В качестве С2-С4-алканоила предпочтительным является ацетил.
Если заместители представляют собой образующие биологически лабильный эфир группы, то соединения, как правило, представляют собой пролекарства активного лекарственного соединения. Пролекарства представляют собой терапевтические средства, которые сами по себе неактивны, но преобразуются в один или большее количество активных метаболитов. Пролекарства представляют собой биологически обратимые производные молекул лекарственных веществ, использующиеся для преодоления некоторых ограничений применения исходной молекулы лекарственного вещества. Эти ограничения включают, но не ограничиваются только ими, ограничения, связанные с растворимостью, проницаемостью, стабильностью, предварительным системным метаболизмом, и ограничения, связанные с направленностью воздействия (см., например, Medicinal Chemistry: Principles and Practice, 1994, ISBN 0-85186-494-5, Ed.: F.D.King, p.215; J. Stella, "Prodrugs as therapeutics". Expert Opin. Ther. Patents, 14(3), 277-280, 2004; P.Ettmayer et al., "Lessons learned from marketed and investigational prodrugs", J.Med. Chem., 47, 2393-2404, 2004).
Подходящие физиологически совместимые соли свободных кислот формулы I включают их соли щелочного металла, щелочноземельного металла или аммония, например, их натриевые или кальциевые соли или соли с физиологически совместимыми, фармакологически нейтральными органическими аминами, такими как, например, диэтиламин или трет-бутиламин.
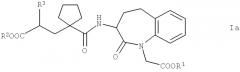
Предпочтительными являются соединения общей формулы Iа
в которой R1, R2 и R3 обладают указанными выше значениями, и физиологически совместимые соли кислот формулы Iа. Предпочтительные соли соединений формулы Iа, например, раскрыты в документе WO 03/059939 А1, который во всей своей полноте включен в настоящее изобретение в качестве ссылки. Соединения формулы Iа содержат 2 хиральных атома углерода, а именно атом углерода, который находится в положении 3 кольцевого скелета (положение 3) и содержит амидную боковую цепь, и атом углерода амидной боковой цепи, который содержит радикал R3 (положение 2'). Поэтому соединения могут находиться в нескольких оптически активных стереоизомерных формах или в виде рацемата. В контексте настоящего изобретения можно применять рацемические смеси и изомерно чистые соединения формулы Iа.
Соединения формулы Iа необязательно являются этерифицированными производными карбоновых кислот. В зависимости от вводимой формы предпочтительными являются биологически лабильные моноэфиры, в особенности соединения, в которых R2 обозначает группу, образующую биологически лабильный эфир, и R1 обозначает водород, или дикарбоновые кислоты, последние являются особенно предпочтительными для внутривенного введения. Группы, которые можно отщепить при физиологических условиях in vivo с высвобождением биологически доступных производных соединений формулы Iа, пригодны для использования в качестве групп, образующих биологически лабильные эфиры карбоновых кислот R1 и R2. Их подходящими примерами являются С1-С4-алкильные группы, предпочтительно метил, этил, н-пропил и изопропил; С1-С4-алкилокси-С1-С4-алкилокси-С1-С4-алкильные группы, предпочтительно метоксиэтоксиметил; С3-С7-Циклоалкильные группы, предпочтительно циклогексил; С3-С7-циклоалкил-С1-С4-алкильные группы, предпочтительно циклопропилметил; N,N-ди-(С0-С4-алкил)амино-С1-С6-алкильные группы; фенильные и фенил-С1-С4-алкильные группы, по фенильному кольцу необязательно один или два раза замещенные галогеном, С1-С4-алкилом или С1-С4-алкоксигруппой или С1-С4-алкиленовой цепью, связанной с двумя соседними атомами углерода; диоксоланилметильные группы, необязательно замещенные по диоксолановому кольцу С1-С4-алкилом; С2-С6-алканоилокси-С1-С4-алкильные группы, необязательно замещенные по окси-C1-С4-алкильной группе С1-С4-алкилом; двойные сложные эфиры, такие как 1-[[(C1-С4-алкил)карбонил]окси]С1-С4-алкиловые сложные эфиры, например (RS)-1-[[(изопропил)карбонил]окси]этил или (RS)-1-[[(этил)карбонил]окси]-2-метилпропил (получение см., например, F.W. Sum et al., Bioorg. Med. Chem. Lett. 9 (1999) 1921-1926, или Y. Yoshimura et al., The Journal of Antibiotics 39/9 (1986) 1329-1342); карбонатные сложные эфиры, такие как 1-[[(С4-С7-циклоалкилокси)карбонил]окси]С1-С4-алкиловые сложные эфиры, предпочтительно (RS)-1-[[(циклогексилокси)карбонил]окси]этил (цилексетил; получение см., например, публикацию К. Kubo et al., J. Med. Chem. 36 (1993) 2343-2349, ниже цитируемую как "Kubo et al.") или 2-оксо-1,3-диоксолан-4-ил-С1-С4-алкиловые сложные эфиры, которые необязательно содержат двойную связь в диоксолановом кольце, предпочтительно 5-метил-2-оксо-1,3-диоксолен-4-илметил (медоксомил, получение см., например, Kubo et al.) или 2-оксо-1,3-диоксолан-4-илметил ((метил)этиленкарбонат). Если группа, образующая биологически лабильный эфир представляет собой необязательно замещенную фенил-С1-С4-алкильную группу, то она может содержать алкиленовую цепь, включающую от 1 до 3, предпочтительно 1, атом углерода и предпочтительно представляет собой необязательно замещенный бензил, предпочтительно 2-хлорбензил или 4-хлорбензил. Если группа, образующая биологически лабильный эфир, представляет собой необязательно замещенную фенильную группу, фенильное кольцо которой замещено низшей алкиленовой цепью, то она может содержать от 3 до 4, предпочтительно 3, атома углерода и предпочтительно представляет собой инданил. Если группа, образующая биологически лабильный эфир представляет собой необязательно замещенную С2-С6-алканоилокси-С1-С4-алкильную группу, то С2-С6-алканоильная группа может быть линейной или разветвленной.
R1 предпочтительно обозначает водород, С1-С4-алкил, п-метоксибензил, N,N-ди-(С0-С4-алкил)амино-С1-С6-алкил, (RS)-1-[[(изопропил)карбонил]окси]этил, (RS)-1-[[(этил)карбонил]окси]-2-метилпропил, (RS)-1-[[(циклогексилокси)карбонил]окси]этил, 5-метил-2-оксо-1,3-диоксолен-4-илметил, 2-оксо-1,3-диоксолан-4-илметил или (RS)-1-[[(этокси)карбонил]окси]этил.
R2 предпочтительно обозначает водород, этил, метоксиэтоксиметил, (RS)-1-[[(изопропил)карбонил]окси]этил, (RS)-1-[[(этил)карбонил]окси]-2-метилпропил, (RS)-1-[[(циклогексилокси)карбонил]окси]этил, 5-метил-2-оксо-1,3-диоксолен-4-илметил, 2-оксо-1,3-диоксолан-4-илметил или (RS)-l-[[(этокси)карбонил]окси]этил.
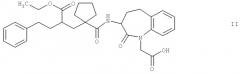
Более предпочтительными являются соединения, которые выбраны из группы, включающей этиловый эфир 2-[1-(1-карбоксиметил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b]азепин-3-илкарбамоил)циклопентилметил]-4-фенилмасляной кислоты [альтернативное название 3-[1-{2'-(этоксикарбонил)}-4'-фенилбутил]циклопентан-1-карбониламино]-2,3,4,5-тетрагидро-2-оксо-1Н-1-бензазепин-1-уксусная кислота] формулы II
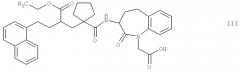
этиловый эфир 2-[1-(1-карбоксиметил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b]азепин-3-илкарбамоил)циклопентилметил]-4-нафталин-1-илмасляной кислоты [альтернативное название 3-[1-{2-(этоксикарбонил)-4-(1-нафтил)бутил]циклопентил}карбонил)амино]-2-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил}уксусная кислота] формулы III
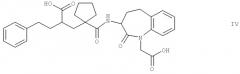
2-[1-(1-карбоксиметил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b]азепин-3-илкарбамоил)-циклопентилметил]-4-фенилмасляную кислоту формулы IV
2-[1-(1-карбоксиметил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b]азепин-3-илкарбамоил)-циклопентилметил]-4-нафталин-1-илмасляную кислоту формулы V
и физиологически совместимые соли кислот формул II, III, IV и/или V
Соединения формул II, III, IV и V являются особенно подходящими в своих 3S,2'R формах. Наиболее предпочтительным является соединение формулы II в своей 3S,2'R форме, также известной как "даглутрил" или "SLV306". Соединения формулы Iа известны, например, из документа ЕР 0733642 А1, который во всей своей полноте включен в настоящее изобретение в качестве ссылки, и могут быть получены по производственным технологиям, раскрытым или цитированным в этом документе, или аналогично указанным производственным технологиям. Кроме того, соединения общей формулы Ib
в которой R1, R4 и R5 обладают указанными выше значениями, или физиологически совместимые соли кислот формулы Ib можно использовать в качестве соединений двойного действия, способного ингибировать НЭП и эндогенную продуцирующую эндотелин систему. Соединения формулы Ib известны, например, из документа ЕР 0916679 А1, который во всей своей полноте включен в настоящее изобретение в качестве ссылки, и могут быть получены по производственным технологиям, раскрытым или цитированным в этом документе, или аналогично указанным производственным технологиям.
Подходящими группами R1, образующими биологически лабильные эфиры карбоновых кислот в соединениях формулы Ib, являются такие, которые указаны выше для соединений формулы Iа.
Группами R4 и R5, подходящими для использования в качестве образующих биологически лабильные эфиры фосфоновой кислоты, являются такие, которые можно удалить при физиологических условиях in vivo с высвобождением группы соответствующей фосфоновой кислоты. Например, группами, которые пригодны для этой цели, являются низшие алкильные группы, С2-С6-алканоилоксиметильные группы, необязательно замещенные по оксиметильной группе низшей алкильной или фенильной или фенил-низшей алкильной группами, фенильное кольцо которых необязательно моно- или полизамещено низшей алкильной, низшей алкоксильной или низшей алкиленовой цепью, связанной с двумя соседними атомами углерода. Если группа R4 и/или R5, образующая биологически лабильный эфир, представляет собой или содержит низший алкил, то она может быть линейной или разветвленной и может содержать от 1 до 4 атомов углерода. Если R4 и/или R5 обозначают необязательно замещенную алканоилоксиметильную группу, то она может содержать предпочтительно разветвленную алканоилоксигруппу, содержащую от 2 до 6, предпочтительно от 3 до 5, атомов углерода и может, например, представлять собой пивалоилоксиметильный радикал (=трет-бутилкарбонилоксиметильный радикал). Если R4 и/или R5 обозначают необязательно замещенную фенил-низшую алкильную группу, то она может содержать алкиленовую цепь, включающую от 1 до 3, предпочтительно 1 атом углерода. Если фенильное кольцо замещено низшей алкиленовой цепью, то она может содержать от 3 до 4, предпочтительно 3 атома углерода, и замещенное фенильное кольцо предпочтительно представляет собой инданил.
Соединения формулы Ib содержат хиральный атом углерода, а именно атом углерода, содержащий амидную боковую цепь в положении 3 бензазепинового каркаса. Таким образом, эти соединения могут находиться в двух оптически активных стереоизомерных формах или в виде рацемата. Настоящее изобретение включает и рацемические смеси, и изомерно чистые соединения формулы I. Если R4 и R5 в соединениях формулы Ib не обозначают водород и в каждом случае являются разными, то атом фосфора фосфоновой группы также может быть хиральным. Настоящее изобретение также относится к смесям стереоизомеров и изомерно чистым соединениям формулы Ib, образовавшимся вследствие хиральности атомов фосфора.
Если соединения формулы Ib применяются в контексте настоящего изобретения, то предпочтительными являются трет-бутиловый эфир (3-{[1-(бензоилоксиэтокси-фосфорилметил)циклопентанкарбонил]амино}-2-оксо-2,3,4,5-тетрагидробензо[b]азепин-1-ил)уксусной кислоты и 1-[[1-(1-карбоксиметил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b]азепин-3-илкарбамоил)циклопентилметил]-(1-изобутирилоксиэтокси)-фосфиноилокси]этиловый эфир изомасляной кислоты. Оба указанных соединения являются особенно предпочтительными, если конфигурацией хирального атома углерода (см. выше) является конфигурация S, а именно их конфигурация (3S). Соединения формулы Ib известны, например, из документа ЕР 0916679 А1, и могут быть получены по производственным технологиям, раскрытым или цитированным в этом документе, или аналогично указанным производственным технологиям.
Также предпочтительными являются соединения общей формулы Iс
в которой R1, R6, R7 и R8 обладают указанными выше значениями, и физиологически совместимые соли кислот формулы Iс и/или физиологически совместимые соли присоединения с кислотами соединений формулы Iс, предназначенные для применения в качестве соединений двойного действия, способных ингибировать НЭП и эндогенную продуцирующую эндотелин систему в фармакологических композициях, предлагаемых в настоящем изобретении. Соединения формулы Iс известны, например, из документа WO 2005/030795 А1, который во всей своей полноте включен в настоящее изобретение в качестве ссылки, и могут быть получены по производственным технологиям, раскрытым или цитированным в этом документе, или аналогично указанным производственным технологиям.
Если в соединениях формулы Iс заместители R7 и/или R8 содержат основные группы, предпочтительно азотсодержащие, то соединения формулы Iс также могут находиться в виде солей присоединения с кислотами. Физиологически совместимые соли присоединения с кислотами соединений формулы Iс являются их обычными солями с неорганическими кислотами, например серной кислотой, фосфорной кислотой или галогенводородной кислотой, предпочтительно хлористоводородной кислотой, или с органическими кислотами, например низшими алифатическими монокарбоновыми, дикарбоновыми или трикарбоновыми кислотами, такими как малеиновая кислота, фумаровая кислота, виннокаменная кислота, лимонная кислота, или с сульфоновыми кислотами, например низшими алкансульфоновыми кислотами, такими как метансульфоновая кислота.
Подходящими группами R1, образующими биологически лабильные эфиры карбоновых кислот в соединениях формулы Iс, являются такие, которые указаны выше для соединений формулы Iа. Подходящими группами R6, образующими биологически лабильные эфиры карбоновых кислот в соединениях формулы Iс, являются такие же, которые указаны выше для групп R2 в соединениях формулы Iа.
R7 предпочтительно обозначает водород, метил, этил, 2-гидроксиэтил или 3-гидроксипропил, каждая гидроксигруппа необязательно этерифицирована С2-С4-алканоилом или аминокислотным остатком.
Если R8 обозначает (С0-С4-алкил)2амино-С1-С6-алкил, то независимо друг от друга могут содержаться одна или две С0-С4-алкильные группы. Более предпочтительно, если "(С0-С4-алкил)2амино-С1-С6-алкил" явно включает значения "(С0)2-алкиламино-С1-С6-алкил", "(С0)(С1-С4)-алкиламино-С1-С6-алкил" и "(С1-С4)2-алкиламино-С1-С6-алкил". "(С0)2-Алкиламино-С1-С6-алкил" обозначает незамещенную первичную (-NH2) аминогруппу, связанную с C1-С6-алкил(еном); "(С0)(С1-С4)-алкиламино-С1-С6-алкил" обозначает вторичную аминогруппу, монозамещенную (С1-С4)-алкилом и связанную с C1-С6-алкил(еном); "(С1-С4)2-алкиламино-С1-С6-алкил" обозначает третичную аминогруппу, дизамещенную (С1-С4)-алкилом и связанную с С1-С6-алкил(еном).
R8 предпочтительно обозначает изопропил; метоксиэтил; 2-гидроксиэтил или 3-гидроксипропил, каждая гидроксигруппа необязательно этерифицирована С2-С4-алканоилом или аминокислотным остатком; 3-ацетилокси-н-пропил; циклопропилметил; 2-метоксибензил, 4-метоксибензил; 4-метоксифенилэтил; 2,4-диметоксибензил; 1-нафтилметил; 3-оксо-1,1-диметилбутил; фенил-2-оксоэтил; 2-(4-метоксифенил)-2-оксоэтил; 3-(2-оксоазепанил); (С0-С4-алкил)2амино-С1-С6-алкил, предпочтительно диметиламино-н-пропил, (метил)аминоэтил, амино-н-пропил, амино-н-бутил или амино-н-пентил.
Если R7 и R8 совместно обозначают С4-С7-алкилен, метиленовые группы которого необязательно заменены или необязательно замещены, то в каждом случае морфолин; пиперидин; 4-кетопиперидин; 4-гидроксипиперидин, необязательно этерифицирован С2-С4-алканоилом или аминокислотным остатком по гидроксигруппе; предпочтительными являются пиперазин и пирролидин.
Если в соединениях формулы Iс гидроксигруппы этерифицированы аминокислотными остатками, то эти аминокислотные остатки могут быть образованы из природных и неприродных α- или β-аминокислот. Подходящими аминокислотами, которые можно использовать, являются, например, выбранные из группы, включающей аланин, 2-аминогексановую кислоту (норлейцин), 2-аминопентановую кислоту (норвалин), аргинин, аспарагин, аспарагиновую кислоту, цистеин, 3,4-дигидроксифенилаланин (дофа), глутамин, глутаминовую кислоту, глицин, гистидин, изолейцин, лейцин, лизин, метионин, орнитин (2,5-диаминовалериановая кислота), 5-оксо-2-пирролидинкарбоновую кислоту (пироглутаминовая кислота), фенилаланин, серин, треонин, тиронин, триптофан, тирозин и валин. Предпочтительными являются аминокислотные остатки, которые получены из аланина, аспарагина, глутамина, глицина, изолейцина, лейцина, лизина, орнитина, фенилаланина, пролина и валина.
Соединения формулы Iс содержат два хиральных атома углерода, а именно атом углерода, содержащий амидную боковую цепь в положении 3 бензазепинового каркаса (Сb*), и атом углерода, содержащий радикал "-COOR6" (Са*). Таким образом, эти соединения могут находиться всего в 4 стереизомерных формах. Настоящее изобретение относится к смесям стереоизомеров и энантиомеров, а также к изомерно чистым соединениям формулы Iс. Изомерно чистые соединения формулы Iс являются предпочтительными. Особенно предпочтительными являются соединения формулы Iс, в которой атом углерода, содержащий амидную боковую цепь в положении 3 бензазепинового каркаса, находится в конфигурации S. По отношению к хиральному атому углерода *Са, содержащему радикал -COOR1, конфигурация соединений формулы I, которые предпочтительны в контексте настоящего изобретения, условно обозначается с помощью "rel1". Путем аналогичного рассмотрения подходящих соединений известной конфигурации можно заключить, что предпочтительная конфигурация "rel1" для хирального це