Новые амидные производные пиперидинкарбоновой кислоты
Иллюстрации
Показать всеИзобретение относится к новым соединениям, выбранным из группы, состоящей из амидов пиперидинкарбоновой кислоты формулы (I)
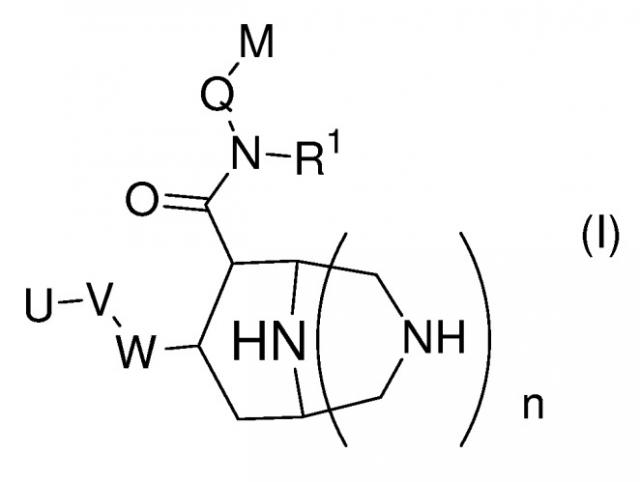
в которой W представляет собой фенильный цикл или шестичленный, не бензоконденсированный ароматический цикл, содержащий один атом азота, где указанные циклы замещены в пара-положении посредством V; V представляет собой связь; -A-(CH2)s- или -A-(CH2)v-B-; А и В независимо представляют собой -O-; U представляет собой моно-, ди-, три- или тетразамещенный арил, в котором заместители независимо выбраны из группы, состоящей из галогена, алкила и -CF3; Q представляет собой метилен; М представляет собой арильную группу, где указанная группа может быть необязательно моно- или дизамещенной заместителями, независимо выбранными из группы, состоящей из алкила; алкокси; -CF3; галогена; алкил-O-(СН2)0-4-СН2- и R'2N-(СН2)0-4-СН2-, где R' независимо выбран из группы, состоящей из водорода, алкила (необязательно замещенного одним, двумя или тремя атомами фтора), циклопропила, циклопропилметила, -C(=O)-R'', где R'' означает С1-С4-алкил или -СН2-CF3; R1 представляет собой циклоалкил; n представляет собой целое число 0 или 1; s представляет собой целое число 3; v представляет собой целое число 2; и заместители в цикле, -CON(R1)-Q-M и -W-V-U, находятся в транс-положении друг к другу, если n представляет собой целое число 1, и где конфигурации в положениях 3 и 4 пиперидинового цикла формулы (I) представляют собой 3R и 4R соответственно, если n представляет собой целое число 0; и к оптически чистым энантиомерам, смеси энантиомеров, такие как рацематы, диастереомеры, смеси диастереомеров, диастереомерные рацематы, смеси диастереомерных рацематов, и мезоформы, а также к солям таких соединений. Изобретение также относится к фармацевтической композиции. Технический результат - получение новых биологически активных соединений, обладающих активностью непептидных ингибиторов ренина. 2 н. и 10 з.п. ф-лы, 1 табл.
Реферат
Изобретение относится к новым соединениям формулы (I). Изобретение также имеет отношение к родственным аспектам, включающим способы получения соединений, фармацевтические композиции, содержащие соединение формулы (I), и особенно их применение как ингибиторов ренина в случаях сердечно-сосудистых нарушений и почечной недостаточности.
В системе ренин-ангиотензин (RAS) биологически активный ангиотензин II (Ang II) образуется по двухступенчатому механизму. Высокоспецифический фермент ренин расщепляет ангиотензиноген до ангиотензина I (Ang I), который затем дополнительно подвергается обработке до Ang II менее специфическим ферментом (АСЕ), превращающим ангиотензин. Известно, что Ang II воздействует, по меньшей мере, на два подтипа рецепторов, называемых как АТ1 и АТ2. В то время как АТ1, по-видимому, передает большинство известных функций Ang II, роль АТ2 является еще неизвестной.
Модуляция RAS-системы представляет собой главное достижение в лечении сердечно-сосудистых заболеваний. АСЕ-ингибиторы и АТ1-блокаторы были приняты для лечения гипертонии (Waeber B. et al., “The renin-angiotensin system: role in experimental and human hypertension”, in Birkenhager W. H., Reid J. L., (eds): Hypertension, Amsterdam, Elsevier Science Publishing Co., 1986, 489-519; Weber M. A., Am. J. Hypertens., 1992, 5, 247S). Кроме того, АСЕ-ингибиторы применяются для защиты почек (Rosenberg M. E. et al., Kidney International, 1994, 45, 403; Breyer J. A. et al., Kidney International, 1994, 45, S156), для профилактики застойной сердечной недостаточности (Vaunghan D. E. et al., Cardiovasc. Res., 1994, 28, 159; Fouad-Tarazi F. et al., Am. J. Med., 1988, 84 (Suppl. 3A), 83) и инфаркта миокарда (Pfeffer M. A. et al., N. Engl. J. Med., 1992, 327, 669).
Рациональный подход для разработки ингибиторов рeнина состоит в специфичности ренина (Kleinert H. D., Cardiovasc. Drugs, 1995, 9, 645). Единственный субстрат, известный для ренина, представляет собой ангиотензиноген, который может быть обработан только ренином (при физиологических условиях). Напротив, АСЕ может также расщеплять брадикинин помимо Ang I и обходным путем может быть дублирована химазой, серинпротеазой (Husain A., J. Hypertens., 1993, 11, 1155). У пациентов ингибирование АСЕ тем самым ведет к аккумуляции брадикинина, вызывающей кашель (5-20%) и потенциально угрожающий жизни ангионевротический отек (0,1-0,2%) (Israili Z. H. et al., Annals of Internal Medicine, 1992, 117, 234). Химаза не ингибируется АСЕ-ингибиторами. Поэтому образование Ang II все же возможно в пациентах, пролеченных АСЕ-ингибиторами. Блокада АТ1-рецептора (например, лозартаном), с другой стороны, чрезмерно воздействует на другие подтипы АТ-рецепторов (например, АТ2) до Ang II, концентрация которых значительно повышается блокадой АТ1-рецепторов. В итоге ингибиторы ренина, как ожидают, будут демонстрировать фармацевтический профиль, отличный от профиля ингибиторов АСЕ и блокаторов AT1 с точки зрения эффективности в блокировании RAS и аспектов безопасности.
Только ограниченный клинический опыт (Azizi M. et al., J. Hypertens., 1994, 12, 419; Neutel J. M. et al., Am. Heart, 1991, 122, 1094) был cоздан с ингибиторами ренина по причине их недостаточной пероральной активности из-за их пептидомиметической природы (Kleinert H. D., Cardiovasc. Drugs, 1995, 9, 645). Клиническая разработка нескольких соединений была прекращена из-за данной проблемы и высокой стоимости продуктов. Только одно соединение, содержащее четыре хиральных центра, вошло в клинические испытания (Rahuel J. et al., Chem. Biol., 2000, 7, 493; Mealy N. E., Drugs of the Future, 2001, 26, 1139). Таким образом, требуются ингибиторы ренина с хорошей пероральной биодоступностью и длительным периодом действия. Недавно были описаны первые непептидные ингибиторы ренина, которые показывают высокую активность in vitro (Oefner C. et al., Chem. Biol., 1999, 6, 127; Patent Application WO 97/09311; Marki H. P. et al., Il Farmaco, 2001, 56, 21). Однако состояние разработки данных соединений неизвестно.
Данное изобретение относится к ингибиторам ренина непептидной природы и низкой молекулярной массы. Описаны перорально активные ингибиторы ренина формулы (I), которые имеют длительный период действия и которые являются активными при симптомах за пределами регулирования кровяного давления, где тканевая система ренин/химаза может быть активирована, что приводит к патофизиологически измененным локальным функциям, таким как почечная, кардиальная и сосудистая перестройка, атеросклероз и возможно рестеноз. Таким образом, настоящее изобретение описывает данные непептидные ингибиторы ренина формулы (I).
В частности, данное изобретение относится к новым соединениям формулы (I)
в которой
W представляет собой фенильный цикл или шестичленный, не бензоконденсированный ароматический цикл, содержащий от одного до четырех атомов азота, где указанные циклы замещены в пара-положении посредством V;
V представляет собой связь; -(СН2)r-; -A-(CH2)s-; -CH2-A-(CH2)t-; -(CH2)s-A-; -(CH2)2-A-(CH2)u-; -A-(CH2)v-B-; -CH2-CH2-CH2-A-CH2-; -A-CH2-CH2-B-CH2-; -CH2-A-CH2-CH2-B-; -CH2-CH2-CH2-A-CH2-CH2-; -CH2-CH2-CH2-CH2-A-CH2-; -A-CH2-CH2-B-CH2-CH2-; -CH2-A-CH2-CH2-B-CH2-; -CH2-A-CH2-CH2-CH2-B-; -CH2-CH2-A-CH2-CH2-B-; -O-CH2-CH(OCH3)-CH2-O-; -O-CH2-CH(CH3)-CH2-O-; -O-CH2-CH(CF3)-CH2-O-; -O-CH2-C(CH3)2-CH2-O-; -O-CH2-C(CH3)2-O-; -O-C(CH3)2-CH2-O-; -O-CH2-CH(CH3)-O-; -O-CH(CH3)-CH2-O-; -O-CH2-C(CH2CH2)-O-; или -O-C(CH2CH2)-CH2-O-;
А и В независимо представляют собой -О- или -S-, предпочтительно -О-;
U представляет собой незамещенный арил; моно-, ди-, три- или тетразамещенный арил, в котором заместители независимо выбраны из группы, состоящей из галогена, алкила, алкокси и -СF3; или моно-, ди-, тризамещенный гетероарил, в котором заместители независимо выбраны из группы, состоящей из галогена, алкила, алкокси и -СF3;
Q представляет собой метилен или этилен, предпочтительно метилен;
М представляет собой арильную, хинолинильную, изохинолинильную, дигидрохинолинильную или тетрагидрохинолинильную группу, где указанные группы могут быть необязательно моно- или дизамещенными заместителями, независимо выбранными из группы, cостоящей из алкила; алкокси; -OCF3; -CF3; гидроксиалкила; галогена; алкил-О-(СН2)0-4-СН2-; алкил-О-(СН2)2-4-О-; R'2N-(СН2)0-4-СН2-, где R' независимо выбран из группы, cостоящей из водорода, алкила (необязательно замещенного одним, двумя или тремя атомами фтора), циклопропила, циклопропилметила, -С(=О)О-R'', и -С(=О)-R'', где R'' означает С1-С4-алкил, -CF3, -CH2-CF3 или циклопропил; и R'''NH-C(=O)-(O)0-1-(CH2)0-4-CH2-, где R''' означает алкил или циклопропил;
R1 представляет собой алкил или циклоалкил, предпочтительно циклоалкил, а именно, особенно циклопропил;
n представляет собой целое число 0 или 1;
r представляет собой целое число 3, 4, 5 или 6;
s представляет собой целое число 2, 3, 4 или 5;
t представляет собой целое число 1, 2, 3 или 4;
u представляет собой целое число 1, 2 или 3; и
v представляет собой целое число 2, 3 или 4;
и к оптически чистым энантиомерам, смесям энантиомеров, таким как рацематы, диастереомерам, смесям диастереомеров, диастереомерным рацематам, смесям диастереомерных рацематов, и мезоформам, а также к солям и сольватам таких соединений и к морфологическим формам.
Общие термины, использованные выше и ниже в данном документе, имеют в рамках данного раскрытия следующие значения, если не оговорено особо.
Там, где применяется форма множественного числа для соединений, солей, фармацевтических композиций, заболеваний и тому подобного, она предполагается также для обозначения отдельного соединения, соли или тому подобного.
Любая ссылка на соединение формулы (I) должна быть воспринята как относящаяся также к оптически чистым энантиомерам, смесям энантиомеров, таким как рацематы, диастереомерам, смесям диастереомеров, диастереомерным рацематам, смесям диастереомерных рацематов и мезоформам, а также к солям (особенно фармацевтически приемлемым солям) и сольватам (включающим гидраты) таких соединений и морфологическим формам, как уместным и практически целесообразным.
В определениях формулы (I) - если не оговорено особо - термин алкил, сам по себе или в комбинации с другими группами, означает насыщенные, прямые и разветвленные цепочечные группы с одним-семью атомами углерода, предпочтительно с одним-четырьмя атомами углерода, т.е. С1-С4-алкил. Примеры алкильных групп представляют собой метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, пентил, гексил и гептил. Предпочитают метильные, этильные и изопропильные группы.
Термин алкокси, сам по себе или в комбинации с другими группами, относится к R-O-группе, в которой R означает алкильную группу. Примеры алкоксигрупп представляют собой метокси, этокси, пропокси, изо-пропокси, изо-бутокси, втор-бутокси и трет-бутокси.
Термин гидроксиалкил, сам по себе или в комбинации с другими группами, относится к НО-R-группе, в которой R означает алкильную группу. Примеры гидроксиалкильных групп представляют собой НО-СН2-, НО-СН2СН2-, НО-СН2СН2СН2- и СН3СН(ОН)-.
Термин галоген означает фтор, хлор, бром или иод, предпочтительно фтор, хлор или бром, особенно фтор или хлор.
Термин циклоалкил, сам по себе или в комбинации, означает насыщенную циклическую углеводородную кольцевую систему с 3-7 атомами углерода, например, циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Циклопропильная группа является предпочтительной группой.
Термин арил, сам по себе или в комбинации, относится к фенильной, нафтильной или инданильной группе, предпочтительно к фенильной группе.
Термин гетероарил, сам по себе или в комбинации, означает шестичленные ароматические циклы, содержащие от одного до четырех атомов азота; бензоконденсированные шестичленные ароматические циклы, содержащие от одного до трех атомов азота; пятичленные ароматические циклы, содержащие один атом кислорода, один атом азота или один атом серы; бензоконденсированные пятичленные ароматические циклы, содержащие один атом кислорода, один атом азота или один атом серы; пятичленные ароматические циклы, содержащие два гетероатома, независимо выбранные из кислорода, азота и серы, и бензоконденсированные производные таких циклов; пятичленные ароматические циклы, содержащие три атома азота и их бензоконденсированные производные; тетразолильный цикл; триазинильный цикл; или кумаринил. Примеры таких циклических систем представляют собой фуранил, тиенил, пирролил, пиридинил, пиримидинил, индолил, хинолинил, изохинолинил, имидазолил, триазинил, тиазолил, изотиазолил, пиридазинил, пиразолил, оксазолил, изоксазолил, бензотиенил, хиназолинил и хиноксалинил.
Соли предпочтительно представляют собой фармацевтически приемлемые соли соединений формулы (I).
Выражение фармацевтически приемлемые соли охватывает соли как с неорганическими кислотами или с органическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота, азотная кислота, фосфористая кислота, азотистая кислота, лимонная кислота, муравьиная кислота, уксусная кислота, щавелевая кислота, малеиновая кислота, молочная кислота, винная кислота, фумаровая кислота, бензойная кислота, миндальная кислота, коричная кислота, пальмитиновая кислота, стеариновая кислота, глутаминовая кислота, аспарагиновая кислота, метансульфоновая кислота, этансульфоновая кислота, этандисульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота, янтарная кислота, трифторуксусная кислота и тому подобное, которые нетоксичны для живых организмов или, в случае соединения формулы (I), являются кислотными по природе, так и с неорганическим основанием, таким как основание щелочного или щелочноземельного элемента, например, гидроксид натрия, гидроксид калия, гидроксид кальция и тому подобное. На другие примеры фармацевтически приемлемых солей можно сделать отсылку к “Salt selection for basic drugs”, Int. J. Pharm. (1986), 33, 201-217.
Соединения формулы (I) могут содержать асимметрические атомы углерода и могут быть приготовлены в форме оптически чистых энантиомеров, смесей энантиомеров, таких как рацематы, диастереомеров, смесей диастереомеров, диастереомерных рацематов, смесей диастереомерных рацематов, или мезоформ. Настоящее изобретение охватывает все данные формы. Смеси разделяют способом, известным для разделения веществ в чистом виде, например, колоночной хроматографией, тонкослойной хроматографией (ТСХ/TLC), высокоэффективной жидкостной хроматографией (ВЭЖХ/HPLC), или кристаллизацией.
Соединения изобретения также включают нитрозированные соединения формулы (I), которые были нитрозированы по одному или нескольким сайтам, таким как кислород (гидроксильная конденсация), сера (сульфгидрильная конденсация) и/или азот. Нитрозированные соединения данного изобретения могут быть приготовлены традиционными способами, известными специалисту в данной области. Например, известные способы по нитрозирующим соединениям описаны в U.A. Pat. Nos. 5380758, 5703073, 5994294, 6242432 и 6218417; WO 98/19672; и Oae et al., Org. Prep. Proc. Int., 15(3): 165-198 (1983).
Группа предпочтительных соединений формулы (I) является группой, в которой n представляет собой целое число 1 и заместители в цикле, -СОN(R1)-Q-M и -W-V-U, находятся в транс-положении друг к другу.
Группа особенно предпочтительных соединений формулы (I) является группой, в которой n представляет собой целое число 0 и конфигурации в положениях 3 и 4 пиперидинового цикла формулы (I) представляют собой 3R и 4S, соответственно.
Группа предпочтительных соединений формулы (I) является группой, в которой М представляет собой арильную, хинолинильную, изохинолинильную, дигидрохинолинильную или тетрагидрохинолинильную группу, где указанные группы необязательно могут быть моно- или дизамещены заместителями, независимо выбранными из группы, состоящей из алкила; алкокси; -OCF3; -CF3; гидроксиалкила; галогена; алкил-О-(СН2)0-4-СН2-; алкил-О-(СН2)2-4-О-; и R'2N-(СН2)0-4-СН2-, где R' независимо выбран из группы, cостоящей из водорода, алкила, циклопропила, и -С(=О)-R'', где R'' означает С1-С4-алкил, -CF3, -CH2-CF3 или циклопропил.
Другая группа предпочтительных соединений формулы (I) является группой, в которой М представляет собой арил, предпочтительно фенил, который, в частности, необязательно моно- или дизамещен заместителями, независимо выбранными из группы, состоящей из алкила, алкокси, -OCF3, -CF3, гидроксиалкила и галогена, предпочтительно из группы, состоящей из алкила, алкокси и галогена.
Другая группа особенно предпочтительных соединений формулы (I) является группой, в которой М представляет собой следующий радикал:
, где R2 означает метил или хлор, R3 означает водород, и R4 означает водород, -СН2СН2-О-СН3, -СН2СН2СН2-О-СН3, или R'NH-(CH2)0-1-CH2-, где R' означает -СН2-СНF2, -CH2-CF3, циклопропил, -СО-СН3, -СО-СН2-СF3, -CO-CH2-CH3, или циклопропилкарбонил, при условии, когда R4 означает водород, то R3 представляет собой метил, метокси, хлор, или -ОСН2СН2-О-СН3.
Очень предпочтительная группа соединений формулы (I) является группой, в которой М представляет собой следующий радикал:
, где R2 означает хлор, R3 означает водород и R4 означает -СН2СН2-О-СН3.
Очень предпочтительная группа соединений формулы (I) является группой, в которой М представляет собой следующий радикал:
, где R2 означает водород, R3 означает метоксиэтокси и R4 означает -СН2СН2СН2-О-СН3.
Следующая группа предпочтительных соединений формулы (I) является группой, в которой Q представляет собой метилен.
Следующая группа предпочтительных соединений формулы (I) является группой, в которой R1 представляет собой циклопропил.
Другая группа предпочтительных соединений формулы (I) является группой, в которой W представляет собой фенил, замещенный на V в пара-положении, или следующий радикал:
Другая группа предпочтительных соединений формулы (I) является группой, в которой W представляет собой фенил, замещенный на V в пара-положении.
Другая группа особенно предпочтительных соединений формулы (I) является группой, в которой W представляет собой следующий радикал:
Следующая группа предпочтительных соединений формулы (I) является группой, в которой V представляет собой -CH2CH2O- или -CH2CH2СН2O-, где в обоих случаях бивалентный радикал присоединен к группе U формулы (I) через атом кислорода, или -ОСН2СН2О-.
Очень предпочтительная группа соединений формулы (I) является группой, в которой V представляет собой -ОСН2СН2О-.
Другая группа предпочтительных соединений формулы (I) является группой, в которой V представляет собой -OCH2CH2O- или особенно -CH2CH2СН2O- [предпочтительно, где -СН2-часть -CH2CH2СН2O-фрагмента присоединена к группе W формулы (I)].
Следующая группа предпочтительных соединений формулы (I) является группой, в которой U представляет собой моно-, ди-, три- или тетразамещенный арил, предпочтительно моно-, ди-, или тризамещенный фенил, где заместители независимо выбраны из группы, состоящей из галогена, алкила, алкокси и -СF3, особенно из группы, состоящей из галогена или алкила.
Другая группа особенно предпочтительных соединений формулы (I) является группой, в которой U представляет собой 2,6-дихлор-4-метилфенил.
Другая группа особенно предпочтительных соединений формулы (I) является группой, в которой U представляет собой 2-хлор-3,6-дифторфенил.
Предпочтительный вариант осуществления данного изобретения относится к соединению формулы (I), где W представляет собой фенил, замещенный на V в пара-положении, или следующий радикал:
V представляет собой -OCH2CH2O- или -CH2CH2СН2O-, где -СН2-часть -CH2CH2СН2O-фрагмента присоединена к группе W формулы (I);
U представляет собой тризамещенный фенил, в котором заместители независимо выбраны из атомов галогена (в частности, фтора и хлора) и алкила (в частности, метила);
Q представляет собой метилен;
М представляет собой следующий радикал:
, где R2 означает метил или хлор, R3 означает водород, и R4 означает водород, -СН2СН2-О-СН3, -СН2СН2СН2-О-СН3, или R'NH-(CH2)0-1-CH2-, где R' означает алкил (необязательно замещенный одним или двумя атомами фтора), циклопропил, циклопропилметил, -СО-СН3, или -СО-СН2-СF3, при условии, когда R4 означает водород, то R3 представляет собой метил, метокси, или хлор;
R1 представляет собой циклопропил; и
n представляет собой целое число 0 или 1.
Данное изобретение также относится к соединениям формулы (I), где значения одного или нескольких заместителей или символов, определенные для формулы (I), или предпочтительного варианта формулы (I), заменены на их предпочтительные значения, определенные здесь, а именно, значения, определенные для вышеданных предпочтительных групп соединений.
Особенно предпочтительные соединения формулы (I) представляют собой соединения, выбранные из группы, включающей:
циклопропил(2,3-дихлорбензил)амид (1R∗, 5S∗, 6R∗, 7S∗)-7-{4-[3-(2-хлор-3,6-дифторфенокси)пропил]фенил}-3,9-диаза-бицикло[3.3.1]нонан-6-карбоновой кислоты,
циклопропил(3-метокси-2-метилбензил)амид 4-{4-[3-(2-хлор-3,6-дифторфенокси)пропил]фенил}пиперидин-3-карбоновой кислоты,
циклопропил(3-метокси-2-метилбензил)амид 4-{4-[3-(2,6-дихлор-4-метилфенокси)пропил]фенил}пиперидин-3-карбоновой кислоты,
циклопропил(3-метокси-2-метилбензил)амид 4-{4-[3-(2,3,6-трифторфенокси)пропил]фенил}пиперидин-3-карбоновой кислоты,
циклопропил(2,3-диметилбензил)амид 4-{4-[3-(2-хлор-3,6-дифторфенокси)пропил]фенил}пиперидин-3-карбоновой кислоты,
циклопропил(2,3-диметилбензил)амид 4-{4-[3-(2,6-дихлор-4-метилфенокси)пропил]фенил}пиперидин-3-карбоновой кислоты,
циклопропил(2,3-диметилбензил)амид 4-{4-[3-(2-хлор-6-фтор-3-метилфенокси)пропил]фенил}пиперидин-3-карбоновой кислоты, и
циклопропил(2,3-диметилбензил)амид 4-{4-[3-(2,3,6-трифторфенокси)пропил]фенил}пиперидин-3-карбоновой кислоты.
Следующие особенно предпочтительные соединения формулы (I) представляют собой соединения, выбранные из группы, включающей:
циклопропил(2,3-диметилбензил)амид (3R∗, 4S∗)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
[2-хлор-5-(3-метоксипропил)бензил]циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
[2-хлор-5-(2-метоксиэтил)бензил]циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
[2-хлор-5-(3-метоксипропил)бензил]циклопропиламид (3R, 4S)-6-[2-(2,6-дихлор-4-метилфенокси)этокси]-1',2',3',4',5',6'-гексагидро[3,4']бипиридинил-3'-карбоновой кислоты, и
[2-хлор-5-(2-метоксиэтил)бензил]циклопропиламид (3R, 4S)-6-[2-(2,6-дихлор-4-метилфенокси)этокси]-1',2',3',4',5',6'-гексагидро[3,4']бипиридинил-3'-карбоновой кислоты.
Другая группа особенно предпочтительных соединений формулы (I) представляет собой соединения, выбранные из группы, включающей:
{2-хлор-5-[(2,2-дифторэтиламино)метил]бензил}циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
{2-хлор-5-[(3,3,3-трифторпропиониламино)метил]бензил}циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
{2-хлор-5-[(циклопропилметиламино)метил]бензил}циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
[5-(ацетиламинометил)-2-хлорбензил]циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
[2-хлор-5-(2-метиламиноэтил)бензил]циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
(2-хлор-5-метиламинометилбензил)циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
{2-хлор-5-[2-(3,3,3-трифторпропиониламино)этил]бензил}циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
[2-хлор-5-(2-этиламиноэтил)бензил]циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
[5-(2-ацетиламиноэтил)-2-хлорбензил]циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
{2-хлор-5-[(2-фторэтиламино)метил]бензил}циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
(2-хлор-5-этиламинометилбензил)циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты,
(2-хлор-5-циклопропиламинометилбензил)циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты, и
[2-хлор-5-(2-циклопропиламиноэтил)бензил]циклопропиламид (3R, 4S)-4-{4-[2-(2,6-дихлор-4-метилфенокси)этокси]фенил}пиперидин-3-карбоновой кислоты.
Cоединения формулы (I) применимы для лечения и/или профилактики заболеваний, таких как (или связанных с ними) гипертония, застойная сердечная недостаточность, легочная гипертензия, почечная недостаточность, почечная ишемия, почечная декомпенсация, фиброз почек, сердечная недостаточность, гипертрофия сердца, фиброз сердца, миокардиальная ишемия, кардиомиопатия, гломерулонефрит, почечная колика, осложнения, полученные от диабета, а именно, нефропатия, васкулопатия и невропатия, глаукома, повышенное внутриглазное давление, атеросклероз, рестеноз после пластической операции на сосудах, осложнения после хирургической операции на сосудах и сердце, эректильная дисфункция, гиперальдостеронизм, пневмофиброз, склеродерма, страх, расстройство познавательной способности, осложнения от лечения иммунодепрессантами, и других заболеваний, которые известны, как связанные с системой ренин-ангиотензин.
Соединения формулы (I) особенно применимы для лечения и/или профилактики заболеваний, таких как (или связанных с ними) гипертония, застойная сердечная недостаточность, легочная гипертензия, почечная недостаточность, почечная ишемия, почечная декомпенсация, фиброз почек, сердечная недостаточность, гипертрофия сердца, фиброз сердца, миокардиальная ишемия, кардиомиопатия, осложнения, полученные от диабета, а именно, нефропатия, васкулопатия и невропатия.
В одном варианте осуществления изобретение относится к способу лечения или профилактики заболеваний, которые связаны с нарушением регулирования системы ренин-ангиотензин, в частности, к способу лечения или профилактики вышеупомянутых заболеваний, при этом указанный способ включает введение пациенту фармакологически активного количества соединения формулы (I).
Следующий аспект данного изобретения относится к фармацевтическим композициям, содержащим соединение формулы (I) и фармацевтически приемлемый материал в качестве носителя. Данные фармацевтические композиции можно применять для лечения и/или профилактики вышеупомянутых заболеваний. Фармацевтические композиции можно применять для энтерального, парентерального или местного введения. Их можно вводить, например, перорально, например, в виде таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректально, например, в виде суппозиториев, парентерально, например, в виде растворов для инъекций или растворов для инфузий, или локально, например, в виде мазей, кремов или масел.
Изобретение также относится к применению соединения формулы (I) для приготовления фармацевтических композиций для лечения или профилактики вышеупомянутых заболеваний.
Изготовление фармацевтических композиций может быть осуществлено способом, который будет знаком любому специалисту в данной области (см., например, Mark Gibson, Editor, Pharmaceutical Preformulation and Formulation, IНS Health Group, Englewood, CO, USA, 2001; Remington, The Science and Practice of Pharmacy, 20th Edition, Philadelphia College of Pharmacy and Science), внесением описанных соединений формулы (I) или их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически полезными веществами, в галеновую форму для введения вместе с подходящими, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими носителями и, если желательно, полезными фармацевтическими адъювантами.
Соединения формулы (I) или вышеупомянутые фармацевтические композиции также применимы в комбинации с другими фармакологически активными соединениями, такими как АСЕ-ингибиторы, ингибиторы нейтральной эндопептидазы, антагонисты альдостерона, антагонисты рецептора ангиотензина II, антагонисты рецепторов эндотелина, вазодилататоры, антагонисты кальция, активаторы калия, диуретики, симпатолитики, бета-адренергические антагонисты, альфа-адренергические антагонисты и/или другие лекарственные средства, полезные для предотвращения или лечения вышеупомянутых заболеваний, такие как ингибиторы 11-бета-гидроксистероидной дегидрогеназы типа 1 и активаторы растворимой гуанилатциклазы.
Данное изобретение также относится к пролекарствам соединения формулы (I), которые превращаются in vivo в соединение формулы (I) как таковое. Любая ссылка на соединение формулы (I) поэтому должна быть воспринята как относящаяся также к соответствующим пролекарствам соединения формулы (I), как уместным и практически целесообразным.
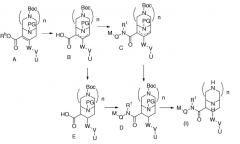
Соединения формулы (I) могут быть приготовлены из соединения вида А (WO 03/093267; WO 04/002957), как описано на схеме 1, где W, V, U и n принимают значения, определенные для формулы (I). PG означает подходящую защитную группу. Rb означает подходящий сложный эфир, который затем можно разложить, например, омылением или гидрированием. В течение омыления соединения вида А образуется соединение вида В с 20-100% выходом в зависимости от условий, в котором двойная связь частично смещена до деконьюгированного положения. Данное соединение можно отделять или можно не отделять от соответствующего аналога с двойной еще коньюгированной связью, и затем, например, амидная конденсация, приводит к соединению вида С, где R1, Q и М принимают значения, определенные для формулы (I). В течение амидной конденсации с помощью оптимизации условий двойная связь может смещаться почти полностью. Соединение вида С затем восстанавливается в соединение вида D. Наконец, удаление защиты приводит к соединению формулы (I). Конечно, восстановление может также происходить с соединением вида В, которое в данном случае отделяют от его региоизомера с еще коньюгированной двойной связью. В данном случае получается соединение вида Е, которое превращается в соединение вида D после амидной конденсации. Если n=0, то коньюгированное соединение вида А или В может восстанавливаться до соответствующего насыщенного соединения магнием в метаноле. После равновесия выделяется транс-пространственно расположенный стереоизомер. Омыление (если необходимо) приводит к соединению вида Е.
Cпециалисту в данной области будет очевидно, что последовательность данных стадий может быть изменена или модифицирована в большинстве случаев. Смещение двойной связи в соединении вида В и его восстановление в соединения D и Е приводят к смесям стереоизомеров. Данные стереоизомеры могут быть выделены стандартными методами, такими как флэш-колоночная хроматография, ВЭЖХ или хиральная ВЭЖХ.
Схема 1
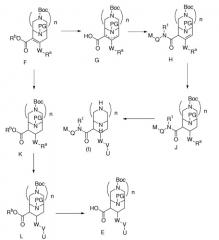
Иное соединение вида F можно использовать, как описано на схеме 2, где Rb означает подходящий сложноэфирный заместитель, и Ra означает предшественник заместителя V, определенного для формулы (I). Данное соединение вида F превращается в соединение вида G, которое, в свою очередь, превращается в соединение вида Н, при применении условий амидной конденсации, которые способствуют смещению двойной связи. Восстановление двойной связи ведет к соединению вида J, которое затем превращается в соединение формулы (I). Также соединение вида F может восстанавливаться в соединение вида К. U-V-W-цепь завершается с образованием соединения вида L, затем сложный эфир гидролизуется до соединения вида Е.
Схема 2
Примеры
Сокращения (использованные в данном документе):
| Ас | ацетил |
| АсОН | уксусная кислота |
| Ang | ангиотензин |
| вод. | водный |
| 9-BBN | 9-борабицикло[3.3.1]нонан |
| Вос | трет-бутилоксикарбонил |
| BSA | альбумин бычьей сыворотки |
| Вu | бутил |
| BuLi | н-бутиллитий |
| conc. | концентрированный |
| Cy | циклогексил |
| DIPEA | диизопропилэтиламин |
| DMAP | 4-N,N-диметиламинопиридин |
| ДМФА | N,N-диметилформамид |
| ДМСО | диметилсульфоксид |
| EDC.HCl | этил-N,N-диметиламинопропилкарбодиимид гидрохлорид |
| EIA | иммуноферментный анализ |
| ELSD | детектирование светорассеяния пара |
| экв. | эквивалент(ы) |
| ES | электроспрей |
| Et | этил |
| EtOAc | этилацетат |
| EtOH | этанол |
| FC | флэш-хроматография |
| ч | час(ы) |
| Hex | гексан |
| HOBt | гидроксибензотриазол |
| ВЭЖХ | высокоэффективная жидкостная хроматография |
| ЖХ-МС | жидкостная хроматография-масс-спектроскопия |
| Ме | метил |
| MeOH | метанол |
| мин | минута(ы) |
| МС | масс-спектроскопия/МС |
| NMO | N-метилморфолиноксид |
| ОАc | ацетат |
| OD | оптическая плотность |
| Орг. | органический |
| PBS | фосфатно-солевой буферный раствор |
| PG | защитная группа |
| Ph | фенил |
| Rf | показатель удерживания (для ТСХ) |
| к.т. | комнатная температура/к.т. |
| нас. | насыщенный |
| раст. | раствор |
| ТВАС | тетрабутиламмоний хлорид |
| TBAF | тетрабутиламмоний фторид тригидрат |
| TBDMS | трет-бутилдиметилсилил |
| ТBTU | O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний тетрафторборат |
| tBu | трет-бутил |
| Tf | Трифторметилсульфонил |
| TFA | трифторуксусная кислота |
| ТГФ | тетрагидрофуран |
| ТСХ | тонкослойная хроматография |
| tR | время удерживания |
| УФ | Ультрафиолетовый |
| вид. | видимый |
ВЭЖХ- или ЖХ-МС-условия (если не оговорены особо)
Аналитические: Zorbax 59 SB Aqua колонка, 4,6 × 50 мм от Agilent Technologies. Элюент: А: ацетонитрил; В: Н2О + 0,5% TFA. Градиент: 90% В → 5% В в течение 2 мин. Поток: 1 мл/мин. Детектирование: УФ/вид. + МС.
Препаративные: Zorbax SB Aqua колонка, 20 × 500 мм от Agilent Technologies. Элюент: А: ацетонитрил; В: Н2О + 0,05% аммоний гидроксид (25% водным). Градиент: 80% В → 10% В в течение 6 мин. Поток: 40 мл/мин. Детектирование: УФ + МС, или УФ + ELSD.
Хиральные, аналитические: Regis Whelk колонка, 4,6 × 250 мм, 10 мкм. Элюент А: EtOH + 0,05% Et3N. Элюент В: гексан. Изократические условия, 1 мл/мин. Изократическая смесь может меняться в зависимости от соединений.
Хиральные, препаративные: такие как аналитические условия, но на Regis Whelk 01 колонке, 50 × 250 мм, на потоке при 100 мл/мин.
Общая методика для Mitsunobu конденсации и удаления Вос-защиты
Требуемый фенол (2 экв.) помещают в реакционную колбу. Добавляют соединение J3 или J4 (примерно 80 мг, 1 экв.), растворенное в толуоле (1 мл), с последующим добавлением дипиперидида азодикарбоновой кислоты (2 экв.), растворенного в толуоле (1 мл). Реакционную смесь дегазируют с помощью N2 и в конце добавляют PВu3 (3 экв.). Реакционную смесь нагревают при 90°С (в предварительно нагретой системе) в течение 1 час, затем охлаждают снова до к.т. Добавляют Et2O (5 мл), смесь фильтруют, и растворители выпаривают при пониженном давлении. Сырой промежуточный продукт очищают ВЭЖХ с обращенными фазами. Очищенный продукт растворяют в диоксане (1 мл) и добавляют HCl в диоксане (4 М; 1 мл). Смесь перемешивают при к.т. в течение 2 час. Растворители удаляют при пониженном давлении, получая гидрохлоридную соль конечного соединения формулы (I).
Общие условия А для амидной конденсации
HOBt (16,9 мг, 0,125 ммоль), DMAP (3,05 мг, 0,025 ммоль), DIPEA (0,068 мл, 0,40 ммоль) и EDC.HCl (28,8 мг, 0,150 ммоль) добавляли к смеси карбоновой кислоты (0,100 ммоль) и амина (0,100 ммоль) в CH2Cl2 (1,00 мл). Смесь перемешивали в течение 4 дней при к.т. Смесь фильтровали через Isolute® (0,6 г сорбента, приготовленного с 1 мл водной 1 М НCl). Органический слой упаривали при пониженном давлении. Сырой продукт затем использовали без очистки.
Общие условия В для удаления Вос-защиты
Исходный продукт растворяли в CH2Cl2 (1 мл), и раствор охлаждали до 0°С. HCl (4 M в диоксане, 0,5 мл), и смесь перемешивали в течение 1 час, в то время как смесь нагревалась до к.т. Добавляли водный 1 М NaOH, и смесь перемешивали еще в течение 5 мин. Слои разделяли, и органический слой упаривали при пониженном давлении. Очистка с помощью ВЭЖХ (ацетонитрил с 0,05% водным концентрированным NH3/вода 10:90→90:10 по всей Х-мостиковой колонке) давала указанное в заголовке соединение.
Общие условия С для амидной конденсации через хлорангидрид кислоты
Исходную карбоновую кислоту (1,00 экв.) растворяли в толуоле (14 мл/ммоль карбоновой кислоты) и добавляли ДМФА (каталитическое количество). Добавляли оксалилхлорид (1,30 экв.), и смесь перемешивали в течение 1 час при к.т. Раст