Анализы и способы, использующие биомаркеры
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Представлены способы, исследующие экспрессию одного или нескольких биомаркеров в образце ткани и клеток млекопитающего. В соответствии с описанными способами определение экспрессии одного или нескольких таких биомаркеров является показателем или означает, что образец ткани или клеток будет чувствительным к апоптоз-индуцирующим веществам, таким как антителам-агонистам Apo2L/TRAIL и анти-DR5. Некоторые биомаркеры, которые можно исследовать, включают фукозилтрансферазы, в частности фукозилтрансферазу 3 (FUT3) и/или фукозилтрансферазу 6 (FUC6), а также и сиалил-Льюис А и/или Х антигены. Изобретение расширяет арсенал способа прогнозирования и лечения рака. 6 н. и 31 з.п. ф-лы, 13 ил., 1 табл.
Реферат
Родственные заявки
В данной заявке испрашивается приоритет согласно разделу 119 (e) предварительной заявки США № 60/599393, зарегистрированной 6 августа 2004, содержание которой приведено здесь в полном объеме в качестве ссылки.
Область изобретения
Описанное здесь изобретение относится к способам и анализам для определения биомаркеров, прогнозирующих чувствительность клеток млекопитающих к антителам-агонистам Apo2L/TRAIL и/или рецептора смерти.
Предпосылки изобретения
Различные лиганды и рецепторы, принадлежащие к суперсемейству фактора некроза опухоли (TNF), были идентифицированы в данной области. Включенные в число таких лигандов представляют собой фактор некроза опухоли альфа ("TNF-альфа"), фактор некроза опухоли бета ("TNF-бета" или "лимфотоксин-альфа"), лимфотоксин-бета ("LT-бета"), CD30 лиганд, CD27 лиганд, CD40 лиганд, OX-40 лиганд, 4-1BB лиганд, LIGHT, Apo-1 лиганд (также обозначаемый Fas лигандом или CD95 лигандом), Apo-2 лиганд (также обозначаемый Apo2L или TRAIL), Apo-3 лиганд (также обозначаемый TWEAK), APRIL, OPG лиганд (также обозначаемый RANK лигандом, ODF, или TRANCE), и TALL-1 (также обозначаемый BlyS, BAFF или THANK) (см., например, Ashkenazi, Nature Review, 2:420-430 (2002); Ashkenazi and Dixit, Science, 281: 1305-1308 (1998); Ashkenazi and Dixit, Curr. Opin. Cell Biol., 11:255-260 (2000); Golstein, Curr. Biol., 7:750-753 (1997) Wallach, Cytokine Reference, Academic Press, 2000, pages 377-411; Locksley et al., Cell, 104:487-501 (2001); Gruss and Dower, Blood, 85:3378-3404 (1995); Schmid et al., Proc. Natl. Acad. Sci., 83:1881 (1986); Dealtry et al., Eur. J. Immunol., 17:689 (1987); Pitti et al., J. Biol. Chem., 271:12687-12690 (1996); Wiley et al., Immunity, 3:673-682 (1995); Browning et al., Cell, 72:847-856 (1993); Armitage et al. Nature, 357:80-82 (1992); WO 97/01633 опубликованный 16 января 1997; WO 97/25428, опубликованный 17 июля 1997; Marsters et al., Curr. Biol., 8:525-528 (1998); Chicheportiche et al., Biol. Chem., 272:32401-32410 (1997); Hahne et al., J. Exp. Med., 188:1185-1190 (1998); WO98/28426, опубликованный 2 июля 1998; WO98/46751, опубликованный 22 октября 1998; WO/98/18921, опубликованный 7 мая 1998; Moore et al., Science, 285:260-263 (1999); Shu et al., J. Leukocyte Biol., 65:680 (1999); Schneider et al., J. Exp. Med., 189:1747-1756 (1999); Mukhopadhyay et al., J. Biol. Chem., 274:15978-15981 (1999)).
Индукция различных клеточных ответов, опосредованная такими лигандами семейства TNF, обычно вызывается их связыванием со специфическими клеточными рецепторами. Некоторые, но не все, лиганды семейства TNF связываются и вызывают различные биологические активности посредством "рецепторов смерти" клеточной поверхности для активации каспаз или ферментов, которые осуществляют клеточную смерть или апоптотический путь (Salvesen et al., Cell, 91:443-446 (1997). Идентифицированные к настоящему времени включенные в число членов суперсемейства представляют собой TNFR1, TNFR2, TACI, GITR, CD27, OX-40, CD30, CD40, HVEM, Fas (также обозначаемый Apo-1 или CD95), DR4 (также обозначаемый TRAIL-R1), DR5 (также обозначаемый Apo-2 или TRAIL-R2), DcR1, DcR2, остеопротегерин (OPG), RANK и Apo-3 (также обозначаемый DR3 или TRAMP) (см., например, Ashkenazi, Nature Reviews, 2:420-430 (2002); Ashkenazi and Dixit, Science, 281: 1305-1308 (1998); Ashkenazi and Dixit, Curr. Opin. Cell Biol., 11:255-260 (2000); Golstein, Curr. Biol., 7:750-753 (1997) Wallach, Cytokine Reference, Academic Press, 2000, pages 377-411; Locksley et al., Cell, 104:487-501 (2001); Gruss and Dower, Blood, 85:3378-3404 (1995); Hohman et al., J. Biol. Chem., 264:14927-14934 (1989); Brockhaus et al., Proc. Natl. Acad. Sci., 87:3127-3131 (1990); EP 417563, опубликованный 20 марта 1991; Loetscher et al., Cell, 61:351 (1990); Schall et al., Cell, 61:361 (1990); Smith et al., Science, 248:1019-1023 (1990); Lewis et al., Proc. Natl. Acad. Sci., 88:2830-2834 (1991); Goodwin et al., Mol. Cell. Biol., 11:3020-3026 (1991); Stamenkovic et al., EMBO J., 8:1403-1410 (1989); Mallett et al., EMBO J., 9:1063-1068 (1990); Anderson et al., Nature, 390:175-179 (1997); Chicheportiche et al., J. Biol. Chem., 272:32401-32410 (1997); Pan et al., Science, 276:111-113 (1997); Pan et al., Science, 277:815-818 (1997); Sheridan et al., Science, 277:818-821 (1997); Degli-Esposti et al., J. Exp. Med., 186:1165-1170 (1997); Marsters et al., Curr. Biol., 7:1003-1006 (1997); Tsuda et al., BBRC, 234:137-142 (1997); Nocentini et al., Proc. Natl. Acad. Sci., 94:6216-6221 (1997); vonBulow et al., Science, 278:138-141 (1997)). Большинство из этих членов семейства рецептора TNF имеют характерную структуру рецепторов клеточной поверхности, включающую внеклеточную, трансмембранную и внутриклеточную области, тогда как другие обнаруживаются в природе в виде растворимых белков, не имеющих трансмембранного и внутриклеточного домена. Внеклеточный участок характерных TNFR содержит набор повторяющейся аминокислотной последовательности из множественных богатых цистеинов доменов (CRD), начиная с NH2-конца.
Лиганд, именуемый Apo-2L или TRAIL, несколько лет назад был идентифицирован как член TNF семейства цитокинов, (см., например, Wiley et al., Immunity, 3:673-682 (1995); Pitti et al., J. Biol. Chem., 271:12697-12690 (1996); WO 97/01633; WO 97/25428; патент США 5763223 выданный 9 июня 1998; патент США 6284236, выданный 4 сентября 2001). Apo2L/TRAIL полипептид человека полноразмерной нативной последовательности имеет 281 аминокислоту в длину, трансмембранный белок Типа II. Некоторые клетки могут вырабатывать природную растворимую форму полипептида путем ферментативного отщепления внеклеточной области полипептида (Mariani et al., J. Cell. Biol., 137:221-229 (1997)). Кристаллографические исследования растворимых форм Apo2L/TRAIL показали гомотримерную структуру, сходную со структурами TNF и других родственных белков (Hymowitz et al., Molec. Cell, 4:563-571 (1999); Cha et al., Immunity, 11:253-261 (1999); Mongkolsapaya et al., Nature Structural Biology, 6:1048 (1999); Hymowitz et al., Biochemistry, 39:633-644 (2000)). Однако, в отличие от других членов семейства TNF, было обнаружено, что Apo2L/TRAIL обладает уникальным структурным свойством, заключающимся в том, что три цистеиновых остатка (в положении 230 каждой субъединицы гомотримера) сообща координируют атом цинка, и это связывание цинка важно для устойчивости тримера и биологической активности (Hymowitz et al., выше; Bodmer et al., J. Biol. Chem., 275:20632-20637 (2000)).
Как сообщалось в литературе, Apo2L/TRAIL может играть роль в модуляции иммунной системы, включая аутоиммунные заболевания, такие как ревматоидный артрит [см., например, Thomas et al., J. Immunol., 161:2195-2200 (1998); Johnsen et al., Cytokine, 11:664-672 (1999); Griffith et al., J. Exp. Med., 189:1343-1353 (1999); Song et al., J. Exp. Med., 191:1095-1103 (2000)].
Также сообщалось, что растворимые формы Apo2L/TRAIL вызывают апоптоз в разных раковых клетках, включая опухоли толстой кишки, легкого, молочной железы, предстательной железы, мочевого пузыря, почки, яичника и мозга, а также и меланому, лейкоз и множественную миелому (см., например, Wiley et al., выше; Pitti et al., выше; патент США 6030945 опубликованный 29 февраля 2000; патент США 6746668 публикованный 8 июня 2004; Rieger et al., FEBS Letters, 427:124-128 (1998); Ashkenazi et al., J. Clin. Invest., 104:155-162 (1999); Walczak et al., Nature Med., 5:157-163 (1999); Keane et al., Cancer Research, 59:734-741 (1999); Mizutani et al., Clin. Cancer Res., 5:2605-2612 (1999); Gazitt, Leukemia, 13:1817-1824 (1999); Yu et al., Cancer Res., 60:2384-2389 (2000); Chinnaiyan et al., Proc. Natl. Acad. Sci., 97:1754-1759 (2000)). В in vivo исследованиях на мышиных опухолевых моделях далее показали, что Apo2L/TRAIL, один или в сочетании с химиотерапией или лучевой терапией может обнаруживать значительные противоопухолевые эффекты (см., например, Ashkenazi et al., выше; Walzcak et al., выше; Gliniak et al., Cancer Res., 59:6153-6158 (1999); Chinnaiyan et al., выше; Roth et al., Biochem. Biophys. Res. Comm., 265:1999 (1999); заявка PCT US/00/15512; заявка PCT US/01/23691). По-видимому, в отличие от многих типов раковых клеток большинство типов нормальных клеток человека устойчивы к индукции апоптоза определенными рекомбинантными формами Apo2L/TRAIL (Ashkenazi et al., выше, Walzcak et al., выше). Jo et al. сообщали, что меченная полигистидином растворимая форма Apo2L/TRAIL вызывает апоптоз in vitro в нормальных выделенных человеческих, но не нечеловеческих, гепатоцитах (Jo et al., Nature Med., 6:564-567 (2000); см. также Nagata, Nature Med., 6:502-503 (2000)). Полагают, что определенные препараты рекомбинантных Apo2L/TRAIL могут различаться по биохимическим свойствам и биологическим активностям в больных клетках по сравнению с нормальными клетками, в зависимости, например, от присутствия или отсутствия маркерной молекулы, содержания цинка и проценты содержания тримера (см., Lawrence et al., Nature Med., Letter to the Editor, 7:383-385 (2001); Qin et al., Nature Med., Letter to the Editor, 7:385-386 (2001)).
Было обнаружено, что Apo2L/TRAIL, связывается, по крайней мере, с пятью различными рецепторами. По крайней мере, два рецептора, которые связывают Apo2L/TRAIL, содержат функциональный, цитоплазматический домен смерти. Один такой рецептор был обозначен как "DR4" (и альтернативно как TR4 или TRAIL-R1) (Pan et al., Science, 276:111-113 (1997); см. также WO98/32856, опубликованный 30 июля 1998; WO99/37684, опубликованный 29 июля 1999; WO 00/73349, опубликованный 7 декабря 2000; патент США № 6433147, выданный 13 августа 2002; патент США № 6461823, выданный 8 октября 2002, и патент США № 6342383, выданный 29 января 2002).
Другой такой рецептор для Apo2L/TRAIL был обозначен как DR5 (также альтернативно обозначен как Apo-2; TRAIL-R или TRAIL-R2, TR6, Tango-63, hAPO8, TRICK2 или KILLER) (см., например, Sheridan et al., Science, 277:818-821 (1997), Pan et al., Science, 277:815-818 (1997), WO98/51793, опубликованный 19 ноября 1998; WO98/41629, опубликованный 24 сентября 1998; Screaton et al., Curr. Biol., 7:693-696 (1997); Walczak et al., EMBO J., l6:5386-5387 (1997); Wu et al., Nature Genetics, 17:141-143 (1997); WO98/35986, опубликованный 20 августа 1998; EP870827, опубликованный 14 октября 1998; WO98/46643, опубликованный 22 октября 1998; WO99/02653, опубликованный 21 января 1999; WO99/09165, опубликованный 25 февраля 1999; WO99/11791, опубликованный 11 марта 1999; US 2002/0072091, опубликованный 13 августа 2002; US 2002/0098550, опубликованный 7 декабря 2001; US 6313269, выданный 6 декабря 2001; US 2001/0010924, опубликованный 2 августа 2001; US 2003/01255540, опубликованный 3 июля 2003; US 2002/0160446, опубликованный 31 октября 2002, US 2002/0048785, опубликованный 25 апреля 2002; US 6342369, выданный в феврале 2002; US 6569642, выданный 27 мая 2003, US 6072047 выданный 6 июня 2000, US 6642358, выданный 4 ноября 2003; IS 6743625, выданный 1 июня 2004). Сообщали, что подобные DR4, DR5 содержат цитоплазматический домен смерти и способны вызывать апоптоз при связывании лиганда (или при связывании молекулы, такой как антитело-агонист, которое имитирует активность лиганда). Кристаллическую структуру комплекса, образованного между Apo-2L/TRAIL и DR5, описали Hymowitz et al., Molecular Cell, 4:563-571 (1999).
При связывании лиганда и DR4, и DR5 могут вызывать апоптоз независимо друг от друга, рекрутируя и активируя инициатор апоптоза, каспазу-8, посредством содержащей домен смерти адапторной молекулы, обозначаемой FADD/Mort1 [Kischkel et al., Immunity, 12:611-620 (2000); Sprick et al., Immunity, 12:599-609 (2000); Bodmer et al., Nature Cell Biol., 2:241-243 (2000)].
Сообщали, что Apo2L/TRAIL также связывают те рецепторы, которые обозначают DcRl, DcR2 и OPG, которые, как полагают, выполняют функцию скорее ингибиторов, чем трансдукторов передачи сигнала (см., например, DCR1 (также обозначенного как TRID, LIT или TRAIL-R3) [Pan et al., Science, 276: 111-113 (1997); Sheridan et al., Science, 277:818-821 (1997); McFarlane et al., J. Biol. Chem., 272:25417-25420 (1997); Schneider et al., FEBS Letters, 416:329-334 (1997); Degli-Esposti et al., J. Exp. Med., 186:.1165-1170 (1997); и Mongkolsapaya et al., J. Immunol., 160:3-6 (1998); DCR2 (также названный TRUNDD или TRAIL-R4) [Marsters et al., Curr. Biol., 7:1003-1006 (1997); Pan et al., FEBS Letters, 424:41-45 (1998); Degli-Esposti et al., Immunity, 7:813-820 (1997)], и OPG [Simonet et al., выше]. В отличие от DR4 и DR5, рецепторы DcR1 и DcR2 не вызывают апоптоз.
В литературе описаны некоторые антитела, которые связываются с DR4 и/или DR5 рецепторами. Например, анти-DR4 антитела, отнесенные к DR4 рецептору и обладающие агонистическим или апоптотическим действием в некоторых клетках млекопитающих, описаны, например, в WO 99/37684, опубликованной 29 июля 1999; WO 00/73349, опубликованной 12 июля 2000; WO 03/066661, опубликованной 14 августа 2003. См. также, например, Griffith et al., J. Immunol., 162:2597-2605 (1999); Chuntharapai et al., J. Immunol., 166:4891-4898 (2001) ; WO 02/097033, опубликованной 2 декабря 2002; WO 03/042367, опубликованной 22 мая 2003; WO 03/038043, опубликованной 8 мая 2003; WO 03/037913, опубликованной 8 мая 2003. Описаны некоторые анти-DR5 антитела, сходные с описанными, см., например, WO 98/51793, опубликованную 8 ноября 1998; Griffith et al., J. Immunol., 162:2597-2605 (1999); Ichikawa et al., Nature Med., 7:954-960 (2001); Hylander et al., "An Antibody to DR5 (TRAIL-Receptor 2) Suppresses the Growth of Patient Derived Gastrointestinal Tumors Grown in SCID mice", Abstract, 2d International Congress on Monoclonal Antibodies in Cancers, Aug. 29-Sept. 1, 2002, Banff, Alberta, Canada; WO 03/038043, опубликованный 8 мая 2003; WO 03/037913 опубликованный 8 мая 2003. К тому же были описаны некоторые антитела, которые обладают перекрестной реактивностью как к DR4, так и к DR5 рецепторам (см., например, патент США № 6252050, выданный 26 июня 2001).
Злокачественное перерождение некоторых клеток млекопитающих, имеющее место в некоторых случаях, было связано с характерными изменениями в экспрессии сиалил-Льюис A и сиалил-Льюис X антигенов. Относительно высокие количества сиалил-Льюис A/X присутствуют, например, в некоторых аденокарциномах человека толстой кишки, поджелудочной железы и желудка, и способы с использованием антител, направленных на углеводородные структуры этих антигенов, используют как средства для определения злокачественных опухолей поджелудочной железы и желудочно-кишечного тракта (см., например, Ugorski et al., Acta Biochimica Polonica, 49:2:303-311 (2002). Уровень экспрессии этих углеводородных опухолевых маркеров также коррелирует с исходом болезни, временем выживаемости больного и индикацией метастазирования.
Как было показано, как и сиалил-Льюис A, так и сиалил-Льюис X связываются с семейством углеводород-связывающих белков, участвующих в выхождении в ткани из сосудистого русла клеток, названных селектинами. В некоторых отчетах показано, что сиалил-Льюис A и X представляют собой лиганды для E-селектина, и могут быть ответственными за адгезию клеток рака человека к эндотелию. Представленные на поверхности раковых клеток структуры сиалил-Льюис опираются углеводородными цепями гликопротеинов и гликолипидов и связывают представленный на поверхности эндотелиальных клеток E-селектин. Поэтому селектины и их углеводородные лиганды могут играть важную роль в избирательном хоминге опухолевых клеток во время метастазирования.
Полагают, что биосинтез сиалил-Льюис A и X зависит от конечного добавления фукозы из гуанозиндифосфата фукозы (GDP-Fuc) в альфа (1,3) и альфа (1,4) связи к сиализированным формам предшественников специфичными к типу клеток и специфичными для стадии развития ферментами, стадию катализировали альфа-1,3/1,4-фукозилтрансферазами (альфа 1,3/1,4 Fuc-T, FUT).
Несколько генов фукозилтрансферазы человека клонированы и охарактеризованы к настоящему времени. Экспрессия этих генов (FUT 3-7) и их ферментные продукты (Fuc-TIII-VII), по-видимому, тканеспецифичны. Кодируемые пятью генами ферменты обозначаются FUTIII, FUTIV, FUTV, FUTVI и FUTVII. Кодирующие FUTIII, FUTV и FUTVI три гена локализуются в закрытых естественных положениях на хромосоме 19pl3.3. В биохимических и молекулярного клонирования исследованиях показано, что линиеспецифическая экспрессия сиалил-Льюис A/X молекул обуславливается линиеспецифической экспрессией генов альфа-1,3-фукозилтрансферазы, чьи ферментные продукты оказывают влияние на конститутивно экспрессируемые олигосахаридные предшественники для образования поверхностно-локализованных детерминант сиалил-Льюис A/X. Ответственные за активность в эпителиальных тканях фукозилтрансферазы человека представляют собой FUT3 и FUT6. FUT3 [также названный геном Льюиса альфа(1,3/1,4) фукозилтрансферазы] и FUT6 [плазменный ген альфа(1,3) фукозилтрансферазы] транскрипты присутствуют как в нормальных, так и в трансформированных тканях. Транскрипты фукозилтрансферазы также преобладают во многих клеточных линиях аденокарциномы, с исключительно высокой экспрессией FUT3 и 6 в карциноме толстой кишки (см., например, Ugorski et al., Acta Biochimica Polonica, 49:303-311 (2002); Nakamori et al., Dis. Colon Rectum., 40:420-431 (1997); Takada et al., Cancer Res., 53:354-361 (1993); Ichikawa et al., J. Surg. Oncol., 75:98-102 (2000)); Nakagoe et al., J Exp Clin Cancer Res., 2002 Mar, 21 (1):107-13 ; Matsumoto et al., Br J Cancer. 2002 Jan 21; 86 (2):161-7; Ito et al., J Gastroenterol. 2001 Dec; 36(12): 823-9; Nakagoe et al., Cancer Detect Prev. 2001; 25 (3):299-308; Kumamoto et al., Cancer Res. 2001 Jun 1, 61(11):4620-7; Murata et al., Dis Colon Rectum. 2001 Apr; 44(4):A2-A4; Nakagoe et al., J Exp Clin Cancer Res. 2001 Mar; 20(1):85-90; Nakagoe et al., J Gastroenterol. 2001 Mar; 36(3):166-72; Nakagoe et al., Tumour Biol. 2001 Mar-Apr; 22(2):115-22; Nakagoe et al., Can J Gastroenterol. 2000 Oct; 14(9):753-60; Izawa et al., Cancer Res. 2000 Mar 1; 60(5):1410-6; Tanaka et al., Hepatogastroenterology. 1999 Mar-Apr; 46(26):875-82; Matsushita et al., Cancer Lett. 1998 Nov 27; 133(2):151-60; Sato et al., Anticancer Res. 1997 Sep-Oct; 17(5A):3505-11; Yamada et al., Br J Cancer. 1997; 76 (5):582-7; Nakamori et al., Dis Colon Rectum. 1997 Apr; 40(4):420-31; Srinivas et al., Scand J Immunol. 1996 Sep; 44(3):197-203; Matsushita et al., Lab Invest. 1990 Dec; 63(6):780-91; Ashizawa et al., J Exp Clin Cancer Res. 2003 Mar; 22(1):91-8; Nakagoe et al., J Exp Clin Cancer Res. 2002 Sep, 21 (3):363-9; Nakagoe et al., Anticancer Res. 2002 Jan-Feb; 22(1A):451-8; Nakagoe et al., J Clin Gastroenterol. 2002 Apr; 34(4):408-15; Nakagoe et al., Cancer Lett. 2002 Jan 25; 175(2):213-21; Tatsumi et al., Clin Exp Metastasis. 1998 Nov; 16(8):743-50; Ikeda et al., J Surg Oncol. 1996 Jul; 62(3):171-6; Ikeda et al., Eur J Surg Oncol. 1995 Apr; 21 (2):168-75; Togayachi et al., Int J Cancer. 1999 Sep 24; 83(1):70-9; Satoh et al., Clin Cancer Res. 1997 Apr; 3(4):495-9; Satoh et al., Respiration. 1998; 65(4):295-8; Satoh et al., Anticancer Res. 1998 Jul-Aug; 18(4B):2865-8; Fukuoka et al., Lung Cancer. 1998 May; 20(2):109-16; Fujiwara et al., Anticancer Res. 1998 Mar- Apr; 18(2A):1043-6; Ogawa et al., Int J Cancer. 1997 Apr 22; 74(2):189-92; Ogawa et al., J Thorac Cardiovasc Surg. 1994 Aug; 108(2):329-36; Asao et al., Cancer. 1989 Dec 15; 64(12):2541-5; Narita et al., Breast Cancer. 1996 Mar 29; 3(1):19-23; Yamaguchi et al., Oncology. 1998 Jul-Aug; 55(4):357-62; Sikut et al., Int J Cancer. 1996 May 29; 66(5):617-23; Saito et al., Anticancer Res. 2003 Jul-Aug; 23(4):3441-6; Fujii et al., Urol Int. 2000; 64(3):129-33; Idikio et al., Glycoconj J. 1997 Nov; 14(7):875-7; Inoue et al., Obstet Gynecol. 1992 Mar; 79(3):434-40; Yamashita et al., Eur J Cancer. 2000 Jan; 36(1):113-20; Hamanaka et al., Pancreas. 1996 Aug; 13(2):160-5; Ho et al., Cancer Res. 1995 Aug 15; 55(16):3659-63.
Сущность изобретения
В изобретении, раскрытом здесь, представлены способы и анализы контрольной экспрессии одного или нескольких биомаркеров в образце ткани или клеток млекопитающего, где экспрессия одного или нескольких таких биомаркеров является показателем того, будет ли образец ткани или клеток чувствительным к вызывающим апоптоз агентам, таким как антитела-агонистам Apo2L/TRAIL и анти-DR5. В различных примерах осуществления изобретения способы и анализы исследуют экспрессию биомаркеров таких как фукозилтрансферазы, в частности, фукозилтрансфераза 3 (FUT3) и/или фукозилтрансфераза 6 (FUT6), а также сиалил-Льюис A и/или X антигенов.
Как отмечалось выше, по-видимому, большинство типов нормальных клеток человека устойчивы к индукции апоптоза некоторыми рекомбинантными формами Apo2L/TRAIL (Ashkenazi et al., выше; Walzcak et al., выше). Также было получено, что некоторые популяции поврежденных клеточных типов (такие как определенные популяции раковых клеток) устойчивы к индукции апоптоза определенными рекомбинантными формами Apo2L/TRAIL (Ashkenazi et al., J. Clin. Invest., 1999, выше; Walczak et al., Nature Med., 1999, выше). Следовательно, изучая образцы ткани или клеток млекопитающих в отношении экспрессии определенных биомаркеров посредством анализа, можно удобно и эффективно получить данные, полезные в оценке адекватной или эффективной терапии для лечения пациентов. Например, информация, полученная из анализа определения FUT3 или FUT6 экспрессии в образце ткани или клеток млекопитающих, может снабдить врачей полезными данными, которые можно использовать для определения оптимальной схемы лечения (с использованием антител-агонистов Apo2L/TRAIL или рецептора смерти) для больных, страдающих от такого нарушения как рак.
В изобретении представлены способы прогнозирования чувствительности образца ткани или клеток млекопитающего (такой как раковая клетка) к Apo2L/TRAIL или антителу-агонисту рецептора смерти. В некоторых вариантах осуществления способы включают получение образца ткани или клеток млекопитающих и исследование ткани или клетки на экспрессию фукозилтрансферазы 3 или фукозилтрансферазы 6. Способы могут также включать исследование ткани или клетки на экспрессию других биомаркеров, таких как сиалил-Льюис A и/или X антигены. Способы могут быть проведены в различных форматах анализа, включающих анализы определения экспрессии мРНК, ферментные анализы определения наличия ферментной активности, иммуногистохимические анализы и другие описанные здесь. Определение экспрессии таких биомаркеров в вышеупомянутых тканях или клетках будет показателем того, что такие ткани или клетки будут чувствительны к апоптоз-индуцированной активности Apo2/TRAIL и/или антитела рецептора смерти. В дополнительных вариантах осуществления в тканях или клетках можно также исследовать экспрессию DR4, DR5, DcR1 или DcR2 рецепторов.
Далее способы изобретения включают способы индукции апоптоза в образце ткани или клеток млекопитающего, включающие стадии получения образца ткани или клеток млекопитающего, исследование экспрессии в ткани или клетке одного или нескольких биомаркеров, таких как фукозилтрансфераза 3, фукозилтрансфераза 6, сиалил-Льюис A и/или X антиген(ы), и на основании определения того, что указанный образец ткани или клеток экспрессирует указанный один или несколько биомаркеров, воздействие на указанный образец ткани или клеток эффективным количеством антитело-агониста Apo2L/TRAIL или рецептора смерти. Стадии способов исследования экспрессии одного или нескольких биомаркеров можно проводить при различных форматах анализа, включающих анализы определения экспрессии мРНК, ферментные анализы определения наличия ферментной активности, и иммуногистохимические анализы. В дополнительных вариантах осуществления в способы также включают исследование в образце ткани или клетки экспрессии DR4, DR5, DcR1 или DcR2 рецепторов. Необязательно, образец ткани или клеток включает ткань или клетки злокачественной опухоли.
Более того, способы изобретения включают способы лечения нарушений у млекопитающего, таких как иммунно-связанное нарушение или рак, включающие стадии получения образца ткани и клеток млекопитающего, исследование в ткани и клетках экспрессии одного или нескольких биомаркеров, таких как фукозилтрансфераза 3, фукозилтрансфераза 6, сиалил-Льюис A и/или X антиген(ы), и на основании определения того, что указанный образец ткани или клеток экспрессирует указанный один или несколько биомаркеров, введение эффективного количества антитело-агониста Apo2L/TRAIL или рецептора смерти указанному млекопитающему. Стадии способов исследования экспрессии одного или нескольких биомаркеров можно проводить в различных форматах анализа, включающих анализы определения экспрессии мРНК, ферментные анализы определения наличия ферментной активности, и иммуногистохимические анализы. В дополнительных вариантах осуществления способы также включают исследование в образце ткани или клеток экспрессии DR4, DR5, DcR1 или DcR2 рецепторов. Необязательно способы включают лечение рака у млекопитающего. Необязательно способы включают в дополнение к введению эффективного количества антитела-агониста Apo2L/TRAIL и/или рецептора смерти, назначение химиотерапевтического средств(а) или лучевой терапии указанному млекопитающему.
Далее варианты осуществления более конкретно описываются следующими формулами изобретения:
1. Способ прогнозирования чувствительности образца ткани или клеток млекопитающего к антителу рецептора смерти, включающий стадии:
получение образца ткани или клеток млекопитающего;
исследование образца ткани или клетки для определения экспрессии одного или нескольких биомаркеров, выбранных из группы фукозилтрансферазы 3, фукозилтрансферазы 6, сиалил-Льюис A и/или X антигена (антигенов), где экспрессия указанных одного или нескольких биомаркеров является показателем того, что указанный образец ткани или клеток является чувствительным к апоптоз-индуцирующей активности одного или нескольких антител рецептора смерти.
2. Способ по п.1 формулы изобретения, где указанную экспрессию одного или нескольких биомаркеров исследуют путем определения экспрессии мРНК фукозилтрансферазы 3 или фукозилтрансферазы 6.
3. Способ по п.1 формулы изобретения, где указанную экспрессию одного или нескольких биомаркеров исследуют иммуногистохимией для определения экспрессии сиалил-Льюис A и/или X антигена (антигенов).
4. Способ по п.1 формулы изобретения, дополнительно включающий стадию исследования экспрессии DR4, DR5, DcR1 или DcR2 рецепторов в указанном образце ткани или клеток.
5. Способ по п.1 формулы изобретения, где образец ткани или клеток включает в ткань или клетки злокачественной опухоли.
6. Способ по п.5 формулы изобретения, где указанные клетки злокачественной опухоли представляют собой раковые клетки или ткань толстой кишки, колоректальные, желудочно-кишечные или поджелудочной железы.
7. Способ по п.1 формулы изобретения, где указанное одно или несколько антител рецептора смерти представляют собой антитела DR5 или DR4.
8. Способ индукции апоптоза в образце ткани или клеток млекопитающего, включающий стадии:
получение образца ткани или клеток млекопитающего;
исследование образца ткани или клеток для определения экспрессии одного или нескольких биомаркеров, выбранных из группы фукозилтрансферазы 3, фукозилтрансферазы 6, сиалил-Льюис A и/или X антигена (антигенов), и после определения экспрессии указанных одного или нескольких биомаркеров,
воздействие на указанный образец ткани или клеток эффективным количеством антитела-агониста рецептора смерти.
9. Способ по п.8 формулы изобретения, где указанную экспрессию одного или нескольких биомаркеров исследуют тестированием экспрессии мРНК фукозилтрансферазы 3 или фукозилтрансферазы 6.
10. Способ по п.8 формулы изобретения, где указанную экспрессию одного или нескольких биомаркеров исследуют иммуногистохимией для определения сиалил-Льюис A и/или X антигена (антигенов).
11. Способ по п.8 формулы изобретения, дополнительно включающий стадию исследования экспрессии DR4, DR5, DcR1 или DcR2 рецепторов в указанном образце ткани или клеток.
12. Способ по п.8 формулы изобретения, где указанный образец ткани или клеток включает ткань или клетки злокачественной опухоли.
13. Способ по п.11 формулы изобретения, где указанные клетки злокачественной опухоли представляют собой раковые клетки или ткань толстой кишки, колоректальные, желудочно-кишечные или поджелудочной железы.
14. Способ по п.8 формулы изобретения, где указанные клетки подвергаются действию эффективного количества DR5 или DR4 антител-агонистов.
15. Способ лечения нарушения у млекопитающих, такого как связанное с иммунитетом нарушение или рак, включающий стадии:
получение образца ткани или клеток из указанного млекопитающего;
исследование образца ткани или клеток для определения экспрессии одного или нескольких биомаркеров, выбранных из группы фукозилтрансферазы 3, фукозилтрансферазы 6, сиалил-Льюис A и/или X антигена (антигенов), и после определения экспрессии указанных одного или нескольких биомаркеров, введение указанному млекопитающему эффективного количества антитела-агониста рецептора смерти.
16. Способ по п.15 формулы изобретения, где указанную экспрессию одного или нескольких биомаркеров исследуют определением экспрессии мРНК фукозилтрансферазы 3 или фукозилтрансферазы 6.
17. Способ по п.15 формулы изобретения, где указанную экспрессию одного или нескольких биомаркеров исследуют иммуногистохимией для определения экспрессии сиалил-Льюис A и/или X антигена (антигенов).
18. Способ по п.15 формулы изобретения, дополнительно включающий стадию исследования экспрессии DR4, DR5, DcR1 или DcR2 рецепторов в указанной ткани или клетке.
19. Способ по п.15 формулы изобретения, где образец ткани или клеток включает ткань или клетки злокачественной опухоли.
20. Способ по п.19 формулы изобретения, где указанные клетки или ткани злокачественной опухоли включают раковые клетки или ткань толстой кишки, колоректальные, желудочно-кишечные или поджелудочной железы.
21. Способ по п.14 формулы изобретения, где указанному млекопитающему вводят эффективное количество антитела-агониста DR5 или DR4.
22. Способ по п.15 формулы изобретения, где указанному млекопитающему также назначают химиотерапевтическое средство(а) или лучевую терапию.
23. Способ по п.15 формулы изобретения, где указанному млекопитающему также вводят цитокин, цитотоксический агент, или агент, ингибирующий рост.
24. Способ по любому из пп.7, 14 или 21 формулы изобретения, где указанное антитело представляет собой моноклональное антитело DR5.
25. Способ по любому из пп.7, 14 или 21 формулы изобретения, где указанное антитело представляет собой моноклональное антитело DR4.
26. Способ по любому из пп.7, 14 или 21 формулы изобретения, где указанное антитело представляет собой человеческое моноклональное антитело, которое связывает DR5.
27. Способ по любому из пп.7, 14 или 21 формулы изобретения, где указанное антитело представляет собой человеческое моноклональное антитело, которое связывает DR4.
28. Способ по любому из пп.7, 14 или 21 формулы изобретения, где указанное антитело представляет собой химерное или гуманизированное моноклональное антитело, которое связывает DR5.
29. Способ по любому из пп.7, 14 или 21 формулы изобретения, где указанное антитело представляет собой химерное или гуманизированное моноклональное антитело, которое связывает DR4.
30. Способ по любому из пп.7, 14 или 21 формулы изобретения, где указанное антитело представляет собой антитело DR5, которое связывает аминокислотную последовательность, содержащую остатки 1-411 из фиг.3A (SEQ ID NO:5).
31. Способ по любому из пп.7, 14 или 21 формулы изобретения, где указанное антитело представляет собой антитело DR4, которое связывает аминокислотную последовательность, содержащую остатки 1-468 из фиг.2 (SEQ ID NO:3).
32. Способ прогнозирования чувствительности клеток злокачественной опухоли толстой кишки или колоректальных раковых клеток млекопитающего к антителу DR5 рецептора, включающий стадии: получение клеток злокачественной опухоли толстой кишки или колоректальных раковых клеток млекопитающего;
исследование раковых клеток для определения экспрессии одного или нескольких биомаркеров, выбранных из группы фукозилтрансферазы 3, фукозилтрансферазы 6, сиалил-Льюис A и/или X антигена(ов), где экспрессия указанных одного или нескольких биомаркеров является показателем того, что указанные раковые клетки чувствительны к апоптоз-индуцирующей активности антитела DR5 рецептора.
33. Способ по п.32 формулы изобретения, где указанное антитело DR5 рецептора представляет собой человеческое, химерное или гуманизированное антитело.
34. Способ по п.32 формулы изобретения, где указанное антитело DR5 рецептора связывает аминокислотную последовательность, содержащую остатки 1-411 из фиг.3A (SEQ ID NO:5).
35. Способ индукции апоптоза клеток злокачественной опухоли толстой кишки или колоректальных раковых клеток млекопитающих, включающий стадии:
получение клеток злокачественной опухоли толстой кишки или колоректальных раковых клеток млекопитающих,
исследование раковых клеток для определения экспрессия одного или нескольких биомаркеров, выбранных из группы фукозилтрансферазы 3, фукозилтрансферазы 6, сиалил-Льюис A и/или X антигена(ов), и
после определения экспрессии вышеупомянутых одного или нескольких биомаркеров,
воздействие на указанный образец ткани или клеток эффективным количеством антитела-агониста DR5.
36. Способ по п.35 формулы изобретения, где указанное антитело-агонист DR5 представляет собой человеческое, химерное или гуманизированное антитело.
37. Способ по п.35 формулы изобретения, где указанное антитело-агонист DR5 связывает аминокислотную последовательность, содержащую остатки 1-411 из фиг.3A (SEQ ID NO:5).
38. Способ лечения рака толстой кишки и колоректального рака у млекопитающего, включающий стадии:
получение образца рака толстой кишки или колоректального рака из указанного млекопитающего;
исследование образца рака для определения экспрессии одного или нескольких биомаркеров, выбранных из группы фукозилтрансферазы 3, фукозилтрансферазы 6, сиалил-Льюис A и/или X антигена(ов), и
после определения экспрессии указанного одного или нескольких биомаркеров,
введение указанному млекопитающему эффективного количества антитела-агониста DR5.
39. Способ по п.38 формулы изобретения, где указанное антитело-агонист DR5 представляет собой человеческое, химерное или гуманизированное антитело.
40. Способ по п.38 формулы изобретения, где указанное антитело-агонист DR5 связывает аминокислотную последовательность, содержащую остатки 1-411 из фиг.3A (SEQ ID NO:5).
Краткое описание фигур
На фиг.1 изображены нуклеотидная последовательность человеческого Apo-2 лиганда кДНК (SEQ ID N0:2) и ее производная аминокислотная последовательность (SEQ ID NO:1). "N" в нуклеотидном положении 447 используется для обозначения нуклеотидного основания, которое может быть "T" или "G".
На фиг.2A и 2B изображена нуклеотидная последовательность кДНК (SEQ ID NO:4) для человеческого DR4 полной длины и ее производная аминокислотная последовательность (SEQ ID NO:3). Соответствующие нуклеотидная и аминокислотная последовательности для DR4 человека также опубликованы в Pan et al., Science, 276:111 (1997).
На фиг.3A изображена последовательность из 411 аминокислот (SEQ ID NO:5) человеческого DR5, как опубликовано в WO 98/51793 19 ноября 1998. Транскрипционный сплайсинговый вариант человеческого DR5 известен специалисту в данной области. Этот сплайсинговый вариант DR5 кодируется последовательностью из 440 аминокислот (SEQ ID NO:6) человеческого DR5, изображенного на фиг.3B и 3C, как опубликовано в WO 98/35986 20 августа 1998.
На фиг.3D изображены нуклеотидные последовательности кДНК (SEQ ID NO:7) для человеческого DcR1 полной длины и ее производная аминокислотная последовательность (SEQ ID NO:8). Соответствующий нуклеотид и аминокислотные последовательности человеческого DcR1 (и его конкретные домены) также изображены и опубликованы в WO 98/58062.
На фиг.3E изображены нуклеотидные последовательности кДНК (SEQ ID NO:9) для человеческого DcR2 полной длины и ее производная аминокислотная последовательность (SEQ ID NO:10). Соответствующий нуклеотид и аминокислотные последовательности человеческого DcR2 (и его конкретные домены) изображены в WO 99/10484.
На фиг.4 изображены нуклеотидная последовательность кДНК (SEQ ID NO:11) для человеческой (1,3/1,4)фукозилтрансферазы (FUT3) полной длины и ее производная аминокислотная последовательность (SEQ ID NO:12). Эти последовательности соответствуют инвентарному номеру GenBank HSU27328, и описаны, например, в Kukowska-Latallo et al., Genes Dev. 1990 Aug;4 (8):1288-303.
На фиг.5 изображена нуклеотидная последовательность кДНК (SEQ ID NO:13) для человеческой альфа (1,3) фукозилтрансферазы (FUT6) полной длины и ее производная аминокислотная последовательность (SEQ ID NO:14). Эти последовательности соответствуют инвентарному номеру GenBank HSU27333 и описаны, например, в Koszdin and Bowen, Biochem Biophys Res Commun. 1992 Aug 31;187 (1):152-7.
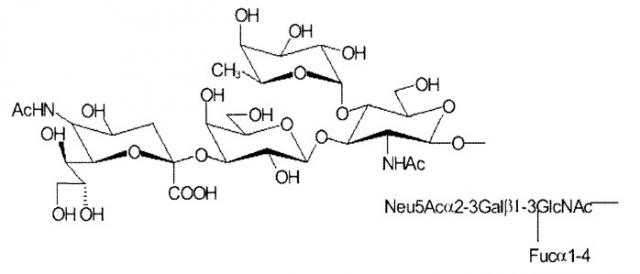
На фиг.6 представлено краткое изложение схемы данных, полученных при анализе 28 кишечных или колоректальных раковых клеточных линий на чувствительность или резистентность к апоптотической активности Apo2L (+ 0,5% эмбриональной бычьей сыворотки "FBS" или 10% FBS) или DR5 моноклональным антителам "mab", перекрестно-связанным "XL" или не перекрестно-связанным (+ 0,5% эмбриональной бычьей сыворотки "FBS" или 10% FBS) и экспрессия FUT 3, FUT 6, сиалил-Льюис A и сиалил-Льюис X.
На фиг.7 представлено сравнение чувствительности различных кишечных или колоректальных раковых клеточных линий к DR5 антителу и экспрессия FUT 3, как измеренная количественной PCR.
На фиг.8 представлены сравнение различных кишечных или колоректальных раковых клеточных линий на чувствительность или резистентность к DR5 антителам (плюс перекрестная связь) и экспрессия сиалил-Льюис X или A, как установлено FACS.
На фи.9A изображен критерий ранговой корреляции Спирмана, анализирующий чувствительность или резистентность различных кишечных или колоректальных раковых клеточных линий и корреляция с экспрессией FUT3.
На фиг.9В изображены результаты точного критерия Фишера, анализирующие чувствительность или резистентность различных кишечных или колоректальных раковых клеточных линий, и статистическая значимость между FUT3 и экспрессией сиалил-Льюис A/X и чувствительностью соответствующих клеточных линий к апоптотической активности DR5 антитела.
На фиг.10 представлено сравнение экспрессии рецепторов DcR1 или DcR2 различных кишечных или колоректальных раковых клеточных линий (как установлено количественным PCR) и состояние (чувствительность или резистентность) постоянных клеточных линий к антителу Apo2L или DR5.
На фиг.11 представлено сравнение экспрессии рецепторов DcR1 или DcR2 различных кишечных или колоректальных раковых клеточных линий (что установлено FACS) и состояние (чувствительность или резистентность) постоянных клеточных линий к антителу Apo2L или DR5.
На фиг.12 изображено иммуногистохимическое окрашивание для сиалил-Льюис A и X в четырех колоректальных раковых клеточных линиях, CaCO2, SW 1417, DLD-1 и Colo 205, и их корреляции с экспрессией сиалил-Льюис A и X, определяемой FACS, и их корреляции с чувствительностью к Apo2L.
На фиг.13 изображено краткое описание IHC экспериментов, демонстрирующих экспрессию сиалил-Льюис A и X в образцах ткани нормальной слизистой кишечника, нормальной ткани печени, первичного рака кишечника и кишечных раковых метастазов.
Подробное описание изобретения
Способы и процедуры, описанные или упомянутые в данном описании, как правило, хорошо изучены и обычно применяемы специалистами в данной области, используя общепринятый способ, такие как, например, широко используемые способы молекулярного клонирования, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual 2nd. edition (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. В соответствующих случаях процедуры, предполагающие применение коммерчески доступных наборов и реагентов, как правило, проводятся в соответствии с определяемыми производителем протоколами и/или параметрами производителя, если не указано иначе.
Перед описанием настоящих способов и а