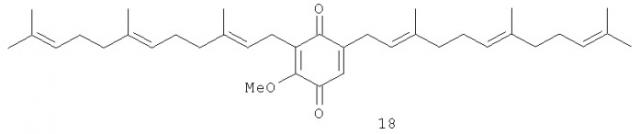
Терапевтические хиноны
Иллюстрации
Показать всеИзобретение относится к новым полипренилированным 1,4-бензохинонам формулы 1 или формулы 3 или полипренилированнам 1,4-гидрохинонам формулы 2 или формулы 4, или к их фармацевтически приемлемым солям, обладающим противораковой активностью
.
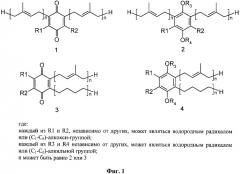
В формулах 1-4 каждый из R1 и R2, независимо от других, может являться водородным радикалом или (С1-С6)-алкокси-группой; каждый из R3 и R4 независимо от других может являться водородным радикалом или (C1-С6)-алкильной группой; n может быть равно 2 или 3. Также предлагаемое изобретение относится к применению новых соединений и некоторых известных 1,4-бензохинонов и 1,4-гидрохинонов для приготовления лекарственного средства, к фармацевтической композиции на их основе, к методу лечения онкологических заболеваний, методу индуцирования в клетке АР-1-зависимой или NF-κВ-зависимой транскрипционной активности или обеих активностей одновременно и к методу индуцирования апоптоза в клетке, а также к методу выделения глабрухинонов. 7 н. и 14 з.п. ф-лы, 3 табл., 28 ил.
Реферат
Кросс-ссылки на соответствующие патентные заявки
Этот патентный документ заявляет приоритет патентной заявки США номер 60/612,472, поданной 23 сентября 2004 года, которая представлена здесь по этой ссылке.
Предпосылки
Полипренилированные 1,4-бензохиноны и гидрохиноны, такие как убихиноны, пластохиноны и токоферолы, широко распространены в растениях и животных, в которых они играют важную роль в транспорте электронов, фотосинтезе и как антиоксиданты (см. Thomson, R.H. Naturally Occurring Quinones, Academic Press, London, 1971, стр. 1-197; и Pennock, J.F. В: Terpenoids in plants, J.B. Pridham, Ed. Academic Press, London, 1967, стр.129-146).
Природные пренилированные бензохиноны и гидрохиноны, имеющие терпеноидную часть длиной от одной до девяти изопреновых единиц, были выделены ранее из морских организмов, таких как коричневые водоросли рода Fucales, губки и асцидии. Многие водоросли содержат тетрапренил-, трипренил-, и дипренилхиноны и гидрохиноны (см. Ochi, M.; Kotsuki, H.; Inooue, M.; Taniguchi, M.; Tokoroyama, T. Chem. Lett., 1979, 831-832; и Capon, R.J.; Ghisalberti, E.L.; Jeffereis, P.R. Phytochemistry, 1981, 20, 2598-2600). Кроме того, губки содержат линейные незамещенные полипренилированные гидрохиноны и бензохиноны с более длинными боковыми цепями и умеренной антимикробной активностью, а также ингибиторы АТФ-аз, сульфатированные полипренилхиноны (см. Cimino, G.; De Stefano, S.; Minale, L. Tetrahedron, 1972, 28, 1315; Cimino, G.; De Stefano, S.; Minale, L. Experientia, 1972, 28, 1401; Pouches Y.F.; Verbist, J.F.; Biard, J.F.; Boukef, K.J. Nat. Prod., 1988, 51, 188; Lumsdon, D.; Capon, R.J.; Thomas, S.G.; Beveridge, A.A. Aust. J. Chem. 1992, 45, 1321-1325; De Rosa, S.; De Giulio, Iodice, C. J. Nat. Prod. 1994, 57, 1711-1716; Fusetani, N.; Sugano, M.; Matsunaga, S.; Hashimoto, K.; Shikama, H.; Ohta, A., Nagano, H. Experientia, 1987, 43, 1233; Stonik, V.A.; Makarieva, T.N.; Dmitrenok, A.S. J. Nat. Prod., 1992, 55, 1256-1260; и Bifulco, G.; Bruno; I.; Minale; L., Riccio, R.; Debitus, S.; Bourdy, G.; Vassa, A.; Lavayre, J. J. Nat. Prod. 1995, 58, 1444-1449). Из асцидий рода Aplidium были ранее выделены около дюжины пренилированных хинонов, включая наиболее простые из них, монопренилбензохиноны (см. Guella, G; Mancini, I; Pietra, F. Helv. Chim. Acta. 1987, 70, 621-626; Howard, B.M.; Clarkson, K.; Bernstein, R.L. Tetrahedron. Lett. 1979, 4449 - argett, N.M.; Keeran, W.S. J. Nat. Prod., 1984, 47, 556-557; и Faulkner, D.J. Nat. Prod. Rep., 1993, 93, 1771-1791).
Раковые заболевания занимают одну из ведущих позиций по летальным исходам в США. Однако все еще по-прежнему ощущается необходимость в соединениях, обладающих противоопухолевыми свойствами. Также ощущается необходимость в фармакологических инструментах для дальнейшего исследования физиологических процессов, связанных с онкологическими заболеваниями.
Краткое изложение сущности изобретения
В настоящем изобретении заявляются полипренилированные 1,4-бензохиноны (формулы 1 или формулы 3) или полипренилированные 1,4-гидрохиноны (формулы 2 или формулы 4):
где
каждый из R1 и R2, независимо от других, может являться водородным
радикалом или (С1-С6)-алкокси-группой;
каждый из R3 и R4 независимо от других, может являться водородным радикалом или (С1-С6)-алкильной группой;
n может быть равно 2 или 3;
или их фармацевтически приемлемые соли.
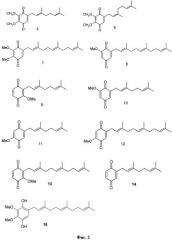
В настоящем изобретении заявляется также применение соединения формулы 1, или формулы 2, или формулы 3, или формулы 4, а также известных полипренилированных 1,4-бензохинонов формулы 5, или формулы 6, или формулы 7, или формулы 8, или формулы 9, или формулы 10, или формулы 11, или формулы 12, или формулы 13, или формулы 14 или полипренилированных 1,4-гидрохинонов формулы 15 или их фармацевтически приемлемых солей для приготовления лекарственного средства, которое может быть использовано для лечения онкологических заболеваний у млекопитающих.
В изобретении также заявляется применение вышеперечисленных новых и известных веществ или их фармацевтически приемлемых солей для приготовления лекарственного средства, используемого для лечения раковых опухолей у млекопитающих, т.е. для уменьшения размера и/или ингибирования роста раковой опухоли у млекопитающих.
В изобретении также заявляется применение вещества изобретения для приготовления лекарственного средства, используемого для индуцирования АР-1-зависимой транскрипционной активности у млекопитающих.
В изобретении также заявляется применение вещества изобретения для приготовления лекарственного средства, используемого для индуцирования NF-κВ-зависимой транскрипционной активности у млекопитающих.
В изобретении также заявляется применение вещества изобретения для приготовления лекарственного средства, используемого для индуцирования одновременно АР-1- и NF-κВ-зависимой транскрипционной активности у млекопитающих.
В изобретении также заявляется применение вещества изобретения для приготовления лекарственного средства, используемого для уменьшения трансформации нормальных клеток в опухолевые у млекопитающих.
В изобретении также заявляется применение вещества изобретения для приготовления лекарственного средства, используемого для уменьшения пролиферации опухолевых клеток у млекопитающих.
В изобретении также заявляется применение вещества изобретения для приготовления лекарственного средства, используемого для индуцирования апоптоза у млекопитающих.
В изобретении также заявляется фармацевтическая композиция, обладающая антираковой активностью, включающая эффективное количество соединения формулы 1, или формулы 2, или формулы 3, или формулы 4, или формулы 5, или формулы 6, или формулы 7, или формулы 8, или формулы 9, или формулы 10, или формулы 11, или формулы 12, или формулы 13, или формулы 15 или фармацевтически приемлемой соли этого соединения в комбинации с фармацевтически приемлемым растворителем или носителем.
В изобретении также заявляется метод лечения онкологических заболеваний, включающий введение млекопитающему, в случае необходимости в таком лечении, эффективного количества соединения формулы 1, или формулы 2, или формулы 3, или формулы 4, или формулы 5, или формулы 6, или формулы 7, или формулы 8, или формулы 9, или формулы 10, или формулы 11, или формулы 12, или формулы 13, или формулы 14, или формулы 15, или эффективного количества фармацевтически приемлемой соли этого соединения или эффективного количества фармацевтической композиции, включающей эти соединения.
В изобретении также заявляется метод лечения онкологических заболеваний, где введение соединения или фармацевтической композиции уменьшает размеры или ингибирует рост раковой опухоли у млекопитающего, предотвращает трансформацию нормальных клеток в опухолевые, уменьшает пролиферацию опухолевых клеток, вызывает апоптоз опухолевых клеток у млекопитающего.
В изобретении также заявляется метод индуцирования в клетке АР-1-зависимой транскрипционной активности в клетках, включающий обработку клеток эффективным количеством вещества изобретения.
В изобретении также заявляется метод индуцирования в клетке NF-κВ-зависимой транскрипционной активности в клетках, включающий обработку клеток эффективным количеством вещества изобретения.
В изобретении также заявляется метод одновременного индуцирования АР-1 и NF-κВ-зависимой транскрипционной активности в клетке, включающий обработку клеток эффективным количеством вещества изобретения.
В изобретении также заявляется метод индуцирования апоптоза или клеточной смерти в клетках, включающий обработку клеток эффективным количеством вещества изобретения.
В изобретении также заявляется метод индуцирования апоптоза или клеточной смерти у млекопитающих, включающий, в случае необходимости такого лечения, введение эффективного количества вещества изобретения.
В изобретении также заявляется метод выделения глабрухинона А (формула 5) и глабрухинона В (формула 6), включающий экстракцию асцидий асцидий Aplidium glabrum этанолом, упаривание этанола, экстракцию водного остатка хлороформом, упаривание хлороформенного слоя до получения коричневого маслообразного остатка, хроматографирование остатка на колонке с силикагелем, в системе гексан - этилацетат, 10:1 и разделение смеси полученных глабрухинонов А и В при помощи ВЭЖХ на колонке с силикагелем в системе гексан - этилацетат, 7:1 с получением индивидуальных глабрухинонов А и В.
Краткое описание фигур.
Фиг.1. Структурные формулы веществ изобретения, заявляемых как новые.
Фиг.2. Структурные формулы веществ 5-15.
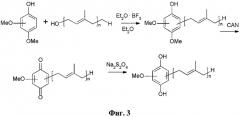
Фиг.3. Генеральная схема синтеза глабрухинона А (5) и его аналогов.
Фиг.4. Синтез целевых хинонов и гидрохинонов из производного фенола 35.
Фиг.5. Синтез целевых хинонов и гидрохинонов из производного фенола 36.
Фиг.6. Синтез целевых хинонов и гидрохинонов из производного фенола 37.
Фиг.7. Структуры соединений 5 и 6 и установление структуры 5 с помощью НМВС и 1H-1H-COSY корреляций.
Фиг.8А. Цитотоксическое действие глабрухинона А (5) на JB6 P+ Cl 41 клетки, установленное с помощью MTS-метода. Клетки культивировали в 96-луночных планшетах в 5% FBS/MEM. Затем среду сменили на 0.1% FBS/MEM и клетки обработали указанными концентрациями глабрухинона А (1). Клетки инкубировали с веществом в течение 22 часов и затем добавили по 20 µл MTS-реагента в каждую лунку и инкубировали еще в течение 2 часов. Данные представлены в виде процентного содержания живых клеток в сравнении с контрольными, необработанными глабрухиноном клетками. Каждая точка на графике отражает полученное значение ±SD (стандартное отклонение от среднего значения) и является результатом двух независимых экспериментов, по пять образцов на каждую концентрацию в каждом из экспериментов (*р<0,05; Манн-Уитни U-тест).
Фиг.8В. Вычисление IC50 для глабрухинона А (5) при действии на JB6 P+ Cl 41 клетки, произведенное методом линейной регрессии.
Фиг.9А. Цитотоксическое действие глабрухинона А (5) на НТ-460 клетки, установленное с помощью MTS-метода. Клетки культивировали в 96-луночных планшетах в 10% FBS/RPMI. Затем среду сменили на 0.5% FBS/RPMI и далее клетки обрабатывали, как указано для Фиг.8А. Данные представлены в виде процентного содержания живых клеток в сравнении с контрольными, необработанными глабрухиноном А клетками. Каждая точка на графике отражает полученное значение ±SD (стандартное отклонение от среднего значения) и является результатом двух независимых экспериментов, по три образца на каждую концентрацию в каждом из экспериментов (*р<0,05; Манн-Уитни U-тест).
Фиг.9В. Вычисление IC50 для глабрухинона А (5) при действии на НТ-460 клетки, произведенное методом линейной регрессии.
Фиг.10А. Ингибирование глабрухиноном А (5) колонеобразования НСТ-116 клеток в мягком агаре. НСТ-116 клетки были обработаны указанными концентрациями глабрухинона А (5) в мягком агаре. Колонии клеток были подсчитаны после инкубации с веществом 5 в течение недели. Каждый столбец на графике отражает полученное значение ±SD и является результатом двух независимых экспериментов, по три образца на каждую концентрацию в каждом из экспериментов (*р<0,05; Манн-Уитни U-тест).
Фиг.10В. Вычисление INCC50 для глабрухинона А (5) при действии на НСТ-116 клетки в мягком агаре, произведенное методом линейной регрессии.
Фиг.11А. Ингибирование глабрухиноном А (5) EGF-индуцированной JB6 Р+ Cl 41 клеточной трансформации в мягком агаре. JB6 Р+ Cl 41 клетки были обработаны EGF (10 нг/мл) и указанными концентрациями глабрухинона А (5) в мягком агаре. Колонии клеток были подсчитаны после инкубации с веществом 5 в течение недели. Каждый столбец на графике отражает полученное значение ±SD и является результатом двух независимых экспериментов, по три образца на каждую концентрацию в каждом из экспериментов (*р<0,05; Манн-Уитни U-тест).
Фиг.11В. Вычисление INCC50 для глабрухинона А (5) при действии на трансформированные с помощью EGF JB6 Р+ Cl 41 клетки в мягком агаре, произведенное методом линейной регрессии.
Фиг.12А. Ингибирование глабрухиноном А (5) ТРА-индуцированной JB6 P+ Cl 41 клеточной трансформации в мягком агаре. JB6 P+ Cl 41 клетки были обработаны ТРА (10 нг/мл) и указанными концентрациями глабрухинона А (5) в мягком агаре. Колонии клеток были подсчитаны после инкубации с веществом 5 в течение двух недель. Каждый столбец на графике отражает полученное значение ±SD и является результатом двух независимых экспериментов, по три образца на каждую концентрацию в каждом из экспериментов (*р<0,05; Манн-Уитни U-тест).
Фиг.12В. Вычисление INCC50 для глабрухинона А (5) при действии на трансформированные с помощью ТРА JB6 P+ Cl 41 клетки в мягком агаре, произведенное методом линейной регрессии.
Фиг.13А. Индукция глабрухиноном А апоптоза в JY клетках (В лимфобласты человека). JY клетки были выращены и обработаны указанными концентрациями глабрухинона А (5). Процент апоптоза был вычислен после 3 часов инкубации с веществом (5). Каждый столбец на графике отражает полученное значение ±SD и является результатом двух независимых экспериментов, по три образца на каждую концентрацию в каждом из экспериментов (*р<0,05; Манн-Уитни U-тест).
Фиг.13В. Индукция глабрухиноном А апоптоза в JB6 Р+ Cl 41 клетках мыши. JB6 P+ Cl 41 клетки были выращены и обработаны указанными концентрациями глабрухинона А (5). Процент апоптоза был вычислен после 3 часов инкубации с веществом (5). Каждый столбец на графике отражает полученное значение ±SD и является результатом двух независимых экспериментов, по два образца на каждую концентрацию в каждом из экспериментов (*р<0,05; Манн-Уитни U-тест).
Фиг.13С. Индукция глабрухиноном А апоптоза в SK-MEL-28 клетках. Клетки меланомы человека SK-MEL-28 были выращены и обработаны указанными концентрациями глабрухинона А (5). Процент апоптоза был вычислен после 3 часов инкубации с веществом (5). Каждый столбец на графике отражает полученное значение ±SD и является результатом двух независимых экспериментов, по три образца на каждую концентрацию в каждом из экспериментов (*р<0,05; Манн-Уитни U-тест).
Фиг.13D. Индукция глабрухиноном А апоптоза в НТ-460 клетках. Клетки рака легких человека НТ-460 были выращены и обработаны указанными концентрациями глабрухинона А (5). Процент апоптоза был вычислен после 3 часов инкубации с веществом (5). Каждый столбец на графике отражает полученное значение ±SD и является результатом двух независимых экспериментов, по три образца на каждую концентрацию в каждом из экспериментов (*р<0,05; Манн-Уитни U-тест).
Фиг.13Е. Индукция глабрухиноном А апоптоза в НСТ-116 клетках. Клетки рака кишечника человека НСТ-116 были выращены и обработаны указанными концентрациями глабрухинона А (5). Процент апоптоза был вычислен после 20 часов инкубации с веществом (5). Каждый столбец на графике отражает полученное значение ±SD и является результатом двух независимых экспериментов, по три образца на каждую концентрацию в каждом из экспериментов (*р<0,05; Манн-Уитни U-тест).
Фиг.14. Индукция апоптоза глабрухиноном А (5) в COX2+/+или COX2-/- МЭФ, определенная с помощью метода ДНК-лестницы. Клетки COX2+/+ или СОХ2-/- МЭФ (мышиные эмбриональные фибробласты) были выращены, обработаны указанными концентрациями глабрухинона А (5) и инкубированы в течение 24 часов. Затем клетки собрали и поставили тест на апоптоз методом ДНК-лестницы.
Фиг.15А. Глабрухинон А (5) индуцирует NF-κВ-зависимую транскрипционную активность в JB6 Cl 41 клетках. JB6 Cl 41 клетки со стабильно экспрессированным люциферазным репортерным геном, контролируемым NF-κВ ДНК-связанным сиквенсом, были обработаны указанными концентрациями глабрухинона А (5) и инкубированы в течение 24 часов. Затем клетки были экстрагированы лизисным буфером и люциферазная активность была измерена.
Фиг.15В. Глабрухинон А (5) индуцирует АР-1-зависимую транскрипционную активность в JB6 Cl 41 клетках. JB6 Cl 41 клетки со стабильно экспрессированным люциферазным репортерным геном, контролируемым АР-1 ДНК-связанным сиквенсом, были обработаны указанными концентрациями глабрухинона А (5) и инкубированы в течение 24 часов. Затем клетки были экстрагированы лизисным буфером и люциферазная активность была измерена.
Фиг.16. Ингибирование глабрухиноном А (он же деметилубихинон Q2, 5) роста карциномы Эрлиха у белых нелинейных мышей. Мыши были обработаны однократно путем внутрибрюшинного введения, глабрухиноном А, растворенным в 50% ДМСО, за сутки до инокуляции опухоли. Размеры опухоли измеряли на 6-й, 9-й, 12-й, 15-й и 18-й день. Данные представлены в виде процента ингибирования роста опухоли в мышах, обработанных глабрухиноном А, по сравнению с размерами опухоли в необработанных мышах. Каждый столбец на графике отражает полученное значение ±SD и является результатом двух независимых экспериментов, по четыре мыши в каждом из экспериментов (*р<0,05; Манн-Уитни U-тест).
Фиг.17. Ингибирование глабрухиноном А (он же деметилубихинон Q2, 5) роста карциномы Эрлиха у белых нелинейных мышей. Мыши были обработаны однократно путем внутрибрюшинного введения, глабрухиноном А, растворенным в 50% этиловом спирте, за сутки до инокуляции опухоли. Размеры опухоли измеряли на 6-й, 9-й, 12-й, 15-й и 18-й день. Данные представлены в виде процента ингибирования роста опухоли в мышах, обработанных глабрухиноном А, по сравнению с размерами опухоли в необработанных мышах. Каждый столбец на графике отражает полученное значение ±SD и является результатом двух независимых экспериментов, по четыре мыши в каждом из экспериментов (*р<0,05; Манн-Уитни U-тест).
Фиг.18. Ингибирование глабрухиноном А (он же деметилубихинон Q2, 5) роста карциномы Эрлиха у белых нелинейных мышей. Мыши были обработаны однократно путем внутрибрюшинного введения, глабрухиноном А, растворенным в 50% ДМСО, через сутки после инокуляции опухоли. Размеры опухоли измеряли на 9-й, 12-й, 15-й и 18-й день. Данные представлены в виде процента ингибирования роста опухоли в мышах, обработанных глабрухиноном А, по сравнению с размерами опухоли в необработанных мышах. Каждый столбец на графике отражает полученное значение ±SD и является результатом двух независимых экспериментов, по четыре мыши в каждом из экспериментов (*р<0,05; Манн-Уитни U-тест).
Детальное описание изобретения
Вещества изобретения показали противораковую превентивную и терапевтическую активность, что было показано с помощью методов определения опухолевой трансформации клеток в мягком агаре, определения апоптоза методами проточной цитометрии и ДНК-лестницы, определения цитотоксической активности MTS-методом, а также в опытах in vivo на белых нелинейных мышах с привитой карциномой Эрлиха. Для экспериментов использовались мышиные эпидермальные JB6 P+ Cl 41 клетки, COX2+/+ и COX2-/- мышиные эмбриональные фибробласты (МЭФ), JY клетки (В лимфобласты человека), опухолевые клетки человека НТ-460 (рак легких), НСТ-116 (рак кишечника), SK-MEL-28 (рак кожи, меланома). Исследуемые полипренилхиноны и гидрохиноны индуцировали в JB6 Cl 41 клетках АР-1- и NF-κВ-зависимую транскрипционную активность. Вещества изобретения также показали раково-превентивную активность в опытах в мягком агаре, в нецитотоксических концентрациях, что свидетельствует о том, что противоопухолевое действие веществ изобретения опосредовано через нетоксический механизм.
Соотношения структура-активность на примере репрезентативной выборки веществ изобретения
Зависимость структура - активность представленных сединений изучалась с использованием статистического анализа (компьютерная программа Statistica 6, Stat Soft Inc., USA). Исследуемые соединения подразделялись на три группы в зависимости от количества изопреновых единиц в терпеноидной части (Табл.2). Группа 1 содержала хиноны с двумя изопреновыми звеньями (10 атомов углерода) в боковой цепи. Группа 2 - хиноны с треми изопреновыми звеньями (15 атомов углерода) в терпеноидной части и группа 3 - хиноны, содержащие от 4 до 6 изопреновых единиц (20-30 атомов углерода) в боковой цепи. Существенные отличия и корреляции между данными о биологической активности, полученные для различных структурных групп хинонов, определялись при помощи метода непараметрической корреляции Спирмана и Манн-Уитни U-тестом при использовании данных из Табл. 2.
Результаты показали, что биологическая активность представленных соединений зависит от длины боковой цепи терпеноидной части молекулы. Статистический анализ данных из Табл.2 показал, что цитотоксичность хинонов из группы 1 имеет в среднем значение IC50 20.0±15.2 Мµ для JB6 Cl 41 клеток. Хиноны из группы 2 имеют среднее значение IC50 9.7±9.0 Mµ. И наконец, хиноны из группы 3 показали среднее значение IC50 84.9±63.8 Mµ. Эти результаты означают, что хиноны с тремя изопреновыми звеньями в терпеноидной части более токсичны для JB6 Cl 41 клеток чем хиноны из группы 1, имеющие 2 изопреновых звена. Противоположный вывод можно сделать при сравнении значений IC50 для хинонов из групп 1 и 3 или 2 и 3. Хиноны из групп 1 или 2 существенно более токсичны для JB6 Cl 41 клеток, чем соединения из группы 3. Следовательно, в соединениях групп 1, 2 с увеличением длины терпеноидной части увеличивается активность соединений, но активность существенно снижается при дальнейшем увеличении длины терпеноидной части от группы 2 к группе 3.
Данные статистического анализа по влиянию представленных соединений на EGF-индуцируемую трансформацию JB6 Cl 41 клеток показали, что хиноны группы 1 имеют среднее значение INCC50 9.4±5.3 Mµ, а хиноны группы 2 - INCC50 24.0±16.7 Мµ. Группа 3 снова показала минимальную активность среди трех групп соединений с INCC50 59.7±33.3 Мµ (Табл.2). Таким образом, учитывая эти данные и данные Манн-Уитни U-теста можно заключить, что хиноны группы 1 обладают наиболее сильным эффектом ингибирования клеточной трансформации (р=0.0283 при сравнении с группой 2; р=0.0253 при сравнении с группой 3; р=0.0084 при сравнении с объединенными данными для групп 2 и 3), а группа 3 наименее эффективна. Существенные корреляции наблюдались между длиной терпеноидной части и INCC50 (р=0.0002, R=0.8556). Это означает, что с увеличением длины терпеноидной части значения INCC50 для клеточной трансформации также увеличиваются.
Сравнивались токсичность и клеточная трансформация JB6 Cl 41 клеток, и было найдено, что хиноны из группы 1 имеют среднее значение INCC50 в 1.4-4 раза меньше, чем IC50 для соответствующих клеток (табл. 2). С другой стороны, большинство хинонов из группы 2 показали значения INCC50 в 4-10 раз выше, чем IC50. На основании этих данных можно сказать, что хиноны группы 1 существенно более токсичны для трансформированных JB6 клеток, чем для нормальных. И наоборот, хиноны группы 2 более токсичны в отношении нормальных JB6 клеток, чем трансформированных. Таким образом, хиноны группы 1 имеют более сильную канцерпревентивную активность чем хиноны группы 2.
Исследовали также влияние репрезентативной выборки соединений 5, 7-18 на транскрипционную активность, зависимую от некоторых ядерных факторов, в частности, р53, АР-1 и NF-κВ. Было показано, что активность патентуемых соединений зависит в некоторой степени от положения метоксильной группы по отношению к терпеноидной части. Было выбрано несколько пар структурных аналогов с метоксильными группами в одинаковом положении: 1) орто-аналоги, хиноны 9 и 13; 2) мета-аналоги, хиноны 10 и 8; 3) пара-аналоги, хиноны 11 и 12. Из данных таблиц 2 и 3 следует, что канцерпревентивная активность и влияние хинонов на АР-1 зависимую транскрипционную активность возрастает в ряду орто - мета - пара. INCC50 имеет следующие значения: для хинонов 9, 13: 15.1 и 24.6 Мµ соответственно; хинонов 10, 8: 6.6 и 16.7 Мµ, соответственно и для хинонов 11, 12: 3.1 и 7.4 Мµ соответственно.
Индукция АР-1 зависимой транскрипционной активности орто-соединениями 9, 13 составляет 133,8% по отношению к контролю, а мета-соединениями 10, 8 - 188,7%. Пара-соединения 11 и 12 показали самое высокое значение АР-1 зависимой транскрипционной активности - 486,9% по сравнению с контролем. Орто-дизамещенные хиноны 9 и 13 являются наименее активными соединениями по сравнению с мета- и пара-аналогами не только в отношении индукции АР-1 зависимой транскрипционной активности, но и при ингибировании клеточной трансформации. Среди пара-дизамещенных производных хинон 11, имеющий две изопреновые единицы в боковой цепи, показал лучшую активность по сравнению с хиноном 12, имеющим три изопреновые единицы. Кроме того, пара-дизамещенные хиноны 11 и 12 имеют INCC50 3.1 и 7.4 Мµ соответственно против EGF-индуцируемой клеточной трансформации JB6 Р+ Cl 41 клеток. Хинон 9 также показал более высокую индукцию АР-1 зависимой транскрипционной активности (721.7%) по сравнению с хиноном 13 (252.2%).
Канцерпревентивные свойства патентуемых соединений были изучены с использованием мышиных эпителиальных клеток JB6 Cl 41. Хиноны с двумя изопреновыми звеньями в боковой цепи показали специфический эффект против трансформированных в опухолевые JB6 Cl 41 клеток по сравнению с нормальными клетками. Действующие концентрации могли отличаться в 4 раза.
Зависимость структура - активность патентуемых соединений изучалась в отношении цитотоксичности или канцерпревентивной активности. Данное изучение показало, что цитотоксичность хинонов возрастает с увеличением числа атомов углерода, от хинонов с двумя пренильными звеньями в боковой цепи к хинонам с тремя звеньями и затем уменьшается для соединений, имеющих от 4 до 6 изопреновых единиц. Канцерпревентивная активность уменьшалась с увеличением длины полипренильной цепи. Наиболее активные канцерпревентивные полипренилхиноны имеют боковую цепь из двух изопреновых единиц.
Как было показано с помощью методов проточной цитометрии и ДНК-лестницы, репрезентативная выборка патентуемых соединений индуцировала апоптоз в JB6 Р+ Cl 41 клетках и МЭФ. Белок-суппрессор опухолей р53, который является частью "системы безопасности" клетки и функционирует по принципу негативной регуляции клеточного роста в клетках с поврежденной ДНК, часто вовлекается в апоптоз, индуцируемый некоторыми внешними стимулами, включая хемопревентивные агенты и противоопухолевые препараты. Однако патентуемые соединения не только не активируют р53, но даже наоборот, многие из изученных патентуемых соединений демонстрируют значительное ингибирование р53-зависимой транскрипционной активности. В дополнение к этому, патентуемые соединения индуцируют значительную активацию АР-1- или NF-κВ-зависимой транскрипционной активности. АР-1 транскрипционный фактор регулирует множество клеточных процессов, таких как пролиферация, дифференциация, апоптоз, и прежде рассматривался преимущественно как онкоген. Недавно было показано, что некоторые из составляющих АР-1 белков, такие как Jun-B и c-Fos имеют раково-превентивную активность, как in vitro, так и in vivo. Активация другого АР-1 белка, c-Jun требуется для индукции Fas L-опосредованного апоптоза в PC 12 клетках и клетках лейкемии человека HL-60. Активация как АР-1, так и NF-κВ ядерных факторов важна для действия ДНК-повреждающих агентов и апоптоза, индуцируемого церамидами в Т-лимфоцитах и Jurkat Т-клетках. Баланс между белками-членами АР-1 семейства, c-Jun и ATF-2 регулирует выбор между направлениями на дифференциацию или на апоптоз в PC 12 клетках. Противораковые препараты, такие как винбластин, которые ингибируют микротьюбулы, активируют АР-1 фактор транскрипции в клетках карциномы человека КВ-3. Эта активация необходима для эффективного апоптоза, индуцируемого этим лекарством.
NF-κВ, член высокорегулируемого семейства димерных ядерных факторов транскрипции, вовлекается в активацию большого числа генов, которые отвечают на инфекцию, воспаление и другие стрессовые ситуации. Сообщается, что NF-κВ вовлекается как в индукцию, так и в ингибирование апоптоза.
Результаты, представленные в настоящем изобретении, предполагают, что апоптоз, индуцируемый репрезентативной выборкой патентуемых соединений происходит независимо от р53-ядерного фактора транскрипции, но вместо этого может быть опосредован через АР-1 и NF-κВ-ядерные факторы.
Таким образом, полученные результаты показывают, что метоксилированные полипренилхиноны и их синтетические аналоги являются новой перспективной группой противораковых препаратов морского происхождения. Патентуемые соединения показывают цитотоксическую активность и индуцируют апоптоз в JB6 Р+ Cl 41 и МЭФ клетках. Наиболее активные из этих соединений являются мощными индукторами АР-1 и NF-κB-зависимой транскрипционной активности и в то же время, ингибиторами р53-зависимой транскрипционной активности. Канцерпревентивное действие этих соединений может быть объяснено индукцией р53-независимого апоптоза.
Было обнаружено, что хиноны, имеющие боковую цепь, состоящую из 10 атомов углерода, оказывают специфический эффект ингибирования трансформированных JB6 Р+ Cl 41 клеток в отличие от хинонов, имеющих боковую цепь с 15 или от 20 до 30 атомов углерода. Поскольку представленные соединения активны против трансформации эпидермальных JB6 клеток, они могут быть использованы как средства против рака кожи, т.е. средства, предотвращающие рак кожи. Хинон 11, имеющий боковую цепь в пара-положении относительно метокси-группы, обладает наиболее сильным канцерпревентивным эффектом из изученных соединений.
Противораковые и терапевтические свойства исследуемых соединений проявлялись в относительно нетоксичных концентрациях. Это подтверждалось тестом на цитотоксичность с использованием метода MTS, тестом на опухолевую трансформацию клеток в мягком агаре и определением апоптоза методами проточной цитометрии и ДНК-лестницы. Изучение проводилось на мышиных эпидермальных JB6 Cl 41 клетках, JY лимфобластах человека, СОХ2-дефицитных и нормальных мышиных эмбриональных фибробластах (МЭФ), а также некоторых человеческих опухолевых клеточных линиях включая рак легких (НТ460), рак кишечника (НСТ) и меланому (SK-MEL-28). Канцерпромоторный эффект эпидермального фактора роста (EGF) или 12-O-тетрадеканоил-форбол-13-ацетата (ТРА) значительно уменьшался при применении нетоксических доз глабрухинона А или других патентуемых соединений.
Помимо уже упомянутых использовались следующие определения, если другие не описаны: алкил, алкокси и т.д., обозначающие как разветвленные, так и неразветвленные группы, но ссылка на такой радикал как «пропил» означает только неразветвленный радикал, а «изопропил» относится только к разветвленному радикалу.
В основном, термин «выделенное и очищенное» означает, что соединение в значительной степени очищено от биологического материала (например, крови, тканей, клеток, растительного материала и т.д.). В рамках патента в одном случае это означает, что вещество очищено на 75%, в другом - по меньшей мере на 90%, в третьем - на 98 или, наконец, на 99% от биологического материала. В других случаях этот термин относится к синтезированным соединениям.
Термин «лечение» относится как к терапевтическому, так и профилактическому лечению, когда целью является предотвращение или уменьшение нежелательных физиологических изменений или нарушений, таких как развитие и распространение рака. Желательные клинические результаты включают, но не ограничиваются, смягчение симптомов, ограничение распространения болезни, стабилизацию состояния болезни, ограничение или замедление прогресса болезни, улучшение или временное облегчение болезненного состояния, а также ремиссию (частичную или полную), определяемую или неопределяемую. «Лечение» может также означать пролонгирование выживания при сравнении с ожидаемым выживанием при отсутствии лечения. Клинические результаты при необходимости лечения включают результаты уже имеющегося состояния или нарушения, а также склонности к данному состоянию или нарушению или результаты, при которых данное состояние или нарушение предотвращается.
Термины «рак» или «раковый» относятся физиологическому состоянию млекопитающего, при котором характерен неконтролируемый рост клеток. «Рак» может включать одну или больше опухолевых линий. Список видов рака, таких как, к примеру, рак кожи, включен в патент США №6,833,373.
Специфические и предпочтительные значения, перечисленные ниже для радикалов, заместителей и рангов, используются только для иллюстрации, они не исключают других определенных значений или других значений в пределах определенных рангов для радикалов и заместителей.
Специфически (С1-С6)алкил может быть метилом, этилом, пропилом, изопропилом, бутилом, изо-бутилом, втор-бутилом, пентилом, 3-пентилом, или гексилом; (С1-С6)алкокси может быть метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, вторбутокси, пентокси, 3-пентокси или гексилокси.
Процесс получения патентуемых соединений дается в следующих примерах изобретения и иллюстрирован процедурами, в которых радикалы обозначаются так, как указано выше, если не квалифицированы по-другому.
В тех случаях, когда патентуемые соединения являются достаточно сильными основаниями или кислотами для формирования стабильных нетоксичных солей, введение веществ в виде солей может быть предпочтительным. Примерами фармацевтически приемлемых солей могут служить соли органических кислот, которые формируются с кислотами, образующими физиологически приемлемый анион, к примеру тозилат, метансульфонат, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, α-кетоглутарат, и α-глицерофосфат.Подходящие неорганические соли могут также быть получены, включая гидрохлорид, сульфат, нитрат, бикарбонат и карбонат.
Фармацевтически приемлемые соли могут быть получены с использованием стандартных, широко известных процедур, к примеру, при реакции достаточно основного соединения, такого как амин, с подходящей кислотой, дающей физиологически приемлемый анион. Соли щелочных металлов (к примеру, натрия, калия или лития) или щелочноземельных металлов (к примеру, кальция) и органических кислот, также могут быть получены.
Патентуемые соединения также могут быть сформулированы как фармацевтические композиции и введены млекопитающему, например человеку, в виде различных форм, адаптированных к выбранному пути введения, т.е. орально или парентерально, внутривенно, внутримышечно, местно или подкожно.
Так, представленные соединения могут систематически вводиться, например орально, в комбинации с фармацевтически приемлемым наполнителем, таким, как инертный растворитель или съедобный носитель. Они могут быть оформлены в виде жестких или мягких желатиновых капсул, могут быть сформированы в таблетки или могут быть включены прямо в пищу пациента в виде пищевой добавки. Для орального терапевтического применения активное вещество может быть скомбинировано с одним или более инертным наполнителем и использоваться в форме проглатываемых таблеток, защечных таблеток, капсул, эликсиров, суспензий, сиропов, облаток и т.п. Такие композиции и препараты должны содержать не менее 0,1% активного вещества. Процентное содержание активного вещества в составе композиций и препаратов может, конечно, варьироваться и обычно может составлять от 2 до 60% веса единицы лекарственной формы. Количество активного вещества должно быть таково, чтобы достигался уровень эффективной дозы.
Таблетки, пилюли, капсулы и т.п. могут также содержать следующее: связующие вещества, такие как камедь, акация, желатин; наполнители, такие как фосфат кальция; дезинтегрирующие вещества, например крахмал, альгиновая кислота; смазки, такие как стеарат магния; подсластители, например сахароза, фруктоза, лактоза или аспартам; или отдушки, например мята, винтергрин, вишня. Когда лекарственная форма имеет вид капсулы, она может содержать, кроме вышеупомянутого, жидкий носитель, такой как растительное масло или полиэтиленгликоль. Различные материалы могут быть использованы в качестве оболочек или другой модификации твердой лекарственной формы. Например, таблетки, пилюли или капсулы могут быть покрыты желатином, воском, шеллаком или сахаром и т.п. Сироп или эликсир могут содержать активное вещество, сахарозу или фр