Способы получения 3-(4-(2,4-дифторбензилокси)-3-бром-6-метил-2-оксопиридин-1(2н)-ил)-n,4-диметилбензамида
Иллюстрации
Показать всеИзобретение относится к способу получения (-)-3-(4-(2,4-дифторбензилокси)-3-бром-6-метил-2-оксопиридин-1(2Н)-ил)-N,4-диметилбензамида или его фармацевтически приемлемой соли, включающему стадии: а) контактирования соединения формулы V с бромирующим реагентом в присутствии по меньшей мере одного растворителя с получением соединения формулы IV, б) контактирования соединения формулы IV с гидролазой в присутствии буферного раствора с получением соединения формулы X, в) контактирования соединения формулы Х с активирующим реагентом в присутствии по меньшей мере одного растворителя и затем контактирования полученной смеси с метиламином с получением соединения формулы IX, г) контактирования соединения формулы IX с 2,4-дифторбензилгалогенидом в присутствии основания и по меньшей мере одного растворителя; где соединения V, IV, Х и IX такие, как представлено в формуле изобретения. А также к новым соединениям, а именно к метил-3-(3-бром-4-гидрокси-6-метил-2-оксопиридин-1(2Н)-ил)-4-метилбензоату, (-)-3-(3-бром-4-гидрокси-6-метил-2-оксопиридин-1(2Н)-ил)-4-метилбензойной кислоте и (-)-3-(3-бром-4-гидрокси-6-метил-2-оксопиридин-1(2Н)-ил)-N,4-диметилбензамиду. Технический результат: описан новый способ получения (-)-3-(4-(2,4-дифторбензилокси)-3-бром-6-метил-2-оксопиридин-1(2Н)-ил)-N,4-диметилбензамида, который исключает ряд трудоемких операций, например многократные экстракции, а также позволяет избежать использование дорогостоящих материалов. 2 н. и 10 з.п. ф-лы.
Реферат
Известно, что 3-(4-(2,4-дифторбензилокси)-3-бром-6-метил-2-оксо-пиридин-1(2H)-ил)-N,4-диметилбензамид полезен в качестве терапевтического агента для лечения многочисленных патологических состояний, включая лечение или предупреждение воспалительных и респираторных заболеваний. Полагают, что эффективность 3-(4-(2,4-дифторбензилокси)-3-бром-6-метил-2-оксопиридин-1(2H)-ил)-N,4-диметилбензамида связана с его способностью ингибировать p38 киназу.
Полагают, что p38α киназа может вызывать эффекты, например, воспаления в целом; артрита; нейровоспаления; боли; лихорадки; легочных расстройств; сердечно-сосудистых заболеваний; кардиомиопатии; удара; ишемии; реперфузионного повреждения; почечного реперфузионного повреждения; отека головного мозга; нейротравмы и травмы головного мозга; нейродегенеративных расстройств; расстройств центральной нервной системы; заболевания печени и нефрита; поражений желудочно-кишечного тракта; язвенных заболеваний; офтальмологических заболеваний; офтальмологических состояний; глаукомы; острого повреждения глазной ткани и травм глаза; диабета; диабетической нефропатии; состояний, связанных с кожей; вирусных и бактериальных инфекций; миалгий из-за инфекций; гриппа; эндотоксического шока; синдрома токсического шока; аутоиммунного заболевания; заболеваний резорбции кости; рассеянного склероза; расстройств женской репродуктивной системы; таких патологических (но не злокачественных) состояний, как гемангиомы, ангиофибромы носоглотки и бессосудистого некроза кости; доброкачественных и злокачественных опухолей/новообразований, включая рак; лейкемии; лимфомы; системной красной волчанки (SLE); ангиогенеза, включая неоплазию; и метастазирование, либо вносить вклад в эти эффекты.
В WO 03/068230 А1, опубликованной 21 августа 2003 года, описаны 3-(4-(2,4-дифторбензилокси)-3-бром-6-метил-2-оксопиридин-1(2H)-ил)-N,4-диметил бензамид, его получение и применение в лечении воспаления.
3-(4-(2,4-Дифторбензилокси)-3-бром-6-метил-2-оксопиридин-1(2H)-ил)-N,4-диметилбензамид и его близкие аналоги могут быть получены посредством либо описанного рацемического пути (Путь 1), либо хирального пути (Путь 2).
В попытке сделать предложенный путь более эффективным и крупномасштабным процессом были сделаны некоторые модификации Пути 1. Они включают не только усовершенствованные реакционные условия и процедуры обработки, но также и новые реакции. Последовательность стадий 2, 3 и 4 предложенного пути - алкилирование, гидролиз и бромирование - заменили, по ряду причин, на бромирование, алкилирование и гидролиз. Эти причины включают исключение трудоемких операций на каждой стадии, таких как многократные экстракции и процедуры концентрирования, для получения более высоких выходов. В Пути 1 избегают использования дорогостоящих материалов, где это возможно.
Путь 2 был использован для развития нового хирального пути для получения соединения формулы I для устранения необходимости в хиральной хроматографии. Был предложен эффективный и крупномасштабный хиральный синтез с применением подхода на основе селективного ферментативного гидролиза. В Пути 2 также избегают использования дорогостоящих материалов, где это возможно.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Первое воплощение настоящего изобретения составляет улучшенный способ получения соединения формулы I:
включающий стадии:
а) контактирования соединения формулы V:
с галогенирующим реагентом в присутствии по меньшей мере одного растворителя с получением соединения формулы IV:
б) контактирования соединения формулы IV с замещенным бензилгалогенидом в присутствии по меньшей мере одного растворителя и основания с получением соединения формулы III:
в) контактирования соединения формулы III с основанием в присутствии по меньшей мере одного растворителя с получением соединения формулы II:
г) контактирования соединения формулы II с активирующим реагентом в присутствии по меньшей мере одного растворителя и затем контактирования полученной смеси с амином с получением соединения формулы I;
где
X1, X2, X3, X4, X5 и X6 независимо представляют собой H, галогено или C1-C6алкил;
R1 представляет собой C1-C6алкил или арил;
R2 представляет собой H, галогено или C1-C6алкил;
R3 представляет собой галогено или C1-C6алкил; и
R4 представляет собой H или C1-C6алкил;
R5 представляет собой H, C1-C6алкил или арил; либо
R4, R5 и атом азота, к которому они присоединены, образуют морфолинильное, тиоморфолинильное, пиперидинильное, пирролидинильное или пиперазинильное кольцо, которое возможно замещено 1 или 2 группами, которые независимо представляют собой C1-C4алкил, C1-C4алкокси, гидрокси, гидроксиC1-C4алкил, C1-C4гидроксиалкил или галоген.
Второе воплощение настоящего изобретения составляет улучшенный способ получения соединения формулы I, включающий стадии:
а) контактирования соединения формулы V:
с галогенирующим реагентом в присутствии по меньшей мере одного растворителя с получением соединения формулы IV:
б) контактирования соединения формулы IV с гидролазой в присутствии буферного раствора с получением соединения формулы X:
в) контактирования соединения формулы X с активирующим реагентом в присутствии по меньшей мере одного растворителя и затем контактирования полученной смеси с амином с получением соединения формулы IX:
и
г) контактирования соединения формулы IX с замещенным бензилгалогенидом в присутствии основания и по меньшей мере одного растворителя с получением соединения формулы I;
где
X1, X2, X3, X4, X5 и X6 независимо представляют собой H, галогено или С1-С6алкил;
R1 представляет собой C1-C6алкил или арил;
R2 представляет собой H, галогено или C1-C6алкил;
R3 представляют собой галогено или C1-C6алкил; и
R4 представляет собой H или C1-C6алкил;
R5 представляет собой H, C1-C6алкил или арил; либо
R4, R5 и атом азота, к которому они присоединены, образуют морфолинильное, тиоморфолинильное, пиперидинильное, пирролидинильное или пиперазинильное кольцо, которое возможно замещено 1 или 2 группами, которые независимо представляют собой C1-C4алкил, C1-C4алкокси, гидрокси, гидроксиC1-C4алкил, C1-C4дигидроксиалкил или галоген.
Третье воплощение настоящего изобретения составляет улучшенный способ получения соединения формулы I, имеющего следующую структуру:
включающий стадии:
а) контактирования соединения формулы V, имеющего следующую структуру:
с 1,3-дибром-5,5-диметилгидантоином в присутствии ацетонитрила с получением соединения формулы IV, имеющего следующую структуру:
б) контактирования соединения формулы IV с протеазой Bacillus sp. в присутствии буферного раствора двухосновного фосфата калия с получением соединения формулы X, имеющего следующую структуру:
в) контактирования соединения формулы X с 1,1'-карбонилдиимидазолом в присутствии диметилформамида и затем контактирования полученной смеси с NH2CH3 в тетрагидрофуране с получением соединения формулы IX, имеющего следующую структуру:
и
г) контактирования соединения формулы IX с соединением, имеющим следующую структуру:
в присутствии карбоната калия и N-метилпирролидинона.
В четвертом воплощении настоящего изобретения предложены новые промежуточные соединения, выбранные из
метил-3-(3-бром-4-гидрокси-6-метил-2-оксопиридин-1(2H)-ил)-4-метилбензоата;
(+)-метил-3-(3-бром-4-гидрокси-6-метил-2-оксопиридин-1(2H)-ил)-4-метилбензоата;
3-(3-бром-4-гидрокси-6-метил-2-оксопиридин-1(2H)-ил)-N,4-диметилбензамида;
3-(3-бром-4-гидрокси-6-метил-2-оксопиридин-1(2Н)-ил)-4-метилбензойной кислоты;
(-)-3-(3-бром-4-гидрокси-6-метил-2-оксопиридин-1(2H)-ил)-4-метилбензойной кислоты и
(-)-1-(5-(1H-имидазол-1-карбонил)-2-метилфенил)-3-бром-4-гидрокси-6-метилпиридин-2(1N)-она,
или их фармацевтически приемлемая соль.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединение и соли по данному изобретению могут быть получены из материалов, доступных в данной области.
Термин "алкил" означает углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 8 атомов углерода, и включает, например, метил, этил, н-пропил, изо-пропил, н-бутил, втор-бутил, изо-бутил, трет-бутил, н-пентил, н-гексил, н-гептил, н-октил и тому подобное.
Термин "арил" означает ароматическую углеводородную кольцевую систему, содержащую по меньшей мере одно ароматическое кольцо. Это ароматическое кольцо возможно может быть конденсировано или иным образом присоединено к другим ароматическим углеводородным кольцам или неароматическим углеводородным кольцам. Примеры арильных групп включают, например, фенил, нафтил, 1,2,3,4-тетрагидронафтил, инданил и бифенил.
Термин "металл группы IA" также известен как щелочной металл и включает, например, литий, натрий и калий.
Термин "металл группы IIA" также известен как щелочноземельный металл и включает, например, кальций, барий, стронций, магний.
Термин "фармацевтически приемлемый" используется в данном описании в качестве прилагательного для указания на то, что модифицированное существительное пригодно для использования в качестве фармацевтического продукта или части фармацевтического продукта.
Что касается слов "содержат", или "содержит", или "содержащий" в данной заявке (включая формулу изобретения), то эти слова используются исходя из понимания того, что их следует толковать включительно, а не исключительно, и того, что авторы изобретения предполагают именно такое толкование этих слов при составлении данной заявки, включая формулу изобретения.
В описании использованы следующие определения для различных аббревиатур:
МГц означает Мегагерц,
Гц означает Герц,
J означает константу сочетания,
m/z означает отношение массы к заряду,
°C означает градусы Цельсия,
г означает грамм,
мг означает миллиграмм,
ммоль означает миллимоль,
мл означает миллилитр,
мкл означает микролитр,
М означает молярность,
HPLC означает высокоэффективную жидкостную хроматографию,
"DMAC" означает N,N-диметилацетамид,
"DMAP" означает диметиламинопиридин,
"DMF" означает диметилформамид,
"DMI" означает 1,3-диметилимидазолидинон,
"DMPU" означает 1,3-диметил-3,4,5,6-тетрагидро-2(1H)-пиримидинон,
"DMSO" означает диметилсульфоксид,
"ее" означает энантиомерный избыток,
"HCl” означает соляную кислоту,
"MTBE" означает метил-трет-бутиловый эфир,
"NMP" означает 1-метил-2-пирролидинон,
"TEA" означает триэтиламин,
"TFA" означает трифторуксусную кислоту,
"THF" означает тетрагидрофуран.
ОБЩИЙ СИНТЕЗ
Данное изобретение, в частности, касается способа получения соединения формулы I:
где X1, X2, X3, X4, X5 и X6 независимо представляют собой H, галогено или C1-C6алкил; R2 представляет собой H, галогено или C1-C6алкил; R3 представляет собой галогено или C1-C6алкил; и R4 представляет собой H или C1-C6алкил; R5 представляет собой H, C1-C6алкил или арил; либо R4, R5 и атом азота, к которому они присоединены, образуют морфолинильное, тиоморфолинильное, пиперидинильное, пирролидинильное или пиперазинильное кольцо, которое возможно замещено 1 или 2 группами, которые независимо представляют собой C1-C4алкил, C1-C4алкокси, гидрокси, гидрокси C1-C4алкил, C1-C4дигидроксиалкил или галоген.
Соединение формулы I может быть получено посредством описанных рацемического пути (Путь 1) или хирального пути (Путь 2).
Соединения, описанные в данном изобретении, могут существовать в виде атропоизомеров, то есть хиральных ротационных изомеров. Данное изобретение охватывает рацемические и разделенные атропоизомеры. В ряде воплощений один из атропоизомеров является более предпочтительным по сравнению с другим. В рацемическом пути предпочтительный атропоизомер может быть отделен посредством хиральной колоночной хроматографии. В хиральном пути необходимость в хиральной колоночной хроматографии была устранена в результате использования подхода на основе селективного ферментативного гидролиза.
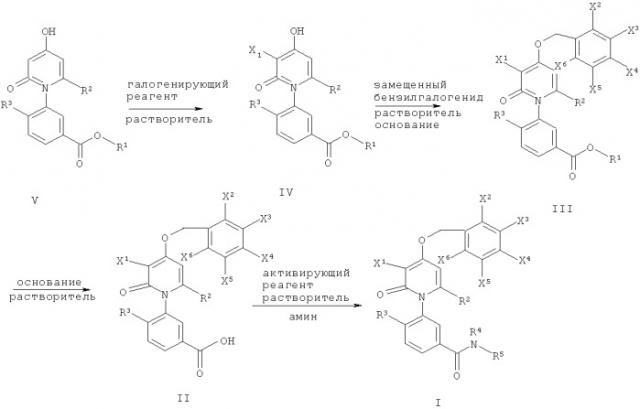
В одном воплощении настоящего изобретения предложен способ получения рацемического соединения формулы I. Путь 1 в общем виде представлен на Схеме 1.
где X1, X2, X3, X4, X5 и X6 независимо представляют собой H, галогено или C1-C6aлкил; R2 представляет собой Н, галогено или C1-C6aлкил; R3 представляет собой галогено или C1-C6aлкил; и R4 представляет собой H или C1-C6aлкил; R5 представляет собой H, C1-C6aлкил или арил; либо R4, R5 и атом азота, к которому они присоединены, образуют морфолинильное, тиоморфолинильное, пиперидинильное, пирролидинильное или пиперазинильное кольцо, которое возможно замещено 1 или 2 группами, независимо представляющими собой C1-C4aлкил, C1-C4алкокси, гидрокси, гидроксиC1-C4алкил, C1-C4дигидроксиалкил или галоген.
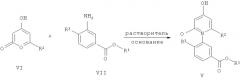
Получение соединения Формулы V - Способ 1
В одном воплощении настоящего изобретения предложен способ получения соединения формулы V, включающий контактирование соединения формулы VI с соединением формулы VII в присутствии по меньшей мере одного растворителя.
где R1 представляет собой C1-C6алкил или арил; R2 представляет собой H, галогено или C1-C6алкил; и R3 представляет собой галогено или C1-C6алкил.
Обычно соединение формулы VI приводят в контакт с соединением формулы VII в присутствии по меньшей мере одного растворителя и основания.
Способ обычно осуществляют при температуре от приблизительно 30°C до приблизительно 300°C. В одном воплощении температура составляет от приблизительно 45°C до приблизительно 150°C. В другом воплощении температура составляет от приблизительно 60°C до приблизительно 100°C.
Способ обычно осуществляют в течение периода времени от приблизительно 4 часов до приблизительно 60 часов. В одном воплощении период времени составляет от приблизительно 2 часов до приблизительно 40 часов. В другом воплощении период времени составляет от приблизительно 15 часов до приблизительно 25 часов.
Растворитель представляет собой полярный растворитель или неполярный растворитель. Примеры пригодных полярных растворителей включают этиленгликоль и трифторэтанол. Примеры пригодных неполярных растворителей включают дихлорбензол, ксилолы и дифениловый эфир. В одном воплощении растворитель представляет собой дихлорбензол, ксилолы, дифениловый эфир, этиленгликоль или трифторэтанол. В другом воплощении растворитель представляет собой трифторэтанол или этиленгликоль. В другом воплощении растворитель представляет собой этиленгликоль.
В одном воплощении основание представляет собой неорганическое основание или органическое основание. В одном воплощении основание представляет собой карбонат, бикарбонат или алкоксид металла группы IA или группы IIA, например карбонат калия, трет-бутоксид калия или бикарбонат натрия. В одном воплощении основание представляет собой, например, затрудненный третичный амин, такой как N,-диизопропилэтиламин, триэтиламин (TEA) или диметиламинопиридин (DMAP). В одном воплощении основание представляет собой карбонат калия.
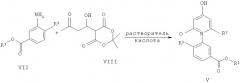
Получение соединения формулы V - Способ 2
В одном воплощении настоящего изобретения предложен способ получения соединения формулы V, включающий контактирование соединения формулы VII с соединением формулы VIII.
где R1 представляет собой C1-C6алкил или арил; R2 представляет собой H, галогено или C1-C6алкил; и R3 представляет собой галогено или C1-C6алкил.
Обычно соединение формулы VII приводят в контакт с соединением формулы VIII в присутствии по меньшей мере одного растворителя и кислоты.
Способ обычно осуществляют при температуре от приблизительно 0°C до приблизительно 250°C. В одном воплощении температура составляет от приблизительно 5°C до приблизительно 100°C. В другом воплощении температура составляет от приблизительно 15°C до приблизительно 60°C.
Способ обычно осуществляют в течение периода времени от приблизительно 0,01 часа до приблизительно 10 часов. В одном воплощении период времени составляет от приблизительно 0,5 часа до приблизительно 7 часов. В другом воплощении период времени составляет от приблизительно 1 часа до приблизительно 7 часов.
Растворитель представляет собой полярный растворитель или неполярный растворитель. Примеры пригодных полярных растворителей включают уксусную кислоту, низший алкил-карбоновую кислоту и диметилформамид. Примеры пригодных неполярных растворителей включают диоксан, тетрагидрофуран, метил-трет-бутиловый эфир, диэтиловый эфир, толуол и дихлорметан. В одном воплощении растворитель представляет собой диоксан, тетрагидрофуран, метил-трет-бутиловый эфир, диэтиловый эфир, уксусную кислоту или низший алкил-карбоновую кислоту, дихлорметан или диметилформамид. В одном воплощении растворитель представляет собой диоксан, тетрагидрофуран, уксусную кислоту или дихлорметан. В одном воплощении растворитель представляет собой диоксан.
В одном воплощении кислота представляет собой органическую кислоту. В другом воплощении органическая кислота представляет собой низший алкил- или замещенный низший алкил-карбоновую кислоту либо сульфоновую кислоту, такую как п-толуолсульфоновая кислота или метансульфоновая кислота. В одном воплощении сульфоновая кислота представляет собой метансульфоновую кислоту.
Синтез соединения Формулы VIII
Способ получения соединения формулы VIII включает контактирование кислоты Мелдрума (Meldrum) с дикетеном в присутствии основания и по меньшей мере одного растворителя.
Следующая процедура сходна с процедурой, описанной в литературе (Kang, J.; Kim, Y.; Park, M.; Lee, C; Kim, W. Synthetic Communications (1984), 14 (3), 265-9).
Способ обычно осуществляют при температуре от приблизительно 0°С до приблизительно 100°С. В одном воплощении температура составляет от приблизительно 5°C до приблизительно 50°C. В другом воплощении температура составляет от приблизительно 20°C до приблизительно 25°C.
Способ обычно осуществляют в течение периода времени от приблизительно 0,01 часа до приблизительно 25 часов. В одном воплощении период времени составляет от приблизительно 0,5 часа до приблизительно 10 часов. В другом воплощении период времени составляет от приблизительно 1 часа до приблизительно 5 часов.
В одном воплощении основание представляет собой органическое или неорганическое основание. Примеры пригодных неорганических оснований включают карбонаты, бикарбонаты или алкоксиды металлов группы IA или IIA, такие как карбонат калия, трет-бутоксид калия и бикарбонат натрия. Примеры пригодных органических оснований включают триэтиламин (TEA), диметиламинопиридин (DMAP) и N,N-диизопропилэтиламин. В одном воплощении основание представляет собой карбонат калия, TEA или DMAP. В другом воплощении основание представляет собой TEA.
Стадия 1 - Галогенирование
В одном воплощении настоящего изобретения предложен способ получения соединения формулы IV, включающий контактирование соединения формулы V с галогенирующим реагентом.
где R1 представляет собой C1-C6алкил или арил; R2 представляет собой H, галогено или C1-C6алкил; и R3 представляет собой галогено или C1-C6алкил.
Обычно соединение формулы V приводят в контакт с галогенирующим реагентом в присутствии по меньшей мере одного растворителя.
Способ обычно осуществляют при температуре от приблизительно - 40°C до приблизительно 50°C. В одном воплощении температура составляет от приблизительно -15°C до приблизительно 20°C. В другом воплощении температура составляет от приблизительно -10°C до приблизительно 10°C.
Способ обычно осуществляют в течение периода времени от приблизительно 0,5 часа до приблизительно 10 часов. В одном воплощении период времени составляет от приблизительно 1,5 часов до приблизительно 5 часов. В одном воплощении период времени составляет от приблизительно 1 часа до приблизительно 3 часов.
В одном воплощении растворитель представляет собой полярный растворитель. Пригодные примеры включают ацетонитрил, уксусную кислоту или уксусную кислоту, содержащую сорастворитель, такой как вода или низшие алкиловые спирты. В одном воплощении растворитель представляет собой, например, ацетонитрил, уксусную кислоту или уксусную кислоту, содержащую сорастворитель, такой как вода или низшие алкиловые спирты. В одном воплощении растворитель представляет собой раствор уксусная кислота/вода. В другом воплощении растворитель представляет собой ацетонитрил.
Галогенирующий реагент может представлять собой чистое вещество или раствор. В одном воплощении галогенирующий реагент представляет собой бромирующий или хлорирующий реагент. В одном воплощении бромирующий или хлорирующий реагент представляет собой, например, фенилтриэтиламмония трибромид, 1,3-дибром-5,5-диметилгидантоин, N-бромсукцинимид, пиридиния бромид, пербромид, бром, дибромтрифенилфосфоран, хлорид брома, N-бромгидантоин, N-бромкапролактам, N-хлорсукцинимид, гипохлорит натрия, хлор, сульфурилхлорид, бромид меди (II), пентахлорид фосфора или трет-бутилгипохлорит. В одном воплощении бромирующий или хлорирующий реагент представляет собой 1,3-дибром-5,5-диметилгидантоин, бром, хлорид брома или хлор. В другом воплощении бромирующий реагент представляет собой бром. В другом воплощении бромирующий реагент представляет собой 1,3-дибром-5,5-диметилгидантоин.
Галогенирование может быть осуществлено в присутствии кислоты. В одном воплощении кислота является органической или неорганической кислотой. Примеры пригодных кислот включают тетрафторборную кислоту, бромистоводородную кислоту, соляную кислоту, фтористофодородную кислоту, серную кислоту и фосфорную кислоту. В одном воплощении кислота представляет собой тетрафторборную кислоту.
Стадия 2 - Бензилирование
В одном воплощении настоящего изобретения предложен способ получения соединения формулы III, включающий контактирование соединения формулы IV с замещенным бензилгалогенидом.
где X1, X2, X3, X4, X5 и X6 независимо представляют собой H, галогено или C1-C6алкил; R1 представляет собой C1-C6алкил алкил или арил; R2 представляет собой H, галогено или C1-C6алкил; и R3 представляет собой галогено или C1-C6алкил.
Обычно соединение формулы IV приводят в контакт с замещенным бензилгалогенидом в присутствии по меньшей мере одного растворителя и основания.
Способ обычно осуществляют при температуре от приблизительно 0°C до приблизительно 200°C. В одном воплощении температура составляет от приблизительно 15°C до приблизительно 100°C. В другом воплощении температура составляет от приблизительно 25°C до приблизительно 75°C.
Способ обычно осуществляют в течение периода времени от приблизительно 0,5 часа до приблизительно 40 часов. В одном воплощении период времени составляет от приблизительно 1 часа до приблизительно 10 часов. В другом воплощении период времени составляет от приблизительно 1 часа до приблизительно 5 часов.
В одном воплощении замещенный бензилгалогенид представляет собой:
где halo представляет собой хлорид, бромид или иодид; и X2, X3, X4, X5 и X6 независимо представляют собой H, галогено или C1-C6алкил. В одном воплощении галогено-замещенный бензилгалогенид представляет собой, например, 2,4-дифторбензилбромид, 2,3-дифторбензилбромид, 2,5-дифторбензилбромид, 2,4-дифторбензилхлорид, 2,3-дифторбензилхлорид или 2,5-дифторбензилхлорид. В другом воплощении галогено-замещенный бензилгалогенид представляет собой 2,4-дифторбензилхлорид. В другом воплощении галогено-замещенный бензилгалогенид представляет собой 2,4-дифторбензилбромид.
В одном воплощении растворитель представляет собой полярный апротонный растворитель. В одном воплощении полярный апротонный растворитель представляет собой, например, N,N-диметилформамид (DMF), N,N-диметилацетамид (DMAC), N-метилпирролидинон (NMP), 1,3-диметилимидазолидинон (DMI) или 1,3-диметил-3,4,5,6-тетрагидро-2(1H)-пиримидинон (DMPU). В другом воплощении полярный апротонный растворитель представляет собой N,N-диметилформамид. В другом воплощении растворитель представляет собой N-метилпирролидинон.
В одном воплощении основание представляет собой органическое или неорганическое основание. Примеры пригодных неорганических оснований включают карбонаты, бикарбонаты или алкоксиды металлов группы IA или IIA, такие как карбонат калия, трет-бутоксид калия и бикарбонат натрия. Примеры пригодных органических оснований включают триэтиламин (TEA), диметиламинопиридин (DMAP) и N,N-диизопропилэтиламин. В одном воплощении основание представляет собой карбонат калия, трет-бутоксид калия или бикарбонат натрия. В другом воплощении основание представляет собой карбонат калия.
Стадия 3 - Гидролиз
В одном воплощении настоящего изобретения предложен способ получения соединения формулы II, включающий контактирование соединения формулы III с основанием.
где X1, X2, X3, X4, X5 и X6 независимо представляют собой H, галогено или C1-C6алкил; R1 представляет собой C1-C6алкил или арил; R2 представляет собой H, галогено или C1-C6алкил; и R3 представляют собой галогено или C1-C6алкил.
Обычно соединение формулы III приводят в контакт с основанием в присутствии по меньшей мере одного растворителя.
Способ обычно осуществляют при температуре от приблизительно 10°C до приблизительно 100°C. В одном воплощении температура составляет от приблизительно 20°C до приблизительно 80°C. В другом воплощении температура составляет от приблизительно 40°C до приблизительно 75°C.
Способ обычно осуществляют в течение периода времени от приблизительно 0,5 часа до приблизительно 40 часов. В одном воплощении период времени составляет от приблизительно 1 часа до 10 часов. В другом воплощении период времени составляет от приблизительно 1 часа до приблизительно 5 часов.
В одном воплощении основание представляет собой неорганическое основание. Пригодные примеры неорганических оснований включают основание в виде гидроксида металла группы IA или IIA или основание в виде карбоната, такое как гидроксид калия, лития, цезия и натрия. В одном воплощении основание представляет собой гидроксид калия, лития, цезия или натрия. В одном воплощении основание представляет собой гидроксид натрия.
В одном воплощении растворитель представляет собой единственный растворитель. В другом воплощении растворитель содержит смесь двух или более растворителей. В одном воплощении растворитель представляет собой, например, воду со смешивающимся с водой органическим сорастворителем, таким как низшие алкиловые спирты, тетрагидрофуран (THF), ацетон, ацетонитрил, N,N-диметилформамид или диметилсульфоксид (DMSO), или без него. В одном воплощении растворитель представляет собой воду. В одном воплощении растворитель содержит ацетонитрил и воду.
В другом воплощении соединение формулы III может быть подвергнуто гидролизу посредством протеолитического фермента или нуклеофила в неводных условиях.
Стадия 4 - Амидирование
В одном воплощении настоящего изобретения предложен способ получения соединения формулы I, включающий взаимодействие соединения формулы II с соответствующим активирующим агентом и затем контактирование полученной смеси с соответствующим первичным или вторичным амином с получением соединения формулы I.
где X1, X2, X3, X4, X5 и X6 независимо представляют собой H, галогено или C1-C6алкил; R2 представляет собой H, галогено или C1-C6алкил; R3 представляет собой галогено или C1-C6алкил; и R4 представляет собой H или C1-C6алкил; R5 представляет собой H, C1-C6алкил или арил; либо R4, R5 и атом азота, к которому они присоединены, образуют морфолинильное, тиоморфолинильное, пиперидинильное, пирролидинильное или пиперазинильное кольцо, которое возможно замещено 1 или 2 группами, независимо представляющими собой C1-C4алкил, C1-C4алкокси, гидрокси, гидрокси C1-C4алкил, C1-C4дигидроксиалкил или галоген.
Обычно соединение формулы II приводят в контакт с активирующим агентом в присутствии по меньшей мере одного растворителя и затем полученную смесь приводят в контакт с амином.
Способ обычно осуществляют при температуре от приблизительно 0°С до приблизительно 50°С. В одном воплощении температура составляет от приблизительно 1°С до приблизительно 25°С. В другом воплощении температура составляет от приблизительно 5°С до приблизительно 15°С.
Способ обычно осуществляют в течение периода времени от приблизительно 0,01 часа до приблизительно 35 часов. В одном воплощении период времени составляет от приблизительно 0,5 часа до приблизительно 10 часов. В другом воплощении период времени составляет от приблизительно 1 до приблизительно 5 часов.
Активирующий агент представляет собой реагент, который активирует карбоновую кислоту. Активирование означает увеличение электрофильности карбоновой кислоты и тем самым увеличение ее реакционноспособности в отношении нуклеофильной атаки. В одном воплощении активирующий агент представляет собой карбонилдиимидазол, дициклогексилкарбодиимид, тионилхлорид, оксалилхлорид, оксихлорид фосфора, трихлорид фосфора, пентахлорид фосфора, фенилтриэтиламмонйя трибромид, пиридиния бромид, пербромид, бром, дибромтрифенилфосфоран, хлорид брома, N-бромгидантоин или N-бромкапролактам. В одном воплощении активирующий агент представляет собой карбонилдиимидазол, дициклогексилкарбодиимид, тионилхлорид, оксалилхлорид, оксихлорид фосфора, трихлорид фосфора, пентахлорид фосфора. В одном воплощении активирующий реагент представляет собой оксалилхлорид. В другом воплощении активирующий реагент представляет собой карбонилдиимидазол.
Растворитель представляет собой полярный растворитель или неполярный растворитель. Пригодные примеры полярных растворителей включают диметилформамид, уксусную кислоту и низший алкил-карбоновую кислоту. Примеры пригодных неполярных растворителей включают дихлорэтан, тетрагидрофуран, диоксан, метил-трет-бутиловый эфир, диэтиловый эфир и толуол. В одном воплощении растворитель представляет собой, например, диметилформамид, дихлорэтан, тетрагидрофуран, диоксан, метил-трет-бутиловый эфир или толуол. В одном воплощении растворитель представляет собой диметилформамид, дихлорэтан, тетрагидрофуран или диоксан. В другом воплощении растворитель представляет собой дихлорэтан. В одном воплощении растворитель представляет собой диметилформамид.
В одном воплощении амин представляет собой HNR4R5, где R4 представляет собой H или C1-C6алкил; и R5 представляет собой H, C1-C6алкил или арил; либо R4, R5 и атом азота, к которому они присоединены, образуют морфолинильное, тиоморфолинильное, пиперидинильное, пирролидинильное или пиперазинильное кольцо, которое возможно замещено 1 или 2 группами, независимо представляющими собой C1-C4алкил, C1-C4алкокси, гидрокси, гидрокси C1-C4алкил, C1-C4дигидроксиалкил или галоген. В одном воплощении R4 представляет собой H. В одном воплощении R5 представляет собой C1-C6алкил. В одном воплощении амин представляет собой метиламин. Обычно амин перед добавлением объединяют с растворителем. В одном воплощении растворитель представляет собой метанол, этанол, тетрагидрофуран или воду. В другом воплощении растворитель представляет собой метанол, тетрагидрофуран или воду. В одном воплощении растворитель представляет собой тетрагидрофуран. В одном воплощении амин представляет собой раствор метиламина в тетрагидрофуране.
Для содействия реакции возможно может быть использована кислота. В одном воплощении кислота представляет собой органическую или неорганическую кислоту. Примеры пригодных кислот включают уксусную кислоту, лимонную кислоту, HCl и серную кислоту. В одном воплощении кислота представляет собой уксусную кислоту, лимонную кислоту, HCl или серную кислоту. В одном воплощении кислота представляет собой HCl, уксусную кислоту или серную кислоту. В одном воплощении кислота представляет собой HCl.
Соединения формулы I могут быть выделены посредством фильтрования либо стандартными методами экстракции или выпаривания.
Специалисты в данной области могут принимать во внимание альтернативу для получения этого продукта с использованием промежуточного соединения, представляющего собой смешанный ангидрид, такого как промежуточное соединение, представляющее собой ангидрид низший алкил-карбоновой кислоты, или промежуточное соединение в виде ацилимидазола вместо промежуточного соединения в виде хлорангидрида кислоты. Промежуточное соединение в виде смешанного ангидрида может быть синтезировано с использованием типичного алкилхлорформиата в присутствии типичного затрудненного аминного основания. Промежуточное соединение в виде ацилимидазола может быть синтезировано с использованием такого реагента, как карбонилдиимидазол.
Последовательность стадий может быть перегруппирована несколькими возможными путями. В одном воплощении перед стадией бензилирования могут быть проведены гидролиз и амидирование.
В другом воплощении настоящего изобретения предложен способ получения энантимерно обогащенной смеси или исключительно единственного энантиомера соединения формулы I, следуя Пути 2. Путь 2 в общем виде представлен на Схеме 2.
,
где X1, X2, X3, X4, X5 и X6 независимо представляют собой H, галогено или C1-C6алкил; R1 представляет собой C1-C6алкил или арил; R2 представляет собой H, галогено или C1-C6алкил; R3 представляет собой галогено или C1-C6алкил; и R4 представляет собой H или C1-C6алкил; R5 представляет собой H, C1-C6алкил или арил; либо R4, R5 и атом азота, к которому они присоединены, образуют морфолинильное, тиоморфолинильное, пиперидинильное, пирролидин