2'-броманилид-3-n,n-диэтиламинопропановой кислоты нитрат, 2'-броманилид-3-n,n,n-триэтиламинопропановой кислоты йодид, проявляющие антиаритмическую активность
Иллюстрации
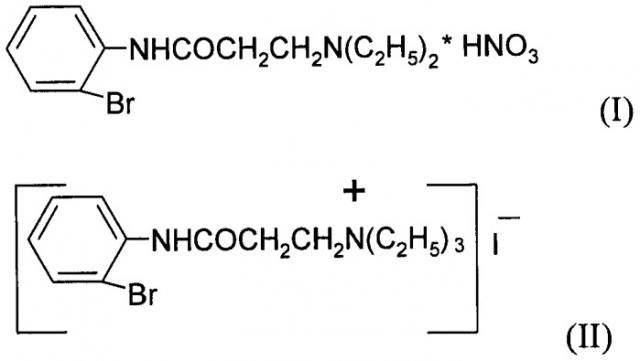
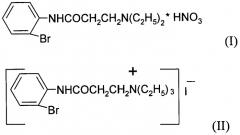
Показать всеНастоящее изобретение относится к 2'-броманилид-3-N,N-диэтиламинопропановой кислоты нитрату (I) и 2'-броманилид-3-N,N,N-триэтиламинопропановой кислоты иодиду (II),
обладающим антиаритмической активностью. Заявляемые соединения по антиаритмической активности превосходят препарат сравнения лидокаин при практически равной токсичности. 1 табл.
Реферат
Заявляемые соединения относятся к области органической химии, классу ариламидов аминокарбоновых кислот, а именно новым биологически активным 2'-броманилиду-3-N,N-диэтиламинопропановой кислоты нитрату (I) и 2'-броманилиду-3-N,N,N-триэтиламинопропановой кислоты иодиду (II) формул
которые могут найти применение в качестве лекарственных антиаритмических препаратов.
В качестве эталона сравнения антиаритмического действия взят известный препарат лидокаин [Машковский М.Д. Лекарственные средства: В 2 т. - 14-е изд., перераб., испр. и доп. - М.: ООО «Издательство Новая Волна», 2000].
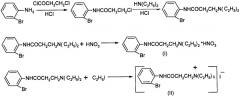
Целью предлагаемого изобретения является получение новых не описанных ранее 2'-броманилида-3-N,N-диэтиламинопропановой кислоты нитрата и 2'-броманилида-3-N,N,N-триэтиламинопропановой кислоты иодида, обладающих антиаритмическим действием. Поставленная цель достигается путем ацилирования 2'-броманилина хлорангидридом 3-хлорпропановой кислоты с последующим аминированием 2'-броманилида 3-хлорпропановой кислоты диэтиламином и дальнейшим взаимодействием 2'-броманилида-3-N,N-диэтиламинопропановой кислоты с азотной кислотой (I) и с йодэтаном (II) по схеме:
Синтез 2'-броманилида-3-N,N-диэтиламинопропановой кислоты осуществлен по аналогии с ранее описанной методикой [Кудряшова Н.И., Ремизов А.Л., Хромов-Борисов Н.В. Жур. общ. химии, Т.29, 1240-1244 (1959)].
Методика получения 2' -броманилида-3-N,N-диэтиламинопропановой кислоты нитрата. К 2'-броманилида-3-N,N-диэтиламинопропановой кислоты (маслянистая жидкость) 4,54 г (0,02 моль) при помешивании добавляют порциями 1,26 г (0,02 моль) азотной кислоты и 10 мл этанола. Реакция протекает с выделением тепла (экзотермическая). Сразу в ходе реакции выделяется хлопьевидный осадок. Реакционную массу охлаждают до комнатной температуры. Выпавший при этом осадок 2'-броманилида-3-N,N-диэтиламинопропановой кислоты нитрата отфильтровывают и высушивают при комнатной температуре до постоянного веса, перекристаллизовывают из ацетона, т.пл. 112-114°C, выход 4,4 г (75,86%).
Методика получения 2'-броманилида-3-N,N,N-триэтиламинопропановой кислоты иодида. К 2'-броманилида-3-N,N-диэтиламинопропановой кислоты (маслянистая жидкость) 9,08 г (0,04 моль) добавляют 3,23 мл (0,04 моль) йодэтана и 30 мл ацетона. Реакционную смесь кипятят в течение 10 часов при температуре 90-110°С. Выпавший осадок 2'-броманилида-3-N,N,N-триэтиламинопропановой кислоты иодида отфильтровывают и высушивают на воздухе до постоянного веса. Перекристаллизовывают из гексана, т.пл. 240-242°C, выход 11,42 г (74,54%).
Заявляемые соединения представляют собой белые кристаллические вещества, растворимые в воде, этаноле, ДМФА, не растворимые в ацетоне, гексане, бензоле. В спектре ЯМР 1Н (BS-56A, (100 МГц) DMSO, внутренний стандарт - ГМДС) соединения (I) имеются: триплет шести протонов СН3-группы этильного радикала в области 1,2-1,4 м.д., квадруплет четырех протонов СН2-группы этильного радикала при 3,1-3,3 м.д., триплет четырех протонов СН2-группы при 3,4-3,7 м.д., мультиплет четырех протонов ароматического кольца ариламида в области 7,0-7,4 м.д., синглет протона азотной кислоты при 8,5 м.д., синглет протона-NH-группы при 9,8 м. д.
В спектре ЯМР 1Н (BS-56A, (100 МГц) DMSO, внутренний стандарт - ГМДС) соединения (II) имеются: триплет девяти протонов СН3-группы этильного радикала в области 1,1-1,4 м.д, квадруплет шести протонов СН2-группы этильного радикала при 3,1-3,3 м.д., триплет четырех протонов СН2-группы при 3,1-3,3 м.д., мультиплет четырех протонов ароматического кольца ариламида в области 6,9-7,3 м.д., синглет протона-NH-группы при 9,6 м.д.
Исследование биологической активности
Острую токсичность при внутривенном введении определяли на белых нелинейных мышах массой 18-24 г. Исследуемое вещество и препарат сравнения вводили в хвостовую вену в виде водного раствора из расчета 0,1 мл на 10 г массы животного в возрастающих дозах. Результаты обрабатывали по Прозоровскому с вычислением средней смертельной дозы (ЛД50) при Р<0,05 [Прозоровский В.В., Прозоровская М.П., Демченко В.М. Фармакол. токсикол., Т.41, №4, С. 497-502 (1978)].
Соединение I, II исследовали на наличие антиаритмической активности. Опыты проводили на белых мышах обоего пола массой 18-24 г. Антиаритмическую активность изучали на модели аритмии, вызванной внутривенным введением 3%-ного раствора хлорида кальция в дозе 280 мг/кг. Заявляемое вещество вводили за 2 мин до воспроизведения аритмии. Эффект оценивали по способности предупреждать смертельные нарушения сердечного ритма [Горбунова В.В., Горбунов Н.П. Фармакол. токсикол., №3, С.48-50 (1983)].
Результаты острой токсичности, антиаритмической активности, антиаритмический индекс заявляемых соединений и аналога по структуре представлены в таблице.
| Таблица | |||
| Соединение | ЛД50, мг/кг | ЭД50, мг/кг | Антиаритмический индекс ЛД50/ЭД50 |
| I | 36,8 | 6,5 | 5,7 |
| (26,0-50,0) | (5,8-8,0) | ||
| II | 32,5 | 4,5 | 7,2 |
| (26,0-40,0) | (3,9-5,0) | ||
| Лидокаин | 39,3 | 7,7 | 5,1 |
| (34,2-44,5) | (5,9-9,4) |
Как видно из таблицы, заявляемые соединения при практически равной токсичности проявляют выраженную антиаритмическую активность, превосходя аналог по структуре.
Таким образом, 2'-броманилид-3-N,N-диэтиламинопропановой кислоты нитрат и 2'-броманилида-3-N,N,N-триэтиламинопропановой кислоты иодид проявляют выраженное антиаритмическое действие при меньшей токсичности. Следовательно, заявляемые соединения (I), (II) могут найти применение в медицине в качестве антиаритмического лекарственного средства.
2'-Броманилид-3-N,N-диэтиламинопропановой кислоты нитрат (I), 2'-броманилид-3-N,N,N-триэтиламинопропановой кислоты йодид (II) обладающие антиаритмической активностью.