Аминоалкиламидометилзамещенные производные 2-(4-сульфониламино)-3-гидрокси-3,4-дигидро-2н-хроман-6-ила и лекарственные средства, содержащие эти соединения
Иллюстрации
Показать всеИзобретение относится к соединениям общей формулы I,
в которой R1 обозначает С1-С4-алкил; R2 обозначает С1-С4-алкил; R3 обозначает фенил, который необязательно содержит 1-3 любых заместителя, выбранных из группы, включающей галоген, C1-С6-алкил и С1-С4-алкоксигруппу; R4 обозначает водород; C1-С6-алкил или С3-С7-циклоалкил-С1-C4-алкил, R5 обозначает водород; и R6 обозначает водород; и R7 обозначает водород; и R8 обозначает водород; и R9 обозначает С1-С4-алкил; и R10 обозначает C1-С6-алкил, фенил-С0-С4-алкил или пиридинил-С0-С4-алкил; при условии, что R10 не обозначает фенил, если R5 и R9 совместно образуют С2-алкилен; или R5 и R9 совместно образуют C1-С3-алкилен; или R6 и R9 совместно образуют C1-С3-алкилен; или R7 и R9 совместно образуют С2-С4-алкилен или C1-С3-алкиленоксигруппу; или R8 и R9 совместно образуют С3-С5-алкилен; или R9 и R10 совместно образуют С4-С6-алкилен; и n равно 0 или 1, или его любые физиологически совместимые соли. Кроме того, изобретение относится к фармацевтической композиции, содержащей соединения формулы I и предназначенной для лечения сердечно-сосудистых заболеваний, к применению этих соединений, для приготовления лекарственного средства, а также к способу получения соединения формулы I. Технический результат: получены и описаны новые соединения, обладающие сердечно-сосудистой активностью. 7 н. и 9 з.п. ф-лы, 5 табл.
Реферат
Настоящее изобретение относится к новым аминоалкиламидометилзамещенным производным 2-(4-сульфониламино)-3-гидрокси-3,4-дигидро-2H-хромен-6-ила, блокирующим калиевые каналы, в частности, воздействующих на сердечно-сосудистую систему, а также к лекарственным средствам, содержащим эти соединения. Кроме того, настоящее изобретение относится к способу получения новых соединений и к промежуточным продуктам этого способа.
Инданы, бензопираны и аналоги таких соединений, которые блокируют калиевые каналы и в особенности благоприятно воздействуют на сердечно-сосудистую систему, уже известны из описания WO 00/12077 А1.
В документе WO 00/58300 раскрыты производные хромана, которые применимы в качестве лекарственных средств, в особенности антиаритмически эффективных лекарственных средств.
В опубликованной заявке WO 2005/037780 описаны новые амидометилзамещенные производные 2-(4-сульфониламино)-3-гидрокси-3,4-дигидро-2H-хромен-6-ила, которые блокируют калиевые каналы, в частности, воздействующие на сердечно-сосудистую систему, а также лекарственные средства, содержащие эти соединения.
В основу настоящего изобретения положена задача получения новых активных соединений, в особенности предназначенных для лечения сердечно-сосудистых заболеваний, предпочтительно - аритмий сердца, которые отличаются высокой эффективностью при хорошей совместимости и в случае антиаритмического воздействия также заметным избирательным воздействием на предсердия.
Согласно изобретению неожиданно было установлено, что предлагаемая в настоящем изобретении группа новых аминоалкиламидометилзамещенных производных 2-(4-сульфониламино)-3-гидрокси-3,4-дигидро-2H-хромен-6-ила способна блокировать калиевые каналы и пригодна для лечения сердечно-сосудистых заболеваний, предпочтительно - для лечения аритмий сердца. Соединения, предлагаемые в настоящем изобретении, отличаются высокой эффективностью при хорошей совместимости и в случае антиаритмического воздействия также заметным избирательным воздействием на предсердия. Кроме того, соединения, предлагаемые в настоящем изобретении, характеризуются относительно хорошей биологической доступностью. Наряду с этим соединения, предлагаемые в настоящем изобретении, обладают такими характеристиками, которые позволяют ожидать дополнительного воздействия на иммунную систему.
Объектом настоящего изобретения являются новые аминоалкиламидометилзамещенные производные 2-(4-сульфониламино)-3-гидрокси-3,4-дигидро-2H-хромен-6-ила общей формулы I,
в которой
R1 обозначает С1-С4-алкил;
R2 обозначает С1-С4-алкил;
R3 обозначает фенил, который необязательно содержит 1-3 любых заместителя, выбранных из группы, включающей галоген, C1-С6-алкил и С1-С4-алкоксигруппу;
R4 обозначает водород; C1-С6-алкил или С3-С7-циклоалкил-C1-С4-алкил,
R5 обозначает водород; и
R6 обозначает водород; и
R7 обозначает водород; и
R8 обозначает водород; и
R9 обозначает C1-С4-алкил; и
R10 обозначает C1-С6-алкил; фенил-С0-С4-алкил или пиридинил-С0-С4-алкил; при условии, что R10 не обозначает фенил, если R5 и R9 совместно образуют C2-алкилен; или
R5 и R9 совместно образуют С1-С3-алкилен; или
R6 и R9 совместно образуют С1-С3-алкилен; или
R7 и R9 совместно образуют С2-С4-алкилен или C1-С3-алкиленоксигруппу; или
R8 и R9 совместно образуют С3-С5-алкилен; или
R9 и R10 совместно образуют С4-С6-алкилен; и
n равно 0 или 1,
или их любые физиологически совместимые соли и/или сольваты.
Кроме того, объектом настоящего изобретения являются фармацевтические композиции, содержащие соединения формулы I. Кроме того, объектом настоящего изобретения является способ получения соединений формулы I и промежуточные продукты этого способа.
Если в соединениях формулы I или в других соединениях, описанных в контексте настоящего изобретения, заместители представляют собой C1-С4-алкил или C1-С6-алкил или содержат его, то все они могут обладать линейной или разветвленной цепью.
Все R1 и R2 предпочтительно обозначают метил.
R3 предпочтительно обозначает фенил, который необязательно 1 или 2 раза замещен галогеном, C1-С4-алкилом или С1-С4-алкоксигруппой. Особенно предпочтительно, если R3 обозначает фенил, однократно замещенный С1-С4-алкилом. Если R3 обозначает галогензамещенный фенил, то галогенами могут являться фтор, хлор, бром или йод. Особенно предпочтительно, если R3 обозначает 4-этилфенил.
R4 предпочтительно обозначает водород; С1-С6-алкил или циклопропил-C1-С4-алкил, предпочтительно - циклопропилметил. Если R4 обозначает С1-С6-алкил, то предпочтительно, если он является разветвленным и более предпочтительно, если он обозначает неопентил, 2,2-диметилбутил, 2-этилбутил, 3-метилбутил или 2-метилпропил.
Предпочтительно, если R5 и R9 совместно образуют C1-С3-алкилен.
R10 предпочтительно обозначает C1-С4-алкил; бензил или фенил. Более предпочтительно, если R10 обозначает фенил-С1-С4-алкил или пиридинил-С1-С4-алкил, например, пиридинилметил, в особенности 2-пиридинилметил, 3-пиридинилметил или 4-пиридинилметил; или R9 и R10 совместно образуют С4-С6-алкилен.
Особенно предпочтительные соединения формулы I выбраны из группы, включающей N-{6-[2-(4-бензилпиперазин-1-ил)-2-оксоэтил]-3-гидрокси-2,2-диметилхроман-4-ил}-4-этилбензолсульфонамид; 4-этил-N-{3-гидрокси-2,2-диметил-6-[2-оксо-2-(4-пиридин-3-илметилпиперазин-1-ил)-этил]-хроман-4-ил}-бензолсульфонамид; 4-этил-N-{3-гидрокси-2,2-диметил-6-[2-оксо-2-(4-пиридин-2-илметилпиперазин-1-ил)-этил]-хроман-4-ил}-бензолсульфонамид и 4-этил-N-{3-гидрокси-2,2-диметил-6-[2-оксо-2-(4-пиридин-4-илметилпиперазин-1-ил)-этил]-хроман-4-ил}-бензолсульфонамид. 4-Этил-N-{3-гидрокси-2,2-диметил-6-[2-оксо-2-(4-пиридин-4-илметилпиперазин-1-ил)-этил]-хроман-4-ил}-бензолсульфонамид являются особенно предпочтительным соединением формулы I.
В контексте настоящего изобретения новые соединения формулы I получают с помощью
а) реакции соединения общей формулы II,
в которой R1, R2, R4, R5, R6, R7, R8, R9, R10 и n имеют указанные выше значения, с соединением общей формулы III,
в которой R3 имеет указанные выше значения и Х означает способную к отщеплению удаляемую группу,
b) реакции соединения общей формулы IV
в которой R1, R2, R3 и R4 имеют указанные выше значения, с соединением общей формулы V,
в которой R5, R6, R7, R8, R9, R10 и n имеют указанные выше значения.
Реакцию по варианту а) способа можно провести по обычной мокрой химической методике в органическом растворителе, который является инертным при условиях проведения реакции, предпочтительно - в дипольном апротонном растворителе, таком как дихлорметан, или в смеси таких растворителей и в присутствии основания. Подходящими основаниями являются ненуклеофильные органические азотистые основания, такие как третичные низш. алкиламины, например триэтиламин. В качестве растворителей также можно использовать взятые в избытке. При необходимости реакцию можно катализировать с помощью известного реагента сочетания, такого как 4-N,N-диметиламинопиридин (= ДМАП). Подходящая температура для проведения реакции находится в диапазоне от комнатной температуры до 80°С, например 65°С. Подходящее давление для проведения реакции находится в диапазоне от нормального давления до примерно 200 бар, например, равно 180 бар. Если использующееся соединение формулы III является жидким, то может оказаться предпочтительным удаление растворителя из реакционной смеси после прибавления соединения формулы III к соединению формулы II, растворенному в растворителе, проводимое известным образом, например, при пониженном давлении. Если в исходных соединениях формулы II R4 обозначает водород, то целесообразно использовать эквимолярные количества соединения формулы III. Обычно в соединениях формулы III в качестве отщепляющейся группы Х используют галоген, предпочтительно - хлор, бром или йод. Кроме того, реакцию соединения формулы II с соединением формулы III также можно проводить по известным методикам в твердой фазе, предпочтительно - на реакционноспособной смоле, такой как аминометилполистирол (АМПС). Этот вариант реакции предпочтительно можно использовать для получения небольших количеств вещества, например, порядка от 1 до 10 ммолей. Если синтез проводят в твердой фазе, то в качестве основания предпочтительно можно использовать легко отфильтровывающееся основание, такое как известный метилпиперидин на полимерной подложке (= ПП метилпиперидин) или пиперидин на полимерной подложке (= ПП пиперидин). Подходящая температура проведения реакции при твердофазном синтезе составляет от 10 до 40°С, предпочтительной является комнатная температура. Соединения формулы I можно выделить из реакционной смеси по известным методикам и при необходимости очистить по известным методикам. Если в соединениях формулы I группы R9 и/или R10 не являются частью ароматической или гетероароматической кольцевой системы, то возможно образование соли. Таким образом, подходящие свободные соединения формулы I можно превратить в их физиологически совместимые соли или соли соединений формулы I можно превратить в свободные соединения формулы I.
Реакцию по варианту b) способа можно провести по методике, применяющейся для аминоацилирования. В качестве реагентов для ацилирования можно использовать карбоновые кислоты формулы IV или их реакционноспособные производные, такие как галогенангидриды кислот, предпочтительно - хлорангидриды кислот или бромангидриды кислот. Если кислоты формулы IV сами используются в качестве ацилирующих реагентов, то их реакцию с аминами формулы V также можно с успехом проводить в присутствии одного или большего количества известных реагентов сочетания, применяющихся в реакциях аминоацилирования, например, 1,1-карбонилдиимидазол (КДИ); этилхлорформиат; N-гидроксибензотриазол (= ГОБТ); алкилкарбодиимид, например, N'-(3-диметиламинопропил)-N-этилкарбодиимид (= ЭКД) или N,N'-диизопропилкарбодиимид (= ДИК), или циклоалкилкарбодиимид, такой как дициклогексилкарбодиимид. Ацилирование можно проводить в органическом растворителе, который является инертным при условиях проведения реакции при температуре от -30 до +50°С, предпочтительно - при комнатной температуре. Подходящими растворителями являются галогенированные углеводороды, такие как дихлорметан, или циклические простые эфиры, такие как тетрагидрофуран или диоксан или смеси этих растворителей.
Физиологически совместимые соли соединений формулы I представляют собой их обычные соли с неорганическими кислотами, например серной кислотой, фосфорными кислотами или галогенводородными кислотами, предпочтительно - хлористоводородной кислотой; или с органическими кислотами, например, низшими алифатическими монокарбоновыми, дикарбоновыми или трикарбоновыми кислотами, такими как малеиновая кислота, фумаровая кислота, молочная кислота, винная кислота, лимонная кислота; или с сульфоновыми кислотами, например низшими алкансульфоновыми кислотами, такими как метаносульфоновая кислота или трифторметаносульфоновая кислота, или бензолсульфоновыми кислотами, необязательно замещенными по бензольному кольцу галогеном или низш. алкилом, такими как п-толуолсульфоновая кислота. Предпочтительными являются гидрохлориды соединений формулы I.
Соединения формулы II являются новыми соединениями, которые прекрасно подходят для использования в качестве промежуточных продуктов для получения новых фармакологически активных веществ, например, для получения соединений формулы I.
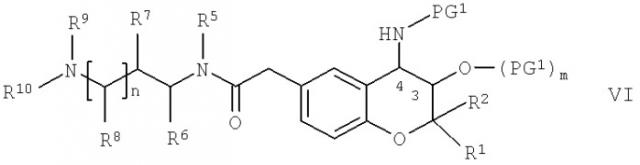
Соединения формулы II, в которой R4 обозначает водород, можно получить по известным методикам путем проводимого в кислых средах отщепления любой содержащейся защитной группы PG1 от соединений общей формулы VI,
в которой R1, R2, R5, R6, R7, R8, R9, R10 и n обладают указанными выше значениями, PG1 обозначает защитную группу аминогруппы, которую можно отщепить в кислых средах, предпочтительно - трет-бутоксикарбонил (= boc), и m равно 0 или 1. Отщепление защитной группы, например, можно проводить путем прибавления кислоты, такой как неорганическая кислота, предпочтительно - хлористоводородная кислота, например, 4 М хлористоводородная кислота, к соединению формулы VI. Кислоту можно растворить в полярном протонном растворителе, таком как диоксан. Если в соединениях формулы VI или любом соединении, содержащем защитные группы PG1 и указанном ниже в настоящем изобретении, m равно 0, то в каждом случае заместителем в положении 3 пиранового кольца является гидроксигруппа.
Подходящие защитные группы PG1 и другие защитные группы, указанные в настоящей заявке, известны в данной области техники и их обычным образом может выбрать специалист в данной области техники, например, из приведенных в публикации T.W.Greene, P.G.M.Wuts Защитных групп in Organic Synthesis, John Wiley & Sons, последнее издание.
Если необходимы соединения формулы I, в которой R4 обозначает C1-С6-алкил или С3-С7-циклоалкил-C1-С4-алкил, то соединение формулы I, в которой R4 обозначает водород, или предшественник соединения формулы I, в которой R4 обозначает водород, а именно, предшественник соединения формулы II или IV, можно алкилировать по известным методикам. Алкилирование предпочтительно можно провести, как аминоалкилирование, проводимое сначала по реакции соединения формулы I, II или IV, в которой R4 в каждом случае обозначает водород, с альдегидом общей формулы VII,
,
в которой R401 обозначает водород, С2-С5-алкил или С3-С7-циклоалкил-С0-С3-алкил, с последующим восстановлением полученного промежуточного имина путем прибавления восстановительного реагента к алкиламину формулы I, II или IV. Подходящими восстановительными реагентами являются комплексные борогидриды, такие как NaBH3CN, или известный борогидрид на полимерной подложке (= ПП-ВН4). В первом варианте реакцию можно провести в полярном протонном органическом растворителе, который является инертным при условиях проведения реакции, предпочтительно - в метаноле, восстановление имина проводят in situ без выделения, в том же растворителе. Подходящая температура проведения реакции для этого варианта находится в диапазоне от комнатной температуры до 60°С, например, равна 50°С. Во втором варианте реакцию соединения формулы I, II или IV, в которой R4 обозначает водород, с альдегидом формулы V с получением промежуточного имина можно провести в дипольном апротонном растворителе, предпочтительно - тетрагидрофуране (= ТГФ). В этом случае для ускорения реакции предпочтительно прибавить каталитическое количество гидрофильного реагента, например, гидрофильного реагента, например, ортоэфира, предпочтительно - триметилортоформиата (= ТМОФ). Затем промежуточный имин можно выделить и растворить в полярном протонном растворителе, указанном выше для первого варианта, и провести восстановление в этом растворителе. Этот второй вариант предпочтительно можно проводить при комнатной температуре.
Соединения формулы VI можно получить по реакции производного карбоновой кислоты общей формулы VIII,
в которой R1, R2, PG1 и m обладают указанными выше значениями, с амином формулы V по известной для аминоацилирования методике, которая подробно описана выше. В качестве ацилирующих реагентов можно использовать карбоновые кислоты формулы VIII или их реакционноспособные производные, такие как галогенангидриды, предпочтительно - хлорангидриды или бромангидриды. Если в качестве ацилирующих реагентов используют сами кислоты формулы VIII, то их реакцию с аминами формулы V также можно с успехом проводить в присутствии одного или большего количества известных реагентов сочетания для реакций аминоацилирования, например, 1,1-карбонилдиимидазола; этилхлорформиата; N-гидроксибензотриазола (= ГОБТ); алкилкарбодиимида, например, N'-(3-диметиламинопропил)-N-этилкарбодиимида (= ЭКД) или N,N'-диизопропилкарбодиимид (= ДИК), или циклоалкилкарбодиимида, такого как дициклогексилкарбодиимид. Ацилирование можно проводить в органическом растворителе, который является инертным при условиях проведения реакции, при температуре от -30 до +50°С, предпочтительно - при комнатной температуре. Подходящими растворителями являются галогенированные углеводороды, такие как дихлорметан, или циклические простые эфиры, такие как тетрагидрофуран или диоксан, или смеси этих растворителей.
Соединения формулы V и соединения формулы VII известны или их можно получить по известным методикам из известных соединений.
Соединения формулы VIII можно получить по известным методикам путем проводимого в щелочных средах отщепления любой содержащейся защитной группы PG2 от соединения общей формулы IX,
в которой R1, R2, PG1 и m обладают указанными выше значениями и PG2 обозначает защитные группы карбоксигрупп, которые можно отщепить в щелочных средах.
PG2 обычно обозначает защитные группы карбоксигрупп, которые можно отщепить в щелочных средах или в кислых средах. Если PG2 обозначает защитные группы карбоксигрупп, которые можно отщепить в щелочных средах, то подходящими являются обладающие линейной цепью или разветвленные C1-C4-алкильные радикалы, предпочтительно - изопропил или метил. Отщепление защитных групп PG2, которые можно отщепить в щелочных средах, обычно можно проводить путем прибавления основания, такого как гидроксид щелочного металла, например гидроксид лития. Подходящими растворителями в этом случае являются вода или полярные протонные органические растворители, такие как ТГФ, или, предпочтительно, смеси таких органических растворителей с водой. Если PG2 обозначает защитные группы карбоксигрупп, которые можно отщепить в кислых средах, то подходящими являются разветвленные C1-С4-алкильные радикалы, предпочтительно - трет-бутил. Отщепление защитных групп PG2, которые можно отщепить в кислых средах, обычно можно проводить путем прибавления кислоты, такой как трифторуксусная кислота. Подходящими растворителями в этом случае являются полярные апротонные органические растворители, такие как толуол или ксилол, или смеси указанных органических растворителей.
Соединения формулы IX можно получить по известным методикам путем защиты производных аминогидроксихромана общей формулы X,
в которой R1, R2 и PG2 обладают указанными выше значениями, приведенными для соединений формулы IX, с помощью защитной группы аминогруппы, которую можно отщепить в кислых средах, предпочтительно - группы boc. При получении защищенных по аминогруппе группой boc соединений формулы Х в качестве реагента можно использовать boc-ангидрид и использовать известные методики. Обычно в этом случае получают смесь содержащего одну защитную группу соединения формулы Х и содержащего две защитные группы соединения формулы X. Обычно продукты находятся в соотношении 2:1 с преобладанием продукта с одной защищенной группой. Обычно последующие реакции получения соединений формулы I, которые являются исходными веществами для получения соединений формулы X, можно выполнять без затруднений, если в каждом случае в качестве исходных веществ использовать смесь защищенных соединений.
Соединения формулы Х можно получить по реакции эпоксида общей формулы XI,
в которой R1, R2 и PG2 обладают указанными выше значениями, приведенными для соединений формулы X, по известным методикам с использованием нуклеофильного органического азотсодержащего соединения, предпочтительно - аммиака в водном растворе, такого как гидроксид аммония, в дипольном протонном растворителе, таком как низш. алкиловый спирт, предпочтительно - этанол. Подходящая температура проведения реакции находится в диапазоне от комнатной температуры до 70°С.
Соединения формулы XI можно получить по реакции соединения общей формулы XII,
в которой R1, R2 и PG2 обладают указанными выше значениями, приведенными для соединений формулы XI, по известным методикам с пероксидом, способным образовывать эпоксид, предпочтительно - с м-хлорпербензойной кислотой (МХПБК), в полярном апротонном органическом растворителе, который является инертным при условиях проведения реакции, предпочтительно - в дихлорметане, и в присутствии основания. Подходящим основанием предпочтительно является водный раствор гидрокарбоната натрия. Реакцию предпочтительно можно проводить при комнатной температуре.
Соединения формулы XII можно получить по реакции соединения общей формулы XIII,
в которой PG21 обладает значением, указанным выше для PG2 в соединениях формулы XII, и предпочтительными альтернативами для PG21 являются неразветвленные низш. алкильные радикалы, такие как C1-С4-алкил, предпочтительно - метил, с соединением общей формулы XIV,
в которой R1 и R2 обладают указанными выше значениями, по известным методикам, и при необходимости с проводимой по известным методикам последующей заменой защитных групп PG21 на любые необходимые защитные группы PG2. Реакцию можно провести в органическом растворителе, который является инертным при условиях проведения реакции, таком как толуол или ксилол, и в присутствии кислоты с отделением воды посредством азеотропной отгонки. Подходящими кислотами являются, например, уксусная кислота или пропионовая кислота. Предпочтительно проводить реакцию с прибавлением катализатора, такого как кислота Льюиса, например, фенилбороновая кислота. Подходящая температура проведения реакции находится в диапазоне от комнатной температуры до температуры кипения растворителя или смеси растворителей, например, равна примерно 120°С.
Соединения формулы XIII и формулы XIV известны или их можно получить по известным методикам из известных соединений.
Соединения формулы IV являются новыми соединениями, которые прекрасно подходят для применения в качестве промежуточных продуктов при получении новых фармакологически активных веществ, например, при получении соединений формулы I.
Соединения формулы IV, в которой R4 обозначает водород, можно получить по известным методикам, например, путем отщепления защитных групп PG3 из соединения общей формулы XV,
в которой R1, R2 и R3 обладают указанными выше значениями и PG2 обозначает защитные группы карбоксигрупп, которые можно отщепить в кислых средах, такие как разветвленные или неразветвленные C1-С4-алкильные радикалы, предпочтительно - трет-бутил.
Соединения формулы XV можно получить по известным методикам, например, по реакции соединения формулы X, в которой PG2 обладает указанным выше значением, приведенным для соединений формулы XV, с соединением формулы III. Реакцию можно провести так, как это описано выше для варианта а) способа для реакции соединения формулы I с соединением формулы III.
Соединения формулы I по меньшей мере по концевым атомам углерода в положениях 3 и 4 пиранового кольца содержат хиральные центры и поэтому могут находиться в разных изомерных формах. Объектами настоящего изобретения являются и изомерно чистые соединения формулы I, и смеси этих изомеров. Оптически активные соединения формулы I можно получить, например, из смесей изомеров соединений формулы I или из смесей изомеров соединений формулы II или IV по известным методикам, например, путем хроматографического разделения на хиральных разделяющих материалах. Смеси изомеров соединений формулы I, в которой R9 и/или R10 не являются частями ароматической или гетероароматической кольцевой системы, или смеси изомеров соединений формулы II также можно получить по реакции с подходящими оптически активными кислотами, например, камфорсульфоновой кислотой или D- или L-винной кислотой с последующим фракционированием на соответствующие оптические антиподы путем фракционной кристаллизации полученных солей. Смеси изомеров соединений формулы IV также можно получить по реакции с подходящими оптически активными основаниями с последующим фракционированием на соответствующие оптические антиподы путем фракционной кристаллизации полученных солей. Соединения формулы I также могут содержать хиральные центры на атомах углерода, содержащих заместители R5, R6, R7 и/или R8. Эти хиральные центры можно заменять путем выбора подходящих соединений формулы VIII, в которых уже имеются соответствующие хиральные центры или проводимого по подходящим методикам синтеза.
Некоторые оптически активные соединения формулы I также можно получить непосредственно с помощью хирального синтеза. Если необходимо получить соединения формулы I, в которой гидроксигруппа в положении 3 пиранового кольца и заместитель R4NSO2R3 в положении 3 пиранового кольца находятся в трансположении друг к другу, то в каждом случае исходными веществами могут быть эпоксиды формулы XI, уже обладающие определенной стереохимической конфигурацией. Эпоксиды формулы XI, уже обладающие определенной стереохимической конфигурацией, например, можно получить эпоксидированием алкенов формулы XII по известным методикам с использованием хирального катализатора, например, (S,S)-(+)-N,N'-бис(3,5-ди-трет-бутилсалицилиден)-1,2-циклогександиаминомарганец(III)хлорида (=("катализатор Якобсона"; "(S,S)-марганец(III)-сален") по методике Якобсона (см., например, WO 91/14694 А1). Если, например, необходимо получить соединение формулы I, в которой хиральный центр в положении 3 пиранового кольца находятся в S-конфигурации и в которой хиральный центр в положении 4 пиранового кольца находятся в R-конфигурации, то промежуточный продукт формулы XII можно ввести в реакцию в присутствии хирального катализатора, предпочтительно - (S,S)-марганец(III)-салена и в присутствии донора кислорода, предпочтительно - гипохлорита натрия в водном растворе, в органическом растворителе, который является инертным при условиях проведения реакции, предпочтительно - дихлорметане. Реакцию целесообразно проводить при значении рН в диапазоне от 9,5 до 11,5. Для установления подходящего значения pH, предпочтительно прибавить к реакционной смеси буфер, содержащий Na2HPO4, и пиридин-N-оксид. Подходящая температура проведения реакции равна от -10°С до комнатной температуры, предпочтительно - 0°С. Если необходимо получить соединения формулы I, в которой хиральный центр в положении 3 пиранового кольца находятся в R-конфигурации и в которой хиральный центр в положении 4 пиранового кольца находятся в S-конфигурации, то методика может быть аналогичной описанной выше, но вместо (S,S)-марганец(III)-салена используют (R,R)-марганец(III)-сален.
По реакции нуклеофильного раскрытия цикла эпоксидов формулы XI, описанной выше в двух вариантах, как правило, получают соединения формулы X, в которых концевые заместители в положении 3 и в положении 4 пиранового кольца, а именно, гидроксигруппа и аминогруппа находятся в транс-положении друг к другу.
Благоприятные воздействия соединений формулы I, как фармакологически активных веществ, станут понятными из следующих соображений: уже известно, что вещества, которые блокируют эндогенные калиевые каналы сердца, можно использовать в качестве активных веществ для борьбы с сердечно-сосудистыми заболеваниями, в особенности с аритмиями сердца. Путем блокирования направленных наружу потоков калия в сердце можно пролонгировать потенциал сердечной деятельности, что оказывает благоприятное воздействие при аритмии сердца. Примерами этих известных лекарственных средств являются антиаритмические лекарственные средства класса III. Одним недостатком этих неспецифических блокаторов калиевых каналов является их низкая избирательность по отношению к разным тканям сердца. По этой причине в течение длительного времени полагали, что в особенности антиаритмические лекарственные средства класса III могут привести к нежелательному увеличению интервала QT на электрокардиограмме (= ЭКГ) и полиморфным желудочковым тахикардиям ("трепетание - мерцание"), вследствие чего в конечном счете могут возникнуть нежелательные осложнения, такие как, например, фибрилляция желудочков. По этой причине необходимы блокаторы калиевых каналов, способные селективно влиять на потоки калия в предсердии, но не в желудочке. Поскольку недавно открытые калиевые каналы Kv1.5 сердца расположены исключительно в предсердии, а не в желудочке, можно предположить, что эти соединения, блокирующие калиевые каналы Kv1.5, пригодны для использования в качестве избирательно воздействующих на предсердия антиаритмических лекарственных средств. Однако калиевые каналы Kv1.5 и другие калиевые каналы расположены не только в сердце, но и в сосудах организма. Поэтому никогда нельзя исключить того, что соединения, блокирующие калиевые каналы Kv1.5, могут привести к повышению артериального давления вследствие блокирования калиевых каналов сосудов. Поэтому предпочтительны соединения, блокирующие калиевые каналы Kv1.5, которые не вызывают побочных эффектов, приводящих к повышению артериального давления. Другими нежелательными побочными эффектами, которые могут возникнуть при введении многих соединений, блокирующих калиевые каналы Kv1.5, являются дополнительные антиаритмические побочные эффекты класса I, а также негативные инотропные эффекты.
Соединения формулы I характеризуются способностью заметно и избирательно блокировать калиевые каналы Kv1.5 сердца. В дополнение к особенно хорошей эффективности и заметному избирательному воздействию на предсердия соединения формулы I приводит самое большее к небольшим нежелательным побочным эффектам, таким как повышение артериального давления, антиаритмические побочные эффекты класса I и негативные инотропные эффекты. Поэтому соединения формулы I показаны для лечения и/или профилактики сердечно-сосудистых заболеваний, в особенности фибрилляция желудочков, трепетания предсердий и других аритмий сердца у крупных млекопитающих и людей.
Соединения формулы I также характеризуются сравнительно хорошей растворимостью в воде, в особенности те соединения формулы I, в которой заместитель R10 обозначает C1-С6-алкил; фенил-C1-С4-алкил или пиридинил-C1-С4-алкил, и атом азота, непосредственно связанный с R10 не является частью ароматической или гетероароматической кольцевой системы. Предполагается, что повышенная растворимость в воде приведет к улучшенной биологической доступности, что позволит приготовить фармацевтические композиции, содержащие уменьшенное количество органических растворителей и/или веществ, улучшающих растворимость, или даже не содержащие этих компонентов.
Кроме того, соединения формулы I обладают выраженной способностью блокировать калиевые каналы Kv1.3. Калиевые каналы Kv1.3 расположены преимущественно в клетках иммунной системы. Установлена взаимосвязь между блокированием калиевых каналов Kv1.3 и, в частности, антипролиферативным и/или иммунодепрессивным воздействием (см. С.Beeton et al., The Journal of Immunology (2001) 936-944). Поэтому можно предположить, что соединения, которые способны блокировать калиевые каналы Kv1.3 - например, соединения формулы I, предлагаемые в настоящем изобретении - также применимы для лечения и/или профилактики пролиферативных, хронических воспалительных и аутоиммунных заболеваний. Такие аутоиммунные заболевания могут включать, например, болезнь Аддисона, гнездную алопецию, анкилоз, спондилит, антифосфолипидный синдром, аутизм, аутоиммунный атеросклероз, аутоиммунный диабет, потерю вкусовых ощущений, аутоиммунный эндометриоз, аутоиммунные заболевания глаз, аутоиммунную гемолитическую анемию, аутоиммунную гемофилию, аутоиммунный гепатит, аутоиммунный интерстициальный цистит, аутоиммунный лимфопролиферативный синдром, аутоиммунную миелопатию, аутоиммунный миокардит, аутоиммунные невропатии, аутоиммунный оофорит, аутоиммунный орхит, аутоиммунную тромбоцитопению, аутоиммунные заболевания щитовидной железы, аутоиммунную уртикарию, аутоиммунный увеит, аутоиммунный васкулит; болезнь Бехчета, паралич Белла, буллезный пемфигоид; глютеновую болезнь, синдром хронического переутомления, болезнь Крона; герпетиформный дерматит, дерматомиозит, дискоидную красную волчанку; синдром Гудпасчера, болезнь Грейвса, синдром Гийена - Барре, тиреоидит Хашимото, герпес беременных, болезнь Гентингтона, IgA нефропатию, иммунную тромбоцитопению, пурпуру, интерстициальный цистит; волчанку, болезнь Лима; синдром Миллера-Фишера, смешанное заболевание соединительной ткани; рассеянный склероз, миастению gravis; паранеопластические аутоиммунные синдромы, листовидную пузырчатку, обыкновенную пузырчатку, пернициозную анемию, болезнь Пейрони, полиэндокринный синдром, первичный биллиарный цирроз, первичный гломерулонефрит, первичный склерозирующий холангит, псориаз, псориатический артрит; энцефалит Расмуссена, рецидивирующую полихондрию, ревматоидный артрит; саркоидоз, склеродермию, синдром Шегрена, синдром Штиффа-Персона; хорею Сиденгама, симпатическую офтальмию, темпоральный артериит, диабет типа 1, язвенный колит; витилиго; гранулематоз Вегенера. Кроме того, установлена взаимосвязь между блокированием калиевых каналов Kv1.3 и метаболическими заболеваниями (см. J. Xu et al., Human Molecular Genetics 2003. Vol.12. No, 5, 551-559). Поэтому можно предположить, что соединения, которые способны блокировать калиевые каналы Kv1.3 - например, соединения формулы I, предлагаемые в настоящем изобретении или соединения, раскрытые и заявленные в опубликованной заявке WO 2005/037780 (= US 2005/0148659) - также могут быть пригодны для лечения и/или профилактики метаболических нарушений или заболеваний, таких как центральное ожирение; гипертензия, в особенности артериальная гипертензия; резистентность к инсулину, в особенности сахарный диабет типа II; непереносимость глюкозы или нарушенная непереносимость глюкозы; дислипопротеинемия, в особенности гипертриглицеридемия, сопровождающаяся дислипопротеинемией, происходящей при пониженном уровне ЛВП-холестерина (ЛВП - липопротеины высокой плотности); и гиперурикемия.
Можно ожидать благоприятных эффектов, если аминоалкиламидометилзамещенные производные 2-(4-сульфониламино)-3-гидрокси-3,4-дигидро-2H-хромен-6-ила, предлагаемые в настоящем изобретении, или амидометилзамещенные производные 2-(4-сульфониламино)-3-гидрокси-3,4-дигидро-2H-хромен-6-ила, раскрытые в WO 2005/037780, вводят в комбинации (в фиксированной комбинации или последовательно в любом порядке) по меньшей мере с одним другим обладающим сердечно-сосудистой активностью лекарственным средством, выбранным из группы, включающей:
антагонисты альфа-адренорецептора (неселекти