Антитела к рецептору альфа 1 il-13 и их применение
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой антитело, которое обладает способностью связываться с IL-13Rα1 и ингибировать биологическую активность IL-13. Антитело можно эффективно применять для лечения астмы и аллергических заболеваний. 5 з.п. ф-лы, 5 ил., 5 табл.
Реферат
Настоящее изобретение относится к человеческим антителам к рецептору альфа1 IL-13 (IL-13Rα (альфа)1), способам их получения и их применению.
Предпосылки создания изобретения
IL-13 представляет собой мономерный пептид, который продуцируется в основном Th2-клетками, а также тучными клетками и NK-клетками (естественными клетками-киллерами). Биологическими функциями IL-13 являются регуляция производства IgE и модуляция развития Th2. IL-13 связывается с рецепторным комплексом, состоящим из цепи рецептора альфа1 IL-13 (IL-13Rα1) и цепи рецептора альфа IL-4 (IL-4Rα). Связывание с IL-13 запускает каскад сигналов трансдукции в основном через STAT6. IL-13 связывается с IL-13 Rα1 индивидуально с низкой аффинностью и не связывается с IL-4Rα1. В отличие от этого IL-4 связывается с IL-4Rα индивидуально и не связывается с IL-13Rα1 индивидуально. В литературе описан другой рецептор IL-13, а именно IL-13Rα2. IL-13 обладает высокой аффинностью к связыванию с этим рецептором. По-видимому, этот рецептор действует в качестве «рецептора-ловушки».
Индуцибельная сверхэкспрессия IL-13 в организме трансгенных мышей приводит к фенотипу, который обладает многими характеристиками, присущими пациентам, страдающим астмой. К ним относятся метаплазия слизи, воспаление, сопровождающееся высоким содержанием макрофагов, лимфоцитов и эозинофилов, повышающая регуляция протеаз типа ММР-9, -12, -13, -2 и -14, катепсина В, Н, K и S, и при этом присутствует также субэпителиальный фиброз. Для мышей с отсутствием (с «выключенным») IL-13 характерно существенное снижение производства цитокинов Th2-клетками вследствие нарушения развития Th2-клеток. У этих мышей не развивается гиперреактивность дыхательных путей (AHR) вследствие наличия эозинофильного воспаления. AHR восстанавливалась после введения IL-13, что свидетельствует о том, что присутствие IL-13 является необходимым и достаточным для индукции AHR у мышей. Другими важными биологическими функциями IL-13, связанными с астмой, являются индукция метаплазии бокаловидных клеток и образование слизи. Он воздействует непосредственно на эпителиальные клетки дыхательных путей, фибробласты и гладкомышечные клетки дыхательных путей и индуцирует различные программы транскрипции в каждом из указанных типов клеток. Интересно отметить, что IL-13 приводит к уменьшению альфа-адренергического ответа в гладкомышечных клетках, что способствует сужению дыхательных путей. Полиморфизм промотора IL-13 связан с повышенным риском возникновения аллергической астмы. Полиморфизм гена IL-13 связан с высокими уровнями IgE в сыворотке. Полиморфизм одного нуклеотида в межгенной последовательности между генами IL-4 и IL-13 связан с атонической астмой.
Антагонисты IL-13 применяли в моделях с использованием животных. Например, слитый белок растворимый мышиный IL-13Rα2-IgGFc применяли для демонстрации эффективности осуществления полной реверсии индуцированной альбумином AHR и большого количества содержащих слизь клеток. Реверсию достигали даже в том случае, когда обработку проводили после полного развития фенотипа. Кроме того, обработка мышей молекулой цитотоксина, слитой с IL-13, приводила к уменьшению всех признаков заболевания дыхательных путей при хроническом индуцированном грибками аллергическом воспалении. И, наконец, IL-13 является имеющим решающее значение медиатором эффекторного «плеча» аллергического ответа.
IL-13Rα1 является представителем суперсемейства рецепторов гематопоэтина (семейство цитокиновых рецепторов типа 1), он идентифицирован и описан Obiri N.I. и др., J. Biol. Chem., 270, 1995, cc.8797-8804) и в WO 96/29417. Он представляет собой белок, состоящий из 427 аминокислот, включая сигнальную последовательность. Его последовательности ДНК и белка представлены в WO 97/15663 и SwissProt No. P78552. IL-13Rα1 представляет собой гликозилированный белок, который связывается с IL-13 с низкой аффинностью, но будучи связанным с IL-4Rα с образованием гетеродимера, он связывается с IL-13 с высокой аффинностью. Этот комплекс является также рецептором для IL-4.
Антитела к IL-13Rα1 описаны также в WO 96/29417, WO 97/15663, WO 03/080675, у Graber Р. и др., Eur. J. Immunol., 28, 1998, cc.4286-4298; Poudrier J. и др., J. Immunol., 163, 1999, cc.1153-1161; Poudrier J. и др., Eur. J. Immunol., 30, 2000, cc.3157-3164; Aikawa М. и др., Cytokine, 13, 2001, cc.75-84. Антитела к IL-13Rα1 поступают в продажу от фирмы R&D Systems Inc. USA.
Краткое изложение сущности изобретения
Изобретение относится к антителу, которое связывается с IL-13Rα1 и ингибирует биологическую активность IL-13, отличающемуся тем, что аминокислотную последовательность CDR3 вариабельной области тяжелой цепи антитела выбирают из группы, включающей последовательности CDR3 тяжелой цепи, представленные в SEQ ID NO:1, 3, 5, 7 или 9.
Антитело предпочтительно представляет собой человеческое антитело.
Антитело предпочтительно отличается тем, что аффинность связывания с IL-13Rα1 составляет 10-9 М (KD) или менее, предпочтительно от 10-9 до 10-13 М.
Предпочтительно антитело отличается тем, что его последовательности CDR1, CDR2 и CDR3 тяжелой цепи выбирают из группы, включающей последовательности CDR1, CDR2 и CDR3, представленные в SEQ ID NO:1, 3, 5, 7 или 9.
Антитело предпочтительно отличается тем, что аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельной области легкой цепи антитела выбирают из группы, включающей последовательности CDR легкой цепи, представленные в SEQ ID NO:2, 4, 6, 8 или 10.
Антитело предпочтительно отличается тем, что аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи антитела выбирают из группы, включающей последовательности CDR тяжелой цепи, представленные в SEQ ID NO:1, 3, 5, 7 или 9, и аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельной области легкой цепи антитела выбирают из группы, включающей последовательности CDR легкой цепи, представленные в SEQ ID NO:2, 4, 6, 8 или 10.
Последовательности CDR предпочтительно выбирают независимо друг от друга и их разделяют каркасными участками (FR).
Антитело предпочтительно отличается тем, что оно содержит в качестве CDR тяжелой цепи CDR, представленные в SEQ ID NO:1, и в качестве CDR легкой цепи CDR, представленные в SEQ ID NO:2, в качестве CDR тяжелой цепи CDR, представленные в SEQ ID NO:3, и в качестве CDR легкой цепи CDR, представленные в SEQ ID NO:4, в качестве CDR тяжелой цепи CDR, представленные в SEQ ID NO:5, и в качестве CDR легкой цепи CDR, представленные в SEQ ID NO:6, в качестве CDR тяжелой цепи CDR, представленные в SEQ ID NO:7, и в качестве CDR легкой цепи CDR, представленные в SEQ ID NO:8, или в качестве CDR тяжелой цепи CDR, представленные в SEQ ID NO:9, и в качестве CDR легкой цепи CDR, представленные в SEQ ID NO:10.
Последовательности CDR можно определять с использованием стандартного определения, приведенного у Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991. Согласно этому определению гипервариабельные участки (CDR), представленные в SEQ ID NO:1-8, имеют следующие последовательности:
CDR тяжелой цепи: CDR1 (ак 31-35) SEQ ID NO:1, 3, 5, 7, 9, CDR2 (ак 50-66) SEQ ID NO:1, 3, 5, 7, 9, CDR3 (ак 99-108) SEQ ID NO:1, 3, 9, CDR3 (ак 99-107) SEQ ID NO:5, CDR3 (ак 99-112) SEQ ID NO:7;
CDR легкой цепи: CDR1 (ак 24-34) SEQ ID NO:2, 4, 6, 10, CDR1 (ак 24-35) SEQ ID NO:8, CDR2 (ак 50-56) SEQ ID NO:2, 4, 6, 10, CDR2 (ак 51-57) SEQ ID NO:8 и CDR3 (ак 89-97) SEQ ID NO:2, 4, 6, 10, CDR3 (ак 90-97) SEQ ID NO:8.
Предпочтительно антитело, предлагаемое в изобретении, содержит в качестве гипервариабельных участков (CDR) следующие последовательности:
а) тяжелая цепь антитела содержит CDR тяжелой цепи, представленные в SEQ ID NO:1, 3, 5, 7 или 9;
б) легкая цепь антитела содержит CDR легкой цепи, представленные в SEQ ID NO:2, 4, 6, 8 или 10,
где CDR выбирают независимо друг от друга.
Антитело предпочтительно отличается тем, что содержит в качестве вариабельной области тяжелой цепи SEQ ID NO:1 и в качестве вариабельной области легкой цепи SEQ ID NO:2, в качестве вариабельной области тяжелой цепи SEQ ID NO:3 и в качестве вариабельной области легкой цепи SEQ ID NO:4, в качестве вариабельной области тяжелой цепи SEQ ID NO:5 и в качестве вариабельной области легкой цепи SEQ ID NO:6, в качестве вариабельной области тяжелой цепи SEQ ID NO:7 и в качестве вариабельной области легкой цепи SEQ ID NO:8 или в качестве вариабельной области тяжелой цепи SEQ ID NO:9 и в качестве вариабельной области легкой цепи SEQ ID NO:10.
Антитело предпочтительно отличается тем, что содержит
а) в качестве вариабельной области тяжелой цепи SEQ ID NO:1, в качестве вариабельной области легкой цепи SEQ ID NO:2, в качестве константной области легкой κ-цепи SEQ ID NO:11 и в качестве константной области тяжелой γ1-цепи SEQ ID NO:12, необязательно имеющую мутации L234A и L235A или D265A и N297A,
б) в качестве вариабельной области тяжелой цепи SEQ ID NO:3 и в качестве вариабельной области легкой цепи SEQ ID NO:4, в качестве константной области легкой κ-цепи SEQ ID NO:11 и в качестве константной области тяжелой γ1-цепи SEQ ID NO:12, необязательно имеющую мутации L234A и L235A или D265A и N297A,
в) в качестве вариабельной области тяжелой цепи SEQ ID NO:5 и в качестве вариабельной области легкой цепи SEQ ID NO:6, в качестве константной области легкой κ-цепи SEQ ID NO:11 и в качестве константной области тяжелой γ1-цепи SEQ ID NO:12, необязательно имеющую мутации L234A и L235A или D265A и N297A,
г) в качестве вариабельной области тяжелой цепи SEQ ID NO:7 и в качестве вариабельной области легкой цепи SEQ ID NO:8, в качестве константной области легкой κ-цепи SEQ ID NO:11 и в качестве константной области тяжелой γ1-цепи SEQ ID NO:12, необязательно имеющую мутации L234A и L235A или D265A и N297A, или
д) в качестве вариабельной области тяжелой цепи SEQ ID NO:9 и в качестве вариабельной области легкой цепи SEQ ID NO:10, в качестве константной области легкой κ-цепи SEQ ID NO:11 и в качестве константной области тяжелой γ1-цепи SEQ ID NO:12, необязательно имеющую мутации L234A и L235A или D265A и N297A.
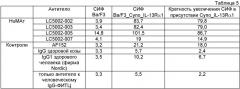
Предпочтительно антитело отличается тем, что антитело связывается с IL-13Rα1 конкурентно с антителом LC5002-002, LC5002-003, LC5002-005, LC5002-007 и/или LC5002-018. Предпочтительно антитело отличается тем, что содержит в качестве вариабельных областей вариабельные области LC5002-002, LC5002-003, LC5002-005, LC5002-007 или LC5002-018. Вариабельные области этих антител представлены в SEQ ID NO:1-10. Пригодные константные области хорошо известны в данной области. Их примеры представлены в SEQ ID NO:11-12.
Антитело предпочтительно представляет собой моноклональное или полученное рекомбинантным путем антитело.
В одном из вариантов осуществления изобретения антитело относится к классу измененных человеческих антител.
В предпочтительном варианте осуществления изобретения антитело содержит человеческую тяжелую γ1-цепь, включающую
а) аминокислотную последовательность Pro233Val234Ala235, имеющую делецию Gly236, и/или аминокислотную последовательность Gly327Leu328Pro329Ser330Ser331,
б) аминокислотную последовательность Ala234Ala235 или
в) аминокислоты Ala265 и Ala297.
Предпочтительно антитело, предлагаемое в изобретении, обладает способностью ингибировать индуцируемое IL-13 фосфорилирование Stat-6, характеризующейся значением IC50, составляющим 6нМ или менее, способностью ингибировать индуцируемое IL-13 производство эотаксина, характеризующейся значением IC50, составляющим 20 нМ или менее и/или способностью ингибировать индуцируемую IL-13 или IL-4 пролиферацию клеток, предпочтительно TF-1-клеток (АТСС CRL 2003), характеризующуюся значением IC50, составляющим 10 нМ или менее (IL-13) и 60 нМ или менее (IL-4). Индуцируемое IL-13 фосфорилирование Stat-6, производство эотаксина и индукцию пролиферации клеток определяют согласно методам, описанным в примерах 6-8.
Антитело, предлагаемое в изобретении, предпочтительно не связывается с денатурированным IL-13Rα1 (значение KD для аффинности связывания составляет 10-6 М или более). Антитело предпочтительно отличается тем, что практически не обладает перекрестной реактивностью с IL-13Rα2 и IL-4Rα (значение KD для аффинности связывания составляет 10-6 М или более).
В изобретении предложены также линии клеток гибридомы, продуцирующие антагонистические моноклональные антитела к IL-13Rα1.
Предпочтительные линии клеток гибридомы, предлагаемые в изобретении (hu-MAB<h-IL-13R alpha>LC.5002-002 (DSM ACC2709), hu-MAB<h-IL-13Ralpha>LC.5002-003 (DSM ACC2710), hu-MAB<h-IL-13Ralpha>LC.5002-005 (DSM ACC2711), hu-MAB<h-IL-13R alpha>LC.5002-007 (DSM ACC2712)) депонированы 13.01.2005 г. в Немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH) (DSMZ), Германия.
Антитела, которые можно получать с помощью указанных линий клеток, также являются вариантами осуществления изобретения.
Кроме того, изобретение относится к нуклеиновым кислотам, кодирующим полипептиды, из которых состоят антитела, предлагаемые в изобретении, экспрессионным векторам, содержащим такие нуклеиновые кислоты, и клеткам-хозяевам, предназначенным для рекомбинантного получения таких антител. Кроме того, в изобретении предложены способы рекомбинантного получения таких антител.
Полипептиды, кодируемые нуклеиновыми кислотами, предлагаемыми в изобретении, представляют собой
а) тяжелую цепь антитела, содержащую CDR тяжелой цепи, представленные в SEQ ID NO:NO:1, 3, 5, 7 или 9, и
б) легкую цепь антитела, содержащую CDR легкой цепи, представленные в SEQ ID NO:2, 4, 6, 8 или 10.
Эти полипептиды обладают способностью к сборке с соответствующей другой цепью антитела с образованием антитела.
Антитела, предлагаемые в изобретении, обладают преимуществами для пациентов, нуждающихся в лечении с применением кортикостероидов. Антитела, предлагаемые в изобретении, имеют новые и патентоспособные свойства, обладая преимуществом для пациента, который страдает астмой или аллергическим заболеванием.
Кроме того, в изобретении предложены способы лечения астмы и аллергических заболеваний.
Изобретение относится также к применению антитела, предлагаемого в изобретении, для лечения астмы и для приготовления фармацевтической композиции, предлагаемой в изобретении. Кроме того, изобретение относится к способу приготовления фармацевтической композиции, предлагаемой в изобретении.
Изобретение относится также к фармацевтической композиции, содержащей антитело, предлагаемое в изобретении, в фармацевтически эффективном количестве необязательно в сочетании с буфером и/или адъювантом, которые можно применять для приготовления содержащей антитела препаративной формы для фармацевтических целей.
Изобретение относится также к фармацевтической композиции, содержащей указанное антитело в фармацевтически приемлемом носителе. В одном из вариантов осуществления изобретения фармацевтическую композицию можно включать в изделие или набор.
Изобретение относится также к вектору, содержащему нуклеиновую кислоту, предлагаемую в изобретении, который обладает способностью осуществлять экспрессию нуклеиновой кислоты в прокариотической или эукариотической клетке-хозяине.
Изобретение относится также к прокариотической или эукариотической клетке-хозяину, содержащей вектор, предлагаемый в изобретении.
Изобретение относится также к способу получения рекомбинантного человеческого антитела, предлагаемого в изобретении, отличающемуся тем, что осуществляют экспрессию нуклеиновой кислоты, предлагаемой в изобретении, в прокариотической или эукариотической клетке-хозяине и выделяют антитело из клетки. Кроме того, изобретение относится к антителу, которое можно получать таким способом рекомбинации.
Изобретение относится также к способу получения фармацевтической композиции, отличающемуся тем, что отбирают антитело к IL-13Rα1 из множества антител к IL-13Rα1 на основе сравнения с использованием анализа без применения антитела, получают антитело с помощью рекомбинантной экспрессии, выделяют антитело и объединяют антитело с фармацевтически приемлемым буфером и/или адъювантом. Предпочтительно антитело обладает одним или несколькими из указанных выше дополнительных свойств.
Подробное описание изобретения
Понятия «IL-13Rα1, мышиный IL-13Rα1, IL-13, IL-13Rα2 и IL-4Rα» и их домены хорошо известны в данной области и представлены, например, в SwissProt P78552, 009030, Р35225, Q14627 и Р24394. Если не указано иное, понятия «IL-13Rα1, IL-13, IL-13Rα2 и IL-4Rα» в контексте настоящего описания обозначают человеческие полипептиды IL-13Rα1, IL-13, IL-13Rα2 и IL-4Rα.
Понятие «человеческое антитело» в контексте настоящего описания включает антитела, имеющие вариабельные и константные области (домены), которые можно отнести к последовательностям иммуноглобулинов человеческой зародышевой линии на основе их высокой степени сходства или идентичности с этими последовательностями зародышевой линии. Человеческие антитела хорошо известны в данной области (van Dijk М.А. и van de Winkel J.G., Curr. Opin. Chem. Biol. 5, 2001, cc.368-374). Человеческие антитела можно получать также в трансгенных животных (например, мышах), которые в результате иммунизации могут продуцировать полный спектр или набор человеческих антител при отсутствии производства эндогенного иммуноглобулина. Перенос набора генов иммуноглобулинов человеческой зародышевой линии в такую мутантную зародышевую линию мышей должен приводить к производству человеческих антител после антигенной стимуляции (см., например, Jakobovits А., и др., Proc. Natl. Acad. Sci. USA 90, 1993, cc.2551-2555; Jakobovits А. и др., Nature 362, 1993, cc.255-258; Bruggemann M. и др., Year Immunol. 7, 1993, cc.33-40). Человеческие антитела можно получать также с помощью фаговых дисплейных библиотек (Hoogenboom H.R. и Winter, G., J. Mol. Biol. 227, 1992, cc.381-388; Marks J.D. и др., J. Mol. Biol. 222, 1991, cc.581-597). Для получения человеческих моноклональных антител можно использовать также методы Cole с соавторами и Boerner с соавторами (Cole и др., Monoclonal Antibodies and Cancer Therapy, под ред. Alan R. Liss, 1985, с.77; и Boerner Р. и др., J. Immunol. 147, 1991, cc.86-95). Понятие «человеческое антитело» относится к различным формам антител, предпочтительно моноклональных антител, включая (но, не ограничиваясь ими) полные антитела, фрагменты антител, антитела измененного (переключенного) класса и генетически сконструированные антитела (варианты или мутантные антитела), если они сохраняют характерные особенности, присущие антителам, предлагаемым в изобретении. Наиболее предпочтительными являются рекомбинантные человеческие антитела. Понятие «моноклональное антитело» в контексте настоящего описания относится к получению молекул антитела, которые все имеют практически одинаковые аминокислотные последовательности.
Подразумевается, что понятие «рекомбинантное человеческое антитело» в контексте настоящего описания включает все человеческие антитела, которые получают, экспрессируют, создают или выделяют с помощью методов рекомбинации, такие как антитела, выделенные из клетки-хозяина, такой как NS0- или СНО-клетка, или из организма животного (например, мыши), которое является трансгенным из-за присутствия человеческих генов иммуноглобулинов, или антитела, экспрессируемые с использованием рекомбинантного экспрессионного вектора, которым трансфектирована клетка-хозяин. Такие рекомбинантные человеческие антитела имеют вариабельную и константную области, которые находятся в преобразованной форме. Рекомбинантные человеческие антитела, предлагаемые в изобретении, подвергают соматической гипермутации in vivo. Таким образом, аминокислотные последовательности VH- и VL-областей рекомбинантных антител представляют собой последовательности, которые, хотя и выведены из человеческой зародышевой линии последовательностей VH и VL, могут не существовать в естественных условиях в спектре зародышевой линии человеческих антител in vivo. Понятие «антитело переключенного класса» относится к моноклональному антителу, предпочтительно человеческому антителу, содержащему вариабельную область, т.е. связывающую область, из одного источника или зародышевой линии и, по меньшей мере часть константной области, соответствующей константной области антитела из другого источника или зародышевой линии, которое, как правило, получают методами рекомбинантной ДНК. Такие антитела переключенного класса не встречаются в естественных условиях и, следовательно, не могут быть получены непосредственно из ксенотрансплантированных мышей. Формы «антител переключенного класса», подпадающие под объем настоящего изобретения, представляют собой формы, в которых константная область имеет отличия от последовательности константной области дикого типа, что приводит к получению антител, предлагаемых в изобретении, обладающих различными свойствами, прежде всего касательно связывания с C1q и/или связывания с рецептором Fc (FcR), т.е. путем изменения или мутации Fc. Антитела переключенного класса являются продуктом экспрессируемых генов иммуноглобулина, которые содержат сегменты ДНК, кодирующие вариабельные области иммуноглобулина, и сегменты ДНК, кодирующие константные области иммуноглобулина. Методы получения антител переключенного класса включают общепринятые методы рекомбинантной ДНК и генной трансфекции, хорошо известные в данной области (см., например, Morrison S.L. и др., Proc. Natl. Acad. Sci. USA 81, 1984, cc.6851-6855; US 5202238 и 5204244).
Понятие «вариабельная область» (вариабельная область легкой цепи (VL), вариабельная область тяжелой цепи (VH)) в контексте настоящего описания относится к каждой из пары легких и тяжелой цепей, которые участвуют непосредственно в связывании антитела с антигеном. Домены вариабельных человеческих легких и тяжелых цепей имеют одинаковую общую структуру, и каждый домен содержит четыре каркасных участка (FR), последовательности которых являются весьма консервативными, связанных тремя «гипервариабельными участками» (или определяющими комплементарность участками, CDR). Каркасные участки адаптированы к β-складчатой конформации, а CDR могут образовывать петли, соединяющие β-складчатую структуру. CDR в каждой цепи сохраняют их трехмерную структуру с помощью каркасных участков, и образуют вместе с CDR из другой цепи антигенсвязывающий центр. CDR3-участки тяжелой и легкой цепей антитела, предпочтительно CDR3 тяжелой цепи, играют особенно важную роль в специфичности связывания/аффинности антител, предлагаемых в изобретении, и поэтому являются еще одним объектом изобретения.
Понятия «гипервариабельный участок» или «антигенсвязывающий центр антитела» в контексте настоящего описания относятся к аминокислотным остаткам антитела, которые ответственны за связывание антигена. Гипервариабельный участок содержит аминокислотные остатки из «определяющих комплементарность участков» или «CDR». «Каркасные» или «FR»-участки представляют собой участки вариабельной области, отличные от указанных в настоящем описании остатков гипервариабельного участка. Таким образом, легкие и тяжелые цепи антитела содержат в направлении от N- к С-концу участки FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. CDR- и FR-участки определяют с помощью стандартной номенклатуры Кэбота (Kabat и др., Sequences of Proteins of Immunological Interest, 5-изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD (1991).
«Константные области» не принимают непосредственного участия в связывании антитела с антигеном, но обладают различными эффекторными функциями. В зависимости от аминокислотной последовательности константной области их тяжелых цепей антитела или иммуноглобулины подразделяют на следующие классы: IgA, IgD, IgE, IgG и IgM, некоторые из которых можно дополнительно подразделять на подклассы (изотипы), например, IgG1, IgG2, IgG3 и IgG4, IgA1 и IgA2. Константные области тяжелой цепи, соответствующие различным классам иммуноглобулинов, обозначают µ, δ, γ, α и ε соответственно. Антитела, предлагаемые в изобретении, предпочтительно относятся к IgG1-типу.
Fc-фрагмент антитела принимает непосредственное участие в активации комплемента, связывании C1q, активации С3 и связывании Fc-рецептора. Связывание с C1q обусловлено определенными сайтами связывания в Fc-фрагменте. Такие сайты связывания известны в данной области и описаны, например, у Lukas T.J. и др., J. Immunol. 127, 1981, cc.2555-2560; Brunhouse R. и Cebra J.J., Mol. Immunol. 16, 1979, cc.907-917; Burton D.R. и др., Nature 288, 1980, cc.338-344; Thommesen J.E. и др., Mol. Immunol. 37, 2000, cc.995-1004; Idusogie E.E. и др., J. Immunol. 164, 2000, cc.4178-4184; Hezareh M. и др., J. Virol. 75, 2001, cc.12161-12168; Morgan А. и др., Immunology 86, 1995, cc.319-324; и ЕР 0307434. Такие сайты связывания представляют собой, например, L234, L235, D270, N297, Е318, K320, K322, Р331 и Р329 (нумерация согласно EU-индексу, предложенному Кэботом, см. ниже). Антитела подклассов IgG1, IgG2 и IgG3, как правило, обусловливают активацию комплемента, связывание C1q и активацию С3, в то время как антитело подкласса IgG4 не активирует систему комплемента, не связывает C1q и не активирует С3. В контексте настоящего описания понятие «Fc-фрагмент, который имеет человеческое происхождение» обозначает Fc-фрагмент, который предпочтительно имеет аминокислотную последовательность Fc-фрагмента человеческого антитела подкласса IgG1, модифицированный таким образом, что нельзя обнаружить ни связывание с C1q, ни активацию С3 и/или связывание с FcR, или связывание которого уменьшено по меньшей мере на 50%, предпочтительно на 70% по сравнению с человеческим антителом подкласса IgG1. Понятие «Fc-фрагмент антитела» хорошо известно специалисту в данной области и этот фрагмент определяют на основе расщепления антител папаином. Антитела, предлагаемые в изобретении, содержат в качестве Fc-фрагмента предпочтительно аминокислотную последовательность Fc-фрагмента, имеющего человеческое происхождение и предпочтительно все другие части человеческих константных областей. Предпочтительно Fc-фрагмент представляет собой мутантный фрагмент человеческого иммуноглобулина подкласса IgG1. Наиболее предпочтительными являются Fc-фрагменты, содержащие константную область тяжелой γ1-цепи (например, представленную в SEQ ID NO:11) с мутациями L234A и L235A или D235A и N297A (WO 99/51642).
Подробное описание цепей человеческих константных областей, например, тяжелых γ1-цепей, приведено у Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD., 1991; у Brüggemann M. и др., J. Exp. Med. 166, 1987, cc.1351-1361; и у Love T.W. и др., Methods Enzymol. 178, 1989, cc.515-527. Константные области, которые являются предпочтительными согласно изобретению, не обеспечивают связывания комплемента. Понятие «вариабельная область» (вариабельная область легкой цепи (VL), вариабельная область тяжелой цепи (VH)) в контексте настоящего описания относится к каждой из пары легких и тяжелой цепей, которые участвуют непосредственно в связывании антитела с антигеном.
Подразумевается, что понятие «нуклеиновая кислота или молекула нуклеиновой кислоты» в контексте настоящего описания включает молекулы ДНК и молекулы РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно представляет собой двухцепочечную ДНК.
Нуклеиновую кислоту «функционально связывают», когда создают функциональную связь между ней и другой нуклеотидной последовательностью. Например, ДНК предпоследовательности или лидера секреции функционально связана с ДНК полипептида, если она экспрессируется в виде предбелка, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он оказывает воздействие на транскрипцию последовательности; или сайт связывания рибосом функционально связан с кодирующей последовательностью, если он помещен так, чтобы он облегчал трансляцию. Как правило, понятие «функционально связаны» означает, что последовательности ДНК, будучи связаны, находятся в цис-положении (являются смежными), а в случае лидера секреции, смежными и находящимися в рамке считывания. Однако для энхансеров не является необходимым, чтобы они были смежными. Связывание осуществляют путем лигирования в удобных сайтах рестрикции. Если такие сайты не существуют, то согласно общепринятой практике используют синтетические олигонуклеотидные адаптеры или линкеры.
В контексте настоящего описания понятия «клетка», «клеточная линия» и «клеточная культура» используются взаимозаменяемо, и все такие определения включают потомство. Так, понятия «трансформанты» и «трансформированные клетки» относятся к первичной клетке субъекта и полученным из нее культурам безотносительно к количеству переносов. Следует понимать также, что все потомство может не быть полностью идентичным по составу ДНК из-за преднамеренных или случайных мутаций. Под объем изобретения подпадает вариант потомства, имеющего такую же функцию или биологическую активность, которая обнаружена у исходной трансформированной клетки. Если используются другие определения, то это будет очевидно из контекста.
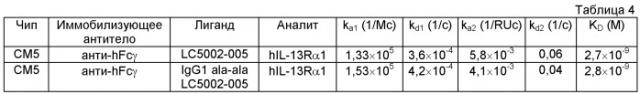
Понятие «связывание с IL-13Rα1» в контексте настоящего описания означает связывание антитела с IL-13Rα1, которое оценивают с помощью анализа in vitro, предпочтительно анализа связывания, в котором антитело связывают с поверхностью и связывание с IL-13Rα1 измеряют с помощью поверхностного плазменного резонанса (SPR). Наличие связывания означает, что аффинность к связыванию (KD) составляет 10-8 М или менее, предпочтительно от 10-13 до 10-9 М. «Отсутствие связывания» означает, что значение KD составляет 10-6 М или более. Антитела, предлагаемые в изобретении, связываются с внеклеточным доменом человеческого IL-13Rα1 и предпочтительно также мышиного IL-13Rα1.
Связывание с IL-13Rα1 можно оценивать с помощью BIAcore-анализа (фирма Pharmacia Biosensor AB, Уппсала, Швеция). Аффинность связывания оценивают, используя в качестве критериев ka (константа скорости ассоциации антитела с антигеном), kd (константа скорости диссоциации антитела из комплекса антитело/антиген) и KD (kd/ka).
Антитела, предлагаемые в изобретении, ингибируют связывание IL-13 с IL-13Rα1. Ингибирование оценивают по величине IC50 при оценке с помощью ELISA связывания IL-13 с гетеродимером IL-13Rα1/IL-4Rα. Для осуществления такого анализа IL-13Rα1 иммобилизуют и добавляют IL-13 и IL-4Rα. Значения IC50 для антител, предлагаемых в изобретении, при оценке связывания IL-13 с IL-13Rα1 составляют не более 6 нМ. Величины IC50 определяют в виде средних или медианных значений по меньшей мере по трем независимым экспериментам. Отдельные значения IC50 могут выпадать из указанного диапазона.
Антитела, предлагаемые в изобретении, предпочтительно обладают способностью к связыванию с теми же самыми эпитопами IL-13Rα1, что и антитело, выбранное из группы, включающей антитела LC5002-002, LC5002-003, LC5002-005, LC5002-007 или LC5002-018, или ингибируют связывание с IL-13Rα1 вследствие стерической помехи к связыванию, создаваемой этими антителами. Ингибирование связывания можно оценивать с помощью SPR-анализа с использованием иммобилизованного антитела, выбранного из группы, включающей антитела LC5002-002, LC5002-003, LC5002-005, LC5002-007 или LC5002-018, и IL-13Rα1 в концентрации 20-50 нМ и антитела, подлежащего оценке, в концентрации 100 нМ. Уменьшение сигнала на 50% или более свидетельствует о том, что антитело конкурирует с антителом, выбранным из группы, включающей антитела LC5002-002, LC5002-003, LC5002-005, LC5002-007 или LC5002-018. Понятие «эпитоп» обозначает белковую детерминанту, обладающую способностью специфически связываться с антителом. Эпитопы, как правило, состоят из химически активных расположенных на поверхности групп молекул, таких как боковые цепи аминокислот или сахаров, и, как правило, имеют характеристики специфической трехмерной структуры, а также специфические характеристики зарядов. Конформационные и неконформационные эпитопы различаются тем, что связывание с эпитопами первого, но не второго типа, нарушается в присутствии денатурирующих растворителей. Изобретение относится также к связыванию человеческого антитела с IL-13Rα1 и ингибированию биологической активности IL-13, которое характеризуется аффинностью, составляющей 10-9 М (KD) или менее, предпочтительно от 10-9 до 10-13 М, для связывания с IL-13Rα1 и аффинностью, составляющей 10-7 М (KD) или менее, предпочтительно от 10-8 до 10-9 М, для связывания с мышиным IL-13Rα1.
В предпочтительном варианте осуществления изобретения антитела, предлагаемые в изобретении, отличаются также наличием одной или нескольких характеристик связывания (выбранных из параметров связывания ka, kd и KD) с тем же самым эпитопом, с которым связывается антитело, выбранное из группы, включающей антитела LC5002-002, LC5002-003, LC5002-005, LC5002-007 или LC5002-018.
Антитела, предлагаемые в изобретении, предпочтительно получают методами рекомбинации. Такие методы широко известны в данной области и представляют собой экспрессию белков в прокариотических и эукариотических клетках с последующим выделением полипептида антитела и, как правило, очистку до фармацевтически приемлемой чистоты. Для экспрессии белка нуклеиновые кислоты, кодирующие легкие и тяжелые цепи или их фрагменты, встраивают в экспрессионные векторы стандартными методами. Экспрессию осуществляют в пригодных прокариотических или эукариотических клетках-хозяевах типа СНО-клеток, NS0-клеток, SP2/0-клеток, HEK293-клеток, COS-клеток, клеток дрожжей или клеток E.coli, и антитело выделяют из клеток (из супернатанта или клеток после лизиса).
Рекомбинантное получение антител хорошо известно в данной области и описано, например, в обзорных статьях Makrides S.C., Protein Expr. Purif. 17, 1999, cc.183-202; Geisse S. и др., Protein Expr. Purif. 8, 1996, cc.271-282; Kaufman R.J., Mol. Biotechnol. 16, 2000, cc.151-161; Werner R.G. и др., Drug Res. 48, 1998, cc.870-880.
Антитела могут присутствовать в целых клетках, в клеточном лизате или в частично очищенной или практически чистой форме. Очистку осуществляют для удаления других клеточных компонентов или других загрязнителей, например, других клеточных нуклеиновых кислот или белков, стандартными методами, которые включают обработку щелочью/ДСН, CsCl-бэндинг, хроматографию на колонках, элекрофорез в агарозном геле и другие методы, хорошо известные в данной области (см. в Current Protocols in Molecular Biology, под ред. Ausubel F., и др., изд-во Greene Publishing and Wiley Interscience, New York, 1987).
Экспрессия в NS0-клетках описана, например, у Barnes L.M. и др., Cytotechnology 32, 2000, cc.109-123; и Barnes L.M. и др., Biotech. Bioeng. 73, 2001, cc.261-270. Кратковременная экспрессия описана, например, у Durocher Y. и др., Nucl. Acids. Res. 30, 2002, с.Е9. Клонирование вариабельных областей описано у Orlandi R. и др., Proc. Natl. Acad. Sci. USA 86, 1989, cc.3833-3837; Carter Р. и др., Proc. Natl. Acad. Sci. USA 89, 1992, cc.4285-4289; и Norderhaug L. и др., J. Immunol. Methods 204, 1997, cc.77-87. Предпочтительная система кратковременной экспрессии (НЕК 293) описана у Schlaeger E.-J. и Christensen K. в Cytotechnology 30, 1999, cc.71-83 и у Schlaeger E.-J. в J. Immunol. Methods 194, 1996, cc.191-199.
Контролирующие последовательности, которые можно применять для прокариот, представляют собой, например, промотор, необязательно последовательность оператора и сайт связывания рибосом. Известно, что эукариотические клетки могут использовать промоторы, энхансеры и сигналы полиаденилирования.
Моноклональные антитела можно отделять от культуральной среды с помощью общепринятых методов очистки иммуноглобулинов, таких, например, как хроматография на протеин А-сефарозе, гидроксилапатите, гель-электрофорез, диализ или аффинная хроматография. ДНК и РНК, которые кодируют моноклональные антитела, легко выделять и секвенировать с помощью общепринятых методов. Клетки гибридом могут служить источником таких ДНК и РНК. Для осуществления синтеза рекомбинантных моноклональных антител в клетках-хозяевах ДНК после выделения можно встраивать в экспрессионные векторы, которыми затем трансфектируют клетки-хозяева, такие как СНО-клетки, HEK 293-клетки или клетки миеломы, которые в ином варианте не могут продуцировать белок иммуноглобулина.
К антителам, предлагаемым в изобретении, относятся также антитела, несущие «консервативные модификации последовательностей», модификации нуклеотидных и аминокислотных последовательностей, которые не оказывают воздействия или не изменяют вышеуказанные характеристики антитела, предлагаемого в изобретении. Модификации можно интродуцировать стандартными методами, известными в данной области, такими как сайтнаправленный мутагенез и опосредуемый ПЦР мутагенез. Консервативные аминокислотные замены включают замены, при которых аминокислотный остаток заменяют аминокислотным остатком с такой же боковой цепью. Семейства аминокислотных остатков, имеющих аналогичные боковые цепи, известны в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например лизин, аргинин, гистидин), кислотными боковыми цепями (например аспарагиновую кислоту, глутаминовую кислоту), незаряженными полярными боковыми цепями (например глицин, аспарагин, глутамин, серии, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например треонин, валин, изолейцин) и ароматическими боковыми цепями (например тирозин, фенилаланин, триптофан, гистидин). Таким образом, выбранный остаток заменимой аминокислоты в человеческом антителе к IL-13Rα1 предпочтительно можно заменять другим аминокислотным остатком из семейства с такой же боковой цепью.
Аминокислотные замены