Способ получения диарилциклоалкилпроизводных
Иллюстрации
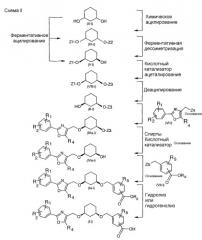
Показать всеИзобретение относится к способу получения соединения общей формулы (I), включающему стадии согласно следующей схеме:
причем на отдельных стадиях: а1) соединение формулы (IX) превращают в соединение формулы (V) в присутствии фермента, выбранного из липазы В из Candida antarctica, b) соединение формулы (V) в присутствии кислотного катализатора посредством действия соединения, которое может образовывать защитную группу Z3, стабильную в щелочной среде и лабильную в кислой среде, превращают в соединение формулы (VIII) и с) соединение формулы (VIII) в присутствии нуклеофильного агента превращают в соединение формулы (II); d) соединение формулы (II) в присутствии основания В1 превращают посредством действия соединения формулы (VI) в соединение формулы (IIIа); е) соединение формулы (IIIа) превращают в соединение формулы (IVa), причем соответствующее превращение осуществляют посредством действия спирта в присутствии кислотного катализатора; f) соединение (IVa) посредством действия соединения (VII) превращают в соединение формулы (Iа) в присутствии основания В1 и g) при необходимости, соединение (Iа) гидролизуют или подвергают гидрогенолизу до соединения (I), если R3 представляет собой Н; причем соединения (IX) представляет собой чистый цис-изомер или смесь цис/транс-изомеров соответственно; при этом переменные и заместители имеют следующие значения соответственно: цикл А представляет собой С3-С8циклоалкил, R1, R2, R4 и R5 представляют собой независимо друг от друга Н, F, Cl, Вr, C1-С6алкил или -O-(С1-С6алкил); R3 представляет собой Н, C1-С6алкил; R6 представляет собой C1-С6алкил или бензил; Х представляет собой C1-С6алкил; Y представляет собой C1-С6алкил; Z1 представляет собой защитную группу, стабильную в кислой среде; Z2 представляет собой защитную группу, стабильную в кислой среде; Z3 представляет собой защитную группу, стабильную в щелочной среде и лабильную в кислой среде; Z4 представляет собой уходящую группу; Z5 представляет собой уходящую группу; В1 представляет собой третичный алкоголят щелочноземельного металла, третичный алкоголят щелочного металла, амид щелочноземельного металла, амид щелочного металла, силазид щелочноземельного металла, силазид щелочного металла или гидрид щелочного металла. Изобретение также относится к способу получения соединения общей формулы (I), включающему стадии согласно следующей схеме:
причем на отдельных стадиях: а2) соединение формулы (X) посредством по меньшей мере одного донора ацильных групп в присутствии фермента, выбранного из липазы В из Candida antarctica, превращают в соединение (V); стадии b) - g) описаны выше, причем соединение (X) представляет собой чистый цис-изомер или смесь цис/транс-изомеров соответственно. Изобретение также относится к соединению общей формулы (IIIа), где цикл А представляет собой циклогексил, причем Х-содержащий и Z3-содержащий заместители стоят в цис-1,3-положении циклогексильного фрагмента; R1, R2 и R4 представляют собой независимо друг от друга Н, F, Сl, C1-С3алкил или -С(O)-(С1-С6алкил); Z3 представляет собой тетрагидропиранил; Х представляет собой метил и к соединению общей формулы (VIII), где цикл А представляет собой циклогексил, причем Z1-содержащий и Z3-содержащий заместители стоят в цис-1,3-положении циклогексильного фрагмента; Z1 представляет собой -С(O)СН3; Z3 представляет собой тетрагидропиранил. 4 н. и 10 з.п. ф-лы, 2 табл.
Реферат
Настоящее изобретение относится к способу получения диарилциклоалкилпроизводных общей формулы (I). Кроме того, данное изобретение относится к новым промежуточным продуктам, которые образуются способом по настоящему изобретению, к способу получения промежуточных продуктов для соединений общей формулы (I) и к способу отделения смеси цис/транс-изомеров от исходных веществ, применяемых при получении соединений общей формулы (I)
Соединения формулы (I) представляют собой активаторы рецепторов, активируемых пролифератором пероксисом (PPAR-активаторы), и уже известны из документа WO 03/020269. Из описанных в документе WO 03/020269 PPAR-активаторов эффективными PPAR-активаторами оказались те, которые проявляют способность к цис-замещению X- и Y-содержащих заместителей в центральном цикле A. В частности, это относится к соединениям, в которых цикл A представляет собой циклогексил‚ предпочтительно цис-1,3-циклогексил.
При синтезе или выделении требуемых целевых соединений формулы (I) трудность представляют, главным образом, два фактора. Одним из них является цис/транс-изомерия заместителей цикла A. Так как вместе с соединениями формулы (I) соответствующие цис-изомеры эффективных PPAR-активаторов имеются в виде соответствующих транс-изомеров, то целесообразно уже к началу синтеза на соответствующих промежуточных стадиях отделять соответствующие транс-изомеры цикла A, чтобы избежать нежелательного снижения выхода продукта. В качестве другого фактора при рассмотрении соответствующего цис-изомера цикла A следует учитывать то, что в большинстве промежуточных продуктов, а также в целевых соединениях формулы (I) имеются два асимметрических атома углерода и цикл A замещен двумя различными радикалами (X, Y). Следовательно, при присоединении к циклу A, например, X-содержащих заместителей необходимо учитывать, что при эквимолярном превращении образуется рацемическая смесь, поскольку данный заместитель принципиально может присоединяться к обеим функциональным группам цикла A. Если данное обстоятельство не учитывают, то получают соединения формулы (I) в виде рацемической смеси.
Хотя описанным в документе WO 03/020269 способом получения PPAR-активаторов принципиально можно получать соединения формулы (I) в энантиомерно чистой форме, однако описанный в данном документе способ обладает отдельными значимыми недостатками: применение и утилизация ядовитых соединений олова и фторида цезия; применение и утилизация йодсодержащих соединений; рацемический синтез, то есть после отделения ненужного энантиомера хиральной хроматографией по меньшей мере половина дорогостоящих исходных веществ теряется в качестве отходов, при этом хиральную хроматографию необходимо дополнительно сочетать с нехиральной хроматографией; половина продукта и, соответственно, половина применяемых ценных исходных веществ теряется при разделении рацемата с обоими энантиомерами; "ложный" энантиомер не может быть использован как вторичное сырье и должен быть утилизирован в качестве отхода; применение гидрида натрия в качестве основания и N,N-диметилформамида в качестве растворителя (возможно экзотермическое разложение).
Для получения избытка энантиомера или энантиомерно чистого соединения формулы (I) по способу, описанному в документе WO 03/020269, необходимо в обязательном порядке применять хиральную хроматографию. В частности, при крупномасштабном производстве большие издержки, связанные с применением хиральной хроматографии, оказываются главным недостатком данного способа.
Альтернативный способ получения PPAR-активаторов, которые относятся к PPAR-активаторам, описанным в документе WO 03/020269, описывается в международной заявке 10308350.2. В данном способе, который ограничивается только цис-1,3-двузамещенными производными циклогексана, алкилируют сначала цис-1,3-циклогександиол с защитной группой (бензил или силил) или уже с одним из двух заместителей целевого соединения, причем образуется рацемическая смесь соответствующего моноалкилированного соединения в цис-форме. В свою очередь, данный промежуточный продукт приводят во взаимодействие с донором ацильных групп, после чего его также в виде рацемата моноалкилированного и моноацилированного промежуточного продукта разделяют ферментативным расщеплением сложного эфира с последующей хроматографией на две фракции, из которых соответственно могут быть синтезированы раздельно проводимыми реакциями оба энантиомера целевого соединения. Рацемический моноалкилированный промежуточный продукт альтернативным образом может быть разделен ферментативной этерификацией с последующей хроматографией на две фракции, из которых, в свою очередь, могут быть синтезированы в двух отдельных загрузках обе энантиомерные формы целевого соединения. Недостатком данного способа является, в частности, то, что, несмотря на отсутствие хиральной хроматографии, вначале получают рацемический промежуточный продукт, из которого безальтернативно получают обе энантиомерные формы целевого соединения. При использовании варианта синтеза с предварительно введенной защитной группой бензилсодержащие защитные группы необходимо удалять гидрированием. При таком гидрировании первый заместитель целевого соединения, уже присоединенный на соответствующей промежуточной стадии, также может удаляться в известной степени, что ведет к снижению выхода продукта. Силилсодержащие защитные группы удаляют фторидом, но это также ведет к другим побочным реакциям с остальными заместителями соответствующих промежуточных соединений, и, следовательно, этого необходимо избегать.
Применение ферментов для разделения рацемических смесей различных соединений (исходных веществ или промежуточных продуктов) было уже многократно описано в литературе. Однако отыскание приемлемого фермента для энантиоселективного разделения соответствующей рацемической смеси, подлежащей разделению, представляет собой трудную задачу.
Так, Hirata et al., Chirality 9: 250-253 (1997), описывают гидролиз цис- и транс-1,3-диацетоксициклогексанов до ацилоксициклогексанола в присутствии культивированных растительных клеток маршанции разнообразной (Marchantia polymorpha). При этом необходимо культивировать растительные клетки, а соответствующие ферменты неизвестны. Избыток энантиомера при гидролизе мезо-цис-1,3-диацетоксициклогексана составляет при этом только 15% для (1R,3S)-1-ацетоксициклогексан-3-ола. Транс-1,3-диацетоксициклогексан превращается в (1R, 3R)-3-ацетоксициклогексан-1-ол (выход 60%) с 27% избытка энантиомера и циклогексан-1,3-диол (выход 70%). Поэтому данный способ не подходит для получения приемлемого избытка энантиомера или энантиомерно чистого цис-1S-ацилоксициклогексан-3R-ола.
K. Laumen et al., J. Chem. Soc., Chem. Common., (1986) 1298 - 1299, описали ферментативный гидролиз цис-1,4-диацетоксициклопент-2-ена в присутствии липаз, таких, как Pseudomonas species или Mucor miehei. При степени превращения приблизительно 50% образуется моноацетилированный энантиомер с энантиомерной чистотой от 95 до 97%. Энантиомерная чистота может быть повышена перекристаллизацией до значения более 99%.
Лежащая в основе данного изобретения задача состоит в том, чтобы разработать новый способ получения PPAR-активаторов общей формулы (I), который не обладает недостатками известных способов предшествующего уровня техники. В частности, необходимо разработать способ, которым можно получать PPAR-активаторы общей формулы (I) с приемлемым избытком энантиомера, то есть с более высокой энантиоселективностью, без необходимости применять хиральную хроматографию.
Решение задачи представляет собой способ получения соединения общей формулы (I), содержащий следующие стадии, причем:
а1) соединение формулы (IX) превращают в соединение формулы (V) посредством действия воды в присутствии фермента, обеспечивающего приемлемый избыток энантиомера соединения (V), или
a2) соединение формулы (X) превращают в соединение (V) посредством действия по меньшей мере одного донора ацильных групп в присутствии фермента, обеспечивающего приемлемый избыток энантиомера соединения (V);
b) соединение (V) в присутствии кислотного катализатора действием соединения, которое может образовывать защитную группу Z3, стабильную в щелочной среде и лабильную в кислой среде, превращают в соединение формулы (VIII) и
c) соединение (VIII) в присутствии нуклеофильного агента превращают в соединение формулы (II);
d) соединение (II) в присутствии основания B1 превращают действием соединения формулы (VI) в соединение формулы (IIIa) или действием соединения формулы (VII) в соединение формулы (IIIb)
e) соединение (IIIa) превращают в соединение формулы (IVa) или соединение (IIIb) превращают в соединение формулы (IVb), причем соответствующее превращение осуществляют действием спирта в присутствии кислотного катализатора;
f) соединение (IVa) посредством действия соединения (VII) или соединение (IVb) посредством действия соединения (VI) превращают в соединение формулы (Ia) в присутствии основания B1 и
g) при необходимости, соединение (Ia) гидролизуют или, если R3 представляет собой H, подвергают гидрогенолизу до соединения (Ia);
причем соединения (IX) и (X) представляют собой чистый цис-изомер или смесь цис/транс-изомеров соответственно;
при этом переменные и заместители имеют следующие значения соответственно:
цикл A представляет собой C3-C8циклоалкил или C3-C8циклоалкенил, причем в циклолалкильных или циклоалкенильных циклах один или несколько атомов углерода могут быть замещены атомами кислорода;
R1, R2, R4 и R5 представляют собой независимо друг от друга H, F, Cl, Br, OH, NO2, CF3, OCF3, C1-C6алкил или -O-(C1-C6алкил);
R3 представляет собой H, C1-C6алкил или бензил, которые, при необходимости, могут быть замещены F, Cl, Br, OH, NO2, CF3, OCF3, C1-C6алкилом или -O-(C1-C6алкилом);
R6 представляет собой C1-C6алкил или бензил, которые, при необходимости, могут быть замещены F, Cl, Br, OH, NO2, CF3, OCF3, C1-C6алкилом или -O-(C1-C6алкилом);
X представляет собой C1-C6алкил, причем в алкильной группе один или несколько атомов углерода могут быть замещены атомами кислорода;
Y представляет собой C1-C6алкил, причем в алкильной группе один или несколько атомов углерода могут быть замещены атомами кислорода;
Z1 и Z2 представляют собой независимо друг от друга защитные группы, стабильные в кислой среде;
Z3 представляет собой защитную группу, стабильную в щелочной среде и лабильную в кислой среде;
Z4 и Z5 представляют собой независимо друг от друга уходящие группы;
B1 представляет собой третичный алкоголят щелочноземельного металла, третичный алкоголят щелочного металла, амид щелочноземельного металла, амид щелочного металла, силазид щелочноземельного металла, силазид щелочного металла или гидрид щелочного металла.
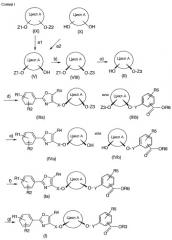
Соединения, упомянутые в приведенных ранее стадиях способа, показаны на представленной далее схеме I, служащей для пояснения способа по настоящему изобретению.
Стадии способа, приведенные на схеме I, далее поясняются более подробно.
В соединениях (с I по VIII), приведенных на схеме I, касательно обоих заместителей, связанных с циклом A (в соответствующих соединениях), имеет место замещение в цис-положении упомянутыми обоими заместителями относительно цикла A. Например, речь может идти о замещении в цис-1,2-, цис-1,3- или цис-1,4-положении. При этом предпочтительным является замещение в цис-1,2- и цис-1,3-положении и более предпочтительным является замещение в цис-1,3-положении. В частности, предпочтительным является замещение в цис-1,3-положении циклогексильного цикла A. Для упрощения цикл A или также заместители X и Y далее обозначаются просто как радикалы (алкил или алкенил), даже если - в зависимости от рассматриваемого варианта - в случае цикла A под обозначением подразумевается алкан или алкен (цикл A как основной фрагмент формулы (I)) и соответственно алкилен или алкенилен.
Под приемлемым избытком энантиомера (высокой энантиоселективностью) следует понимать энантиомерную чистоту (ee) больше 50%, предпочтительно больше 90%, более предпочтительно больше 95%, еще более предпочтительно больше 98%, наиболее предпочтительно больше 99% и особо предпочтительно больше 99,5%.
Предпочтительно стадию a1) и/или a2) проводят в присутствии липазы B из Candida antarctica.
Способ по настоящему изобретению по сравнению со способами по предшествующему уровню техники обладает тем преимуществом, что посредством использования соответствующих ферментов хиральная структура вводится уже к началу процесса с соответствующими предшественниками, вследствие чего упомянутые предшественники уже обладают в отношении энантиоселективности приемлемым, при необходимости даже крайне высоким, избытком энантиомера (энантиомерная чистота более 99%). Следовательно, возможно также получать требуемые энантиомеры соединений (I) энантиоселективно с приемлемым, при необходимости даже крайне высоким, избытком энантиомера (энантиомерная чистота более 99%). Вследствие этого по сравнению с известными способами по предшествующему уровню техники не наблюдается снижение выхода продукта до 50% и также не требуется разделять рацемические смеси цис-энантиомеров соответствующих промежуточных продуктов для того, чтобы получить требуемый энантиомер соединений (I) с приемлемым избытком энантиомера.
Неожиданным образом, благодаря стабильной в щелочной среде защитной группе Z3, несмотря на двойную стадию алкилирования, сохраняется имеющаяся уже к началу синтеза хиральная структура (энантиомерная чистота предшественников отчасти более 99%) вплоть до получения требуемого хирального PPAR-активатора формулы (I), энантиомерная чистота которого, таким образом, также превосходит 99%. Кроме того, применяемые в способе по настоящему изобретению ферменты предоставляют возможность использовать применяемые исходные вещества не только в виде соответствующего чистого цис-изомера, но также и в виде смеси цис/транс-изомеров, при этом не ухудшая энантиомерную чистоту промежуточных продуктов и соответственно целевого соединения. При применении в способе по настоящему изобретению в качестве исходных соединений смеси цис/транс-изомеров соответствующие исходные соединения в транс-форме, благодаря применяемой технике защитных групп, можно без проблем удалять при очистке промежуточных продуктов, например экстракцией. Вследствие этого не требуется в обязательном порядке дополнительная стадия очистки, например хроматографией.
По сравнению с вариантом синтеза, изложенным в документе WO 03/020269, могут быть отмечены, в частности, следующие преимущества: при выборе приемлемой липазы ферментативной десимметризацией можно получать почти чистый энантиомер (чистота более 99%) соединения (V), который в качестве исходного вещества является важным элементом для стереоселективного синтеза PPAR-активаторов формулы (I) с оптической чистотой более 99%; стереохимическая структура сохраняется неожиданным образом благодаря соответствующей технике защитных групп вплоть до получения требуемого хирального PPAR-активатора, так что больше не требуется утилизировать в качестве отхода половину ценных исходных веществ; дорогостоящее разделение рацемата, например хиральной хроматографией, может больше не проводиться; применение и утилизация ядовитых соединений олова, йодсодержащих соединений и фторида цезия больше не являются необходимыми; применение гидрида натрия в качестве основания и N,N-диметилформамида в качестве растворителя больше не является необходимым; применение хроматографии требуется только лишь в незначительной степени, если вообще требуется.
В частности, при использовании липазы B из Candida antarctica, применяемой на стадии а1) по настоящему изобретению, в количестве более 90% уже в растворе может быть достигнута энантиомерная чистота более 99%, вследствие чего перекристаллизация не требуется.
Способом по настоящему изобретению можно получать соединения общей формулы (I):
где:
цикл A представляет собой C3-C8циклоалкил или C3-C8циклоалкенил, причем в циклолалкильных или циклоалкенильных циклах один или несколько атомов углерода могут быть замещены атомами кислорода;
R1, R2, R4 и R5 представляют собой независимо друг от друга H, F, Cl, Br, OH, NO2, CF3, OCF3, C1-C6алкил или -O-(C1-C6алкил);
R3 представляет собой H, C1-C6алкил или бензил, которые, при необходимости, могут быть замещены F, Cl, Br, OH, NO2, CF3, OCF3, C1-C6алкилом или -O-(C1-C6алкилом);
X представляет собой C1-C6алкил, причем в алкильной группе один или несколько атомов углерода могут быть замещены атомами кислорода;
Y представляет собой C1-C6алкил, причем в алкильной группе один или несколько атомов углерода могут быть замещены атомами кислорода.
Предпочтительно способом по настоящему изобретению можно получать соединения общей формулы (I), где:
цикл A представляет собой циклопентил, циклогексил или циклогептил;
R1, R2, R4 и R5 представляют собой независимо друг от друга H, F, Cl, Br, OH, NO2, CF3, OCF3, C1-C6алкил или O-(C1-C6алкил);
R3 представляет собой H или C1-C6алкил или бензил;
X и Y представляют собой независимо друг от друга C1-C6алкил.
Более предпочтительно способом по настоящему изобретению можно получать соединения общей формулы (I), где:
цикл A представляет собой циклогексил, причем X-содержащий и Y-содержащий заместители формулы (I) стоят в цис-1,3-положении циклогексильного фрагмента;
X и Y представляют собой метил.
Еще более предпочтительно способом по настоящему изобретению можно получать соединения общей формулы (I), где:
цикл A представляет собой циклогексил, причем X-содержащий и Y-содержащий заместители формулы (I) стоят в цис-1,3-положении циклогексильного фрагмента и атом углерода цикла A, связанный с Y-содержащим заместителем, имеет R-конфигурацию;
X и Y представляют собой метил.
Особо предпочтительно способом по настоящему изобретению можно получать соединения общей формулы (I), где:
цикл A представляет собой циклогексил, причем X-содержащий и Y-содержащий заместители формулы (I) стоят в цис-1,3-положении циклогексильного фрагмента и атом углерода цикла A, связанный с Y-содержащим заместителем, имеет R-конфигурацию;
X и Y представляют собой метил;
R1, R2 и R4 представляют собой независимо друг от друга H, F, Cl, C1-C3алкил или -O-(C1-C3алкил);
R5 представляет собой H или C1-C3алкил.
Приведенное на схеме I соединение (IX), которое по настоящему изобретению может применяться в качестве исходного вещества, в свою очередь, может быть получено:
i) превращением соединения (X) посредством действия по меньшей мере одного донора ацильных групп в присутствии фермента, обеспечивающего получение преимущественно цис-изомера соединения (IX), и отделением транс-изомеров соединений формулы (V), в случае их образования в качестве побочных продуктов, или
ii) превращением соединения (X) посредством действия по меньшей мере одного донора ацильных групп.
Стадию i) проводят предпочтительно в присутствии липазы поджелудочной железы свиньи, липазы из Burkholderia cepacia, липазы из Burkholderia species, липазы из Pseudomonas cepacia или липазы из Pseudomonas species.
Далее в качестве примера представлен способ по настоящему изобретению с учетом схемы I в пределах типично принимаемой последовательности реакций, включая предварительные стадии.
Отсылка на конкретный пример в следующем далее тексте служит только для пояснения последовательности реакций, описанной в качестве примера, и не означает, что способ по настоящему изобретению ограничивается данным конкретным примером.
Стадия a)
В способе по настоящему изобретению на стадии a) получают соединения (V), причем имеется несколько вариантов. Соединения (V) уже давно известны из литературных источников. Например, K. Dimroth et al., Ber. (1942), 75B, 322-6, описали моноацетат ацилоксициклогексанола. Кроме того, в процитированной ранее публикации T. Hirata и др. описано возможное выделение различных цис-1S-ацилоксициклогексан-3R-олов хиральной хроматографией. Главной проблемой при этом следует считать выделение соединения (V) в виде отдельного энантиомера, что на практике представляет очень большую трудность, так как для этого должна применяться преимущественно хиральная хроматография.
а) Ферментативное ацилирование
В качестве альтернативы хиральной хроматографии может быть представлено получение отдельных энантиомеров соединений (V) ферментативным ацилированием соединений (X). Соединения (X) могут использоваться или в виде смеси цис/транс-изомеров, или в виде чистых цис-изомеров и в такой форме продаются различными производителями(например, фирмами Merck, Fluka или Aldrich). Недостатком использования соединений (X) в виде чистых цис-изомеров является то, что изомеры сначала должны быть выделены из соответствующих смесей цис/транс-изомеров, и соответственно то, что чистые цис-изомеры стоят дороже. Для разделения смесей цис/транс-изомеров соединений (X) может использоваться, например, в случае 1,3-циклогександиола, кристаллизация в виде комплекса цис-1,3-циклогександиола с медью (W. Rigby, J. Chem. Soc. (1949), 1586; R. Sillanpää et al., Polyhetron 21 (2002), 1133-1138).
Исходя из соединений (X), можно проводить ферментативное ацилирование в пределах способа по настоящему изобретению в присутствии различных ферментов (например, липаз) с донором ацильных групп. При этом могут использоваться отдельные доноры ацильных групп или смесь нескольких доноров ацильных групп. Реакцию можно осуществлять без дополнительного органического растворителя (пример 1) или с дополнительным органическим растворителем (пример 2). В качестве органического растворителя принципиально могут быть приняты во внимание все традиционные органические растворители, такие как толуол, хлорированные углеводороды или простые эфиры, например метил-трет-бутиловый эфир. Однако реакция не может быть проведена в воде. В качестве доноров ацильных групп приемлемыми являются все химические соединения, которые могут образовывать стабильные в кислой среде защитные группы Z1 или Z2. В качестве примера могут быть приведены сложные эфиры карбоновых кислот. Предпочтительно приемлемыми являются виниловые сложные эфиры, такие как винилацетат, изопропенилацетат, виниллаурат или винилбутират, особо предпочтительными являются винилацетат или изопропенилацетат.
Для ферментативного ацилирования не может быть использован любой фермент. Более того, должен применяться такой фермент, с которым можно получать, прямо или косвенно, требуемое целевое соединение с приемлемым избытком энантиомера. Кроме того, от используемого фермента зависит, образуется ли из соединений формулы (X) соединения (V) прямым путем или сначала (при косвенном пути) образуется соединение (IX), которое, в свою очередь, затем должно быть превращено в соединение (V). Если используется липаза, которую выделяют из фракции B микроорганизма Candida antarctica (далее упоминается как липаза B из Candida antarctica, выделение фракций по EP-A 287634), то при использовании, в качестве исходной, смеси цис/транс-изомеров соединения (X) образуется преимущественно моноацильное соединение (V) в цис-форме, в то время как диацильное соединение (IX) образуется в качестве побочного продукта. Тогда как моноацильное соединение (V) в транс-форме при применении липазы B из Candida antarctica не образуется, поскольку соответствующее исходное соединение (X) в транс-форме или не вступает во взаимодействие, или превращается в соответствующее диацильное соединение (IX).
Прямое превращение (ферментативное ацилирование) соединения формулы (X) в соединение формулы (V) проводят предпочтительно в присутствии липазы B из Candida antarctica. Особо предпочтительно такое превращение проводят в присутствии липазы, выбранной из ферментов Chirazyme L2 lyo., Chirazyme L2 c.f. C2 или Chirazyme L2 c.f. C3. Соответствие упомянутых ферментов (по их коммерческим названиям) c надлежащими номерами доступа банка генов Национального центра биотехнологической информации (NCBI) может быть выяснено из таблицы 1, приведенной в примере 1.
Получающаяся при таком превращении реакционная смесь соединений формул (IX) и (V) может быть, при необходимости, разделена экстракцией, перегонкой или хроматографией. Однако для достижения избытка энантиомера разделение на данной стадии не требуется в обязательном порядке, так как образующееся в качестве побочного продукта соединение (IX) на следующей далее стадии b) может быть и без защитной группы Z3. Вследствие этого на стадии c) способа по настоящему изобретению снимают двойную защиту побочного продукта (IX) и, при необходимости, удаляют экстракцией при обработке соединения (II). Подобное соображение может быть принято во внимание в отношении непревращенного исходного соединения (X), чтобы провести разделение или уже на данной стадии экстракцией, перегонкой или хроматографией, или при обработке соединений (II) или (IX).
Вместо липазы B из Candida antarctica при ферментативном ацилировании могут применяться также липаза поджелудочной железы свиньи, липаза из Burkholderia cepacia, липаза из Burkholderia species, липаза из Pseudomonas cepacia или липаза из Pseudomonas species. При применении упомянутых липаз из исходного соединения (X) образуются как соединения (IX), так и соединения (V). Однако моноацильные соединения (V) не находятся в требуемой транс-форме, в то время как образовавшиеся при этом соединения (IX) неожиданным образом находятся преимущественно в цис-форме диацильных соединений. Упомянутые диацильные соединения (IX) в цис-форме могут быть превращены, как поясняется далее, ферментативной десимметризацией (ферментативным гидролизом) в требуемые цис-энантиомеры соединения (V).
Превращение соединения (V) ферментативным ацилированием в соединение (IX), которое находится преимущественно в виде цис-изомера, проводят предпочтительно в присутствии липазы, выбранной из липазы поджелудочной железы свиньи, липазы из Burkholderia cepacia, липазы из Burkholderia species, липазы из Pseudomonas cepacia или липазы из Pseudomonas species. Более предпочтительно липазу выбирают из липазы поджелудочной железы свиньи, липазы из Burkholderia cepacia, липазы из Burkholderia species или липазы из Pseudomonas cepacia. Наиболее предпочтительно липазу выбирают из ферментов Chirazyme L1 lyo, Chirazyme L1 c.f., Chirazyme L7 lyo или липазы PS. Особо предпочтительно липазу выбирают из ферментов Chirazyme L1 lyo., Chirazyme I1 c.f. или Chirazyme I7 lyo. Соответствие коммерческих названий упомянутых ферментов c номерами доступа банка генов NCBI может быть выяснено из таблицы 1.
Если используется исходное вещество (X) в виде смеси цис/транс изомеров, то для достижения избытка энантиомера, разумеется, требуется отделение соединения (V) в транс-форме, которое образуется при данном варианте синтеза в виде нежелательного побочного продукта, от соединения (IX) экстракцией, перегонкой или, при необходимости, хроматографией. Однако данная стадия обработки отпадает при применении соединения (X) в виде чистого цис-изомера. Возможное отделение побочного продукта (V) осуществляют предпочтительно экстракцией. Так как заключительную ферментативную десимметризацию соединения (IX) осуществляют с другим ферментом и, к тому же, в водной среде, необходимо заранее удалить примененный при ферментативном ацилировании фермент, например фильтрованием. Фермент удаляют предпочтительно перед отделением моноацильного соединения (соединение (V) в транс-форме).
Химическое ацилирование/ферментативная десимметризация
Другую возможную отправную точку для получения соединений (V) представляют соединения (IX), которые также в виде смеси цис/транс-изомеров или в виде чистых цис-изомеров продаются различными производителями (например, фирмами Merck, Fluka или Aldrich). Разделение смесей цис/транс-изомеров можно осуществлять, например, в случае цис-1,3-диацетоксициклогексана, перегонкой обоих изомеров, температуры кипения которых различаются на 1°C. Однако вследствие обычно небольшой разницы температур кипения данный метод является затратным и дорогостоящим. Соединения (IX) могут быть получены, как было упомянуто ранее, ферментативным ацилированием соединений (X). Альтернативно соединения формулы (X) также можно прямо превращать действием упомянутых ранее доноров ацильных групп (в присутствии ферментов) в соединения (IX). Данная реакция известна уже давно и называется химическим ацилированием, которое протекает, однако, нестереоселективно (примеры 3 и 4). Химическое ацилирование можно осуществлять, например, действием смеси уксусный ангидрид/4-диметиламинопиридин (4-DMAP), триэтиламина (TEA) в дихлорметане. Химическое ацилирование можно осуществлять действием отдельного донора ацильных групп или смеси доноров ацильных групп, предпочтительно действием отдельного донора ацильных групп, так что заместители Z1 и Z2 в соединении (IX) имеют одинаковое значение.
Соединения (IX) могут быть превращены в соединение (V) посредством действия воды в присутствии фермента, обеспечивающего приемлемый избыток энантиомера соединения (V). В качестве фермента применяют предпочтительно липазу B из Candida antarctica. Особо предпочтительно такое превращение проводят в присутствии липазы, выбранной из ферментов Chirazyme L2 lyo., Chirazyme L2 c.f. C2 или Chirazyme L2 c.f. C3. Данную реакцию необходимо проводить в водном растворе, заключительное применение органических растворителей в данном случае неприемлемо. Неожиданным образом диацильное соединение (IX) в транс-форме не видоизменяется липазой B из Candida antarctica.
Таким образом, в обоих упомянутых способах (ферментативном ацилировании и химической десимметризации), а также возможной комбинации обоих способов (ферментативного ацилирования с заключительной ферментативной десимметризацией) могут использоваться соединения (X) в виде смеси цис/транс изомеров для получения избытка энантиомера или энантиомерно чистого моноацильного соединения (V) в цис-форме. Данный способ является более экономичным, чем применение чистых изомеров. Таким образом, получение энантиомерно чистых соединений (V) является другим объектом данного изобретения. Под энантиомерно чистыми соединениями в пределах данного изобретения следует понимать соединения, чистота которых составляет более 98% (ee >98%), предпочтительно более 99% (ee >99%), особо предпочтительно более 99,5% (ee >99,5%).
Большим преимуществом применения липазы B из Candida antarctica следует считать то, что независимо от того, применяется ли отдельный донор ацильных групп или смесь доноров ацильных групп, соединение формулы (V) всегда образуется в энантиомерно чистой форме. В соединениях (IX), (V) и (XIII) защитные группы Z1 и Z2 независимо друг от друга представляют собой защитные группы, стабильные в кислой среде. Предпочтительно защитные группы Z1 и Z2 имеют одинаковые значения. Z1 и Z2 представляют собой предпочтительно -C(O)-R, где R представляет собой при необходимости замещенный алкил или арил, например C1-C6алкил или фенил. Z1 и Z2 независимо друг от друга представляют собой более предпочтительно -C(O)-(C1-C3алкил) и особо предпочтительно -C(O)-CH3. Липаза B из Candida antarctica может применяться как в неиммобилизованной форме (Chirazym L2), так и в иммобилизованной форме (c.f., c.f.C2, c.f.C3, производитель: Roche Diagnostics).
Липаза B из Candida antarctica поставляется также другими производителями, такими, как, например, Novozym (Novozym 435 в виде иммобилизата). К тому же, альтернативно может применяться также растворимая липаза B из Candida antarctica, такая, как, например, Novozym CALB L или Novozym 525 F после иммобилизации фермента.
Описанные ранее способы разделения смесей цис/транс-изомеров соединений (X) или (IX) и соответственно способы получения избытка энантиомера соединения (V) в цис-форме или энантиомерно чистого соединения (V) в цис-форме находят применение по настоящему изобретению, в частности, в том, что избыток энантиомера соединения (V) в цис-форме или энантиомерно чистое соединение (V) в цис-форме переводят соответствующей техникой защитных групп и последующим алкилированием в требуемое целевое соединение (I) (избыток энантиомера или энантиомерно чистое соединение), причем не требуется ни хиральная, ни нехиральная хроматография.
Все попытки по осуществлению селективного алкилирования энантиомерно чистого соединения (V) до сих пор не удавались, так как была отмечена меж- и внутримолекулярная миграция ацильной группы в неустранимых щелочных условиях алкилирования (ацил представляет собой, например, ацетил, бензоил). Поэтому пытаются применять технику защитных групп, стабильных в щелочных условиях, используя в качестве защитных групп такие, как, например, тетрагидропиранил, метоксиизопропил, так что сохраняется хиральная структура, образовавшаяся в соединении (V) вследствие ферментативной десимметризации, несмотря на щелочные условия алкилирования. Целенаправленным последовательным алкилированием с использованием техники защитных групп может быть достигнуто, в качестве второго объекта данного изобретения, получение требуемого стереоизомера PPAR-активатора, неожиданным образом, без потери хиральной структуры.
Стадия b)
Соединение (V) в присутствии кислотного катализатора действием соединения, которое может образовывать группу Z3, стабильную в щелочной среде и лабильную в кислой среде, превращают в соединение формулы (VIII). В качестве кислотных катализаторов могут применяться, например, неорганические кислоты, толуолсульфокислота, пириридин-пара-толуолсульфонат или кислотный ионообменник, такой как Amberlyst H15. С этой целью предпочтительно используют пириридин-пара-толуолсульфонат. Защитная группа Z3, имеющаяся в соединении (VIII), представляет собой защитную группу, стабильную в щелочной среде и лабильную в кислой среде. При этом речь идет предпочтительно об ацетальной или кетальной защитной группе. Z3 представляет собой более предпочтительно тетрагидропиранил или метоксиизопропил, особо предпочтительно тетрагидропиранил. В качестве соединения, которое может образовывать защитную группу, стабильную в щелочной среде и лабильную в кислой среде, предпочтительно приемлемым является дигидро-2H-пиран. Один эквивалент соединения (V) приводят во взаимодействие с соединением, образующим защитную группу Z3, стабильную в щелочной среде и лабильную в кислой среде, в количестве от 1 до 10 эквивалентов, предпочтительно от 1,1 до 1,4 эквивалента. Кислотный катализатор используют, как правило, в количестве от 0,01 до 1 эквивалента, предпочтительно от 0,05 до 0,1 эквивалента. Температура реакции составляет обычно от 20 до 80°C, предпочтительно от 50 до 60°C. Стадию b), как и все другие стадии по настоящему способу, осуществляют обычно при нормальном давлении. В качестве растворителя на стадии b) приемлемыми являются органические растворители, такие, как, например, хлорированные углеводороды, сложные эфиры карбоновых кислот, такие как этилацетат, амиды карбоновых кислот, такие как N-метилпирролидон, простые эфиры, такие как диэтиловый эфир или метил-трет-бутиловый эфир, ароматические углеводороды, такие как хлорбензол или толуол. Aльтернативно в качестве растворителя может применяться также и сам 3,4-дигидро-2H-пиран. Предпочтительным растворителем является толуол. Тогда как вода или спирты не являются приемлемыми растворителями, поскольку они взаимодействуют, например, с 3,4-дигидро-2H-пираном с образованием соответствующих ацеталей. Образующееся на данной стадии соединение (VIII) может быть очищено перегонкой, однако оно может использоваться на следующей стадии без дальнейшей очистки.
Стадия c)
Соединение (VIII) в присутствии нуклеофильного агента превращают в соединение (II). В данной реакции, называемой деацилированием, в качестве нуклеофильного агента могут использоваться, например, алкоголяты щелочных или щелочноземельных металлов, предпочтительно этилат натрия. На один эквивалент соединения (VIII) применяют от 0,1 до 10 эквивалентов нуклеофильного агента, каталитические количества составляют предпочтительно от 0,1 до 0,3 эквивалента. Температура реакции составляет обычно от 10 до 80°C, предпочтительно от 15 до 25°C. Данная ст