Производные хиназолина
Иллюстрации
Показать всеНастоящее изобретение относится к новым антагонистам рецептора АМРА-производным 1H-хиназолин-2,4-диона, выбранных из группы: N-(6-имидазол-1-ил-7-нитро-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)-метансульфонамида; N-(6-морфолин-4-ил-7-нитро-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)-метансульфонамида; N-(7-нитро-2,4-диоксо-6-пиррол-1-ил-1,4-дигидро-2Н-хиназолин-3-ил)метансульфонамида; N-(7-нитро-2,4-диоксо-6-[1,2,4]триазол-1-ил-1,4-дигидро-2Н-хиназолин-3-ил)-метансульфонамида; N-(7-нитро-2,4-диоксо-6-пиразол-1-ил-1,4-дигидро-2Н-хиназолин-3-ил)-метансульфонамида; N-(7-нитро-2,4-диоксо-6-пирролидин-1-ил-1,4-дигидро-2Н-хиназолин-3-ил)-метансульфонамида; N-(6-азетидин- 1-ил-7-нитро-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)-метансульфонамида; N-(7-нитро-2,4-диоксо-6-[1,2,3]триазол-1-ил-1,4-дигидро-2Н-хиназолин-3-ил)-метансульфонамида; N-(6-морфолин-4-ил-2,4-диоксо-7-трифторметил-1,4-дигидро-2Н-хиназолин-3-ил)метансульфонамида; N-(2,4-диоксо-6-[1,2,4]триазол-4-ил-7-трифторметил-1,4-дигидро-2Н-хиназолин-3-ил)метансульфонамида; (2,4-диоксо-6-[1,2,4]триазол-4-ил-7-трифторметил-1,4-дигидро-2Н-хиназолин-3-ил)амида этансульфоновой кислоты;
N-(6-имидазол-1-ил-2,4-диоксо-7-трифторметил-1,4-дигидро-2Н-хиназолин-3-ил)метансульфонамида; N-(2,4-диоксо-6-тиоморфолин-4-ил-7-трифторметил-1,4-дигидро-2Н-хиназолин-3-ил)метансульфонамида; N-(6-[1,4]оксазепан-4-ил-2,4-диоксо-7-трифторметил-1,4-дигидро-2Н-хиназолин-3-ил)метансульфонамида и N-(6-азетидин-1-ил-2,4-диоксо-7-трифторметил-1,4-дигидро-2Н-хиназолин-3-ил)-метансульфонамида и их физиологически приемлемых солей. Соединения могут найти применение при лечении таких заболеваний, как эпилепсия или шизофрения. Изобретение также относится к фармацевтической композиции на основе указанных выше соединений. 4 н. и 5 з.п. ф-лы.
Реферат
Настоящее изобретение относится к 1H-хиназолин-2,4-дионам, их получению, их применению в качестве фармацевтических веществ и фармацевтическим композициям, содержащим их.
В частности, настоящее изобретение обеспечивает соединения формулы (I)
где
G означает NR3R4 или OR5
где
R3, R4 и R5 означают независимо водород, арил, аралкил, ацил или алкил, необязательно замещенный арилом, гетероциклилом, арилоксигруппой, аралкилоксигруппой или алкоксикарбониламиногруппой, или
R3 и R4 образуют вместе со смежным атомом азота гетероарильную или гетероциклильную группу, содержащую по меньшей мере один кольцевой атом азота и присоединенную посредством данного кольцевого атома азота, где гетероарильная и гетероциклильная группы необязательно замещены арилом, аралкилом, арилоксиалкилом, аминокарбонилалкилом, моно- или диалкиламинокарбонилалкилом или морфолинокарбонилалкилом,
R1 означает нитрогруппу или трифторметильную группу, и
R2 означает алкил, арил или аралкил,
и их соли.
Как указано выше, алкил, гетероарил и гетероциклил являются необязательно замещенными, предпочтительно незамещенными, моно-, ди- или тризамещенными упомянутыми заместителями, более предпочтительно незамещенными или монозамещенными упомянутыми заместителями.
Если не указано иначе, выражения, использованные в данном изобретении, имеют следующие значения.
Ацил означает алкилкарбонил, арилкарбонил или аралкилкарбонил.
Алкил означает линейный, разветвленный или циклический, насыщенный или ненасыщенный, предпочтительно насыщенный алкил, предпочтительно (С1-С8)алкил, более предпочтительно (С1-С6)алкил, наиболее предпочтительно (С1-С4)алкил. Алкил является необязательно замещенным одним или несколькими заместителями, предпочтительно от одного до трех заместителей. Заместителями предпочтительно являются галоид, гидроксил, циангруппа, (С1-С4)алкоксигруппа, (С1-С4)алкоксикарбонил, (С1-С4)алкиламиногруппа, ди(С1-С4)алкиламиногруппа, (С1-С4)алкоксикарбониламиногруппа или (С1-С4)алкилкарбониламиногруппа.
Алкан (например, в алкансульфониле) и алк (например, в алкокси) определяются аналогично алкилу, особенно в отношении линейности, насыщенности, предпочтительного размера и необязательного замещения.
Арил означает предпочтительно фенил, нафтил или 5-10-членный гетероарил, более предпочтительно фенил или 5-6-членный гетероарил. Арил является необязательно замещенным, предпочтительно незамещенным, моно-, ди- или тризамещенным. Заместителями предпочтительно являются галоид, более предпочтительно фтор или хлор, нитрогруппа, циангруппа, формил, карбоксамидогруппа, гидроксил, аминогруппа, (С1-С4)алкиламиногруппа, ди(С1-С4)алкиламиногруппа, (С1-С4)алкил, (С1-С4)алкоксигруппа, (C1-С4)алкоксикарбонил, (С1-С4)алкансульфонил, (С1-С4)алкилкарбонил, (С1-С4)алкоксикарбониламиногруппа или (С1-С4)алкилкарбониламиногруппа.
Аралкил означает алкил, замещенный арилом.
Галоид означает предпочтительно бром, хлор или фтор.
Гетероарил означает моно- или полициклический, предпочтительно моно- или бициклический, наиболее предпочтительно моноциклический ароматический остаток, содержащий один или несколько, предпочтительно от одного до трех, кольцевых гетероатомов, предпочтительно выбранных из атомов азота, кислорода и серы, наиболее предпочтительно азот. Гетероарил означает предпочтительно 5-10-членный гетероарил, более предпочтительно 5-6-членный гетероарил. Гетероарил является необязательно замещенным, предпочтительно незамещенным, моно-, ди- или тризамещенным. Заместителями предпочтительно являются галоид, более предпочтительно фтор или хлор, нитрогруппа, циангруппа, формил, карбоксамидогруппа, гидроксил, аминогруппа, (C1-С4)алкиламиногруппа, ди(С1-С4)алкиламиногруппа, (С1-С4)алкил, (С1-С4)алкоксигруппа, (С1-С4)алкоксикарбонил, (С1-С4)алкансульфонил, (С1-С4)алкилкарбонил, (С1-С4)алкоксикарбониламиногруппа или (C1-С4)алкилкарбониламиногруппа.
Гетероциклил означает моно- или полициклический, предпочтительно моно- или бициклический, наиболее предпочтительно моноциклический, насыщенный или частично ненасыщенный циклический остаток, содержащий три или несколько кольцевых атомов, предпочтительно от трех до десяти кольцевых атомов, из которых один или несколько, предпочтительно от одного до трех, являются гетероатомами, предпочтительно выбранными из атомов азота, кислорода и серы. Гетероциклил является необязательно замещенным, предпочтительно галоидом, циангруппой, карбоксамидогруппой, гидроксилом, аминогруппой, (С1-С4)алкиламиногруппой, ди(С1-С4)алкиламиногруппой, (С1-С4)алкилом, (С1-С4)алкоксигруппой, (С1-С4)алкоксикарбонилом, (C1-С4)алкилкарбонилом, (С1-С4)алкоксикарбониламиногруппой или (C1-С4)алкилкарбониламиногруппой.
Соли означают предпочтительно физиологически приемлемые соли, образованные, как соответствует, прибавлением кислоты или основания.
Упомянутые необязательные заместители, перечисленные в определениях для алкила, арила, гетероарила и гетероциклила, следует понимать как заместители в добавление к тем, которые перечислены в общих формулах, т.е., например, алкил может иметь заместители, перечисленные в общей формуле и/или определениях.
Таутомерные формы соединений формулы (I) также охватываются изобретением. В тех случаях, где имеется один или несколько асимметрических атомов, особенно углеродных атомов, соединения существуют в индивидуальной оптически активной изомерной форме или в качестве их смесей, например в качестве рацемических или диастереомерных форм. Настоящее изобретение охватывает индивидуальные оптически активные изомеры, а также их смеси, например рацемические или диастереомерные смеси.
Предпочтение отдается соединениям формулы (Ia)
где R1, G и R2 имеют такие значения, которые определены в данном описании.
Дополнительное предпочтение отдается соединениям формулы (Ib)
где R2, R3 и R4 имеют такие значения, которые определены в данном описании.
Дальнейшее предпочтение отдается соединениям формулы (1с)
где R1, R2 и R5 имеют такие значения, которые определены в данном описании.
Дальнейшее предпочтение отдается соединениям формулы (Id)
где G и R2 имеют такие значения, которые определены в данном описании.
Дальнейшее предпочтение отдается соединениям формулы (Ie)
где R1 и R2 имеют такие значения, которые определены в данном описании.
Дальнейшее предпочтение отдается соединениям формулы (Ih)
где G и R2 имеют такие значения, которые определены в данном описании.
Предпочтительно G означает R3R4N.
Предпочтительно R3 означает водород, арил, аралкил, ацил или алкил, необязательно замещенный гетероциклилом, арилоксигруппой, аралкилоксигруппой или алкоксикарбониламиногруппой, и R4 означает водород или алкил, или R3 и R4 образуют вместе со смежным атомом азота гетероарил или гетероциклил, содержащий по меньшей мере один кольцевой атом азота и присоединенный посредством этого кольцевого атома азота, где гетероарил и гетероциклил являются необязательно замещенными арилом, аралкилом, арилоксиалкилом, аминокарбонилалкилом или морфолинокарбонилалкилом. Предпочтительно R3 и R4 образуют вместе со смежным атомом азота 5-членный гетероарил, содержащий по меньшей мере один кольцевой атом азота и связанный посредством данного кольцевого атома азота, наиболее предпочтительно имидазол-1-ил.
Предпочтительно R1 представляет нитрогруппу.
Предпочтительно R2 представляет метил, этил, фенил, бензил, нитрофенил или пиридил, наиболее предпочтительно метил, этил или фенид.
В другом варианте воплощения изобретение обеспечивает соединения формулы (I),
где
G означает NR3R4 или OR5,
где
R3 означает водород, аралкил или алкил, необязательно замещенный арилом, гетероциклилом, арилоксигруппой, аралкилоксигруппой или алкоксикарбониламиногруппой,
R4 означает водород или алкил, или
R3 и R4 образуют вместе со смежным атомом азота гетероарил или
гетероциклил, содержащий по меньшей мере один кольцевой атом азота и связанный посредством данного кольцевого атома азота, где гетероарил и гетероциклил являются необязательно замещенными арилом, аминокарбонилалкилом, моно- или
диалкиламинокарбонилалкилом или морфолинокарбонилалкилом, и
R5 означает алкил,
R1 означает нитрогруппу или трифторметил, и
R2 означает алкил,
и их соли.
Особенно предпочтительными являются соединения формулы (Ia), где R1 представляет нитрогруппу и R2 представляет метил.
Особенно предпочтительными являются соединения формулы (Ia), где R1
представляет трифторметил и R2 представляет метил.
Особенно предпочтительными являются соединения формулы (Ia), где R1 представляет нитрогруппу и R2 представляет этил.
Особенно предпочтительными являются соединения формулы (Ia), где R1 представляет трифторметил и R2 представляет этил.
Особенно предпочтительными являются соединения формулы (Ia), где R1 представляет нитрогруппу и R2 представляет фенил.
Особенно предпочтительными являются соединения формулы (Ia), где R1 представляет трифторметил и R2 представляет фенил.
Особенно предпочтительными являются соединения формулы (I), где G представляет насыщенный незамещенный гетероцикл.
Особенно предпочтительными являются соединения формулы (I), где R3 представляет метил и R4 представляет гидроксиэтил.
Предпочтительные, особенно предпочтительные диапазоны и формулы могут быть сопоставлены по усмотрению. Определения применимы к соединениям формулы (I) и соответствующим исходным материалам и промежуточным веществам.
В дальнейшем аспекте настоящее изобретение обеспечивает способы получения соединений по изобретению.
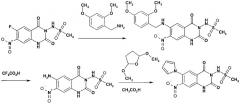
Способ 1
Соединения формулы (Ib)
где R2, R3 и R4 имеют значения, указанные выше,
могут быть получены взаимодействием соединения формулы (II)
где R2 имеет значение, указанное выше,
с соединением формулы (III)
,
где R3 и R4 имеют значения, указанные выше.
С этой целью смесь соединения формулы (II) с избытком соединения формулы (III), предпочтительно 1,5 до 30 эквивалентов, наиболее предпочтительно 2 до 10 эквивалентов, беспримесная или растворенная в соответствующем инертном растворителе, таком как 1,3-диметилимидазолидин-2-он, диметилсульфоксид, уксусная кислота или этанол, может быть нагрета в закрытом сосуде при высоких температурах, например 150°С, используя масляную баню или микроволновой реактор, в течение требуемого времени, например 5 мин до 1 ч, или альтернативно в соответствующем высококипящем инертном растворителе, как диметилсульфоксид, в открытой системе до более низкой температуры, например 120°С, в течение более длительного времени, например 16 ч. При необходимости защищенные части соединения, такие как гидроксил или аминогруппа, могут быть деблокированы в продукте реакции или продукт реакции может быть далее трансформирован, например, восстановлением или окислением.
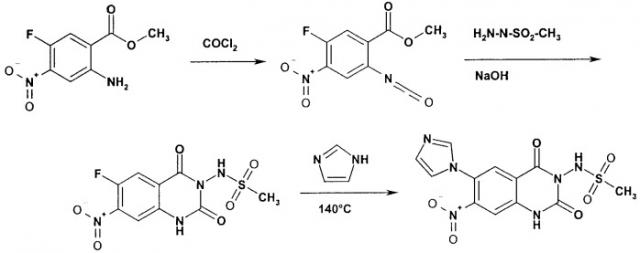
Соединение формулы (II) может быть получено общепринятыми способами из амина (IV).
где R6 означает алкил,
конверсией в изоцианат (V)
где R6 имеет значение, указанное выше,
например, реакцией с фосгеном и последующей циклоконденсацией с сульфонилгидразином (VI)
где R2 имеет значение, указанное выше,
в соответствующем инертном растворителе, таком как тетрагидрофуран, с последующим прибавлением основания, например водного раствора гидроксида натрия, или органического основания, такого как триэтиламин или основание Хюнига (N,N-диизопропилэтиламин). Соединения формул (IV) и (V) известны или могут быть получены по известным в литературе методикам или по аналогии с ними.
Следующая реакционная схема является иллюстративной для способа 1.
Схема 1
Способ 2
Соединения формулы (Ic)
где R1, R2 и R5 имеют значения, указанные выше, могут быть получены реакцией соединения формулы (VII)
где R1 и R5 имеют значения, указанные выше, и R7 означает алкил, с соединением формулы (VI) в соответствующем инертном растворителе, таком как тетрагидрофуран, необязательно в присутствии соответствующего основания, такого как водный раствор гидроксида натрия, или органического основания, такого как триэтиламин или основание Хюнига. Соответствующие температуры для данной реакции находятся в интервале 0-40°С, предпочтительно 22°С.
Изоцианат (VII) может быть получен из амина (VIII)
где R1 и R7 имеют значения, указанные выше,
реакцией с алкоголятом (IX)
где R5 имеет значение, указанное выше, и М+ означает металл, предпочтительно ион щелочного металла, в соответствующем инертном растворителе, например соответствующем спирте R5-ОН, с последующим гидролизом ацетамида, например с 98% серной кислотой, в амин (X).
где R1 и R7 имеют значения, указанные выше,
и конверсией в изоцианат (VII), например, с фосгеном или трифосгеном. Соединения формулы (VIII) известны или могут быть получены по известным в литературе методикам или по аналогии с ними.
Следующая реакционная схема является иллюстративной для способа 2.
Схема 2
Способ 3
Соединения формулы (Id)
где G и R2 имеют значения, указанные выше,
могут быть получены реакцией соединения формулы (XI)
где G имеет значение, указанное выше,
с соединением формулы (VI).
Реакцию осуществляют в соответствующем инертном растворителе, таком как тетрагидрофуран, с последующим действием основания, например водного раствора гидроксида натрия, или органического основания, такого как триэтиламин или основание Хюнига.
Изоцианат (XI) может быть получен нуклеофильным замещением фторида (XII)
с амином (III) или алкоксидом (IX), давая нитросоединение (XIII),
где G имеет значение, указанное выше,
с последующим восстановлением в амин (XIV),
где G имеет значение, указанное выше,
с соответствующим восстанавливающим агентом, например, гидрированием с водородом, используя палладий на угле в качестве катализатора, и трансформацией в изоцианат (XI), например, с фосгеном или трифосгеном.
Соединения формулы (XII) известны или могут быть получены по известным в литературе методикам или по аналогии с ними.
Следующая реакционная схема является иллюстративной для способа 3.
Схема 3
Способ 4
Соединения формулы (Ie)
где
R1 и R2 имеют значения, указанные выше, и
G' означает R3'R4'N или R5'O,
где
R3', R4' и R5' имеют значения R3, R4 и R5 соответственно, как указано выше, при условии, что углеродные атомы R3', R4' и R5', смежные с азотом и кислородом
R3'R4'N и R5'O соответственно, являются первичными или вторичными углеродными атомами,
могут быть получены конденсацией, алкилированием или восстановительным алкилированием соединений формулы (If),
где
R1 и R2 имеют значения, указанные выше, и
R8 означает аминогруппу или гидроксил,
с соответствующими галоидными или альдегидными предшественниками R3', R4' или R5' в присутствии катализатора конденсации, основания или восстанавливающего агента, например натрийборциангидрида, соответственно.
Соединения формулы (If) могут быть получены деблокированием соединений формулы (Ig)
где
R1 и R2 имеют значения, указанные выше, и
R9 означает замещенные аминогруппу или гидроксил,
которое, в свою очередь, может быть получено одним из приведенных выше способов 1-3. Соответствующие галоидные или альдегидные предшественники R3', R4' или R5' известны или могут быть получены по известным в литературе методикам или по аналогии с ними.
Следующая реакционная схема является иллюстративной для способа 4.
Схема 4
Способ 5
Соединения формулы (Ih)
где G и R2 имеют значения, указанные выше, получаются реакцией соединения формулы (XVI)
где
G имеет значение, указанное выше,
R11 представляет фенил, который необязательно замещен галоидом или (С1-С4)алкилом, с соединением формулы (VI).
Реакция предпочтительно осуществляется в соответствующем инертном растворителе, таком как тетрагидрофуран, с последующим прибавлением основания, например водного раствора гидроксида натрия, или органического основания, такого
как триэтиламин, этилдиизопропиламин или основание Хюнига.
Реакция особенно предпочтительна для соединений формулы (If), в которых G
находится в положении 6, и трифторметильная группа находится в положении 7.
Карбамат (XVI) может быть получен реакцией замещения соответствующего
аминосоединения формулы (XVII)
с хлорформиатом (XVIII)
где R11 имеет значения, указанные выше, в присутствии разбавителя, такого как диоксан, давая карбамат (XVI).
Соединения формул (XVIII) и (XVII) известны или могут быть получены по известным в литературе методикам или по аналогии с ними.
Следующая реакционная схема является иллюстративной для способа 5.
Схема 5
Следующие соображения могут применяться в зависимости от обстоятельств ко всем способам, описанным в контексте, а также к получению соответствующих исходных материалов и промежуточных веществ.
Одна или несколько функциональных групп, например карбоксигруппа, гидроксигруппа, аминогруппа или меркаптогруппа, могут нуждаться в блокировании в исходных соединениях с помощью защитных групп. Используемые защитные группы могут уже присутствовать в предшественниках и должны защищать реакционно-способные функциональные группы от нежелательных вторичных реакций, таких как реакции алкилирования, образования простых эфиров, образования сложных эфиров, сольволиз и подобные реакции. Отличительной чертой защитных групп является то, что они сами легко, т.е. без нежелательных вторичных реакций, подвергаются удалению, обычно сольволизом, восстановлением, фотолизом или также с помощью ферментативной активности, например, в условиях, аналогичных физиологическим условиям, и что они не присутствуют в конечных продуктах. Специалист знает или может легко установить, какие защитные группы соответствуют реакциям, упомянутым ранее и впредь.
Защита подобных функциональных групп такими защитными группами, сами защитные группы и реакции их удаления описаны, например, в стандартных справочных публикациях, таких как J.F.W.McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London and New York, 1973, в Т.W.Greene, "Protective Groups in Organic Synthesis", Wiley, New York, 1981, в "The Peptides"; том 3 (редакторы: E.Gross и J.Meienhofer), Academic Press, London and New York, 1981, в "Methoden der organischen Chemie" (Methods of organic chemistry), Houben Weyl, 4-е издание, том 15/1, Georg Thieme Verlag, Stuttgart, 1974, в H.-D.Jakubke и H.Jescheit, "Aminosäuren, Peptide, Proteine" (Amino acids, peptides, proteins), Verlag Chemie, Weinheim, Deerfield Beach, and Basel, 1982 и в Jochen Lehmann, "Chemie der Kohlenhydrate: Monosaccharide und Derivate" (Chemistry of carbohydrates: monosaccharides and derivatives), Georg Thieme Verlag, Stuttgart, 1974.
Кислотно-аддитивные соли могут быть получены из свободных оснований известным образом и наоборот. Соединения формулы (I) в оптически чистой форме могут быть получены из соответствующих рацематов согласно хорошо общепринятым процедурам, например ВЭЖХ с хиральной матрицей. Альтернативно могут быть использованы оптически чистые исходные соединения.
Стереоизомерные смеси, например смеси диастереомеров, могут быть разделены на соответствующие изомеры общепринятым по сути образом посредством соответствующих способов разделения. Диастереомерные смеси, например, могут быть разделены на их индивидуальные диастереомеры посредством фракционной кристаллизации, хроматографии, распределением между растворителями и подобными процедурами. Данное разделение может происходить или на уровне исходного соединения, или на уровне самого соединения формулы (I). Энантиомеры могут быть разделены посредством образования диастереоизомерных солей, например солеобразованием с энантиомерно чистой хиральной кислотой, или посредством хроматографии, например ВЭЖХ, с использованием хроматографических субстратов с хиральными лигандами.
В дальнейшем аспекте соединения обеспечивают новые промежуточные соединения, как определено выше. Данные промежуточные соединения применимы для получения соединений формулы (I) и также обладают интересными фармацевтическими свойствами. Данные соединения также являются объектом по настоящему изобретению.
Соединения по изобретению обладают фармакологической активностью и, следовательно, пригодны в качестве фармацевтических средств. В частности, соединения являются мощными конкурентными антагонистами рецептора АМРА (α-амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислоты) с некоторой активностью в отношении каинатных рецепторов.
Соединения по изобретению особенно эффективны в качестве фармацевтических средств в лечении эпилепсии, особенно частичных эпилептических припадков (простых, сложных и частичных, эволюционирующих во вторичные генерализованные эпилептические припадки) и генерализованных эпилептических припадков [малого эпилептического припадка (типичного и атипичного), миоклонического, клонического, тонического, тонического-клонического и атонического].
Соединения по изобретению особенно эффективны также в качестве фармацевтических средств в лечении психозов при шизофрении, при биполярном нарушении, болезни Паркинсона и при индуцированных препаратами психозах, а также в улучшении позитивных и негативных симптомов и эффективны при лечении пациентов, устойчивых к действию препаратов (сравни Н.О.Kalkman, E. GAD67: the link between GABA-deficit hypothesis and the dopaminergic- and glutamatergic theories of psychosis. J. Neural. Transm. 2003, 1110, c.c.803-812).
Кроме того, соединения по изобретению пригодны в качестве фармацевтических средств для лечения любой патологии, нарушения или клинического состояния, включающего опосредованное рецептором АМРА нейронное повреждение, например нейродегенеративные нарушения, такие как множественный склероз, амиотрофический латеральный склероз, болезнь Паркинсона, болезнь Хантингтона или болезнь Альцгеймера, шизофрения, особенно хроническая шизофрения, тревога, депрессия, биполярные нарушения настроения, нарушения сна, нарушения познавательной способности, рвота, шум в ушах, боль, неврональная боль, мигрень, рост опухоли, симптомы аутизма, ишемические и гипоксические состояния, такие как инсульт, субарахноидальная геморрагия, перинатальная гипоксия, травмы мозга и позвоночника, повреждение головы, высокое внутричерепное давление и любая хирургическая процедура, потенциально ассоциируемая с гипоксией центральной нервной системы, и состояния, вызываемые действиями окружающей среды, экзогенными нейротоксинами, включая те, которые вызваны инфекциями, а также те, которые вызваны метаболическими изменениями и гепатоэнцефалопатией, ассоциированной с печеночной недостаточностью.
Для всех этих показаний соответствующая доза будет, безусловно, меняться, завися, например, от используемого соединения по изобретению, пациента, способа введения и природы и тяжести подлежащих обработке состояний. Однако, в общем, удовлетворительные результаты у животных, как показано, получаются при ежедневных дозах от примерно 0,1 до примерно 30 мг/кг массы тела животного. У крупных млекопитающих, например у человека, указанная ежедневная доза находится в интервале от примерно 5 мг до примерно 2 г соединения по изобретению, удобно вводимых, например, в раздельных дозах до четырех раз в день.
Активные препараты по изобретению могут быть введены любым общепринятым путем, особенно энтерально, предпочтительно перорально, например, в форме таблеток или капсул, или парентерально, например, в форме инъекционных растворов или суспензий.
Согласно вышеупомянутому настоящее изобретение обеспечивает соединения для применения в качестве фармацевтических средств, в особенности для применения в лечении любой патологии, нарушения или клинического состояния, включающих этиологию рецепторов АМРА или включающих опосредованное рецепторами АМРА неврональное повреждение, и особенно для применения в любых специфических показаниях, перечисленных выше.
Настоящее изобретение обеспечивает также фармацевтическую композицию, включающую соединения в сочетании по меньшей мере с одним фармацевтическим носителем или разбавителем. Такие композиции могут быть получены обычным образом. Стандартные лекарственные формы содержат, например, от примерно 1 мг до примерно 400 мг активного агента согласно изобретению.
Кроме того, настоящее изобретение обеспечивает применение соединения по изобретению для получения лекарственного средства для лечения любой патологии, нарушения или клинического состояния, включающих этиологию рецепторов АМРА или включающих опосредованное рецепторами АМРА неврональное повреждение.
Более того, настоящее изобретение обеспечивает способ лечения любой патологии, нарушения или клинического состояния, включающих этиологию рецепторов АМРА или включающих опосредованное рецепторами АМРА неврональное повреждение у субъекта, нуждающегося в таком лечении, которое включает введение такому субъекту терапевтически эффективного количества соединения по изобретению.
Кроме того, соединения по изобретению могут быть скомбинированы с другими препаратами, пригодными для различных показаний, например, в случае эпилепсии с другими антиэпилептическими препаратами, как барбитураты и их производные, бензодиазепины, карбоксамиды, гидантоины, сукцинимиды, вальпроевая кислота и другие производные жирных кислот, другие антагонисты АМРА. Соединения по изобретению могут быть также скомбинированы с нейролептическими препаратами, выбранными из списка, состоящего из атипичных антипсихотических препаратов, таких как клозапин, оланзапин, рисперидон, и типичных антипсихотических препаратов, таких как галоперидол.
Данная заявка раскрывает в дополнительном аспекте применение соединений формулы (I) для лечения патологических состояний, которые реагируют на блокаду возбудительных аминокислотных рецепторов, таких как рецепторы АМРА, например нейродегенеративных нарушений, инсульта, эпилепсии, тревоги и боли.
В настоящее время неожиданно было найдено, что соединения полезны также в лечении невропатической боли.
Активность соединений в лечении нейропатической боли подтверждается, например, на следующей модели невропатической боли у крыс.
Крысам линии Wistar давали наркоз с энфлураном и производили небольшой разрез в верхней части середины одного бедра, чтобы выделить седалищный нерв. Нерв освобождали от соединительной ткани и шелковую шовную нить вводили в нерв, используя на 3/8 изогнутую хирургическую режущую мини-иглу, и плотно лигировали так, чтобы 1/3-1/2 тыльной толщины нерва удерживалась внутри лигатуры. Мышцу и кожу закрывали швами и скобками и рану посыпали порошком антибиотика. Данная процедура создает механическую гипералгезию, которая развивается в интервале 2-3 дней и поддерживается в течение по крайней мере 4 недель. Механическая гипералгезия оценивается измерением порогов подергивания лапки как на одной стороне (лигированной), так и на противоположной стороне (нелигированной) задней лапки в ответ на увеличивающееся воздействие раздражителя, нанесенного на лапку с использованием анальгезиметра (Ugo-Basile) с клинообразным зондом (площадь 1,75 мм2) и прерыванием порога в 250 г. Конечная точка принимается в качестве первого признака болевой реакции (сопротивление, звуковой сигнал или подергивание лапки). На гипералгезию указывает различие порогов подергивания на одной стороне и противоположной стороне. Обратимость установившейся гипералгезии с помощью введенных соединений измеряется 12-14 дней после хирургического вмешательства с использованием 6 животных на группу обработки. Пороги подергивания лапки измеряются до введения и затем до 6 ч после введения препарата или наполнителя. Статистический анализ осуществляется по показателям порога подергивания, используя дисперсионный анализ ANOVA, затем тест Тьюки правдоподобно достоверных различий (HSD), сравнивая животных, обработанных препаратом и согласованным по времени наполнителем.
На этой модели соединения в значительной степени обращали невропатическую механическую гипералгезию при 10 мг/кг перорально. С отобранными соединениями формулы (I) максимальное обращение невропатической механической гипералгезии 35% достигается через 3 ч после введения 10 мг/кг перорально.
Активность соединений формулы I в лечении невропатической боли может быть подтверждена в клинических испытаниях, например в следующем исследовании, проведенном с целью оценки эффективности соединения в лечении хронической боли у пациентов с диабетической невропатией.
Пациенты рандомизируются в соотношении 1:1, чтобы получать 2400 мг/день соединения или плацебо.
Исследование состоит из фазы, предшествующей рандомизации (1 неделя), и двойной слепой фазы (5 недель). Двойная слепая фаза состоит из трех периодов: однонедельный период титрования дозы, трехнедельный период поддерживающей терапии и однонедельный период последующего наблюдения.
В течение однонедельной фазы перед рандомизацией оценивается пригодность пациентов. Пациенты, отвечающие критериям включения в исследование/исключения из исследования, рандомизировались для получения или соединения, или плацебо в двойной слепой фазе исследования. В ходе 1 недели периода титрования дозы изучаемый препарат титровали от 800 мг/день (данных дважды в день) до 2400 мг/день (данных дважды в день). Пациенты, которые завершали однонедельный период титрования дозы, затем входили в трехнедельный период поддерживающей терапии. Пациенты, которые завершали трехнедельный период поддерживающей терапии или преждевременно прекращали обработку двойным слепым способом, затем входили в однонедельный период последующего наблюдения. Исследование назначения лекарственного средства полностью прекращалось или переходило в период последующего наблюдения. В ходе двойной слепой фазы получали оценки серийной эффективности и безопасности.
Амбулаторные больные, 120 мужчин и женщин, в возрасте 18-65 лет с клиническим диагнозом сахарного диабета (типа I или II) и историей боли, ассоциированной с диабетической невропатией в течение 6 месяцев до 3 лет перед вхождением в исследование, случайно распределяются в соотношении 1:1 для получения соединения или плацебо.
Общий балл краткой болевой анкеты МакГилла (SF-MPQ) в конце периода поддерживающей терапии используется в качестве параметра первичной эффективности. Средняя еженедельная оценка тяжести боли (ежедневный дневник боли пациента) от начала рандомизированной обработки до конца периода поддерживающей терапии, использование «спасательной» лекарственной терапии в период титрования дозы и поддерживающей терапии и средняя оценка тяжести боли в ходе периода последующего наблюдения (возвратная боль) используются в качестве вторичных параметров эффективности.
Общий болевой балл SF-MPQ в конце периода поддерживающей терапии анализируется с использованием анализа ковариантной модели, скорректированной для эффекта обработки по баллам после обработки с использованием базисной линии общего болевого балла SF-MPQ в качестве коварианта. Средняя еженедельная тяжесть боли анализируется с применением анализа ковариантной модели с повторяющимися измерениями с использованием недельной обработки и среднего показателя тяжести боли в ходе фазы, предшествующей рандомизации, в качестве коварианта. Использование «спасательной» лекарственной терапии в ходе двойной слепой фазы анализируется с использованием контроля с помощью критерия Кохрана-Мантеля-Гензеля для центра. Показатель средней тяжести боли в ходе периода последующего наблюдения (возвратная боль) анализируется с использованием анализа ковариантной модели, скорректированной для эффекта обработки по показателю средней тяжести боли периода последующего наблюдения с показателем средней тяжести боли в ходе периода, предшествующего рандомизации, в качестве коварианта.
В данном исследовании найдено, что соединения
N-{6-[(2-гидроксиэтил)метиламино]-2,4-диоксо-7-трифторметил-1,4-дигидро-2H-хиназолин-3-ил}метансульфонамид,
N-(6-[1,4]оксазепан-4-ил-2,4-диоксо-7-трифторметил-1,4-дигидро-2H-хиназолин-3-ил)-метансульфонамид и
N-(6-морфолин-4-ил-2,4-диоксо-7-трифторметил-1,4-дигидро-2H-хиназолин-3-ил)-метансульфонамид
наиболее специфично и статистически значимым образом снижают показатели тяжести боли относительно плацебо в ходе периодов поддерживающей терапии и последующего наблюдения.
Следовательно, соединения пригодны для лечения невропатической боли и ассоциированной гипералгезии, включая невралгию тройничного нерва и герпетическую, диабетическую невропатическую боль, мигрень, каузалгию и деафферентационные синдромы, такие как авульсия плечевого сплетения.
В дальнейшем аспекте по изобретению неожиданно было обнаружено, что соединения пригодны также для лечения эмоциональных расстройств и расстройств внимания.
Активность соединений в лечении эмоциональных расстройств, включая биполярные нарушения, например маниакально-депрессивные психозы, экстремальные психотические состояния, например манию, подтверждается, например, в следующих анализах, подходящих для определения препаратов, обращающих психомоторные стимулирующие эффекты.
Анализ 1: локомоция, индуцированная антагонистом N-метил-D-аспартата (NMDA)
Использовали самцов крыс линии Wistar Kyoto (Iffa Credo, Lion, France) с массой между 250 и 310 г. В принципе образовывали 4 группы обработки: 1) сое