Производное фосфорамидита и способ получения олиго-рнк
Иллюстрации
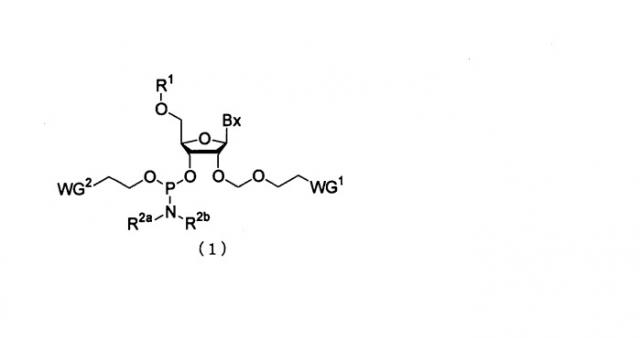
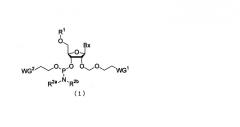
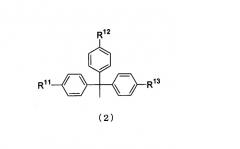
Показать всеНастоящее изобретение относится к производным фосфорамидита общей формулы (1), где Вх представляет собой аденин, гуанин, цитозин, тимин или урацил, причем аминогруппа аденина, гуанина и цитозина может быть необязательно защищена защитной группой, выбранной из ацетила и феноксиацетила; R1 - заместитель общей формулы (2), в которой R11, R12 и R13 одинаковы или различны, и каждый представляет собой водород или алкокси; R2a и R2b одинаковы или различны, и каждый представляет собой алкил; и WG1, WG2 представляют собой цианогруппу. Изобретение относится также к многостадийному способу получения указанных соединений. Кроме того, изобретение относится к промежуточным соединениям названного способа, а именно к промежуточному эфирному соединению общей формулы (13), где L представляет собой галоген или С1-С5алкилтиогруппу; WG1 - цианогруппу; к промежуточному соединению общей формулы (21), где Вх представляет собой аденин, гуанин, цитозин, тимин или урацил, причем аминогруппа аденина, гуанина и цитозина может быть необязательно защищена защитной группой, выбранной из ацетильной группы и феноксиацетильной группы; и WG1 представляет собой цианогруппу; к промежуточному соединению общей формулы (15), где Вх имеет названные выше значения; R1 представляет собой заместитель общей формулы (2); к промежуточному соединению общей формулы (17), где Вх имеет названные выше значения; А представляет собой кремнесодержащий заместитель общей формулы (18а) или (18b)
,
где R6 - алкил, а WG1 - цианогруппа. Изобретение относится также к способу получения олигонуклеотида общей формулы (3), где каждый В независимо представляет собой аденин, гуанин, цитозин, урацил или тимин; каждый R независимо представляет собой Н или гидроксил, и, по меньшей мере, один из R представляет собой гидроксил; Z представляет собой Н или фосфатную группу; и n представляет собой целое число от 1 до 100, включающий стадии A-G, отличающийся использованием указанных выше производных фосфорамидита в качестве мономерного соединения нуклеиновой кислоты на стадии В. 7 н.п. ф-лы, 1 ил.
Реферат
Область техники
Настоящее изобретение относится к новому производному фосфорамидита, в которое введена новая защитная группа по 2'-гидроксильной группе, и к реагенту для введения этой защитной группы.
Уровень техники
Олигорибонуклеиновые кислоты (олиго-РНК) являются полезными в качестве РНК-зондов для генного анализа, фармацевтических веществ на основе РНК (антисмысловые РНК, рибозимы, РНК для РНК-опосредуемого регулирования экспрессии генов), искусственных ферментов, и аптамеров (олигонуклеотидов, которые проявляют специфическое связывание с молекулой-мишенью). Способ твердофазного синтеза для получения олиго-РНК создали в конце восьмидесятых годов. В первом сообщении, касающемся этого способа, использовали производные фосфорамидитов с трет-бутилдиметилсилильной группой (TBDMS) или триизопропилсилильной группой (TIPS) в качестве защитной группы для 2'-гидроксильной группы (непатентный документ 1).
В химическом синтезе олиго-РНК присутствует намного больше проблем, чем в химическом синтезе олигодезоксирибонуклеиновых кислот (олиго-ДНК), состоящих только из дезоксирибонуклеотидов.
Например, использование группы TBDMS в качестве защитной группы для 2'-гидроксильной группы может вызывать побочную реакцию, в которой группа TBDMS, защищающая 2'-гидроксильную группу, мигрирует к 3'-гидроксильной группе во время фосфитилирования 3'-гидроксильной группы. Кроме того, использование объемного заместителя, такого как группа TBDMS, в качестве защитной группы для 2'-гидроксильной группы, может снизить скорость реакции конденсации при образовании межнуклеотидной связи вследствие пространственного затруднения около атома фосфора в 3'-положении, возможно приводя к разрыву или перегруппировке межнуклеотидной связи во время удаления защитной группы для 2'-гидроксильной группы после олигомеризации.
Для того чтобы преодолеть вышеприведенные проблемы, в настоящий момент изучаются более эффективные способы синтеза олиго-РНК.
В качестве защитной группы для 2'-гидроксильной группы известна 1-(2-цианоэтокси)этильная (CEE) группа, которую удаляют вместе с 3'- и 5'-защитной бис-силильной группой в нейтральной среде, обеспечивающей удаление бис-силильной защитной группы (непатентный документ 2).
На основе этой информации Wada разработал производное фосфорамидита для получения олиго-РНК, в котором группа CEE, которая может быть удалена в нейтральной среде, является введенной в 2'-гидроксигруппу (непатентный документ 3 и непатентный документ 4). Однако, поскольку введение группы СЕЕ в положение 2'-гидроксильной группы приводит к образованию нового асимметричного центра, олиго-РНК, в которых 2'-гидроксильные группы являются защищенными группой СЕЕ, представляют собой диастереоизомерную смесь. Следовательно, очищение и выделение желательной олиго-РНК являются более сложными. К тому же, поскольку олиго-РНК, в которые была введена группа СЕЕ, имеют метильную группу на углероде, присоединенном к атому кислорода в положении 2', следует ожидать возникновения некоторого пространственного затруднения вокруг атома фосфора, присоединенного к 3'-гидроксильной группе, вызывающего опасения относительно снижения эффективности конденсации и скорости реакции конденсации.
Непатентный документ 1: N.A. Usman et al., Journal of the American Chemical Society, Vol. 109, 7845 (1987).
Непатентный документ 2: Wolfgang Pfleiderer et al., Helvetica Chimica Acta, Vol. 81, 1545 (1998).
Непатентный документ 3: Takeshi Wada, Bioindustry, Vol. 21, No. 1, 17 (2004).
Непатентный документ 4: T. Umemoto et al., Tetrahedron Letters, Vol. 45, 9529 (2004).
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Задача, которая должна быть решена с помощью изобретения
Основная цель настоящего изобретения заключается в том, чтобы обеспечить полезное и новое производное фосфорамидита для простого и высокопродуктивного способа синтеза олиго-РНК. Другая цель настоящего изобретения заключается в том, чтобы обеспечить новое эфирное соединение, которое может быть использовано для присоединения защитной группы к 2'-гидроксильной группе рибозы, при этом защитная группа может быть удалена в нейтральной cреде.
СРЕДСТВА ДЛЯ РЕШЕНИЯ ЗАДАЧ
После интенсивных и настойчивых исследований авторы настоящего изобретения нашли соединение, посредством которого можно достигнуть вышеприведенных целей, и таким образом осуществить настоящее изобретение.
I. Производное фосфорамидита настоящего изобретения
Настоящее изобретение может включать производное фосфорамидита, представленное следующей общей формулой (1) (в дальнейшем в этом документе именуется как производное фосфорамидита настоящего изобретения).
в которой
Bx представляет собой нуклеиновое основание, которое может иметь защитную группу;
R1 представляет собой заместитель, представленный следующей общей формулой (2)
в которой
R11, R12 и R13 являются одинаковыми или различными, и каждый представляет собой водород или алкоксигруппу.
R2a и R2b являются одинаковыми или различными, и каждый представляет собой алкильную группу, или R2a и R2b, взятые вместе со смежным атомом азота, могут образовывать 5-6-членную насыщенную циклическую аминогруппу, при этом циклическая аминогруппа необязательно имеет атом кислорода или серы в составе цикла в дополнение к смежному атому азота; и WG1 и WG2 являются одинаковыми или различными, и каждый представляет собой электроноакцепторную группу.
Примеры нуклеинового основания Вх специально не ограничивают до тех пор, пока оно представляет собой нуклеиновое основание, используемое в синтезе нуклеиновой кислоты, и могут включать, например, аденин, гуанин, цитозин, урацил или их модифицированную форму.
Модифицированная форма нуклеинового основания означает соединение, в котором нуклеиновое основание несет один или более произвольных заместителей.
Примеры заместителя для модифицированной формы Вх могут включать галоген, ацильную группу, алкильную группу, арилалкильную группу, алкоксигруппу, алкоксиалкильную группу, гидроксигруппу, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу, карбоксигруппу, цианогруппу и нитрогруппу. Модифицированная форма Вх может быть замещена одним-тремя такими заместителями.
Нуклеиновое основание Вх может быть защищенным. Особенно предпочтительно, чтобы была защищенной аминогруппа нуклеинового основания, имеющего аминогруппу, такого как аденин, гуанин и цитозин.
Защитную группу аминогруппы особо не ограничивают до тех пор, пока она представляет собой защитную группу, используемую в качестве защитной группы нуклеиновой кислоты, и она может включать, например, бензоильную группу, 4-метоксибензоильную группу, ацетильную группу, пропионильную группу, бутирильную группу, изобутирильную группу, фенилацетильную группу, феноксиацетильную группу, 4-трет-бутилфеноксиацетильную группу, 4-изопропилфеноксиацетильную группу и (диметиламино)метиленовую группу.
Примеры насыщенных циклических аминогрупп R2 могут включать пирролидин-1-ильную группу, пиперидин-1-ильную группу, морфолин-1-ильную группу и тиоморфолин-1-ильную группу.
Электроноакцепторные группы WG1 и WG2 могут включать цианогруппу, нитрогруппу, алкилсульфогруппу и галоген. Среди них цианогруппа является предпочтительной.
Примеры галогена производного фосфорамидита настоящего изобретения могут включать фтор, хлор, бром и йод.
Примеры ацильной группы производного фосфорамидита настоящего изобретения могут включать линейную или разветвленную алканоильную группу, имеющую 1-6 атомов углерода, и ароильную группу, имеющую 7-13 атомов углерода. Более конкретно, ацильная группа может включать, например, формильную группу, ацетильную группу, н-пропионильную группу, изопропионильную группу, н-бутироильную группу, изобутироильную группу, трет-бутироильную группу, валероильную группу, гексаноильную группу, бензоильную группу, нафтоильную группу и левулиноильную (ß-ацетилпропионильную) группу.
Примеры алкильной группы производного фосфорамидита настоящего изобретения могут включать линейную или разветвленную алкильную группу, имеющую 1-5 атомов углерода. Более конкретно, алкильная группа может включать, например, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, изопентильную группу, неопентильную группу и трет-пентильную группу. Алкильная группа может быть замещена, и примеры заместителя могут включать галоген, алкильную группу, алкоксигруппу, цианогруппу и нитрогруппу. Алкильная группа может быть замещена одним-тремя такими заместителями.
Примеры алкильной части арилалкильной группы, алкоксиалкильной группы, моноалкиламиногруппы, диалкиламиногруппы и алкилсульфогруппы в производном фосфорамидита настоящего изобретения могут включать алкильные группы, идентичные приведенным выше.
Примеры алкоксигруппы производного фосфорамидита настоящего изобретения могут включать линейную или разветвленную алкоксигруппу, имеющую 1-4 атома углерода. Более конкретно, алкоксигруппа может включать, например, метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу и трет-бутоксигруппу. Среди них алкоксигруппы, имеющие 1-3 атома углерода, являются предпочтительными, а метоксигруппа является более предпочтительной.
Примеры алкоксичасти алкоксиалкильной группы производного фосфорамидита настоящего изобретения могут включать алкоксигруппы, идентичные приведенным выше.
Примеры арильной части арилалкильной группы производного фосфорамидита настоящего изобретения могут включать арильные группы, имеющие 6-12 атомов углерода.
Конкретно, арильная группа может включать, например, фенильную группу, 1-нафтильную группу, 2-нафтильную группу и бифенильную группу. Арильная группа может быть замещена, и примеры заместителя могут включать галоген, алкильную группу, алкоксигруппу, цианогруппу и нитрогруппу. Арильная группа может быть замещена одним-тремя такими заместителями. Примеры галогена, алкильной группы и алкоксигруппы, которые являются заместителями алкильной или арильной группы производного фосфорамидита настоящего изобретения, могут включать, соответственно, группы, идентичные приведенным выше.
Производное фосфорамидита настоящего изобретения может быть использовано в качестве реагента для получения олиго-РНК. Производное фосфорамидита настоящего изобретения представляет собой производное фосфорамидита, имеющее защитную группу эфирного типа в положении 2'-гидроксильной группы, которая может быть удалена в нейтральной среде. Кроме того, производное фосфорамидита настоящего изобретения отличается тем, что реакция конденсации протекает за более короткое время и приводит к лучшему выходу во время синтеза олиго-РНК по сравнению с традиционным производным фосфорамидита. Так происходит потому, что защитная группа эфирного типа, введенная в 2'-гидроксильную группу, является линейной защитной группой и, следовательно, не создает стерических затруднений в пространстве вокруг атома фосфора, присоединенного к 3'-гидроксильной группе. Производное фосфорамидита настоящего изобретения делает возможным получение олиго-РНК высокой степени чистоты способом, по существу идентичным способу, используемому в производстве олиго-ДНК.
В настоящем документе термин «олиго-ДНК» означает олигонуклеиновую кислоту, имеющую только дезоксирибонуклеотиды. К тому же, в настоящем документе термин «олиго-РНК» означает олигонуклеиновую кислоту, содержащую, по меньшей мере, один рибонуклеотид, и которая также может иметь один или более дезоксирибонуклеотидов.
Конкретные примеры производного фосфорамидита настоящего изобретения могут включать следующие соединения 1-5:
1.
N6-ацетил-5'-О-(4,4'-диметокситритил)-2'-О-(2-цианоэтоксиметил)аденозин 3'-О-(2-цианоэтил N,N-диизопропилфосфорамидит)
2.
N2-ацетил-5'-О-(4,4'-диметокситритил)-2'-О-(2-цианоэтоксиметил)гуанозин 3'-О-(2-цианоэтил N,N-диизопропилфосфорамидит)
3.
N2-феноксиацетил-5'-О-(4,4'-диметокситритил)-2'-О-(2-цианоэтоксиметил)гуанозин 3'-О-(2-цианоэтил N,N-диизопропилфосфорамидит)
4.
N4-ацетил-5'-О-(4,4'-диметокситритил)-2'-О-(2-цианоэтоксиметил)цитидин 3'-О-(2-цианоэтил N,N-диизопропилфосфорамидит)
5.
5'-О-(4,4'-диметокситритил)-2'-О-(2-цианоэтоксиметил)уридин 3'-О-(2-цианоэтил N,N-диизопропилфосфорамидит)
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Чертеж показывает хроматограмму, полученную методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с обращенной фазой.
На чертеже вертикальная ось указывает время (мин) и горизонтальная ось указывает оптическое поглощение.
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
II. Способ получения производного фосфорамидита настоящего изобретения
Производное фосфорамидита настоящего изобретения может быть получено следующим образом.
В следующем способе получения в тех случаях, когда исходные вещества имеют заместитель, который оказывает влияние на реакцию (например, гидроксильная группа, аминогруппа и карбоксигруппа), эти исходные вещества традиционно используют в реакции, защищая их соответствующей защитной группой в соответствии с известным способом.
После завершения реакции защитная группа может быть удалена известным способом, таким как каталитическое восстановление, щелочная обработка, кислотная обработка или т.п. Производное фосфорамидита настоящего изобретения может быть получено из известного соединения или промежуточного соединения, которое может быть легко получено, например, посредством следующих стадий а-h.
Способ получения производного фосфорамидита настоящего изобретения описан подробно ниже.
(1) Стадия а:
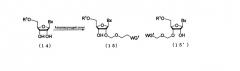
Процесс получения производного нуклеозида, представленного следующими общими формулами (15) и (15'), где защитную группу эфирного типа, которая может быть удалена в нейтральной среде, вводят по 2'-гидроксильной группе путем воздействия алкилирующего реагента на производное нуклеозида, представленное следующей общей формулой (14)
где
Вх, R1 и WG1 такие, как определено выше.
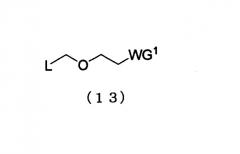
Примеры алкилирующего реагента могут включать эфирное соединение, представленное следующей общей формулой (13)
в которой
L представляет собой галоген, арилтиогруппу, алкилсульфоксидную группу или алкилтиогруппу; и WG1 такая, как определено выше.
Примеры галогена, арильной части арилтиогруппы, и алкильных частей алкилсульфоксидной группы и алкилтиогруппы L могут включать соответственно такие же галоген, арильную и алкильную группы, как галоген, арильная и алкильная группы производного фосфорамидита настоящего изобретения.
Конкретные примеры эфирного соединения (13) могут включать следующие соединения 1 и 2:
1. Хлорметил 2-цианоэтиловый эфир
2. 2-Цианоэтилметилтиометиловый эфир
Эфирное соединение (13) представляет собой новый алкилирующий реагент, который может вводить заместитель эфирного типа, который является удаляемым в нейтральной среде, в положение 2'-гидроксильной группы в щелочной среде, и который является полезным в качестве реагента для получения производного фосфорамидита настоящего изобретения.
Эфирное соединение (13) может быть получено посредством следующих стадий 1-4.
Стадия 1:
Процесс получения соединения, представленного следующей общей формулой (24), путем алкилтиометилирования спиртового соединения, представленного следующей общей формулой (20)
в которой
WG1 такая, как определено выше; и
R3 представляет собой алкильную или арильную группу.
Соединение (24) представляет собой эфирное соединение (13), где L является алкилтиогруппой.
Примеры алкильной группы для R3 могут включать такую же алкильную группу, как алкильная группа производного фосфорамидита настоящего изобретения.
В тех случаях, когда R3 представляет собой метильную группу, примеры алкилтиометилирующего реагента могут включать смешанный растворитель, содержащий диметилсульфоксид, уксусный ангидрид и уксусную кислоту. Количество диметилсульфоксида, которое должно быть использовано, может колебаться в пределах диапазона 10-200 моль на моль соединения (20) и предпочтительно 20-100 моль на моль соединения. Количество уксусной кислоты, которое должно быть использовано, может колебаться в пределах диапазона 10-150 моль на моль соединения (20) и предпочтительно 20-100 моль на моль соединения. Количество уксусного ангидрида, которое должно быть использовано, может находиться в диапазоне 10-150 моль на моль соединения (20) и предпочтительно 20-100 моль на моль соединения. Температура реакции предпочтительно колеблется в пределах диапазона 0-100ºС. Время реакции варьируется в зависимости от типа исходных веществ и температуры реакции и предпочтительно составляет от 1 до 48 час.
Стадия 2:
Процесс получения соединения, представленного следующей общей формулой (25), путем галогенирования соединения (24).
в которой
WG1 и R3 такие, как определено выше; и
X2 представляет собой галоген.
Соединение (25) представляет собой соединение, где L эфирного соединения (13) является галогеном.
Примеры галогена в Х2 могут включать такой же галоген, как галоген производного фосфорамидита настоящего изобретения.
Эта стадия может быть выполнена известным способом (например, T. Benneche et al., Synthesis 762 (1983)).
Примеры растворителя, который должен быть использован, особо не ограничивают, исключая те случаи, когда он является вовлеченным в реакцию, и могут включать, например, галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан.
Примеры галогенирующего агента могут включать сульфурилхлорид и оксихлорид фосфора.
Количество галогенирующего агента, которое должно быть использовано, соответственно может колебаться в пределах диапазона 1-20 моль на моль соединения (24) и предпочтительно 1-10 моль на моль соединения. Температура реакции предпочтительно колеблется в пределах диапазона 0-100ºС. Время реакции варьируется в зависимости от типа исходных веществ и температуры реакции и предпочтительно составляет от 30 мин до 24 час.
Стадия 3:
Процесс получения соединения, представленного следующей общей формулой (25а), путем арилтиолирования соединения (25).
в которой
WG1 и Х2 такие, как определено выше; и
R3а представляет собой арильную группу.
Соединение (25а) представляет собой соединение класса эфирных соединений (13), где L является арилтиогруппой. Примеры арильной группы для R3а могут включать арильную группу, идентичную арильной группе производного фосфорамидита настоящего изобретения. Эта стадия может быть выполнена известным способом. Примеры растворителя, который должен быть использован, особенным образом не ограничивают, исключая те случаи, когда он является вовлеченным в реакцию, и могут включать, например, дихлорметан и ацетонитрил. Примеры арилтиолирующего реагента могут включать тиофенол и 4-метилтиофенол. Количество арилтиолирующего реагента, которое должно быть использовано, может колебаться в пределах диапазона 1-20 моль на моль соединения (25) и предпочтительно 1-5 моль на моль соединения. Температура реакции предпочтительно находится в диапазоне 0-100ºС. Время реакции варьируется в зависимости от типа исходных веществ и температуры реакции и предпочтительно составляет от 1 до 48 час.
Стадия 4:
Процесс получения соединения, представленного следующей общей формулой (24а), путем окисления соединения (24).
в которой
WG1 и R3 такие, как определено выше.
Соединение (24а) представляет собой соединение класса эфирных соединений (13), где L является алкилсульфоксидной группой. Примеры алкильной группы R3 могут включать алкильную группу, идентичную алкильной группе производного фосфорамидита настоящего изобретения.
Эта стадия может быть выполнена известным способом. Примеры растворителя, который должен быть использован, особо не ограничивают, исключая те случаи, когда он является вовлеченным в реакцию, и могут включать, например, дихлорметан, хлороформ и метанол. Примеры окислителя могут включать метахлорпербензойную кислоту, метапериодатную соль и пероксид водорода. Количество окислителя, которое должно быть использовано, может колебаться в пределах диапазона 1-10 моль на моль соединения (24) и предпочтительно 1-2 моля на моль соединения. Температура реакции предпочтительно находится в диапазоне 0-100ºС. Время реакции варьируется в зависимости от типа исходных веществ и температуры реакции и предпочтительно составляет от 1 до 48 час.
В тех случаях, когда в качестве алкилирующего реагента используют соединение (25), эта стадия может быть выполнена следующим образом.
Стадия может быть выполнена путем взаимодействия алкилирующего реагента и основания с соединением (14), которое имеется в продаже или является синтезированным в соответствии с известным способом.
Примеры растворителя, который должен быть использован, особенным образом не ограничивают, исключая те случаи, когда он является вовлеченным в реакцию, и могут включать, например, галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан. Количество алкилирующего реагента, которое должно быть использовано, может колебаться в пределах диапазона 1-20 моль на моль соединения (14) и предпочтительно 1-10 моль на моль соединения. На этой стадии при необходимости алкилирующий реагент может быть подвергнут реакции посредством промежуточного соединения, получаемого взаимодействием металлсодержащего реагента и основания с соединением (14). Примеры металлсодержащего реагента могут включать дибутилоловодихлорид. Количество металлсодержащего реагента, которое должно быть использовано, может колебаться в пределах диапазона 1-20 моль на моль соединения (14) и предпочтительно 1-10 моль на моль этого соединения. Примеры основания могут включать органическое основание, такое как пиридин, 2,6-диметилпиридин, 2,4,6-триметилпиридин, N-метилимидазол, триэтиламин, трибутиламин, N,N-диизопропилэтиламин и 1,8-диазабицикло[5.4.0]-7-ундецен. Количество основания, которое должно быть использовано, может находиться в пределах диапазона 1-20 моль на моль соединения (14) и предпочтительно 1-10 моль на моль соединения. Температура реакции предпочтительно колеблется в пределах диапазона 0-120ºС. Время реакции варьируется в зависимости от типа исходных веществ и температуры реакции и предпочтительно составляет от 30 мин до 24 час.
В тех случаях, когда в качестве алкилирующего реагента используют соединение (24) или (25а), эта стадия может быть выполнена следующим образом.
Стадия может быть выполнена путем взаимодействия алкилирующего реагента, кислоты и реагента для галогенирования атома серы с соединением (14), которое имеется в продаже или является синтезированным в соответствии с известным способом (например, M. Matteucci, Tetrahedron Letters, Vol. 31, 2385 (1990)). Количество алкилирующего реагента, которое должно быть использовано, может колебаться в пределах диапазона 1-5 моль на моль соединения (14) и предпочтительно 1,05-3 моля на моль соединения. Примеры кислоты могут включать трифторметансульфокислоту, трифторметансульфонат серебра и триметилсилилтрифторметансульфонат. Количество кислоты, которое должно быть использовано, может колебаться в пределах диапазона 0,01-20 моль на моль соединения (14) и предпочтительно 0,02-10 моль на моль соединения. Примеры растворителя, который должен быть использован, особо не ограничивают, исключая те случаи, когда он является вовлеченным в реакцию, и могут включать, например, дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан, бензол, толуол, ксилол, тетрагидрофуран, ацетонитрил и их смеси. Примеры реагента для галогенирования атома серы, который должен быть использован на этой стадии, могут включать N-бромсукцинимид (NBS) и N-йодсукцинимид (NIS). Количество реагента для галогенирования атома серы, которое должно быть использовано, может колебаться в пределах диапазона 1-10 моль на моль соединения (14) и предпочтительно 1,05-5 моль на моль соединения. Температура реакции предпочтительно находится в пределах диапазона -78-30ºС. Время реакции варьируется в зависимости от типа исходных веществ и температуры реакции и предпочтительно составляет от 5 мин до 5 час.
В тех случаях, когда в качестве алкилирующего реагента используют соединение (24а), эта стадия может быть выполнена следующим образом.
Стадия может быть выполнена путем взаимодействия алкилирующего реагента, ангидрида кислоты и основания с соединением (14), которое имеется в продаже или является синтезированным в соответствии с известным способом. Количество алкилирующего реагента, которое должно быть использовано, может находиться в пределах диапазона 1-5 моль на моль соединения (14) и предпочтительно 1,05-3 моля на моль соединения. Примеры ангидрида кислоты могут включать ангидрид трифторметансульфокислоты и уксусный ангидрид. Количество ангидрида кислоты, которое должно быть использовано, может находиться в пределах диапазона 0,01-20 моль на моль соединения (14) и предпочтительно 0,02-10 моль на моль соединения. Примеры основания могут включать тетраметилмочевину и коллидин. Количество основания, которое должно быть использовано, может находиться в пределах диапазона 0,01-20 моль на моль соединения (14) и предпочтительно 0,02-10 моль на моль соединения. Примеры растворителя, который должен быть использован, особо не ограничивают, исключая те случаи, когда он является вовлеченным в реакцию, и могут включать, например, дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и их смеси. Температура реакции предпочтительно колеблется в пределах диапазона -78-30ºС. Время реакции варьируется в зависимости от типа исходных веществ и температуры реакции и предпочтительно составляет от 5 мин до 24 час.
(2) Стадия b:
Процесс выделения и очистки производного нуклеозида (15), полученного посредством стадии (а)
На этой стадии производное нуклеозида может быть выделено и очищено из смеси, полученной посредством стадии (а), путем использования стандартного метода выделения и очистки, такого как тонкослойная хроматография, колоночная хроматография на силикагеле или т.п.
(3) Стадия с:
Процесс, который осуществляют отдельно от стадии b, для получения соединения рибонуклеиновой кислоты, представленного следующей общей формулой (17), где защитную группу эфирного типа, которая может быть удалена в нейтральной среде, вводят по 2'-гидроксильной группе путем воздействия алкилирующего реагента на соединение рибонуклеиновой кислоты, представленное следующей общей формулой (16)
в которой
Вх и WG1 такие, как определено выше; и
А представляет собой кремнесодержащий заместитель, представленный следующей общей формулой (18а) или (18b)
в которой
R6 представляет собой алкильную группу.
Примеры алкильной группы для R6 могут включать алкильную группу, идентичную алкильной группе производного фосфорамидита настоящего изобретения.
Примеры алкилирующего реагента могут включать алкилирующие реагенты, идентичные приведенным выше.
В тех случаях, когда в качестве алкилирующего реагента используют соединение (25), эта стадия может быть выполнена следующим образом.
Стадия может быть выполнена путем взаимодействия алкилирующего реагента и основания с соединением (16), которое имеется в продаже или является синтезированным в соответствии с известным способом.
Примеры растворителя, который должен быть использован, особо не ограничивают, исключая те случаи, когда он является вовлеченным в реакцию, и могут включать, например, галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан. Количество алкилирующего реагента, которое должно быть использовано, может находиться в пределах диапазона 1-20 моль на моль соединения (14) и предпочтительно 1-10 моль на моль соединения. На этой стадии при необходимости алкилирующий реагент может быть подвергнут реакции посредством промежуточного соединения, получаемого взаимодействием металлсодержащего реагента и основания с соединением (16). Примеры металлсодержащего реагента могут включать дибутилоловодихлорид и трет-бутилмагнийхлорид. Количество металлсодержащего реагента, которое должно быть использовано, может находиться в пределах диапазона 1-20 моль на моль соединения (16) и предпочтительно 1-10 моль на моль этого соединения. Примеры основания могут включать органическое основание, такое как пиридин, 2,6-диметилпиридин, 2,4,6-триметилпиридин, N-метилимидазол, триэтиламин, трибутиламин, N,N-диизопропилэтиламин и 1,8-диазабицикло[5.4.0]-7-ундецен. Количество основания, которое должно быть использовано, может находиться в пределах диапазона 1-20 моль на моль соединения (16) и предпочтительно 1-10 моль на моль соединения. Температура реакции предпочтительно находится в пределах диапазона 0-120ºС. Время реакции варьируется в зависимости от типа исходных веществ и температуры реакции и предпочтительно составляет от 30 мин до 24 час.
В тех случаях, когда в качестве алкилирующего реагента используют соединение (24) или (25а), эта стадия может быть выполнена следующим образом.
Стадия может быть выполнена путем взаимодействия алкилирующего реагента, кислоты и реагента для галогенирования атома серы с соединением (16), которое имеется в продаже или является синтезированным в соответствии с известным способом (например, M. Matteucci, Tetrahedron Letters, Vol. 31, 2385 (1990)). Количество алкилирующего реагента, которое должно быть использовано, может колебаться в пределах диапазона 1-5 моль на моль соединения (16) и предпочтительно 1,05-3 моля на моль соединения. Примеры кислоты могут включать трифторметансульфокислоту, трифторметансульфонат серебра и триметилсилил-трифторметансульфонат. Количество кислоты, которое должно быть использовано, может колебаться в пределах диапазона 0,01-20 моль на моль соединения (16) и предпочтительно 0,02-10 моль на моль соединения. Примеры растворителя, который должен быть использован, особенно не ограничивают, исключая те случаи, когда он является вовлеченным в реакцию, и могут включать, например, дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан, бензол, толуол, ксилол, тетрагидрофуран, ацетонитрил и их смеси. Примеры реагента для галогенирования атома серы, который должен быть использован на этой стадии, могут включать N-бромсукцинимид (NBS) и N-йодсукцинимид (NIS). Количество реагента для галогенирования атома серы, которое должно быть использовано, может колебаться в пределах диапазона 1-10 моль на моль соединения (16) и предпочтительно 1,05-5 моль на моль соединения. Температура реакции предпочтительно находится в пределах диапазона -78-30ºС. Время реакции варьируется в зависимости от типа исходных веществ и температуры реакции и предпочтительно составляет от 5 мин до 5 час.
В тех случаях, когда в качестве алкилирующего реагента используют соединение (24а), эта стадия может быть выполнена следующим образом.
Стадия может быть выполнена путем взаимодействия алкилирующего реагента, ангидрида кислоты и основания с соединением (16), которое имеется в продаже или является синтезированным в соответствии с известным способом. Количество алкилирующего реагента, которое должно быть использовано, может колебаться в пределах диапазона 1-5 моль на моль соединения (16) и предпочтительно 1,05-3 моля на моль соединения. Примеры ангидрида кислоты могут включать ангидрид трифторметансульфокислоты и уксусный ангидрид. Количество ангидрида кислоты, которое должно быть использовано, может колебаться в пределах диапазона 0,01-20 моль на моль соединения (16) и предпочтительно 0,02-10 моль на моль соединения. Примеры основания могут включать тетраметилмочевину и коллидин. Количество основания, которое должно быть использовано, может колебаться в пределах диапазона 0,01-20 моль на моль соединения (16) и предпочтительно 0,02-10 моль на моль соединения. Примеры растворителя, который должен быть использован, особенно не ограничивают, исключая те случаи, когда он является вовлеченным в реакцию, и могут включать, например, дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и их смеси. Температура реакции предпочтительно находится в пределах диапазона -78-30ºС. Время реакции варьируется в зависимости от типа исходных веществ и температуры реакции и предпочтительно составляет от 5 мин до 24 час.
(4) Стадия d:
Процесс, который осуществляют отдельно от стадий а-с, для получения соединения рибонуклеиновой кислоты, представленного следующей общей формулой (19), путем воздействия диметилсульфоксида, уксусной кислоты и уксусного ангидрида на соединение рибонуклеиновой кислоты (16)
в которых
А и Вх такие, как определено выше.
Эта стадия может быть осуществлена путем взаимодействия диметилсульфоксида, уксусной кислоты и уксусного ангидрида с соединением (14), которое имеется в продаже или является синтезированным в соответствии с известным способом.
Эта стадия может быть осуществлена путем взаимодействия диметилсульфоксида, уксусной кислоты и уксусного ангидрида с соединением (14), которое имеется в продаже или является синтезированным в соответствии с известным способом.
Количество диметилсульфоксида, которое должно быть использовано, может колебаться в пределах диапазона от 10 до 200 моль на моль соединения (16) и предпочтительно от 20- до 100-кратного количества моль на моль соединения.
Количество уксусной кислоты, которое должно быть использовано, может колебаться в пределах диапазона 10-150 моль на моль соединения (16) и предпочтительно 20-100 моль на моль соединения. Количество уксусного ангидрида, которое должно быть использовано, может колебаться в пределах диапазона 10-150 моль на моль соединения (16) и предпочтительно 20-100 моль на моль соединения. Температура реакции предпочтительно находится в пределах диапазона 10-50ºС. Время реакции варьируется в зависимости от типа исходных веществ и температуры реакции и предпочтительно составляет от 30 мин до 24 час.
(5) Стадия е:
Процесс получения соединения рибонуклеиновой кислоты, представленного следующей общей формулой (17), где защитную группу эфирного типа, которая может быть удалена в нейтральной среде, вводят по 2'-гидроксильной группе путем воздействия спиртового соединения, представленного следующей общей формулой (20), кислоты и реагента для галогенирования атома серы на производное нуклеозида (19), полученное посредством стадии d.
где
А, Вх и WG1 такие, как определено выше.
Стадия может быть осуществлена путем взаимодействия спиртового соединения (20), кислоты и реагента для галогенирования атома серы с соединением рибонуклеиновой кислоты (19) в соответствии с известным способом. Примеры растворителя, который должен быть использован, особо не ограничивают, исключая те случаи, когда он является вовлеченным в реакцию, и могут включать, например, дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан, бензол, толуол, ксилол, тетрагидрофуран, ацетонитрил и их смеси. Количество спиртового соединения (20), которое должно быть использовано, может находиться в пределах диапазона 1-20 моль на моль соединения (19) и предпочтительно 1-10 моль на моль соединения. Примеры кислоты могут включать трифторметансульфокислоту, трифторметансульфонат серебра и т