Производные гемина, обладающие антимикробной активностью, или их фармацевтически приемлемые соли, способ получения, фармкомпозиция и применение
Иллюстрации
Показать всеИзобретение относится к биоорганической химии, а именно к новым производным гемина общей формулы (I), их фармацевтически приемлемым солям, способу получения, фармацевтическим и дезинфицирующим композициям. Соединения обладают деструктивным действием в отношении липидной мембраны, антимикробными свойствами, в том числе антибактериальными и противогрибковыми, а также одновременно вирулицидными и антимикробными свойствами. 8 н. и 7 з.п. ф-лы, 2 ил., 11 табл.
Реферат
Изобретение относится к области биоорганической химии, а именно к новым производным гемина общей формулы I
где
R1=OH,
R2=-Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где Х=Trp, или Phe, или
или
к способу синтеза этих соединений, композиции, в том числе фармацевтической, дезинфицирующей, антисептической композиции, средству для лечения и биомедицинскому применению новых и известных производных гемина формулы I в качестве антимикробных - антибактериальных и противогрибковых, а также вирулицидных агентов. Как известно, многие опасные заболевания человека вызываются бактериями. К ним относятся заболевания эпидемического характера, такие как холера, брюшной тиф, паратифы, чума, дифтерия, туляремия, бруцеллез, а также туберкулез, заражение крови (сепсис), проказа, сифилис и др. У животных бактерии вызывают сап, сибирскую язву, туберкулез и др. Борьба с болезнетворными бактериями основывается на применении дезинфецирующих и антисептических средств, бактериостатических и бактерицидных агентов. У бактерий быстро развивается резистентность по отношению к существующим антибактериальным средствам, главным образом к антибиотикам, поэтому проблема поиска новых нетоксичных, биосовместимых антибактериальных агентов, применение которых не приводило бы к резистентности, весьма актуальна [J.-Y.Maillard. Bacterial resistance to biocides in the healthcare environment: should it be of genuine concern // Journal of Hospital Infection, 2007, V.65(S2) p.60-72].
В последнее время особое внимание уделяется дизайну новых антимикробных агентов на основе антимикробных пептидов (АМП) [А.Giuliani, G.Pirri, S.F.Nicoletto. Antimicrobial peptides: an overview of a promising class of therapeutics// Central European Journal of Biology, 2007, V.2(1), p.1-33]. Резистентность в отношении АМП у микроорганизмов развивается довольно редко [M.N.Melo, D.Dugourd, M.A.Castanho // Recent Patents Anti-Infect Drug Disc, 2006, V.1(2), p.201-207], по-видимому, вследствие того, что основным механизмом действия АМП является деструкция липидной мембраны бактерий, микроскопических грибов и вирусов [Н.Jenssen, P.H., and R.E.W. Hancock. Peptide Antimicrobial Agents // Clin. Microbiol. Rev., 2006, 19(3): 491-511]. В связи с этим антимикробные пептиды рассматриваются как перспективный класс новых антибиотиков [M.R.Yeaman, N.Y.Yount. Mechanisms of Antimicrobial Peptide Action and Resistance // Pharmacol. Rev., 2003, 55(1) p.27-55, A.Giuliani, G.Pirri, S.F.Nicoletto. Antimicrobial peptides: an overview of a promising class of therapeutics. // Central European Journal of Biology, 2007, V.2(1) p.1-33]. Антимикробные пептиды эндогенного происхождения являются частью наиболее древней системы защиты организмов от патогенов. Они обнаружены практически у всех живых организмов - от бактерий до человека [M.R.Yeaman, N.Y.Yount. Mechanisms of Antimicrobial Peptide Action and Resistance // Pharmacol. Rev., 2003, V.55(1) p.27-55]. В процессе эволюции многоклеточные организмы умножали и развивали арсенал АМП, защищающих их от широкого спектра патогенов, в том числе грамположительных и грамотрицательных бактерий [M.R.Yeaman, N.Y.Yount. Mechanisms of Antimicrobial Peptide Action and Resistance // Pharmacol. Rev., 2003, 55(1):27-55], ДНК и РНК-содержащих вирусов [A.Bastian, and H.Schafer. Human alpha-defensin 1 (HNP-1) inhibits adenoviral infection in vitro// Regul. Pept., 2001, V.101, p.157-161. Home, W.S., С.M.Wiethoff, С.Cui, et al. Antiviral cyclic D,L-alpha-peptidestargeting a general biochemical pathway in virus infections// Bioorg. Med. Chem., 2005, V.13, p.5145-5153], микроскопических грибов [De Lucca, A.J., and T.J.Walsh. Antifungal peptides: novel therapeutic compounds against emerging pathogens // Antimicrob. Agents Chemother., 1999, V.43, p.1-11] и простейших [J.Alberola,, A.Rodriguez, O.Francino, et al. Safety and efficacy of antimicrobial peptides against naturally acquired leishmaniasis // Antimicrob. Agents Chemother., 2004, V.48, p.641-643].
Антимикробные пептиды, как правило, являются амфифильными соединениями с ярко выраженными гидрофильной и гидрофобной частями. За редкими исключениями молекулы АМП содержат несколько остатков лизина и/или аргинина и при физиологических значениях рН несут большой положительный заряд. По структуре АМП можно разделить на две большие группы: циклические пептиды, как правило, содержащие цистеиновый мостик, и линейные пептиды [Н.Jenssen, P.Hamill, R.E.W. Hancock. Peptide Antimicrobial Agents// Clinical Microbiology Reveiws, 2006, Vol.19, No.3, p.491-511].
Понимание механизмов узнавания и деструкции мембран клеток патогенов антимикробными пептидами является необходимым условием для создания лекарств на их основе. Наиболее важным фактором селективности действия АМП на бактерии, грибы и вирусы при отсутствии их воздействия на эукариотические клетки является различие в составе и строении мембран [Н.Jenssen, P.Hamill, R.E.W. Hancock. Peptide Antimicrobial Agents// Clinical Microbiology Reveiws, 2006, Vol.19, No.3, p.491-511]. Внешняя поверхность эукариотической мембраны состоит из цвиттер-ионных фосфолипидов, в то время как мембраны бактериальных клеток содержат большое количество отрицательно заряженных фосфолипидов как на внутренней, так и на внешней поверхности липидного бислоя. Кислотный характер внешней стороны прокариотической мембраны обуславливает ее взаимодействие преимущественно с положительно заряженными АМП [M.R. Yeaman, N.Y.Yount. Mechanisms of Antimicrobial Peptide Action and Resistance // Pharmacol. Rev.,2003, Vol.55, p.27-55]. Вторым фактором, обуславливающим селективность АМП, является отсутствие холестерина в мембранах бактериальных клеток. Вследствие этого липидный бислой бактериальных мембран более гибок, и образование пор антимикробными пептидами в нем происходит легче, чем в мембранах эукариотических клеток [Н.Jenssen, P.Hamill, R.E.W. Hancock. Peptide Antimicrobial Agents // Clinical Microbiology Reveiws, 2006, Vol.19, No.3, p.491-511. 3. О.Токе. Antimicrobial Peptides: New Candidates in the Fight Against Bacterial Infections // Biopolymers (Peptide Science), 2005, Vol.80, p.717-735]. При деструкции молекулами АМП мембраны бактерии последняя погибает вследствие утечки ионов и метаболитов, деполяризации мембраны, угнетения клеточного дыхания бактерий и синтеза в них биополимеров [M.R.Yeaman, N.Y.Yount. Mechanisms of Antimicrobial Peptide Action and Resistance // Pharmacol. Rev., 2003, Vol.55, p.27-55]. По последним данным, гибель клеток под действием АМП может происходить и по другим причинам, например в результате взаимодействия антимикробных пептидов с внутриклеточными мишенями [J.-P.S.Powers, R.E.W. Hancock. The relationship between peptide structure and antibacterial activity // Peptides, 2003, V.24, p.1681-1691]. По схожим механизмам АМП воздействуют и на мембраны вирусов, приводя к их дезактивации [Н.Jenssen, P.Hamill, R.E.W. Hancock. Peptide Antimicrobial Agents// Clinical Microbiology Reveiws, 2006, Vol.19, No.3, p.491-511. 3].
Основными препятствиями к применению АМП в клинической практике являются их сравнительно высокая стоимость, чувствительность к действию протеолитических ферментов, а также присущий многим АМП гемолитический эффект [A.Giuliani, G.Pirri, S.F.Nicoletto. Antimicrobial peptides: an overview of a promising class of therapeutics. // Central European Journal of Biology, 2007, V.2(1) 1-33]. Например, антимикробные пептиды грамицидин D и грамицидин S вызывают 100% гемолиз в концентрациях 5 мкМ [С.Н.Rammelkamp and L.Weinstein. Toxic Effects of Tyrothricin, Gramicidin, and Tyrocidine // Jour. Infect. Dis., 1942, V.71, №2, p.166-173] и 62,5 мкМ [G.M.Grotenbreg, M.D.Witte, P.A.V. van Hooft, et al. Synthesis and biological evaluation of gramicidin S dimers // Org. Biomol. Chem., 2005, V.3, p.233-238] соответственно. По-видимому, вследствие этого на рынке пока отсутствуют препараты на основе АМП, состоящие исключительно из аминокислот L-ряда. Большинство АМП отсеиваются на ранних стадиях клинических испытаний. И лишь некоторые препараты на основе АМП в настоящее время проходят завершающие этапы клинических испытаний, например, Омиганан (Omiganan) и соединение MX594AN. Действующее начало этих препаратов представляет собой синтетические аналоги антимикробного пептида индолицидина с измененной аминокислотной последовательностью. В ходе фазы III клинических испытаний в качестве препарата, понижающего колонизацию венозных катетеров микроорганизмами, вызывающими заболевания кровеносной системы в разных группах пациентов, омиганан продемонстрировал эффекты, не позволяющие сделать однозначный вывод о возможности его применения в клинической практике [Y.J.Gordon, A.M.McDermott. A Review of Antimicrobial Peptides and Their Therapeutic Potential as Anti-Infective Drugs // Curr Eye Res., 2005, V.30(7), p.505-515]. Соединение MX594AN прошло клинические испытания фазы IIb, и в настоящее время проходит клинические испытания фазы III в качестве средства для лечения угревой сыпи [Обзор по АМП - Гордон]. Кроме того, несколько препаратов на основе АМП находятся на более ранних стадиях клинических испытаний [Y.J. Gordon, A.M. McDermott. A Review of Antimicrobial Peptides and Their Therapeutic Potential as Anti-Infective Drugs // Curr Eye Res., 2005, V.30(7), p.505-515. A.Giuliani, G.Pirri, S.F.Nicoletto. Antimicrobial peptides: an overview of a promising class of therapeutics. // Central European Journal of Biology, 2007, V.2(1) 1-33].
В настоящее время антимикробные пептиды и их аналоги получают в основном твердофазным синтезом, что делает эти вещества чрезвычайно дорогостоящими, а их применение экономически нецелесообразным.
В последнее время все большее внимание уделяется другим стратегиям дизайна модифицированных АМП [D.Knappe, A.Nimptsch, A.Jr. Kolobov, et al. Chemical modifications of short antimicrobial peptides from insects and vertebrates to fight multi-drug resistant bacteria // Adv. Exp. Med. Biol., 2009, V.611, p.395-396], лишенных перечисленных выше недостатков. Основными стратегиями оптимизации структуры АМН с целью получения новых биоцидных агентов являются следующие.
- Синтез циклических аналогов АМП. В ряде случаев [A.Wessolowski, М.Bienert and M.Dathe. Antimicrobial activity of arginine-and tryptophan-rich hexapeptides: the effects of aromatic clusters, D-amino acid substitution and cyclization. J. Pept. Res., 2004, V.64, p.159-169. M.Dathe, H.Nikolenko, J.Klose, et al. Cyclization Increases the Antimicrobial Activity and Selectivity of Arginine- and Tryptophan-Containing Hexapeptides // Biochemistry, 2004, V.43(28), p.9140-9150] циклизация АМП приводит к увеличению антибактериальной активности и повышению устойчивости к протеиназам [A.Rozek, J-P.S.Powers, C.L.Friedrich, et al. Structure-Based Design of an Indolicidin Peptide Analogue with Increased Protease Stability // Biochemistry, 2003, V.42 (48), p.14130-14138], однако при этом может значительно (в 4 раза) возрастать гемолитический эффект [A.Wessolowski, M.Bienert and M.Dathe. Antimicrobial activity of arginine-and tryptophan-rich hexapeptides: the effects of aromatic clusters, D-amino acid substitution and cyclization // J. Pept. Res., 2004, V.64, p.159-169]. Кроме того, циклизация приводит к заметному повышению себестоимости продукта.
- Введение в молекулу АМП атома фтора или трифторметильной группы. Этот подход приводит к снижению МБК (минимальной бактерицидной концентрации) антимикробных пептидов, однако при этом увеличивается время воздействия на микроорганизм, необходимое для проявления бактерицидного действия [D.Gimenez, С.Andreu, M. del Olmo, et al. The introduction of fluorine atoms or trifluoromethyl groups in short cationic peptides enhances their antimicrobial activity // Bioorg. Med. Chem., 2006, V.14, p.6971-6978].
- Иммобилизация АМП на различных полимерных матрицах [М.Bagheri, М.Beyermann, M.Dathe. Immobilization reduces the activity of surface-bound cationic antimicrobial peptides with no influence upon the activity spectrum // Antimicrob Agents Chemother., 2009, V.53(3), p.1132-41]. Этот сравнительно новый подход пока не привел к успешным результатам, т.к. активность иммобилизованных на полимерах пептидов оказалась существенно ниже, чем у свободных АМП. Кроме того, авторами [М.Bagheri, M.Beyermann, M.Dathe. Immobilization reduces the activity of surface-bound cationic antimicrobial peptides with no influence upon the activity spectrun // Antimicrob Agents Chemother., 2009, V.53(3), p.1132-41] не установлено, какое влияние оказывает иммобилизация на гемолитический эффект пептидов.
Таким образом, химическая модификация антимикробных пептидов является перспективным путем получения новых, более эффективных антимикробных агентов без побочных эффектов с антибактериальным, противогрибковым и вирулицидным действием. При этом остается актуальным поиск новых подходов к модификации АМП, позволяющих повысить возможности их практического применения.
Известны антимикробные пептиды - линейный грамицидин D (II),
представляющий собой смесь пептидов формулы:
Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-TrpNHCH2CH2OH, где X=Trp, Tyr, Phe
[W.E.Herrelland D.Heilman. Experimental and Clinical Studies on Gramicidin // J.Clin. Invest., 1941, V.20, 583-591. Annual Reports on NMR Spectroscopy, Volume 60, p 215 London, Academic Press, 2007], циклический грамицидин S (III) [G.Nagamurthi and S.Rambhav. Gramicidin-S: Structure-activity relationship // J.Biosci., 1985, V.7, №3-4, p.323-329], содержащие D-аминокислоты, непротеиногенные аминокислоты (Orn). Соединение II эффективно против грамположительных бактерий [W.E.Herrell and D.Heilman. Experimental and Clinical Studies on Gramicidin // J. Clin. Invest., 1941, V.20, №583] и некоторых вирусов, в частности герпеса [US Patent 6001808, 1999]. Соединение III эффективно главным образом против грамположительных бактерий в концентрациях 5-15 мкМ [Jingbo Xiao, Bernard Weisblum, and Peter Wipf. Electrostatic versus Steric Effects in Peptidomimicry: Synthesis and Secondary Structure Analysis of Gramicidin S Analogues with (E)-Alkene Peptide Isosteres //J. Am. Chem. Soc, 2005, 127 (16), рр 5742-5743]. Соединения II и III используются в медицинской практике только для наружного применения [М.Д.Машковский. Лекарственные средства, 15 изд. Москва, изд-во «Новая волна», 2005, с.822. J.R.Gibson. Trimethoprin-polymyxin В ophthalmic solution in the treatment of presumptive bacterial conjunctivitis-A multicentre trial of its efficacy versus neomycin-polymyxin B-gramicidin and chloramphenicol ophthalmic solutions // J.Antimicrob. Chemother., 1983, V.11, p.217-221]. Недостатками этих антимикробных препаратов являются относительно большая длина этих пептидов и соответственно сравнительно высокая стоимость, недостаточная широта антибактериального, противогрибкового и вирулицидного действия (активность лишь в отношении грамположительных бактерий и вируса герпеса). Но главными их недостатками являются побочные эффекты при применении, в основном гемолиз эритроцитов и аллергические реакции [Heilman, D., and Herrell, W.E.: "Hemolytic Effect of Gramicidin," Proc. Soc. Exper. Biol. and Med., 46: 182 (Jan.) 1941. М.Д.Машковский. Лекарственные средства, 15 изд. Москва, изд-во «Новая волна», 2005, с.822].
Известный пептид в настоящее время исследуется в различных направлениях. В частности, он представляет интерес для создания средств для лечения инфекционных заболеваний [A.J.Kastin. Handbook of biologically active peptides // Elsevier, Academic Press, USA, 2006, p.576]. Пептид IV является фрагментом антимикробных пептидов семейства цекропинов, многих микробных белков и фибронектина поверхности клеток млекопитающих [M.Naito, N.Ohara, S.Matsumoto, T.Yamada. The novel fibronectin binding motif and key residues of micobacteria //J. Biol. Chem., 1998, V.273, p.2905-9].
Известно, что гемин обладает антимикробной активностью, в частности, в отношении золотистого стафилококка. Авторами [Y.Nitzan, H.Ladan, S.Gozansky, Z.Malik. Characterization of hemin antibacterial action on Staphylococcus aureus // FEMS Microbiol. Lett. V.48(3), p.401-406] было показано, что гемин в концентрации 20·10-5 М оказывает сильное, не зависящее от света воздействие на S.aureus, в то время как другие металлопорфирины не проявляли антибактериального эффекта в темноте. Заметное воздействие гемина на инактивацию S.aureus проявилось в немедленной индукции потоков ионов, что было определено рентгеновским микроанализом быстрозамороженных клеток. Авторы [Y.Nitzan, H.Ladan, S.Gozansky, Z.Malik. Characterization of hemin antibacterial action on Staphylococcus aureus // FEMS Microbiol. Lett. V.48(3), p.401-406] полагают, что такое выраженное антибактериальное действие гемина обусловлено тем, что в S.aureus находится множество клеточных мишеней для окислительного воздействия гемина. Однако использование гемина в качестве антибактериального средства затруднено вследствие его нерастворимости в воде, гемолитической активности, а также кратковременности антибактериального эффекта.
Для некоторых пептидных производных гемина общей формулы I, a именно при R1=OH или установлена нуклеазная (нуклеолитическая) активность, проявляющаяся в способности разрушать плазмидную ДНК [Желтухина Г.А., Небольсин В.Е., Лобанова Т.Н // Патент РФ №2250906; Желтухина Г.А., Лобанова Т.Н., Небольсин В.Е., М.О.Галлямов, Драницына С.М., Костанян И.А. // Биоорган, химия. 2006. Т.32, №2, С.198-210]. Отдельные аминокислотные и пептидные производные гемина общей формулы I, а именно при R1=OH, или способны ингибировать протеиназу ВИЧ и оказывать вследствие этого противовирусное анти-ВИЧ действие [Р.П.Евстигнеева, Г.А.Желтухина, Т.В.Зарубина, В.Е.Небольсин, Д.Н.Носик, Н.Н.Носик // Патент РФ №2238950].
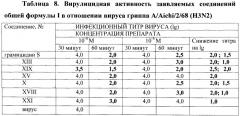
Показано, что некоторые известные производные гемина общей формулы I, а именно обладают вирулицидной активностью [заявка на изобретение RU 2007125604/04(027891)], однако антибактериальная, антигрибковая активности для них не были известны.
Композиции для предотвращения бактериальных и грибковых инфекций, включающие конъюгаты гемина с аминокислотами, пептидами и пептидомиметиками, неизвестны.
Нами предложено провести конъюгацию двух природных соединений (гемина и антимикробного пептида), обладающих антимикробной активностью с различным механизмом действия с целью повышения эффективности действия, снижения токсичности и приобретения новых полезных свойств, в частности водорастворимости и устойчивости к протеолизу.
Задачей настоящего изобретения является создание новых биосовместимых мембраноактивных конъюгатов гемина с АМП общей формулы I, и их фармацевтически приемлемых солей, обладающих деструктирующим действием по отношению к липидной мембране, эффективных против бактерий, микроскопических грибов и вирусов, при этом нетоксичных, без гемолитической активности и без побочных эффектов; создание на их основе противоинфекционного лекарственного средства, обладающего антибактериальной, противогрибковой и вирулицидной активностью; композиций, в том числе фармацевтических, дезинфецирующих и антисептических, а также способов, позволяющих получать заявленные соединения с достаточными выходами и чистотой.
Еще одной задачей настоящего изобретения является способ синтеза соединения включающий получение входящего в его состав трипептида с более высоким выходом, по более простой и экономически целесообразной методике. Известен [Patent GB 2207922А. Tripeptides with pharmacological properties. В.Brunetti, M.Prada, 1989] способ синтеза пептида IV по схеме [1+2] с использованием дикарбобензокси-аргинина и дибензилового эфира аспарагиновой кислоты. Недостатком метода является применение в качестве исходного реагента указанного производного аргинина. Известно, что в таком производном гуанидиновая группа защищена недостаточно, что может приводить к образованию побочных продуктов в синтезах с его использованием [Дж.Гринштейн, М.Виниц. Химия аминокислот и пептидов // М: Мир, 1966, с.558]. Выход целевого трипептида IV, полученного этим способом, был достаточно низким и составил 21%, считая на исходный реагент.Известен другой способ синтеза этого трипептида в растворе [М.Abo-Ghalia, S.Abd El-Rahman, A.El-Kafrawy, and A.Kalomuch. Optimized conventional synthesis of "RGD" and "RGDS" peptides and their sarcosine mimics as integrin GP IIb/IIIa antagonists // Amino Acids, 2003, V.24, p.405-411] по схеме [2+1] с использованием исходных реагентов H-Gly-OEt, Z-Arg(NO2)-OH и Н-Asp(OBzl)-OBzl. Данный подход позволил повысить суммарный выход целевого пептида до 41%. В то же время, существенным недостатком этого метода является использование производного аргинина, известного неполным блокированием гуанидиновой функции аргинина нитрогруппой. Кроме того, известно, что отщепление гидрогенолизом NG-нитрогруппы не всегда бывает удовлетворительным [Дж.Гринштейн, М.Виниц. Химия аминокислот и пептидов // М: Мир, 1966, с.555]. Предусмотренное в данной схеме синтеза омыление Z-Arg(NO2)-GlyOEt представляет собой нежелательное жесткое воздействие на дипептид, которое может приводить к рацемизации и частичной деструкции пептидной связи. Применение переносного гидрирования в присутствии палладиевой черни по данному способу удлиняет и удорожает стадию конечного деблокирования целевого трипептида IV.
Поставленная задача решается новыми соединениями общей формулы I, где R1=OH,
R2=-Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где Х=Trp, или Phe, или
или
и/или их фармацевтически приемлемыми солями, обладающими способностью деструктировать липидную мембрану;
- средством, обладающим антибактериальной активностью, в том числе против резистентных бактерий, противогрибковой и вирулицидной активностью, представляющим собой новое соединение общей формулы I;
- средством, обладающим антибактериальной активностью, в том числе против резистентных бактерий, и противогрибковой активностью, представляющим собой известное соединение общей формулы I;
- фармацевтической, дезинфицирующей и антисептической композицией, включающей соединения общей формулы I для профилактики и/или лечения у человека и животных различных заболеваний, вызванных бактериями, в том числе резистентными, микроскопическими грибами или вирусами с использованием их антибактериальных, противогрибковых и вирулицидных свойств и содержащей одно или несколько из соединений общей формулы I в эффективном количестве;
- способами синтеза новых производных гемина общей формулы I или их фармацевтически приемлемых солей, включающими ацилирование аминогруппы аминокомпонентов бис-N-оксисукцинимидным эфиром гемина, или включающими ацилирование α-аминогруппы пептида 6(7)-моно-N-окси-5-норборнен-2,3-дикарбоксиимидным эфиром гемина, или включающими ацилирование аминогруппы пептида активированным по одной карбоксильной группе производным гемина, причем в качестве активирующего агента используют ди-трет-бутилпирокарбонат в присутствии пиридина;
- способом получения конъюгата гемина с Arg-Gly-Asp, включающим синтез трипептида Arg-Gly-Asp. В соответствии с настоящим изобретением, способ синтеза Arg-Gly-Asp в растворе включает получение дипептида Z3Arg-Gly-ОН методом смешанных ангидридов с использованием силилированного производного глицина с последующим присоединением к упомянутому дипептиду H-Asp(OtBu)2 также методом смешанных ангидридов; далее деблокирование защищенного трипептида проводится в 2 стадии - сначала трет-бутильных защит - действием трифторуксусной кислоты, с последующим отщеплением Z-групп гидрогенолизом над 10÷20% палладием на угле. Предложенный способ позволяет повысить выход целевого продукта - трипептида до 57%, упростить процесс, в частности исключить стадию жесткого воздействия - омыления дипептида, уменьшить время гидрогенолиза и сделать процесс более экономически целесообразным в результате замены палладиевой черни на 10÷20% палладий на угле.
Список сокращений
DCC - N,N′-дициклогексилкарбодиимид
DMSO - диметилсульфоксид
DOPC - диолеоилфосфатидилхолин
GrD - грамицидин D
НА - гистамин
Hem - остаток гемина
МеОН - метиловый спирт
MES - 2-(N-морфолино)этансульфокислота
МН - среда Mueller-Hilton
ОМе - метиловый эфир
ONb - N-окси-5-норборнен-2,3-дикарбоксиимидный эфир
OtBu - трет-бутиловый эфир
Z - карбобензоксигруппа
ДМСО - диметилсульфоксид
ДМФА-N,N′ - диметилформамид
ИК - инфракрасная спектроскопия
ИР - ингибирование роста
КФ - карбоксифлуоресцеин
МБК - минимальная бактерицидная концентрация
МИК - минимальная ингибирующая концентрация
ОФ-ВЭЖХ - обращенно-фазная высокоэффективная жидкостная хроматография
Tris - трис-(гидроксиметил)аминометан
ТСХ - хроматография в тонком слое
ХЛФ - хлороформ
ЭА -этилацетат
Следующие примеры иллюстрируют предлагаемое изобретение.
В работе использовались аминокислоты и их производные L-ряда фирмы «Bachem» (Германия), «Reanal» (Венгрия), DOPC (Sigma-Aldrich), карбоксифлуоресцеин (Fluka, Германия), MES (Sigma-Aldrich), Tris (Sigma-Aldrich), грамицидин D (Sigma-Aldrich), грамицидин S (Красфарма, Россия) хлорид калия ч.д.а. (Химмед, Россия)
Все растворители безводные, за исключением тех, которые использовались для экстракции из водных растворов. Индивидуальность полученных соединений проверяли методом ТСХ на пластинах Kieselgel 60 F254 (Merck, Германия) в системах: хлороформ - метанол 9:1 (1), хлороформ -метанол 8:2 (2), хлороформ - метанол 5:3 (3), хлороформ - метанол - уксусная кислота 5:3:1 (4), метанол - уксусная кислота - вода 4:1:1 (5), бутанол - уксусная кислота - вода 4:1:1 (6). Хроматограммы проявляли хлортолидиновым реактивом, нингидрином, по свечению в УФ-свете.
Масс-спектры высокого разрешения получали на время-пролетном масс-спектрометре «Ultraflex» («Bruker», Германия) методом матриксной лазерно-десорбционной ионизации (TOF MALDI), в качестве матрицы использовалась 2,5-дигидроксибензойная кислота.
ИК-спектры регистрировали на Фурье-спектрометре: «Magna 750» («Nicolet», США).
Электронные спектры снимали на спектрофотометре «Jasco» модель UV/VS 7800 (Япония).
ОФ-ВЭЖХ проводили на приборе Gilson 305 (Gilson, Франция).
Препаративную ОФ-ВЭЖХ проводили на колонке Luna 10 µ, обращенная фаза С5, размеры 250×21.2 мм, (Phenomenex, США) в следующих условиях.
Изократическая элюция 0.1% раствором TFA в воде, скорость потока 4 мл/мин. Поглощение регистрировали при длине волны 220 нм (7).
Динамику выхода КФ из липосом контролировали на флуориметре Сагу Eclipse (Varian, США).
Липосомы получали с помощью мини-экструдера Avanti (Avanti Polar Lipids, США)
Пример 1
6,7-бис-(метиловый эфир Nα-глицил)-протогемина (IX) (XV)
К суспензии 0.030 г (0.236 ммоль) H-GlyOMe·HCl в 1.5 мл DMF прибавляли 0.033 мл (0.236 ммоль) Et3N и перемешивали при комнатной температуре 3 мин. К полученному раствору прибавляли раствор 0.100 г (0.118 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX (I) в 5 мл DMF и перемешивали 2 часа при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (1) и (2). Раствор концентрировали в вакууме до 0.5 мл и прибавляли 6 мл диэтилового эфира. Полученный остаток растворяли в ХЛФ, при этом наблюдалось выпадение белых кристаллов Et3N·HCl, от которых избавлялись декантацией раствора. Растворитель удаляли в вакууме. Для введения противоиона Cl- остаток растворяли в 15 мл смеси ХЛФ-МеОН (8:2), два раза встряхивали с 7.5 мл 0.5 N раствора соляной кислоты и промывали водой до нейтральной реакции. Растворитель удаляли в вакууме. Вещество очищали на колонке (20×2 см) с силикагелем Kieselgel 60 F254 (Merck, Германия), элюировали смесью ХЛФ-МеОН (8:2). Фракцию, содержащую вещество с Rf 0.71 (2), собирали. Растворитель удаляли в вакууме. Выход 0.063 г (67%), Rf 0.26 (1), 0.71 (2). Электронный спектр, λmax, нм, ХЛФ:МеОН (8:2), (ε·10-3): 400 (115.9), 508 (9.38), 640 (3.81). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1737 (СО сл.эф.), 1648 (амид I), 1539 (амид II). Масс-спектр, m/z: [M]+ 758.5.
Пример 2
6,7-бис-гистаминил протогемин (IX) (XIX)
К раствору 0.026 г (0.236 ммоль) гистамина в 1.5 мл DMF прибавляли раствор 0.100 г (0.118 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX (I) в 4 мл DMF и перемешивали 20 мин при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (2) и (3). Раствор концентрировали в вакууме до 1 мл и прибавляли 10 мл диэтилового эфира. Для введения противоиона Cl- остаток растворяли в 4 мл МеОН и прибавляли 0.093 мл (0.354 ммоль) 3.8N HCl/МеОН до достижения рН 4. Растворитель удаляли в вакууме при температуре 30°С. Вещество очищали на колонке (31×2 см) с силикагелем Kieselgel 60 F254 (Merck, Германия), элюировали смесью ХЛФ-МеОН (5:3). Фракцию, содержащую вещество с Rf 0.64 (3), собирали. Растворитель удаляли в вакууме. Выход 0.049 г (51%), Rf 0.25 (2), 0.64 (3). Электронный спектр, λmax, нм, ХЛФ:МеОН (8:2), (ε·10-3): 388 (49.1), 508 (4.18), 640 (1.76). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1644 (амид I), 1543 (амид II). Масс-спектр, m/z: [М]+ 802.3.
Пример 3
6,7-бис-[(бис-метиловый эфир Nα-L-аргинил)-L-глутамил]-протогемина IX (XVIII)
1. Бис-(метиловый эфир Nα-аргинил)-L-глутаминовой кислоты
К суспензии 0.069 г (0.266 ммоль) H-ArgOMe·2 HCl в 2 мл DMF прибавляли 0.074 мл (0.531 ммоль) Et3N и перемешивали при комнатной температуре 5 мин. К полученному раствору прибавляли 0.077 г (0.133 ммоль) бис-пентафторфенилового эфира Вос-глутаминовой кислоты, полученного ранее, и перемешивали 4 часа при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (5). Раствор концентрировали в вакууме до 1 мл и прибавляли 10 мл диэтилового эфира. Маслообразный осадок отделяли от растворителя декантированием, остатки растворителя удаляли в вакууме. Вещество очищали на колонке (23×1 см) с силикагелем Kieselgel 60 F254 (Merck, Германия), элюировали смесью метанол - уксусная кислота - вода 4:0.5:0.5. Фракцию, содержащую вещество с Rf 0.67 (5), собирали. Растворитель удаляли в вакууме. Выход 0.073 г (77%), Rf 0.67 (5). [α]D 25 - 8.53° (С 0.38; МеОН). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1735 (СО сл.эф.), 1653 (амид I), 1542, 1558 (амид II). Масс-спектр, m/z: [M]+ 588.31.
К 0.073 г (0.0946 ммоль) бис-(метилового эфира Nα-аргинил)-Boc-L-глутаминовой кислоты (V) приливали 6 мл ~ 3 н. HCl/MeOH. Полученную суспензию перемешивали 2 часа при комнатной температуре. Контроль процесса осуществляли ТСХ в условиях (6). После достижения полной конверсии в аминосвободный дипептид растворитель удаляли в вакууме при 30°С. Маслообразный остаток кристаллизовали под безводным диэтиловым эфиром, растворитель отделяли декантацией.
2. 6,7-бис-[(бис-метиловый эфир Nα-L-аргинил)-L-глутамил]-протогемина IX (XVIII)
К суспензии полученного H-Glu(ArgOMe)2-3 HCl в 1.5 мл DMF прибавляли 0.047 мл (0.335 ммоль) Et3N и перемешивали при комнатной температуре 2 мин. Наблюдали выпадение осадка Et3N·HCl. К полученной суспензии прибавляли раствор 0.047 г (0.0558 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX (I) в 2 мл DMF и перемешивали 22 часа при комнатной температуре. Контроль за протеканием реакции осуществляли ТСХ в условиях (6). Раствор концентрировали в вакууме до 1 мл и прибавляли 10 мл диэтилового эфира. Для введения противоиона Cl- остаток растворяли в 4 мл МеОН и прибавляли 3.8 N HCl/МеОН до достижения рН 4. Растворитель удаляли в вакууме при температуре 30°С. Вещество трижды очищали на колонке (13×1 см) с сефадексом LH-20, элюировали МеОН. Фракцию, содержащую вещество с Rf 0.07 (6), собирали. Растворитель удаляли в вакууме. Выход 0.030 г (34%). Rf 0.07 (6), Rf(на окиси алюминия) 0.70 (6). Электронный спектр, λmax, нм, ХЛФ:МеОН (8:2), (ε·10-3): 400 (92.2), 508 (6.31), 636 (2.39). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1737 (СО сл.эф.), 1649 (амид I), 1528 (амид II). Масс-спектр, m/z: [M]+ 1554.97.
Пример 4
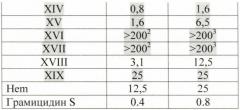
6,7-бис-N-(2-гидроксиэтил)амид-протогемина (IX) (XIV)
К раствору 0.050 г (0.0591 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX (I) в 3 мл DMF прибавляли 0.010 мл (0.118 ммоль) аминоэтанола и перемешивали 20 мин при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (2) и (3). Раствор концентрировали в вакууме до 1 мл и прибавляли 10 мл диэтилового эфира. Для введения противоиона Cl- остаток растворяли в 3 мл МеОН и прибавляли 3.8 N HCl/МеОН до достижения рН 4. Растворитель удаляли в вакууме при температуре 30°С. Вещество очищали на колонке (24×1 см) с силикагелем Kieselgel 60 F254 (Merck, Германия), элюировали смесью ХЛФ-МеОН (5:3). Фракцию, содержащую вещество с Rf 0.52 (3), собирали. Растворитель удаляли в вакууме. Выход 0.036 г (82.5%), Rf 0.35 (2), 0.52 (3). Электронный спектр, λmax, нм, ХЛФ:МеОН (8:2), (ε·10-3): 400 (183.0), 508 (5.23), 640 (2.08). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1632 (амид I), 1549 (амид II). Масс-спектр, m/z: [M]+ 702.5.
Пример 5
6,7-бис-N-(1,3-дигидроксипропан-2-ил)амид протогемина (IX) (XVI)
К раствору 0.050 г (0.0591 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX (I) в 3 мл DMF прибавляли раствор 0.012 г (0.118 ммоль) 2-амино-1,3-пропандиола в 0.5 мл DMF и перемешивали 20 мин при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (4). Раствор концентрировали в вакууме до 0.5 мл и прибавляли 6 мл диэтилового эфира. Для введения противоиона Cl- остаток растворяли в 9 мл смеси ХЛФ-МеОН (8:2), один раз встряхивали с 4 мл 0.06 N раствора соляной кислоты, насыщенного NaCl, и промывали водой до нейтральной реакции. Растворитель удаляли в вакууме. Вещество очищали на колонке (21×2 см) с сефадексом LH-20, элюировали МеОН. Фракцию, содержащую вещество с Rf 0.56 (4), собирали. Растворитель удаляли в вакууме. Выход 0.018 г (36%), Rf 0.56 (4). Электронный спектр, λmax, нм, ХЛФ:МеОН (8:2), (ε·10-3): 400 (40.5), 508 (2.68), 640 (1.02). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1629 (амид I), 1550 (амид II). Масс-спектр, m/z: [M]+ 762.0.
Пример 6
6,7-бис-N-(2,3-дигидроксипропил)амид протогемин (IX) (XVII)
К раствору 0.050 г (0.0591 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX (I) в 3 мл DMF прибавляли 0.009 мл (0.118 ммоль) 3-амино-1,2-пропандиола и перемешивали 20 мин при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (3) и (4). Раствор концентрировали в вакууме до 0.5 мл и прибавляли 6 мл диэтилового эфира. Для введения противоиона Cl- остаток растворяли в 3 мл МеОН и прибавляли 3.8 N HCl/МеОН до достижения рН 4. Растворитель удаляли в вакууме при температуре 30°С. Вещество очищали на колонке (30×2 см) с силикагелем Kieselgel 60 F254 (Merck, Германия), элюировали смесью ХЛФ-МеОН:АсОН (5:3:0.5). Фракцию, содержащую вещество с Rf 0.69 (4), собирали. Растворитель удаляли в вакууме. Выход 0.023 г (46%), Rf 0.33 (3), 0.69 (4). Электронный спектр, λmax, нм, ХЛФ:МеОН (8:2), (ε·10-3): 396-400 (24.2), 488 (2.14), 600 (1.40). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1634 (амид I), 1565 (амид II). Масс-спектр, m/z: [M]+ 762.0.
Пример 7
6(7)-Монометиловый эфир протогемина (IX) (XX)
К раствору 50 мг (0.077 ммоль) гемина в 0.5 мл ДМФА прибавляли 100 мкл пиридина и 17 мг (0.077 ммоль) ди-трет-бутилпирокарбоната и перемешивали 30 мин. К полученному смешанному ангидриду добавляли 2,5 мкл (0.077 ммоль) безводного метанола и перемешивали 6 часов. Растворитель удаляли в вакууме при 30°С. Остаток растворяли в хлороформе. Вещество очищали флэш-хроматографией на колонке (10×2 см) с силикагелем Kieselgel 60 F254 (Merck, Германия), элюировали смесью ХЛФ-МеОН 9:1. Выход 36 мг (65%). Электронный спектр, λmax, нм, хлороформ, (ε·10-3): 387 (130), 511 (2.6) 540 (2.4), 640 (0.11). Масс-спектр, m/z: [M]+ 666.0.
Пример 8
6,7-Диметиловый эфир протогемина (IX) (XXI)
К раствору 50 мг (0.077 ммоль) гемина в 0.5 мл ДМФА прибавляли 100 мкл пиридина и 92 мг (0.420 ммоль) ди-трет-бутилпирокарбоната и перемешивали 30 мин. К полученному смешанному ангидриду добавляли 10 мкл (0.308 ммоль) безводного метанола и перемешивали 6 часов. Растворитель удаляли в вакууме при 30°С. Остаток растворяли в хлороформе. Вещество очищали флэш-хроматографией на колонке (10×2 см) с силикагелем Kieselgel 60 F254 (Merck, Германия), элюировали смесью ХЛФ-МеОН 9:1. Выход 31 мг (60%). Электронный спектр, λmax, нм, хлороформ, (ε·10-3): 387 (125), 538 (1.74), 640 (0.74). Масс-спектр, m/z: [M]+ 680.0.
Пример 9
6(7)-моно-(-Val-Gly-Ala-D-Leu-Ala-D-Val-Val-D-Val-Trp-D-Leu-X-D-Leu-Trp-D-Leu-Trp-NH-CH2CH2OH)амид протогемина (IX) (XII),
где Х=Trp, Tyr, Phe
К раствору 32 мг (0.017 ммоль) грамицидина D в 0.650 мл сухого ДМФА прибавляли 48 мкл 1 н. HCl в метаноле. Реакционную смесь перемешивали 72 ч в темноте при комнатной температуре. Растворитель удаляли в вакууме при 30°С. Выход 30 мг (98%). Масс-спектр, m/z: [M]+ 1854.0
К раствору 30 мг (0.016 ммоль) деформилированного грамицидина D в 0.2 мл ДМФА прибавляли 13.2 мг (0.016 ммоль) 6(7)-моно-N-окси-5-норборнен-2,3-дикарбоксиимидного эфира гемина и перемешивали 1,5 ч при комнатной температуре. Растворитель удаляли в вакууме при 30°С. Остаток растворяли в хлороформе. Остаток очищали на колонке (30×2 см) с силикагелем Kieselgel 60 F254 (Merck, Германия), элюировали смесью ХЛФ-МеОН 9:1. Выход 23.5 мг (59%). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1634 (амид I), 1565 (амид II). Rf 0.65 (1)
Пример 10
6(7)-моно-[цикло-(Orn-Leu-D-Phe-Pro-Val)2])амид протогемин (IX) (XIII)
К раствору 50 мг (0.077 ммоль) гемина в 0.5 мл сухого ДМФА прибавляли 1 мл пиридина и 25,3 мг (0.116 ммоль) ди-трет-бутилпирокарбоната и перемешивали 15 мин при комнатной температуре. Одновременно к суспензии 93.5 мг (0.077 ммоль) дигидрохлорида грамицидина S в 0.5 мл ДМФА прибавляли 22 мкл (0,154 ммоль) триэтиламина и перемешивали 2 мин.
К полученному смешанному ангидриду гемина прибавляли раствор аминосвободного грамицидина S и перемешивали 3 ч. Растворитель удаляли в вакууме при температуре 30°С. Остаток растворяли в хлороформе. Остаток очищали на колонке (30×2 см) с силикагелем Kieselgel 60 F254 (Merck, Германия), элюировали смесью ХЛФ-МеОН 12:1. Выход 20 мг (15%). Масс-спектр, m/z: [М]+ 1739.5. Электронный спектр, λmax, нм, хлороформ:метанол (4:1), (ε·10-3): 400 (105), 492 (10,6), 640 (6).
Пример 11
Arg-Gly-AspCH3COOHCF3COOH (IV)
а) синтез трикарбобензокси-аргинин-глицина
Смесь 0.043 г (0.573 ммоль) глицина, 0.4 мл (1.6 ммоль) бис-(O,N-триметилсилил)ацетамида и 1 мл сухого хлористого метилена интенсивно перемешивали в плотно