Клетка-хозяин, содержащая вектор для продуцирования белков, требующих гамма-карбоксилирования
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии и представляет собой эукариотическую клетку-хозяина для продуцирования гамма-карбоксилированного белка, содержащую вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности контроля экспрессии, и вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую витамин К-эпоксидоредуктазу и ассоциированные последовательности контроля экспрессии. При этом клетка-хозяин дополнительно содержит молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу и ассоциированные последовательности контроля экспрессии. Данное изобретение относится также к способу получения гамма-карбоксилированного белка и способу получения фармацевтической композиции, пригодной для индукции свертывания крови или стимуляции повышенного или пониженного свертывания крови, на основе полученного гамма-карбоксилированного белка. Изобретение позволяет получать гамма-карбоксилированный белок с высокой степенью эффективности. 3 н. и 17 з.п. ф-лы, 2 ил., 9 табл.
Реферат
Область изобретения
Настоящее изобретение относится к клетке-хозяину, содержащей вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности контроля экспрессии, и молекулу нуклеиновой кислоты, кодирующую витамин K-эпоксидоредуктазу и ассоциированные последовательности контроля экспрессии, и γ-глутамилкарбоксилазу и ассоциированные контрольные последовательности. Данное изобретение дополнительно относится к способу получения белка, требующего гамма-карбоксилирования, с высокими выходами.
Предшествующий уровень техники
Кровотечение является обычной клинической проблемой. Оно является следствием заболевания, травмы, хирургического вмешательства и медицинского лечения. Механическая остановка кровотечения является настоятельной необходимостью. Это может быть затруднительным или даже невозможным из-за локализации кровотечения или из-за того, что кровь диффундирует из многих (маленьких) сосудов. Пациентам, которые имеют кровотечение, таким образом, может требоваться лечение агентами, которые поддерживают гемостаз. Это могут быть продукты, происходящие из крови (гемотерапия), агенты, которые вызывают высвобождение эндогенных гемостатических агентов, рекомбинантные факторы свертывания крови (F) или агенты, которые задерживают растворение сгустков крови.
Среди продуктов, происходящих из крови, часто получаемых из местного госпиталя, лечением первого ряда являются цельная кровь для замещения объема и поддержки гемостаза, упакованные красные кровяные клетки для улучшения способности транспортировать кислород, концентраты тромбоцитов для повышения числа тромбоцитов (если оно является низким, или они являются дефективными) и свежая замороженная плазма для поддержки гемостаза (свертывание крови и агрегация тромбоцитов). Второй линией продуктов, происходящих из плазмы, которые поддерживают гемостаз, являются криопреципитат, концентраты комплекса протромбина, концентраты активированного комплекса протромбина и очищенные факторы свертывания крови. Несколько факторов свертывания крови доступны сегодня в виде человеческих рекомбинантных белков, неактивных (факторы свертывания крови VIII и IX) и активированных (фактор свертывания крови VIIa).
Гемофилия представляет собой наследственное или приобретенное расстройство, связанное с кровотечением, либо с ненормальным или находящимся в недостатке фактором свертывания крови, или с антителами, направленными на фактор свертывания крови, которые ингибируют функцию прокоагулянта. Самыми обычными гемофилиями являются гемофилия А (недостаток фактора свертывания крови VIII) и гемофилия В (фактор IX). Очищенные или рекомбинантные одиночные факторы свертывания крови являются главным способом лечения пациентов с гемофилией. У пациентов с ингибиторными антителами имеется проблема с лечением, так как они также могут нейтрализовать фактор свертывания крови, который вводится пациенту.
Активная форма белка С (АРС) представляет собой ингибитор свертывания плазмы путем деградации активированных факторов свертывания крови Va и VIIIa. Было показано, что рекомбинантный АРС является эффективным средством для лечения чрезмерного свертывания крови у пациентов с сепсисом.
Факторы свертывания крови для терапевтического применения можно получить из человеческой плазмы, хотя процесс их очистки является непростым и требует многих стадий, несколько из которых нацелено на устранение загрязняющих вирусов. Но даже при расширенных мерах безопасности и тестирования продуктов, происходящих из крови, нельзя исключить загрязнения инфекционными вирусами или прионами. Из-за этого риска весьма желательным является получение человеческих терапевтических белков из рекомбинантных клеток, выращенных в средах без компонентов животного происхождения. Этот подход не всегда является прямым, так как для того, чтобы многие белки вырабатывались в полностью функциональной форме, т.е. были правильно посттрансляционно модифицированными, требуется млекопитающее-хозяин. Среди факторов свертывания крови, выпускаемых в рекомбинантных клетках в промышленном масштабе, находятся FVII (NovoSeven), FVIII (Kogenate, Recombinate, Refacto) и FIX (BeneFix) (Roddie and Ludlam. Blood Rev. 11:169-177, 1997) и активный белок С (Xigris). Одним из главных препятствий при получении больших количеств полностью функциональных рекомбинантных человеческих факторов свертывания крови является домен Gla, присутствующий у FII, FVII, FIX, FX, белка S и белка С. Этот домен содержит остатки глутаминовой кислоты, которые посттрансляционно модифицируются добавлением карбоксильных групп. Выработка этих факторов затруднена тем фактом, что их сверхэкспрессия приводит к образованию недокарбоксилированного и, следовательно, неактивного белка. Модификации Gla представляют собой результат действия фермента, зависимого от витамина K, называющегося γ-глутамилкарбоксилазой (GGCX). Этот фермент был подробно исследован многими учеными, конкретно теми, которые участвуют в исследовании факторов свертывания крови (WO-A-8803926; Wu et al. Science 254(5038); 1634-1636, 1991; Rehemtulla et al., Proc Natl Acad Sci USA 90:4611-4615, 1993; Stanley J. Biol. Chem. 274(24): 16940-16944, 1999; Vo et al., FEBS Letters 445:256-260, 1999; Begley et al., The Journal of Biological Chemistry 275(46):36245-36249, 2000; Walker et al., The Journal of Biological Chemistry 276(11):7769-7774, 2001; Bandyopadhyay, et al. Proc Natl Acad Sci USA 99(3):1264-1269, 2002; Czerwiec et al., Eur J Biochem 269:6162-6172, 2002; Hallgren et al., Biochemistry 41(50):15045-15055, 2002; Harvey et al., The Journal of Biological Chemistry 278(10):8363-8369, 2003). Попытки коэкспрессировать GGCX с фактором свертывания крови FIX были предприняты по меньшей мере двумя научными группами, но они не были успешными (Rehemtulla, et al. 1993, ibid; Hallgren et al. 2002, ibid). Принимая во внимание большой интерес к ферментам GGCX, можно предположить, что значительно больше исследований потерпели неудачу и поэтому не были описаны. GGCX требует в качестве кофактора восстановленного витамина К. Восстановленный витамин К превращается с помощью GGCX в эпоксид витамина К, который рециклируется до восстановленного витамина К с помощью витамин K-эпоксидоредуктазы (VKOR). Таким образом, для эффективного зависимого от витамина К карбоксилирования белков требуются два фермента - GGCX и VKOR. Клонирование и идентификацию VKOR описали в 2004 году (Li et al., Nature 427:541-543, 2004, Rost et al., Nature 427:537-541, 2004). Белок VKOR представляет собой полипептид из 163 аминокислот с по меньшей мере одним предсказываемым трансмембранным участком. В рекомбинантных клетках, экспрессирующих VKOR, данная активность локализуется в микросомальной субклеточной фракции.
Для человеческого FII (протромбин) по меньшей мере 8 из 10 остатков Glu должны быть правильно модифицированы для того, чтобы получить полностью функциональный протромбин (Malhotra, et al., J. Biol. Chem. 260:279-287, 1985; Seegers and Walz. Prothrombin and other vitamin K proteins. CRC Press, 1986). Аналогично свертывающая активность человеческого фактора свертывания крови IX требует γ-карбоксилирования по меньшей мере 10 из 12 остатков глутаминовой кислоты в домене Gla (White et al., Thromb. Haemost. 78:261-265, 1997). Были предприняты большие усилия по получению высоких уровней выработки rhFII с использованием нескольких разных систем, таких как системы экспрессии на основе клеток СНО, клеток ВНК, клеток 293 и вируса осповакцины, но все они потерпели неудачу или привели к недокарбоксилированному продукту и, таким образом, функционально неактивному протромбину (Jorgensen et al., J. Biol. Chem. 262:6729-6734, 1987; Russo et al., Biotechnol Appl Biochem 14(2):222-233, 1991; Fischer et al., J Biotechnol 38(2):129-136, 1995; Herlitschka et al. Protein Expr. Purif. 8(3):358-364, 1996; Russo et al., Protein Expr. Purif. 10:214-225, 1997; Vo et al. 1999, ibid; Wu and Suttie Thromb Res 96(2):91-98, 1999). Сообщавшиеся ранее продуктивности карбоксилированного рекомбинантного человеческого протромбина являются низкими - 20 мг/л для мутантного протромбина (Côte et al., J. Biol. Chem 269:11374-11380, 1994), 0,55 мг/л для человеческого протромбина, экспрессируемого в клетках СНО (полностью карбоксилированный, Jørgensen et al. 1987, ibid), 25 мг/л в клетках СНО (степень карбоксилирования не указана, Russo et al. 1997, ibid).
Насколько известно, о коэкспрессии белка, требующего γ-карбоксилирования, и VKOR ранее не сообщалось.
WO 92/19636 раскрывает клонирование и идентификацию последовательности человеческой и коровьей витамин K-зависимой карбоксилазы. В данной заявке говорится о коэкспрессии витамин K-зависимой карбоксилазы (GGCX) и витамин K-зависимого белка в подходящей клетке-хозяине для того, чтобы получить витамин K-зависимый белок. Коэкспрессия данной карбоксилазы и витамин K-зависимого белка не проиллюстрирована примерами.
В WO 2005/038019 заявлен способ увеличения общей продуктивности γ-карбоксилированного белка контролируемой коэкспрессией γ-карбоксилированного белка и GGCX. Данное изобретение проиллюстрировано примерами с улучшенной продуктивностью факторов свертывания крови II и FIX.
WO 2005/030039 говорит о коэкспрессии витамин K-зависимых белков с витамин K-эпоксидредуктазой (VKOR) для того, чтобы улучшить γ-карбоксилирование. Однако такая коэкспрессия не проиллюстрирована примерами.
Sun et al. (Blood 106: 3811-3815, 2005) было показано, что коэкспрессия фактора свертывания крови Х (FX) и VKOR увеличивает долю γ-карбоксилированного белка. Кроме того, Wajih et al. (JBC 280:31603-31607, 2005) продемонстрировали увеличение доли γ-карбоксилированного фактора свертывания крови IX (FIX) путем коэкспрессии с VKOR. В обеих публикациях сообщили, что VKOR увеличивал долю γ-карбоксилированного белка, но коэкспрессия VKOR не улучшала общую продуктивность фактора свертывания крови.
Существует потребность в улучшенных способах получения активированных факторов свертывания крови с повышенными выходами. Настоящее изобретение предложено для удовлетворения этой потребности.
Краткое изложение сущности изобретения
Согласно первому аспекту данного изобретения предложена клетка-хозяин, содержащая вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности контроля экспрессии, и вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую витамин K-эпоксидоредуктазу и ассоциированные последовательности контроля экспрессии, где данная клетка-хозяин дополнительно содержит молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу и ассоциированные последовательности контроля экспрессии.
В другом аспекте предложена клетка, которая модифицирована генно-инженерным образом для экспрессии (1) белка, который требует γ-карбоксилирования, и (2) витамин K-эпоксидоредуктазы, где данные белки (1) и (2) экспрессируются в соотношении от 10:1 до 500:1.
Согласно другому аспекту предложена генетически модифицированная эукариотическая клетка, содержащая: (1) полинуклеотид, кодирующий белок витамин K-эпоксидоредуктазу, где указанная кодирующая последовательность белка витамин К-эпоксидоредуктаза функциональным образом связана с последовательностями контроля экспрессии, обеспечивающими экспрессию белка витамин K-эпоксидоредуктаза указанной клеткой; (2) полинуклеотид, кодирующий белок, требующий карбоксилирования белком γ-глутамилкарбоксилазой, функциональным образом связанный с последовательностями контроля экспрессии, обеспечивающими экспрессию указанного белка, требующего карбоксилирования, указанной клеткой, и (3) полинуклеотид, кодирующий гамма-глутамилкарбоксилазу.
Согласно еще одному другому аспекту предложен вектор, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности контроля экспрессии, и молекулу нуклеиновой кислоты, кодирующую витамин K-эпоксидоредуктазу и ассоциированные последовательности контроля экспрессии.
Согласно другому аспекту предложен способ получения гамма-карбоксилированного белка, включающий: (1) культивирование клетки, экспрессирующей рекомбинантный белок, который требует гамма-карбоксилирования, витамин K-эпоксидоредуктазу и γ-глутамилкарбоксилазу, и (2) выделение гамма-карбоксилированного белка.
Согласно другому аспекту предложен способ получения фармацевтической композиции, пригодной для индукции свертывания крови или стимуляции повышенного или пониженного свертывания крови, включающий проведение очистки активного карбоксилированного белка, полученного согласно описанным выше способам, и смешивание очищенного карбоксилированного белка с одним или более чем одним фармацевтически приемлемым носителем или эксципиентом.
Согласно другому аспекту предложен способ стимуляции повышенного или пониженного свертывания крови у субъекта, включающий введение фармакологически эффективного количества выделенного гамма-карбоксилированного белка, полученного описанными выше способами, нуждающемуся в этом пациенту.
Данный белок, требующий гамма-карбоксилирования, полученный способами по настоящему изобретению, можно использовать в гемостатической или антитромботической терапии.
Краткое описание графических материалов
Фиг.1 показывает карту плазмиды вектора коэкспрессии F10NopA (фактор Х+GGCX) и карту плазмиды вектора экспрессии VKORzeo (VKOR).
Фиг.2 показывает карты плазмид векторов, используемых для коэкспрессии FII, GGCX и VKOR.
Подробное описание изобретения
Согласно первому аспекту данного изобретения предложена клетка-хозяин, содержащая вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности контроля экспрессии, и вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую витамин K-эпоксидоредуктазу и ассоциированные последовательности контроля экспрессии, где данная клетка-хозяин дополнительно содержит молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу и ассоциированные последовательности контроля экспрессии.
В одном воплощении указанная молекула нуклеиновой кислоты, кодирующая белок, требующий гамма-карбоксилирования, и ассоциированные последовательности контроля экспрессии, содержит первый промотор, и указанная молекула нуклеиновой кислоты, кодирующая витамин K-эпоксидоредуктазу и ассоциированные последовательности контроля экспрессии, содержит второй промотор. В другом воплощении первый промотор является в достаточной степени более сильным, чем второй промотор, так что белок, требующий гамма-карбоксилирования, и витамин K-эпоксидоредуктаза экспрессируются в соотношении по меньшей мере 10:1. В другом воплощении первый промотор является в достаточной степени более сильным, чем второй промотор, так что белок, требующий гамма-карбоксилирования, и витамин K-эпоксидоредуктаза экспрессируются в соотношении по меньшей мере 5:1.
В другом воплощении данная клетка дополнительно содержит молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу и ассоциированные последовательности контроля экспрессии. В одном воплощении данная молекула нуклеиновой кислоты, кодирующая γ-глутамилкарбоксилазу и ассоциированные последовательности контроля экспрессии, дополнительно содержит третий промотор, где первый промотор является в достаточной степени более сильным, чем третий промотор, так что белок, требующий гамма-карбоксилирования, и γ-глутамилкарбоксилаза экспрессируются в соотношении по меньшей мере 10:1. В другом воплощении первый промотор является в достаточной степени более сильным, чем второй промотор, так что белок, требующий гамма-карбоксилирования, и витамин K-эпоксидоредуктаза экспрессируются в соотношении по меньшей мере 5:1.
Первый промотор может быть немедленным-ранним промотором человеческого цитомегаловируса (hCMV), и второй и третий промотор могут быть ранним промотором SV40.
В одном конкретном воплощении и молекула нуклеиновой кислоты, кодирующая белок, требующий гамма-карбоксилирования, и ассоциированные последовательности контроля экспрессии, и молекула нуклеиновой кислоты, кодирующая, витамин K-эпоксидоредуктазу, и, возможно, γ-глутамилкарбоксилазу, и ассоциированные последовательности контроля экспрессии, локализуются в том же самом векторе экспрессии. В другом воплощении эти две или, возможно, три молекулы нуклеиновой кислоты локализуются в двух или более чем в двух отдельных векторах экспрессии.
В другом аспекте предложена клетка, которая модифицирована генно-инженерным образом для экспрессии (1) белка, который требует гамма-карбоксилирования, и (2) витамин K-эпоксидоредуктазы, где белки (1) и (2) экспрессируются в соотношении от 10:1 до 500:1. В другом воплощении белки (1) и (2) экспрессируются в соотношении от 5:1 до 500:1.
Белок, который требует гамма-карбоксилирования, выбран из группы, состоящей из фактора свертывания крови VII, фактора свертывания крови FVII, фактора свертывания крови IX, фактора свертывания крови FIX, протромбина, фактора свертывания крови II, фактора свертывания крови FII, фактора свертывания крови X, фактора свертывания крови FX и их активированных форм FVIIa, FIXa, FXa, белка С, белка S, белка Z, костного белка Gla, матриксного белка Gla, белка 6, специфичного для задержки роста, протеаз змеиного яда, аналогичных факторам свертывания крови, таких как протеазы змеиного яда, подобные фактору X, и белок, подобный FXa Acanthophiinae.
В одном воплощении белок, который требует гамма-карбоксилирования, представляет собой фактор свертывания крови, зависимый от витамина K. В другом воплощении белок, который требует гамма-карбоксилирования, представляет собой фактор IX. В третьем воплощении белок, который требует гамма-карбоксилирования, представляет собой протромбин. В четвертом воплощении белок, который требует гамма-карбоксилирования, представляет собой фактор X. В пятом воплощении белок, который требует гамма-карбоксилирования, представляет собой фактор VII.
Белок, который требует гамма-карбоксилирования, предпочтительно представляет собой человеческий белок, но все эукариотные белки охвачены данным изобретением. Витамин K-эпоксидоредуктаза предпочтительно представляет собой человеческий белок, но в настоящем изобретении могут быть использованы все эукариотические витамин K-эпоксидоредуктазы. γ-глутамилкарбоксилаза предпочтительно представляет собой человеческий белок, но в настоящем изобретении могут быть использованы все эукариотические γ-глутамилкарбоксилазы.
Согласно другому аспекту предложена генетически модифицированная эукариотическая клетка-хозяин, содержащая:
(1) полинуклеотид, кодирующий белок витамин K-эпоксидоредуктазу, где указанная последовательность, кодирующая белок витамин K-эпоксидоредуктазу, функциональным образом связана с последовательностями контроля экспрессии, обеспечивающими экспрессию белка витамин K-эпоксидоредуктазы указанной клеткой;
(2) полинуклеотид, кодирующий белок, требующий карбоксилирования белком γ-глутамилкарбоксилазой, функциональным образом связанный с последовательностями контроля экспрессии, обеспечивающими экспрессию указанного белка, требующего карбоксилирования, указанной клеткой;
(3) полинуклеотид, кодирующий гамма-глутамилкарбоксилазу, где указанная последовательность, кодирующая белок гамма-глутамилкарбоксилазу, функциональным образом связана с последовательностями контроля экспрессии, обеспечивающими экспрессию белка гамма-глутамилкарбоксилазы указанной клеткой.
В одном воплощении данная клетка способна экспрессировать белок витамин K-эпоксидоредуктазу и белок, требующий карбоксилирования, в соотношении по меньшей мере 1:10. В другом воплощении указанное соотношение составляет по меньшей мере 1:5.
Клетка-хозяин предпочтительно представляет собой эукариотическую клетку. Типичные клетки-хозяева включают, но не ограничиваются, клетки насекомых, дрожжевые клетки и клетки млекопитающих. Клетки млекопитающих являются особенно предпочтительными. Подходящие линии клеток млекопитающих включают клетки СНО, НЕK, N50, 293, Per С.6, ВНК и COS и их производные, но не ограничиваются ими. В одном воплощении клеткой-хозяином является клеточная линия млекопитающих CHO-S.
Согласно еще одному другому аспекту предложен вектор, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности контроля экспрессии, и молекулу нуклеиновой кислоты, кодирующую витамин K-эпоксидоредуктазу и ассоциированные последовательности контроля экспрессии. В одном воплощении данная молекула нуклеиновой кислоты, кодирующая белок, требующий гамма-карбоксилирования, и ассоциированные последовательности контроля экспрессии, содержит первый промотор, и молекула нуклеиновой кислоты, кодирующая витамин K-эпоксидоредуктазу и ассоциированные последовательности контроля экспрессии, содержит второй промотор. Первый промотор может быть в достаточной степени более сильным, чем второй промотор, так что белок, требующий гамма-карбоксилирования, и витамин K-эпоксидоредуктаза экспрессируются в соотношении по меньшей мере 10:1. В другом воплощении это соотношение составляет 5:1. Данный вектор также может содержать молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу и ассоциированные последовательности контроля экспрессии. Указанная молекула нуклеиновой кислоты, кодирующая γ-глутамилкарбоксилазу и ассоциированные последовательности контроля экспрессии, может содержать третий промотор, где первый промотор является в достаточной степени более сильным, чем третий промотор, так что белок, требующий гамма-карбоксилирования, и γ-глутамилкарбоксилаза экспрессируются в соотношении по меньшей мере 10:1. В другом воплощении это соотношение составляет 5:1. Белок, который требует гамма-карбоксилирования, можно выбрать из группы, состоящей из фактора свертывания крови VII, фактора свертывания крови FVII, фактора свертывания крови IX, фактора свертывания крови FIX, протромбина, фактора свертывания крови II, фактора свертывания крови FII, фактора свертывания крови X, фактора свертывания крови FX и их активированных форм FVIIa, FIXa, FXa, протеаз змеиного яда, аналогичных факторам свертывания крови, таких как протеазы змеиного яда, подобные фактору Х и белку, подобному FXa Acanthophiinae, белка С, белка S, белка Z, костного Gla белка, матриксного Gla белка, белка 6, специфичного для задержки роста.
Согласно другому аспекту предложен способ получения гамма-карбоксилированного белка, включающий: (1) культивирование клетки, экспрессирующей рекомбинантный белок, который требует гамма-карбоксилирования, витамин K-эпоксидоредуктазу и γ-глутамилкарбоксилазу, и (2) выделение гамма-карбоксилированного белка.
Указанная клетка экспрессирует белок, который требует гамма-карбоксилирования, и витамин K-эпоксидоредуктазу в соотношении по меньшей мере 10:1 при условиях, подходящих для экспрессии обоих белков.
Можно ожидать, что факторы свертывания крови, зависимые от витамина K (FII, FVII, FIX, FX и их активированные формы FIIa или тромбин, FVIIa, FIXa, FXa), полученные настоящим способом коэкспрессии с одним VKOR или в комбинации с GGGX, являются полезными при предупреждении и лечении кровотечения после травмы, хирургического вмешательства или заболеваний печени, почек, тромбоцитов или заболеваний, связанных с факторами свертывания крови (гемофилия). Подобным образом, можно ожидать, что фактор свертывания крови белок С и его активированная форма АРС являются полезными при предупреждении и лечении расстройств, связанных с повышенным свертыванием крови, в присутствии или в отсутствие пониженных уровней белка С. Данный способ также применим к другим белкам, которые требуют посттрансляционного карбоксилирования.
Настоящее изобретение будет применимо для улучшения продуктивности любого белка, который зависит от γ-карбоксилирования, причем такие белки включают протромбин, фактор свертывания крови II (FII), фактор свертывания крови VII (FVII), фактор свертывания крови IX (FIX), фактор свертывания крови Х (FX), белок С, белок S, белок Z, костный Gla белок (также известный как BGP или остеокальцин), матриксный Gla белок (MGP), обогащенный пролином Gla полипептид 1 (PRRG1), обогащенный пролином Gla полипептид 2 (PRRG2), белок 6, специфичный для задержки роста (Gas 6), но не ограничиваются ими. Другими подходящими белками являются: FXa-подобный белок в яде змей семейства Elapidae (пoдceмeйcтвa Acanthophiinae) и в яде конических улиток (Conus textile).
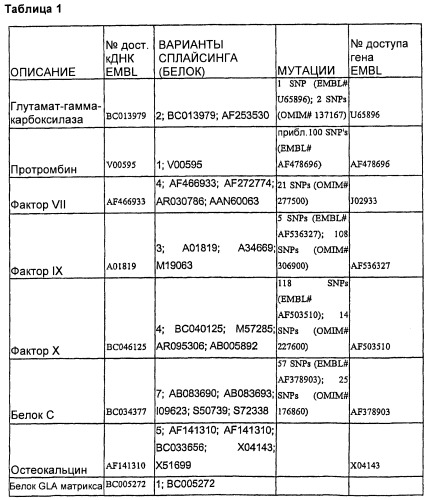
Каждый из этих белков, включая кодирующие их последовательности нуклеиновых кислот и аминокислотные последовательности, является хорошо известным. Таблица 1 определяет репрезентативные последовательности дикого типа и мутантных форм разных белков, которые можно использовать в настоящем изобретении.
Будет понятно, что данное изобретение не ограничивается конкретным белком или последовательностью, кодирующей белок, одного из этих белков, подлежащих коэкспрессии. Кроме того и конкретно по отношению к факторам свертывания крови, в данной области были раскрыты многочисленные мутантные формы данных белков. Настоящее изобретение в равной степени приложимо к этим мутантным формам, включая встречающиеся в природе аллельные варианты, данных белков, а также к последовательностям дикого типа. В одном воплощении данное изобретение может иметь дело с любым белком дикого типа или с белком по меньшей мере с 90%-ной, предпочтительно по меньшей мере 95%-ной идентичностью последовательности с ним.
Идентичность последовательности между двумя последовательностями можно определить компьютерным анализом попарного выравнивания, используя такие программы, как BestFit, Gap или FrameAlign. Предпочтительным инструментом выравнивания является BestFit. На практике при поиске последовательностей, сходных/идентичных с запрашиваемой последовательностью, из базы данных последовательностей обычно необходимо проводить первоначальную идентификацию аналогичных последовательностей, используя подходящее программное обеспечение, такое как Blast, Blast2, NCBI Blast2, WashU Blast2, FastA, Fasta3 и PILEUP, и матрицу подсчета, такую как Blosum 62. Такие программные пакеты стремятся к близкому приближению к «золотому стандарту» алгоритма выравнивания Смита-Уотермана (Smith-Waterman). Таким образом, предпочтительное программное обеспечение/программное средство поиска для применения в оценке сходства, т.е. того, как две первичные полипептидные последовательности выравниваются, основано на алгоритме Смита-Уотермана. Термин «идентичность» относится к прямым соответствиям, термин «сходство» допускает консервативные замены.
Термин «витамин K-эпоксидоредуктаза» или «VKOR» в том виде, как он здесь используется, относится к ферменту, который катализирует восстановление эпоксида витамина K и витамина K с образованием восстановленного витамина K.
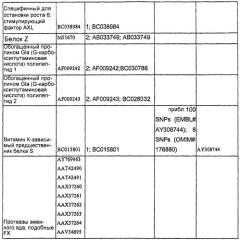
Витамин K-редуктазы являются широко распространенными, и они были клонированы из нескольких разных видов, таких как мышь (Mus musculus), крыса (Rattus norveigicus), курица (Gallus gallus) и крупный рогатый скот (Bos taurus). Гомологичные белки можно предсказать из последовательностей из организмов самого разнообразного филогенетического происхождения, таких как млекопитающие, птицы, земноводные, костистые рыбы, двукрылые, кинетопластиды и бактерии. Таблица 2 представляет неограничивающий список репрезентативных последовательностей предсказанных белков-гомологов человеческой VKOR (которые отсортированы согласно виду, из которого они происходят), которые можно использовать в настоящем изобретении.
Термин «γ-глутамилкарбоксилаза» или «GGCX» в том виде, как он здесь используется, относится к ферменту, зависимому от витамина К, который катализирует карбоксилирование остатков глутаминовой кислоты.
Ферменты GGCX являются широко распространенными, и они были клонированы из многих разных видов, таких как белуха (Delphinapterus leucas), рыба-жаба (Opsanus tau), курица (Gallus gallus), миксина (Myxine glutinosa), мечехвост (Limulus polyphemus) и коническая улитка (Conus textile) (Begley et al., 2000, ibid; Bandyopadhyay et al. 2002, ibid). Карбоксилаза из конической улитки схожа с карбоксилазой крупного рогатого скота, и ее экспрессировали в клетках COS (Czerwiec et al. 2002, ibid). Другие белки, аналогичные GGCX, можно найти у насекомых и прокариот, таких как Anopheles gambiae, Drosophila melanogaster и Leptospira с номерами доступа NCBI: gi 31217234, gi 21298685, gi 24216281 и gi 24197548 (Bandyopadhyay et al. 2002, ibid) соответственно. Карбоксилазные ферменты демонстрируют замечательный эволюционный консерватизм. Несколько ферментов, не являющихся человеческими, показали, или для них можно было предсказать активность, аналогичную активности человеческой GGCX, которую использовали авторы данного изобретения, и, следовательно, их можно использовать в качестве альтернативы человеческому ферменту.
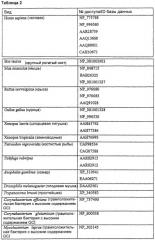
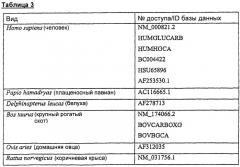
Таблица 3 определяет репрезентативные последовательности предсказываемых белков, гомологичных человеческой GGXC (отсортировано согласно виду, из которого они происходят), которые можно использовать в настоящем изобретении.
Каждый из определенных выше белков GGCX можно использовать в настоящем изобретении в качестве карбоксилазного фермента.
Одним способом осуществления коэкспрессии белков является применение разных промоторов в виде части соответствующих последовательностей контроля экспрессии. Данная область насыщена примерами разных векторов клонирования, промоторов и других последовательностей контроля экспрессии, которые способны к экспрессии гетерологичных белков до разного уровня или в разной степени. Методика рекомбинантной экспрессии является подходящим образом разработанной так, что специалист в области экспрессии белка способен выбрать промоторы и другие контрольные последовательности для осуществления коэкспрессии белка, требующего карбоксилирования, витамин K-эпоксидоредуктазы и, возможно, γ-карбоксилазы. Выбор того, какие конкретные промоторы и другие последовательности контроля экспрессии следует использовать, является вопросом иднивидуального выбора.
В одном воплощении контрольные последовательности, ассоциированные с белком, требующим гамма-карбоксилирования, содержат сильный промотор. В одном воплощении это - немедленный-ранний промотор человеческого цитомегаловируса (hCMV). Сильный промотор здесь определяется как промотор, дающий по меньшей мере в 5 раз более высокое число транскриптов мРНК, чем слабый промотор, используемый в той же самой клетке при аналогичных условиях.
В другом воплощении контрольные последовательности, ассоциированные с витамин K-эпоксидоредуктазой и, когда она присутствует, с γ-глутамилкарбоксилазой, содержат слабый промотор. В одном воплощении - это ранний промотор SV40. В другом воплощении белок, требующий гамма-карбоксилирования, витамин K-эпоксидоредуктаза и, возможно, γ-глутамилкарбоксилаза, находятся под контролем разных промоторных элементов с промотором, контролирующим экспрессию витамин K-эпоксидоредуктазы и, возможно, γ-глутамилкарбоксилазы, являющимся более слабым, чем промотор, контролирующий экспрессию белка, требующего гамма-карбоксилирования.
Данное изобретение было проиллюстрировано примерами использования сильного промотора CMV (Boshart et al. Cell 41:521-530, 1985) для сверхэкспрессии фактора Х и более слабого промотора SV40 (Wenger et al. Anal Biochem 221:416-418, 1994) для контроля экспрессии витамин K-эпоксидоредуктазы и, возможно, экспрессии GGCX. Другой сильный промотор, который можно было использовать согласно настоящему изобретению, включает, но не ограничивается pEF-1α [ген субъединицы человеческого фактора элонгации 1α (Mizushima and Nagata, Nuc Acids Res 18:5322, 1990; Goldman et al., BioTechniques 21:1013-1015, 1996)], pRSV [вирус саркомы Рауса (German et al., Proc Natl Acad Sci USA 79:6777-6781, 1982)] и pUbC [человеческий убиквитин (Schorpp et al., Nuc Acids Res 24:1787-1788, 1996)].
Данное изобретение также распространяется на очищенный гамма-карбоксилированный белок, получаемый способами по настоящему изобретению, и на его применение в коагуляционной терапии.
Согласно еще одному другому аспекту данного изобретения предложен способ стимуляции повышенного или пониженного свертывания крови у субъекта, включающий введение фармакологически эффективного количества выделенного гамма-карбоксилированного белка, полученного способами, описанными выше, пациенту, нуждающемуся в этом.
Согласно другому аспекту данного изобретения предложен способ получения фармацевтической композиции, пригодной для индукции свертывания крови, включающий очистку активного карбоксилированного белка, экспрессируемого в клетке-хозяине, адаптированной для экспрессии белка, требующего гамма-карбоксилирования, и γ-глутамилкарбоксилазы в соотношении по меньшей мере 5:1, и смешивание очищенного карбоксилированного белка с одним или более чем одним фармацевтически приемлемым носителем или эксципиентом.
Композиции по изобретению можно получить традиционными методиками с использованием традиционных фармацевтических эксципиентов, хорошо известных в данной области, но вероятнее всего она будет находиться в форме, подходящей для инъекции либо парентерально, либо непосредственно в место поражения.
Порошки, подходящие для получения водного препарата для инъекции путем добавления подходящего разбавителя, обычно содержат активный ингредиент совместно с подходящими носителями и эксципиентами, суспендирующим агентом и одним или более чем одним стабилизатором или консервантом. Данный разбавитель может содержать другие подходящие эксципиенты, такие как консерванты, модификаторы тоничности и стабилизаторы.
Фармацевтические композиции по изобретению также могут находиться в форме эмульсий масло-в-воде. Масляная фаза может представлять собой растительное масло, такое как оливковое масло или арахисовое масло, или минеральное масло, такое как, например, жидкий парафин, или смесь любых из этих масел. Подходящие эмульгаторы могут представлять собой, например, встречающиеся в природе камеди, такие как аравийская камедь или камедь трагаканта, встречающиеся в природе фосфатиды, такие как лецитин из соевых бобов, сложные эфиры или неполные эфиры, происходящие от жирных кислот или ангидридов гекситола (например сорбитанмоноолеат), и продукты конденсации указанных неполных эфиров с этиленоксидом, такие как полиоксиэтиленсорбитанмоноолеат.
Фармацевтические композиции по данному изобретению также могут находиться в форме стерильного раствора или суспензии в нетоксичном парентерально приемлемом разбавителе или растворителе, который можно приготовить согласно известным методикам, используя один или более чем один подходящий диспергирующий или увлажняющий агент и суспендирующий агент, которые были упомянуты выше. Стерильный инъецируемый препарат также может представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например раствор в 1,3-бутандиоле.
Для дополнительной информации в отношении композиций читатель отсылается к Главе 25.2 в Томе 5 Comprehensive Medicinal Chemistry (Corwin Hansh; председатель редакционного совета), Pergamon Press 1990; или к Тому 99 Drugs and the pharmaceutical sciences; Protein formulation and delivery (Eugen J. McNally, ответственный редактор), Marcel Dekker Inc. 2000.
Количество активного ингредиента, которое объединяют с одним или более чем одним эксципиентом для получения стандартной лекарственной формы с необходимостью будет варьировать в зависимости от хозяина, подлежащего лечению, и конкретного пути введения. Например, композиция, предназначенная для инъекции человеку, обычно будет содержать, например, от 0,2 мг до 6 г или от 0,5 мг до 2 г активного агента, смешанного с подходящим и удобным количеством эксципиентов, которое может варьировать от примерно 5 до примерно 98 процентов от общей массы композиции. Стандартные лекарственные формы обычно будут содержать от примерно 0,2 мг до примерно 10 г или от примерно 1 мг до примерно 500 мг активного ингредиента. Белковые терапевтические агенты обычно хранят замороженными или лиофилизированными. Для дополнительной информации по путям введения и схемам дозирования читатель отсылается к Главе 25.3 в Томе 5 Comprehensive Medicinal Chemistry (Corwin Hansh; председатель редакционного совета), Pergamon Press 1990.
Величина дозы соединения для терапевтических или профилактических целей естественно будет варьировать согласно природе и тяжести состояний, возрасту и полу животного или пациента и пути введения согласно хорошо известным принципам ме