Способ получения липосомального средства, обладающего ранозаживляющим действием
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к способам получения лекарственных средств наружного применения с ранозаживляющим эффектом. Для получения липосомального средства, обладающего ранозаживляющим действием, проводят экстракцию фосфолипидов из печени байкальской нерпы, растворяют смесь полученных фосфолипидов и жир байкальской нерпы в органическом растворителе в соотношении 4:6 с антиоксидантом α-токоферолом. Высушивают тонкий слой липидов на роторном испарителе, добавляют буферный раствор, встряхивают смесь до получения однородной суспензии. Затем проводят обработку липидной смеси ультразвуком при водяном охлаждении. Липосомальную суспензию смешивают в соотношении 1:1 с предварительно расплавленной смесью полиэтиленгликолей 1000 и 6000 Да, взятых в соотношении 9:1. Далее полученную смесь гомогенизируют до однородной массы. Использование способа позволяет получить липосомальное средство для наружного применения, обладающее ранозаживляющим действием. 3 табл., 3 ил.
Реферат
Изобретение относится к медицине, а именно к способам получения лекарственных средств наружного применения с ранозаживляющим эффектом.
Известен способ получения средства, обладающего ранозаживляющей активностью, содержащего специфические биологически активные вещества из минеральных вод [Способ получения средства, обладающего ранозаживляющей активностью. Патент РФ №2357740, опубл. 10.07.2009 г.].
Однако лекарственный препарат, полученный по известному способу, обладает ранозаживляющей активностью при небольших по площади ранах только на ранних стадиях заживления.
Известен способ получения ранозаживляющей мази, содержащей активные ингредиенты из растительного сырья - сухой экстракт остролодочника остролистного [Дерматологическая противовоспалительная, ранозаживляющая и обезболивающая мазь «Оксофил». Патент РФ №2132692, опубл. 10.07.1999 г.].
Недостатком известного способа является то, что в состав мази входят биологически активные вещества только полифенольного ряда и не применяются биогенные высокоактивные липиды.
Известен способ получения лекарственного средства, обладающего ранозаживляющим действием, содержащего смесь ацетата меди, гидрокарбоната натрия и талька, которое используют в виде примочки для лечения ожогов, отморожений, рожистых воспалений [Способ П.И. Федорищева получения лекарственного средства, обладающего ранозаживляющим действием. Патент №2072844, опубл. 10.02.1997 г.].
Однако в известном способе не было выявлено влияния лекарственного средства на заживление кожно-мышечных ран и в состав препарата, полученного по известному способу, входят только синтетические химические соединения, а не биологически активные природные вещества.
Известен способ получения ранозаживляющего средства для лечения повреждений кожи, ран, ожогов и трофических язв, включающего в качестве гелеобразователей или ряд полисахаридов, или желатин, или пектин, или аэросил, или цеолиты и в качестве фармакологически активного компонента мумие очищенное [Ранозаживляющее средство «Витамустим-гель» (варианты), способ его приготовления и способ лечения им повреждений кожи, ран, ожогов и трофических язв. Патент РФ №2185149, опубл. 20.07.2002 г.].
Однако в лекарственном средстве, полученном известным способом, активным веществом является мумие очищенное, являющееся труднодоступным сырьем.
Известен способ получения мази для лечения повреждений кожи, содержащей в качестве активного начала растворимые соли лантанидов и «Олифен» [ВФС 42-2821-96 "Олифен-субстанция"]. Мазь, полученная известным способом, обладает выраженным бактерицидным действием, улучшает и ускоряет эпителизацию ожоговых поверхностей при выраженном местно-анестезирующем действии, ограничивает и/или предотвращает некротические явления, ускоряет сроки заживления порезов и ссадин [Ранозаживляющая мазь «Эпофен». Патент РФ №2141820, опубл. 27.11.1999 г.].
Недостатком мази, полученной известным способом, является наличие синтетических составляющих, что может приводить к повышенной аллергенности и токсичности лекарственного средства.
Известен способ получения композиции, которая содержит одновременно два активно действующих биологически активных вещества липидной природы в виде липосом, что позволяет воздействовать им одновременно в поверхностных и глубоких областях кожи [Косметическая или дерматологическая композиция для одновременного лечения поверхностных и глубоких слоев кожи и ее применение. Патент РФ №2125443, опубл. 27.01.1999 г.].
Однако недостатком средства, полученного известным способом, является то, что липосомы изготавливаются из синтетических липидов, в результате чего средство является дорогим и труднодоступным.
Известен способ получения крема для увядающей кожи, содержащего в качестве биологически активной добавки суспензию липосом из фосфолипидов и липидов животного происхождения с включенным в них экстрактом фитосбора и мумие [Гидратантный и регенерирующий крем и способ его получения. Патент РФ №2139041, опубл. 10.10.1999 г.].
Однако известное средство используется как гидратантный и регенерирующий косметологический крем, тогда как не было изучено его ранозаживляющее действие.
Известен способ получения липосом, заключающийся в растворении лецитина и смеси кислых фосфолипидов, выделяемой из соевых фосфатидов как единый компонент, в органическом растворителе, высушивании полученного раствора с образованием пленки, ресуспендировании липидной пленки в дисперсионной среде и диспергировании суспендированных липидов в микроэмульсию пропусканием суспензии через микрощель при перепаде давления от 50-300 атм до нормального, при этом в качестве дисперсионной среды используют водные растворы цитостатиков, иммуномодуляторов, полиненасыщенные жирные кислоты, выделенные из морских животных [Способ получения липосом. Патент РФ №2071765, опубл. 20.01.1997 г.].
Однако липосомальное средство, полученное известным способом, не обладает ранозаживляющей активностью.
Наиболее близким по существу изобретения является способ получения липосом, обладающих иммунокорригирующим и гепатопротекторным действием, включающий экстракцию фосфолипидов из печени байкальской нерпы, растворение смеси полученных фосфолипидов и жира байкальской нерпы в органическом растворителе в соотношении 4:6 с антиоксидантом α-токоферолом, высушивание тонкого слоя липидов на роторном испарителе, добавление буферного раствора, встряхивание смеси до получения однородной суспензии, обработку липидной смеси ультразвуком при водяном охлаждении, центрифугирование и отделение верхних трех четвертей надосадочной жидкости [RU №2308940, А61К 9/127, 39/10, 35/12, опубл. 27.10.2007 г.].
Полученные по известному способу липосомы обладают иммунокорригирующими и гепатопротекторными свойствами, тогда как не было выявлено их ранозаживляющей активности.
Задача, решаемая в предлагаемом изобретении, заключается в изменении фармакологического эффекта липосомального средства.
Технический результат, достигаемый при осуществлении заявляемого способа, - это создание липосомального средства для наружного применения, обладающего ранозаживляющим действием.
Указанный технический результат при осуществлении изобретения достигается тем, что в известном способе, предусматривающем экстракцию фосфолипидов из печени байкальской нерпы, растворение смеси полученных фосфолипидов и жира байкальской нерпы в органическом растворителе в соотношении 4:6 с антиоксидантом α-токоферолом, высушивание тонкого слоя липидов на роторном испарителе, введение буферного раствора, встряхивание смеси до получения однородной суспензии, обработку липидной смеси ультразвуком при водяном охлаждении, согласно изобретению полученную липосомальную суспензию смешивают в соотношении 1:1 с предварительно расплавленной смесью полиэтиленгликолей 1000 и 6000 Да, взятых в соотношении 9:1, далее полученную смесь гомогенизируют до однородной массы, расфасовывают и упаковывают.
Возрастающие потребности фармацевтической и косметической отраслей промышленности делают актуальной задачу подбора доступных сырьевых ресурсов и разработку оптимальных биотехнологических процессов производства природных липидных препаратов. Препараты природного происхождения отличаются от синтезированных химических соединений совершенной формулой, включающей оптимальное соотношение микро- и макроэлементов, витаминов и незаменимых жирных кислот.
Одним из путей обеспечения максимального лечебного эффекта и минимизации побочного действия химиотерапевтических препаратов является применение липосом. Липосомы - микрокапсулы из природных или синтетических фосфолипидов - оказались во многих отношениях практически идеальными носителями для транспорта лекарственных соединений в организме. Идея использования везикул для целенаправленного транспорта биологически активных веществ не нова и препараты на основе липосом уже получили широкое распространение в медицине во всем мире. Эффективность воздействия липосом обусловлена возможностью их проникновения в ткани. В результате взаимодействия мембраны клетки и мембраны липосом происходит модификация липидного состава мембраны клетки, репарация микроповреждений. С другой стороны, липосомальные везикулы являются универсальными контейнерами для транспортировки одновременно как липофильных веществ, которые включаются в мембраны, так и гидрофильных веществ, инкорпорируемых во внутренний объем (Alving C.R., Richards R.L., 1983; Ostro M.J., 1987; Herele F., 1994). Интерес к липидным препаратам, содержащим такие биологически активные компоненты, как природные фосфолипиды, нейтральные липиды или свободные жирные кислоты, в последние 15-20 лет непрерывно растет (Бергельсон Л.Н., 1984; Барсуков Л.И., 1998, Raschke, Т., Huschka, С, SchmalfuB, W. at al., 2002).
При создании липосом широко используются липиды растительного сырья и морских гидробионтов, в составе которых превалируют полиеновые жирные кислоты. Ткани байкальской нерпы (подкожное сало и печень) являются перспективными источниками биологически активных ω-6 и ω-3 полиненасыщенных жирных кислот (ПНЖК), которые обнаруживаются в соотношениях 3,19:1 (в печени) и 0,77:1 (в жире) (Раднаева Л.Д., 1999, Кабирова И.Р., 2005).
Одним из направлений разработки липосомальных препаратов является конструирование трансдермальных лекарственных средств. При этом решаются задачи, связанные с созданием методического подхода к разработке рецептуры и совершенствованию биотехнологии их создания.
В заявляемом способе выбор полиэтиленгликоля, как гелевой основы, обусловлен его нейтральностью, гигроскопичностью, физиологической индифферентностью, легкостью высвобождения лекарственных веществ. Полиэтиленгликоль (ПЭГ) не подвергается контаминации микроорганизмами, обладает слабым бактерицидным свойством, выраженным дегидратирующим действием, а также не нарушает газообмен кожи, малотоксичен, не вызывает раздражающего действия на ткани организма, легко смывается, устойчив к действию света, влаги. При проведении экспериментальных исследований было выявлено, что смешивание ПЭГ 1000 и 6000 Да, взятых в соотношении 9:1, с липосомальной суспензией позволяет достичь наилучшей консистенции, обеспечивающей легкое распределение средства на поверхности кожи и быстрое всасывание кожей.
Использование ПЭГ в качестве структурообразующего компонента и смешивание его с суспензией липосом создает условия образования связно-дисперсной системы за счет поликонденсации компонентов основы с полярными липидами бислойной мембраны липосом и обеспечивает стабильное распределение липосомальных частиц в массе средства. Кроме того, ПЭГ способствует стерической стабилизации липосомальных частиц (Каплун, 1999).
При разработке трансдермального лекарственного средства, обладающего ранозаживляющим действием, наиболее важным показателем является мембраностабилизирующая активность его основного действующего компонента. Как известно, мембраны играют ключевую роль как в структурной организации, так и в функционировании всех клеток - они формируют внутриклеточные компартменты, участвуют в регуляции всех связей и взаимодействий, которые осуществляются между их наружной и внутренней сторонами (Геннис Р., 1997).
Большинство липидов в мембранах представлено фосфолипидами, гликосфинголипидами и холестеролом. В липидном бислое жирно-кислотные цепочки ориентированы параллельно друг другу, в результате чего образуется достаточно жесткая структура. В зависимости от жирно-кислотного состава фосфолипидного бислоя мембран форменных элементов крови может меняться деформируемость и пластичность эритроцитов и тромбоцитов.
Современная практика показала перспективность использования в качестве мембранообразующих элементов в липосомах природных фосфолипидов, являющихся естественными для организма веществами, способными включаться в обменные процессы и, не накапливаясь, утилизироваться в организме. Фосфолипиды клеточных мембран обычно содержат хотя бы одну ненасыщенную жирную кислоту, имеющую по крайней мере одну двойную связь в цис-положении, тем самым обуславливается неснижаемая текучесть, так называемое разжижающее или "флюидизирующее", свойство мембраны. Текучесть мембраны сильно влияет на ее функционирование. С увеличением текучести мембрана становится более проницаемой для воды и других малых гидрофильных молекул и создаются условия для диффузии интегрального белка.
На текучесть мембран оказывает влияние и степень ненасыщенности высших жирных кислот (ВЖК). Оказалось, что омега-3 ПНЖК в значительно большей степени влияют на повышение текучести, чем ПНЖК ряда омега-6. В этом плане ткани байкальской нерпы (подкожное сало и печень) являются перспективными источниками ПНЖК. Полиненасыщенные жирные кислоты изменяют жидко-кристаллическое состояние мембраны, возрастает подвижность молекул липидов и белков в липидном бислое мембраны. Изменения фазового состояния мембраны оказывают весьма существенное влияние на процессы мембранного транспорта, на системы трансмембранной передачи информации, на активность мембраносвязанных ферментов.
Оценку мембраностабилизирующей активности исследуемого средства в заявляемом способе осуществляли по степени гемолиза эритроцитов человека, вызываемого реактивом Фентона (перекисный гемолиз), и добавлением дистиллированной воды (осмотический гемолиз) (Ковалев И.Е., Данилова Н.П., Андронати С.А., Жеребин Ю.Л., 1986). Компоненты, входящие в состав реактива Фентона, были использованы в оптимальных концентрациях, вызывающих полный лизис 1%-ной суспензии эритроцитов: FeSO4×7Н2О - 0.01 мг/мл; Н2О2 - 0.2 мг/мл (в пересчете на 100%-ный раствор перекиси водорода). Оба компонента в отдельности лизиса не вызывают. Гемолиз учитывали через 24 ч. Для воспроизведения осмотического гемолиза к суспензии эритроцитов добавляли равный объем дистиллированной воды. Степень гемолиза измеряли через 24 часа по оптической плотности при 540 нм. Поскольку испытуемый раствор имеет собственную окраску и мутность, были поставлены дополнительные пробы на цвет препарата в соответствующих дозах.
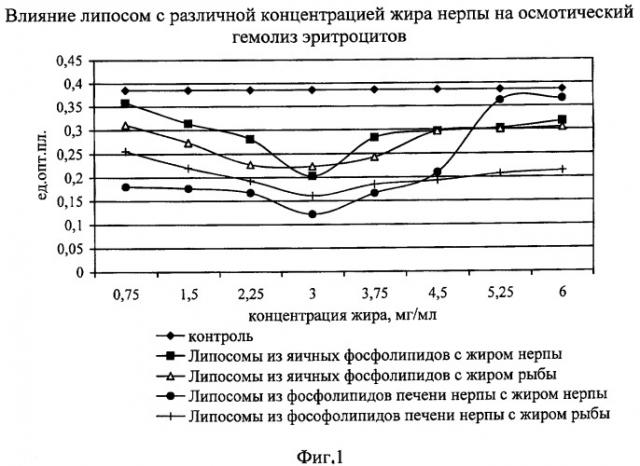
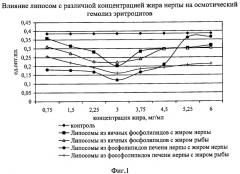
В опыте к суспензии эритроцитов предварительно добавляли липосомы из фосфолипидов печени нерпы с добавлением жира байкальской нерпы в концентрациях от 0.75 до 6.00 мг/мл в пересчете на жир. Для сравнения изучаемых средств в опыте были использованы липосомы из яичных фосфолипидов с добавлением жира нерпы и липосомы из фосфолипидов печени нерпы с фармакопейным препаратом - рыбьим жиром (см. фиг.1 и 2). За контроль брали не обработанную ничем суспензию эритроцитов.
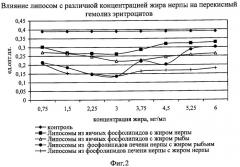
Как видно из фиг.1 и 2, липосомы, приготовленные из всех взятых природных липидов, оказывают мембраностабилизирующее действие. Об этом свидетельствует уменьшение осмотического гемолиза от 5% до 68% в различных вариантах по сравнению с контролем. Также отмечалось уменьшение и перекисного гемолиза под влиянием исследуемых средств от 18% до 67% по сравнению с контролем.
Выявлено, что влияние липосом, созданных на основе фосфолипидов печени нерпы с добавлением жира нерпы, на предотвращение осмотического гемолиза было эффективнее по сравнению с действием липосом на основе яичных фосфолипидов и липосом с фармакопейным препаратом - рыбьим жиром, взятым в тех же концентрациях. Аналогичный эффект наблюдался и при воспроизведении перекисного гемолиза.
Таким образом, показано, что введение в состав липосом биологически активных природных липидов, присутствующих в печени и жире нерпы, приводит к повышению мембраностабилизирующей активности разрабатываемого липосомального средства.
Проведенный заявителем анализ уровня техники, включающий поиск по патентным и научно-техническим источникам информации, позволил установить, что заявитель не обнаружил аналогичных технических решений.
Следовательно, заявляемое изобретение соответствует условиям «новизна» и «изобретательский уровень».
Заявляемый способ получения липосомального средства, обладающего ранозаживляющим действием, осуществляется следующим образом.
Фосфолипиды по известному способу экстрагируют из печени байкальской нерпы [см. М.Кейтс. Техника липидологии. М.: Мир, 1975. - 236 с.], с помощью пипетки вносят раствор фосфолипидов печени нерпы, жира байкальской нерпы [ТУ 9281-017-02069473-2001] и антиоксиданта альфа-токоферол [см. М.Д.Машковский. Лекарственные средства: в 2-х томах. Т.2. - 11-е изд. стер. - М.: Медицина, 1988. - с.37-39] в соотношении 6:4:0.05 (0.1 г смеси) в органическом растворителе (1 мл хлороформа+1 мл метанола) в толстостенную круглодонную колбу. Испаряют растворитель на роторном испарителе [испаритель ротационный ИР - 1М2 ТУ 25-1173.102-84] так, чтобы дать возможность полученной смеси распределиться в виде тонкой пленки по стенке колбы. В колбу добавляют раствор, содержащий 0.25 М сахарозу, 0.01 М трис-буфер, 0.001 М ЭДТА, рН 7.4, встряхивают до получения однородной суспензии на механической качалке [Установка выращивания микроорганизмов термостатированная УВМТ-12-250] в течение 30 минут. Обрабатывают липидную смесь в течение 7 минут ультразвуком на диспергаторе УЗДН-2Т при водяном охлаждении при частоте 22 кГц. Липосомальную суспензию смешивают в соотношении 1:1 с предварительно расплавленной смесью полиэтиленгликолей 1000 и 6000 Да, взятых в соотношении 9:1. Далее полученную смесь гомогенизируют до однородной массы.
Заявляемый способ подтверждается следующими примерами конкретного выполнения:
При оценке ранозаживляющего эффекта разработанного липосомального средства с учетом основных патогенетических факторов развития раневых повреждений, нами были использованы модели линейной и плоскостной кожно-мышечной раны и модель химического ожога кожи. В опытах использовали белых беспородных крыс обоего пола массой 170-250 г из питомника филиала №5 ГНЦ «Институт биофизики федерального управления «Медбиоэкстрем» при Минздраве России г. Ангарск. Животные находились в стандартных условиях содержания вивария на обычном рационе.
Пример 1. Линейные кожные раны получали следующим образом: под барбамиловым наркозом у крыс в области спины стерильным скальпелем наносили линейную рану до собственной фасции длиной 5 см (Клюев М.А., 1989). На равном расстоянии накладывали три шва, сближающих края полученной раны (Фенчин К.М., 1979).
Лечение ран начинали в первые часы после нанесения кожно-мышечных ран, затем ежедневно на раневое повреждение наносили заявляемое липосомальное средство в дозе 7 мг в день. В качестве контроля использовали животных, раны которых обрабатывали смесью полиэтиленгликолей с буфером.
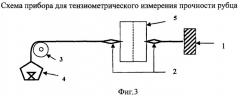
К концу эксперимента на 8-е сутки осуществляли ранотензиометрию по Фисенко В.П. (2000) с помощью прибора. На фиг.3 показана схема прибора для тензиометрического измерения прочности рубца, состоящего из упора 1, зажимов 2, блока 3, площадки с гирями 4 и лоскута с раной 5.
Для определения прочности образовавшегося рубца после заживления линейных кожных ран животных умерщвляли методом мгновенной декапитации под легким эфирным наркозом и вырезали кусочки кожи с зажившими ранами шириной 1 см, длиной 3 см. Фиксировали одним концом в верхней точке с помощью специального зажима, а к нижнему концу кусочка подвешивали другой зажим с площадкой для установки гирь, массу которых постепенно увеличивали до получения разрыва рубца. Регистрировали наибольшую массу гири, необходимую для разрыва рубца.
Результаты опыта показали, что в группе животных, раны которых обрабатывали средством с липосомами, полученным по заявляемому способу, к 8-му дню после операции не происходило нагноения ран. Тогда как в контрольной группе наблюдалось нагноение у шести из десяти крыс.
Эффективными показателями местного воздействия лекарственных средств на рану, указывающими на степень заживления в регенеративный период раневого процесса, считаются сближение краев и, тем самым, упрочнение рубца. Поэтому, при воспроизведении линейной раны на 8-е сутки после операции определяли прочность рубца на разрыв. Измерения проводили методом ранотензиометрии (см. табл.1).
| Таблица 1 | |
| Влияние липосомального средства на прочность рубца у белых крыс (n=10) | |
| Группа животных | Прочность рубца, кг |
| Контроль | 0.303±0.030 |
| Опыт (по изобретению) | 0.360±0.030* |
| Примечание: * - достоверное отклонение значения в опытной группе от значения в контрольной группе животных. |
Установлено, что у животных опытной группы прочность рубца на 8-е сутки эксперимента была на 19% выше по сравнению с показателем ранотензиометрии в контрольной группе. Это свидетельствует о положительном влиянии липосомального средства на укрепление межклеточных структур при регенеративных процессах в поврежденных тканях.
Как показали гистоморфологические исследования, спустя 8 суток с начала опыта по воспроизведению линейных ран у крыс, раны которых обрабатывали заявляемым средством, грануляционная ткань под эпителием выглядела более зрелой, чем у животных других групп. В ней преобладали волокнистые структуры. В пограничной с раной тканью вокруг сохранившихся волосяных фолликул пролиферировал новый эпителий.
Гистологическое исследование раневого дефекта, а также результаты, полученные при измерении прочности сформировавшейся на месте раны рубцовой ткани, показали, что при лечении раневых повреждений кожи заявляемым средством раньше происходит формирование, созревание и фиброзирование грануляционной ткани. Все это свидетельствует о стимулирующем влиянии разрабатываемого трансдермального липосомального средства на регенерацию ткани при линейных раневых повреждениях кожи.
Пример 2. Плоскостную кожно-мышечную рану воспроизводили под барбамиловым наркозом (70 мг/кг) путем иссечения в области спины животных кожно-фасциального лоскута площадью 400 мм2 на предварительно выстриженных участках (Пономарева - Астраханцева Л.З., 1954). К краям раны подшивали алюминиевые рамки для получения одинакового у всех животных исходного размера ран (Каплан А.В., Махсон Н.Е., Мельчикова В.М., 1989).
Лечение ран начинали в первые часы после нанесения кожно-мышечных ран, затем ежедневно на раневое повреждение наносили заявляемое липосомальное средство в дозе 7 мг в день. В качестве контроля использовали животных, раны которых обрабатывали смесью полиэтиленгликолей с буфером.
О ранозаживляющем эффекте исследуемого липосомального средства судили на основании наблюдения за животными, состоянием раны, сроков заживления ран. Оценку динамики заживления ран определяли на 3-й, 7-е, 14-е и 21-е сутки по площади раневой поверхности планиметрическим методом (Пономарева - Астраханцева Л.З., 1954). Для этого на рану накладывали прозрачную пленку и на ней чернилами обрисовывали контуры раны. Зная массу 1 см2 пленки, рассчитывали площадь раны по формуле:
S=(S1×M)/M1,
где S - площадь раны; S1 - площадь 1 см2; M1 - масса 1 см2 пленки; М - масса очерченной пленки (Фенчин К.М., 1979; Попова Л.Н., 1942).
В указанные сроки эксперимента брали материал на цитологическое исследование раневой поверхности.
Данные по планиметрическому исследованию плоскостной раны представлены в таблице 2.
| Таблица 2 | |||
| Влияние липосомального средства на изменение площади плоскостной кожно-мышечной раны (мм2) у экспериментальных крыс (n=10) | |||
| № п/п | Сроки эксперимента, сут | Группы животных | |
| Контроль | Опыт (по изобретению) | ||
| 1 | 3 | 389.9±12.3 | 237.7±21.8* |
| 2 | 7 | З13.6±10.1 | 141.4±15.1* |
| 3 | 14 | 129.2±10.4 | 67.9±7.2* |
| 4 | 21 | 108.2±9.7 | 53.9±6.4* |
| Примечание: * - достоверное отклонение значения в опытной группе от значения в контрольной группе животных. |
Как следует из таблицы 2, применение липосомального средства во все сроки эксперимента у белых крыс оказывает выраженное ранозаживляющее действие. На 3-е, 7-е, 14-е и 21-е сутки исследования у животных опытной группы было отмечено существенное уменьшение площади ран по сравнению с оцениваемым показателем у животных контрольной группы в соответствующие сроки на 39, 55, 47 и 50%.
Цитологическое исследование «раневых отпечатков» показало, что у животных как контрольной, так и опытной группы на 3-и сутки эксперимента отмечалось большое количество нейтрофильных лейкоцитов. При этом в группе животных опытной группы количество деструктивных форм лейкоцитов было в среднем на 9.5% меньше, чем в контроле. На 7-е сутки эксперимента в «раневых отпечатках» у крыс контрольной и опытной групп отмечалось уменьшение числа нейтрофильных лейкоцитов. В опытной группе животных отмечалось появление фибробластов. На 14-е сутки в «раневых отпечатках» животных опытной группы преобладали фибробласты и фиброциты, тогда как данные типы клеток в контрольной группе появлялись только на 21-е сутки эксперимента.
Таким образом, установлено, что исследуемое липосомальное средство способствует структурной реорганизации новообразованной после асептического повреждения ткани и, тем самым, ускоряет процессы заживления ран в более ранние сроки.
Пример 3. Химический ожог кожи в области спины крыс вызывали подкожным введением 0.5 мл 9%-ной уксусной кислоты под барбамиловым наркозом (70 мг/кг) на предварительно выстриженных участках кожи (Ойвин И.А., Шетель С.Л., 1961). Обращали внимание на стандартность получаемых ран, размеры которых не должны были превышать 400 мм2.
На 3-и сутки осуществляли некрэктомию пораженных участков, после чего начинали лечение ран - ежедневно на раневое повреждение наносили заявляемое липосомальное средство в дозе 7 мг в день. В качестве контроля использовали животных, раны которых обрабатывали смесью полиэтиленгликолей с буфером.
Клинические наблюдения за состоянием раневых поверхностей у подопытных крыс после воспроизведения модели химического ожога проводили на 9-е, 17-е и 25-е сутки. В эти сроки измеряли площади ран, отмечали состояние ран, качество и зрелость грануляций, характер раневого отделяемого, состояние окружающих тканей, сроки эпителизации и заживления. Результаты измерений по изменению площади ран после химического ожога приведены в таблице 3.
| Таблица 3 | |||
| Влияние липосомального средства на изменение площади ран (мм2) при химическом ожоге кожи у крыс (n=10) | |||
| № | Сроки эксперимента, сут | Группы животных | |
| Контроль | Опыт (по изобретению) | ||
| 1 | 9 | 526±31 | 314±31* |
| 2 | 17 | 413±39 | 292±27* |
| 3 | 25 | 341±12 | 223±20* |
| Примечание: * - достоверное отклонение значения в опытной группе от значения в контрольной группе животных. |
Как следует из данных, приведенных в таблице 3, при применении средства по изобретению отмечалось ускорение динамики закрытия раны после химического ожога, о чем свидетельствует уменьшение площади раневой поверхности у крыс опытной группы на 9-е, 17-е и 25-е сутки. На 9-е сутки площадь ожога в опытной группе уменьшилась на 40%, на 17-е сутки на 29%, на 25-е сутки на 35% по сравнению с контролем.
Таким образом, в экспериментах по воспроизведению раневых повреждений кожи установлено выраженное ранозаживляющее действие исследуемых липосом, что обусловлено участием биологически активных липидов в репаративной регенерации структур соединительных тканей в посттравматическом процессе. Положительные результаты по ранозаживляющей эффективности липосомального средства, по-видимому, объясняются тем, что биологически активные полиненасыщенные жирные кислоты, присутствующие в тканях нерпы, способствуют стимуляции процессов внутриклеточной регуляции и восстановлению липидных структур как в клеточной мембране, так и в межклеточных пластах кожи.
Таким образом, изложенные сведения свидетельствуют о том, что заявляемый способ позволяет получить липосомальное средство, обладающее ранозаживляющим действием, и расширить сырьевую базу для получения лекарственного средства, используя дешевое биологически активное природное сырье.
Следовательно, заявленное изобретение соответствует условию «промышленная применимость».
Способ получения липосомального средства, обладающего ранозаживляющим действием, предусматривающий экстракцию фосфолипидов из печени байкальской нерпы, растворение смеси полученных фосфолипидов и жира байкальской нерпы в органическом растворителе в соотношении 4:6 с антиоксидантом α-токоферолом, высушивание тонкого слоя липидов на роторном испарителе, введение буферного раствора, встряхивание смеси до получения однородной суспензии, обработку липидной смеси ультразвуком при водяном охлаждении, отличающийся тем, что полученную липосомальную суспензию смешивают в соотношении 1:1 с предварительно расплавленной смесью полиэтиленгликолей 1000 и 6000 Да, взятых в соотношении 9:1, полученную смесь гомогенизируют до однородной массы.