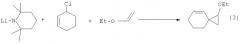Способ получения 1-алкил-1-алкокси-2-арилциклопропанов
Иллюстрации
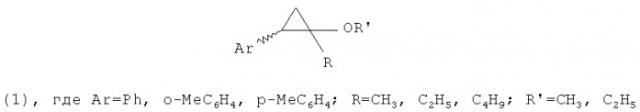
Показать всеНастоящее изобретение относится к способу получения 1-алкил-1-алкокси-2-арилциклопропанов общей формулы (1):
где Ar=Ph, о-МеС6Н4, p-MeC6H4; R=CH3, C2H5, C4H9; R′=CH3, C2H5, которые могут найти применение в тонком органическом синтезе, в частности, синтезе биологически активных соединений, обладающих пиретроидной, акарицидной, пестицидной, росторегулирующей, фунгицидной и противобактериальной активностями. Способ заключается в том, что арилэтилен общей формулы Аr-СН=СН2, где Ar=Ph, о-МеС6Н4, р-МеС6Н4 подвергают взаимодействию с эквимольным количеством сложного эфира общей формулы RCO2R′, где R=CH3, C2H5, C4H9; R′=Me, Et, в присутствии диэтилалюминийхлорида (Et2AlCl), магния (Mg, порошок) и катализатора Cp2ZrCl2 в мольном соотношении Ar-CH=CH2:RCO2R′:Et2AlCl:Mg:Cp2ZrCl2=10:10:(20-30):(10-14):(0.8-1.2) в атмосфере аргона при температуре 20-22°С и атмосферном давлении в течение 8-12 ч. Предлагаемый способ позволяет получить целевые продукты с высокой региоселективностью. 1 табл.
Реферат
Предлагаемое изобретение относится к области органического синтеза, конкретно, к новому способу получения 1-алкил-1-алкокси-2-арилциклопропанов общей формулы (1):
Замещенные циклопропаны могут найти применение в тонком органическом синтезе, в частности, синтезе биологически активных соединений, обладающих пиретроидной, акарицидной, пестицидной, росторегулирующей, фунгицидной и противобактериальной активностями (Куковинец О.С., Николаева С.В., Касрадзе.В.Г., Зайнуллин Р.А., Кунакова Р.В., Абдуллин М.И. Циклопропаны (свойства, синтез, применение). Уфа: Гилем, 2006, 152 с.).
Известен способ (О.Г.Кулинкович, Д.А.Василевский, А.И.Савченко, С.В.Свиридов. Катализируемое тетраизопропоксититаном взаимодействие алкилмагнийгалогенидов со сложными эфирами как удобный метод получения замещенных циклопропанолов. ЖОрХ, 1991, т.27, вып.7, 1428-1430) получения замещенных циклопропанов с гидроксильным заместителем общей формулы (2) действием магнийорганического реагента на сложные эфиры в присутствии каталитических количеств Ti(OPri)4 в эфире при температуре 18-20°С по схеме:
Известный способ не позволяет получать 1-алкил-1-алкокси-2-арилциклопропаны общей формулы (1).
Известен способ (R.A.Olofson, C.M.Dougherty. Lithium 2,2,6,6-Tetramethilpiperidide and Related, Strong, Proton-Specific Bases. Evaluation in Synthesis. JACS, 95, №2, 1973, 582-584) получения замещенных циклопропанов с алкоксильным заместителем общей формулы (3) действием 2,2,6,6-тетраметилпиперидида лития на смесь хлорциклогекс-2-ена и этилвинилового эфира в тетрагидрофуране (ТГФ) по схеме:
Известным способом не могут быть получены 1-алкил-1-алкокси-2-арилциклопропаны общей формулы (1).
Предлагается новый способ получения 1-алкил-1-алкокси-2-арилциклопропанов общей формулы (1).
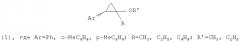
Сущность способа заключается во взаимодействии арилэтилена общей формулы Ar-СН=СН2, где Ar=Ph, о-МеС6Н4, p-МеС6Н4, с эквимольным количеством сложного эфира общей формулы RCO2R', где R=СН3, C2H5, С4Н9; R′=Me, Et, в присутствии диэтилалюминийхлорида (Et2AlCl), магния (Mg, порошок) и катализатора Cp2ZrCl2, взятых в мольном соотношении Ar-СН=СН2:RCO2R′:Et2AlCl:Mg:Cp2ZrCl2=10:10:(20-30):(10-14):(0.8-1.2), предпочтительно 10:10:25:12:1. Реакцию проводят в атмосфере аргона при комнатной температуре (20-22°С) и атмосферном давлении. Время реакции 8-12 ч, выход целевого продукта 55-78%. В качестве растворителя необходимо использовать эфирные растворители (ТГФ). Реакция протекает по схеме:
Ar=Ph, о-МеС6Н4, p-МеС6Н4; R=CH3, C2H5, C4H9; R=CH3, C2H5
Целевой продукт (1) образуется только лишь с участием сложных эфиров (RCO2R′), алкилгалогеналана (Et2AlCl), арилэтилена (Ar-CH=СН2) и магния (акцептор ионов хлора). В присутствии других соединений алюминия (например, изо-Bu3Al, Et3Al, изо-Bu2AlH), других эфиров (например, простые эфиры), других непредельных соединений (например, дизамещенные олефины, терминальные ацетилены) или других металлов (например, Al, Cu, Fe) целевые продукты (1) не образуются.
Реакции проводят при комнатной температуре 20-22°С. При более высокой температуре (например, 50°С) увеличиваются энергозатраты на проведение реакции, при меньшей температуре (например, 0°С) снижается скорость реакции.
Изменение соотношения исходных реагентов в сторону увеличения их содержания по отношению к арилэтилену не приводит к значительному повышению выхода целевого продукта (1). Снижение количества Et2AlCl, RCO2R' или Mg по отношению к арилэтилену уменьшает выход замещенных циклопропанов (1).
Существенные отличия предлагаемого способа:
Предлагаемый способ базируется на использовании в качестве исходных реагентов диэтилалюминийхлорида (Et2AlCl), магния (Mg, порошок) и катализатора Cp2ZrCl2. В известном способе в качестве исходных реагентов применяются 2,2,6,6-тетраметилпиперидид лития, хлорциклогекс-2-ен и этилвиниловый эфир.
Предлагаемый способ обладает следующими преимуществами:
Способ позволяет получать региоизомерные цис/транс-1-алкил-1-алкокси-2-арилциклопропаны в соотношении 1:1 общей формулы (1).
Способ поясняется следующими примерами:
ПРИМЕР 1. В стеклянный реактор, установленный на магнитной мешалке, в атмосфере аргона помещают 5 мл ТГФ, 10 ммолей этилацетата (MeCO2Et), 10 ммолей стирола (Ph-CH=CH2), 12 мг.ат.магния (Mg, порошок), 1.0 ммоль катализатора Cp2ZrCl2, при температуре ~0°С добавляют диэтилалюминийхлорид (Et2AlCl), перемешивают при температуре 20-22°С в течение 10 ч. Получают цис/транс-1-метил-1-этокси-2-фенилциклопропан (1) с выходом 67%.
Спектр ЯМР 13С (δ, м.д., CDCl3) цис-1-метил-1-этокси-2-фенилциклопропана (1): 15.24, 20.95, 21.61, 30.56, 62.14, 62.89, 125.38, 127.62, 128.54, 138.61. Спектр ЯМР 13С (δ, м.д., CDCl3) транс-1-метил-1-этокси-2-фенилциклопропана (1): 15.74, 16.13, 17.97, 29.70, 61.85, 62.43, 125.50, 127.70, 128.16, 138.77.
Спектр ЯМР 13С (δ, м.д., CDCl3) цис-1-метил-1-этокси-2-орто-фенилциклопропана: 15.35, 18.34, 20.15, 21.84, 28.94, 61.98, 62.57, 125.59, 126.19, 127.33, 129.66, 136.57, 138.68. Спектр ЯМР 13С (δ, м.д., CDCl3) транс-1-метил-1-этокси-2-орто-фенилциклопропана: 15.90, 16.05, 17.22, 20.32, 28.52, 61.81, 62.22, 125.35, 125.70, 126.76, 129.32, 137.11, 137.59.
Спектр ЯМР 13С (δ, м.д., CDCl3) цис-1-метил-1-этокси-2-пара-фенилциклопропана: 15.30, 20.83, 21.00, 21.61, 30.22, 62.10, 62.70, 127.46, 128.43,134.75, 135.51.
Спектр ЯМР 13С (δ, м.д., CDCl3) транс-1-метил-1-этокси-2-пара-фенилциклопропана: 15.74, 16.13, 17.93, 21.00, 29.29, 61.82, 62.34, 128.43, 128.86, 134.75, 135.64.
Спектр ЯМР 13С (δ, м.д., CDCl3) цис-1-метил-1-метокси-2-фенилциклопропана (1): 20.92, 21.63, 30.53, 53.72, 62.85, 125.37, 127.59, 128.51, 138.59. Спектр ЯМР 13С (δ, м.д., CDCl3) транс-1-метил-1-этокси-2-фенилциклопропана (1): 16.11, 17.89, 29.72, 54.08, 62.41, 125.54, 127.73, 128.12, 138.71.
Спектр ЯМР 13С (δ, м.д., CDCl3) цис-1-бутил-1-этокси-2-фенилциклопропана: 14.62, 15.51, 22.51, 26.39, 30.09, 34.55, 62.27, 66.92, 125.56, 127.92, 128.53, 138.54. Спектр ЯМР 13С (δ, м.д., CDCl3) транс-1-бутил-1-этокси-2-фенилциклопропана: 14.22, 15.96, 17.33, 22.91, 26.92, 29.08, 29.47, 61.89, 66.77, 125.98, 128.19, 128.53, 138.59.
Другие примеры, подтверждающие способ, приведены в таблице 1.
| Таблица 1 | |||||
| № п/п | Арилэтилен (Ar-СН=СН2) | Сложный эфир (RCO2R′) | Мольное соотношение Ar-CH=CH2:RCO2R′:Et2AlCl:Mg:Cp2ZrCl2, ммоль | Время реакции, час | Выход (1), % |
| 1 | стирол | этилацетат | 10:10:25:12:1.0 | 10 | 67 |
| 2 | -//- | -//- | 10:10:30:12:1.0 | 10 | 71 |
| 3 | -//- | -//- | 10:10:20:12:1.0 | 10 | 61 |
| 4 | -//- | -//- | 10:10:25:14:1.0 | 10 | 69 |
| 5 | -//- | -//- | 10:10:25:10:1.0 | 10 | 65 |
| 6 | -//- | -//- | 10:10:25:12:1.2 | 10 | 78 |
| 7 | -//- | -//- | 10:10:25:12:0.8 | 10 | 55 |
| 8 | -//- | -//- | 10:10:25:12:1.0 | 12 | 73 |
| 9 | -//- | -//- | 10:10:25:12:1.0 | 8 | 63 |
| 10 | о-метил-стирол | -//- | 10:10:25:12:1.0 | 10 | 59 |
| 11 | р-метил-стирол | -//- | 10:10:25:12:1.0 | 10 | 60 |
| 12 | стирол | метилацетат | 10:10:25:12:1.0 | 10 | 70 |
| 13 | -//- | этилпропионат | 10:10:25:12:1.0 | 10 | 64 |
| 14 | -//- | этилпентаноат | 10:10:25:12:1.0 | 10 | 57 |
Все опыты проводили при температуре 20-22°С в ТГФ.
Способ получения 1-алкил-1-алкокси-2-арилциклопропанов общей формулы (1) ,где Ar - Ph, о-МеС6Н4, р-МеС6Н4; R - CH3, C2H5, C4H9; R′=CH3, C2H5, характеризующийся тем, что арилэтилен общей формулы Аr-СН=СН2, где Ar - Ph, о-МеС6Н4, p-МеС6Н4, подвергают взаимодействию с эквимольным количеством сложного эфира общей формулы RCO2R′, где R - CH3, C2H5, С4Н9; R′ - Me, Et, в присутствии диэтилалюминийхлорида (Et2AlCl), магния (Mg, порошок) и катализатора Cp2ZrCl2 в мольном соотношении Аг-СН=СН2: RCO2R′:Et2AlCl:Mg:Cp2ZrCl2=10:10:(20-30):(10-14):(0.8-1.2) в атмосфере аргона при температуре 20-22°С и атмосферном давлении в течение 8-12 ч.