Способ получения 11-цис-изомера ретиналя
Иллюстрации
Показать всеНастоящее изобретение относится к способу стереоселективного получения 11-цис-изомера ретиналя по пути С10+С10=С20, используемого для получения лекарственных средств для профилактики и терапии тяжелых патологий зрительной системы человека. Способ включает олефинирование по Виттигу 6E-изомера 2Е-2,6-диметил-8-трифенилсилилоксиокта-2,6-диен-4-ин-1-аля (синтона С10) илидом, генерированным in situ из β-циклогеранилтрифенилфосфонийгалогенида, удаление трифенилсилильной защиты в полученном силилированном 13E-изомере 11,12-дидегидроретинола. При этом после стадии удаления трифенилсилильной защиты проводят сначала окисление полученного 13Е-изомера 11,12-дидегидроретинола до 11,12-дидегидроальдегида при помощи MnO2, без выделения полупродукта в индивидуальном виде и процедуры дополнительной очистки, а затем стереоспецифическое восстановление тройной связи в 11,12-дидегидроальдегиде гидрированием на катализаторе Линдлара с получением целевого 11-цис-изомера ретиналя, при этом генерирование илида из β-циклогеранилтрифенилфосфонийгалогенида осуществляют при использовании следующих условий: a) NaH в тетрагидрофуране при 0 - -5°С, б) безводный К2СО3 в дихлорметане, в присутствии катализаторов межфазного переноса - четвертичных аммониевых солей, при 20-25°С, или в) 1,2-эпоксибутан в дихлорметане при 50°С до 60°С. 1 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к стереоселективному способу получения 11-цис-изомера альдегида витамина А - ретиналя, важнейшего физиологически активного производного ретиноидов, непосредственно участвующего в процессе зрения в организмах высших животных и человека.
11-цис-Изомер ретиналя играет ключевую роль в системе зрительной рецепции, подвергаясь при поглощении кванта света необратимой 11-цис- → all-E-фотоизомеризации и инициируя запуск всего каскада зрительной трансдукции, ответственного за цветное и темновое зрение у высших животных и человека. На основе 11-цис-изомера ретиналя и его производных разработан ряд новых лекарственных средств для профилактики и терапии тяжелых патологий зрительной системы человека [Rando R. Management of ophthalmological disorders, including macular degeneration / US Patent №2008176952, МПК: А61К 31/136; Petrosian A.M., Haroutounian J.E., Vartanian A. Taurine derivatives useable in the treatment of ophthalmic disorders / US Patent №6391924, МПК A61K 31/07; Palczewski К., Golczak M., Kuksa V. Methods for Treatment of Retinal Degenerative Disease / US Patent №2008275134, МПК: А61К 31/07]. Практическое внедрение указанного нового поколения фармпрепаратов на основе 11-цис-изомера ретиналя сдерживается отсутствием надежных, технологически приемлемых методов получения указанного изомера с высокой степенью изомерной чистоты (более 90-95%). Это напрямую связано с низкой фото- и термической стабильностью 11-цис-изомера ретиналя, что накладывает определенные технические ограничения на экспериментальные процедуры его получения.
Анализ литературных данных показал, что методы синтеза 11-цис-изомеров ретиноидов можно условно разделить на 2 категории:
1) стереоселективные подходы получения индивидуальных ретиноидов с заданной конфигурацией системы двойных связей;
2) совокупность способов, сочетающих синтез или наиболее доступного изомера, или изомерной смеси с последующей фото- или термоизомеризацией и выделением индивидуальных соединений при помощи препаративной ВЭЖХ.
Среди известных стереоселективных методов получения 11-цис-ретиноидов необходимо отметить ряд синтетических подходов, основанных на модификации известной промышленной схемы получения витамина А ацетата, по пути С14+С6=С20. Так, вначале Орошником В., а позже Христофоровым В.Л. и затем Соколовой Н.А., Мицнером Б.И. [Oroshnik W. The synthesis and configuration of neo-b vitamin A and neo-retinene b. // J. Amer. Chem. Soc. - 1956. - V. 78, № 11. - P. 2651-2652; Христофоров В.Л., Звонкова Е.Н., Варламов В.П., Сорокина О.И., Евстигнеева Р.П. Синтез 11-цис- и 11,13-дицис-изоиеров витамина А и 11-цис-ретиналя. // Ж. орган. химии. - 1973. - Т. 9, № 9. - С.1844-1850; Соколова Н.А., Мицнер Б.И., Горина Н.Ю., Евстигнеева Р.П. Способ получения 11-цис- или 11,13-цис-ретинолов. // А.с. СССР №548595. - Приоритет от 19.09.1975. - Бюл. изобр. - 1977. - № 8; Соколова Н.А., Мицнер Б.И., Горина Н.Ю., Евстигнеева Р.П., Щуколюков С.А., Чижевич Е.П., Корчагин В.П. Применение трифенилсилильной защитной группы в синтезе 11-цис-ретналя и его использование для регенерации родопсина рыб. // Биоорган. химия. - 1977. - Т. 3, № 9. - С.1234-1241] был исследован ряд вариантов создания молекулы 11-цис-ретиноидов по пути С14+С6=С20. Особенность всех этих подходов состояла в проведении стадии гидрирования чрезвычайно малоустойчивого 11-цис-изомера ретинола на предпоследнем этапе синтеза. Эта группа способов получения 11-цис-ретиноидов была основана на следующей последовательности стадий: конденсация альдегида β-С14 с реагентом Иоцича, полученным из 2E-изомера С6-первичного ацетиленового карбинола, в результате которой с выходом 40-50% образуется диолин. Ацетилирование этого соединения и последующая дегидратация соответствующего моноацетата под действием n-TsOH/С6Н6 приводили к ацетату 11,12-дидегидроретинола, из которого после омыления и каталитического гидрирования на катализаторе Линдлара получали 11-цис-изомер ретинола. Последний трансформировали в 11-цис-изомер ретиналя (1) окислением при помощи МпО2.
Все перечисленные выше подходы имели ряд существенных недостатков. Во-первых, реактив Иоцича был плохо растворим в большинстве органических растворителей, вследствие чего его конденсация с альдегидом β-С14 протекала в гетерогенной среде. Во-вторых, ацетилирование диолина по первичному гидроксилу происходило недостаточно избирательно, что также снижало чистоту и выход целевого изомера ретиналя, в-третьих, самое узкое место схемы - стадия дегидратации силилированного или ацетилированного диолина, проходила в жестких условиях, что часто сопровождалось рядом побочных процессов с осмолением, изомеризацией и полимеризацией продуктов реакции. Суммарный выход целевого 11-цис-ретиналя (1) в указанных примерах составлял от 10-20% до 35-40%.
Наиболее близким по совокупности существенных признаков к заявляемому техническому решению является способ синтеза 11-цис-изомера ретиналя (1) по пути С10+С10=С20, который был предложен ранее [Ходонов А.А., Ткачевская Е.П., Мицнер Б.И., Звонкова Е.Н., Евстигнеева Р.П. Синтез 11Z-ретиналя. // Биоорган. химия. - 1984. - Т. 10, №10. - С.1409-1413].
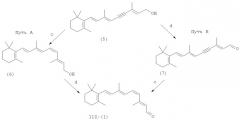
Схема 1. Способ получения 11-цис-изомера ретиналя (1)
Реагенты: (а) н-бутиллитий/тетрагидрофуран или NaH/тетрагидрофуран, или К2СО3/CH2Cl2 - Aliquat 336, или 1,2-эпоксибутан/CH2Cl2; (b) NH4F/ацетон или тетрабутиламмоний фторид/СН3ОН; (с) [H2]/Pd (Pb+2, хинолин)/СаСО3/гексан; (d) MnO2 /гексан.
Указанный способ синтеза 11-цис-изомера ретиналя (1) содержит следующую последовательность стадий, представленную на схеме 1, путь А [Ходонов А.А., Ткачевская Е.П., Мицнер Б.И., Звонкова Е.Н., Евстигнеева Р.П. Синтез 11Z-ретиналя. // Биоорган. химия. - 1984. - Т. 10, № 10. - С.1409-1413]. Центральная стадия схемы 1 - олефинирование по Виттигу соответствующего 6E-изомера карбонильного синтона состава С10 илидом, генерированным in situ из β-циклогеранилтрифенилфосфонийгалогенида под действием раствора н-бутиллития в гексане при - 40° - - 30°С, и используя тетрагидрофуран как растворитель. После удаления трифенилсилильной защиты действием F--ионов, 13Е-изомер 11,12-дидегидроретинола был выделен с выходом 76%. Конечная трансформация дидегидроретинола (5) в целевой альдегид (1) проходила в две стадии: сначала следовало стереоспецифическое восстановление тройной связи до 11-цис-двойной гидрированием на катализаторе Линдлара на предпоследней стадии схемы 1, а затем последующее окисление спирта до альдегида (1) при помощи MnO2. Конечный 11-цис-изомера ретиналя (1) получали с суммарным выходом до 54% и с изомерной чистотой (около 90%).
Несмотря на значительное повышение выхода и изомерной чистоты целевого препарата техническое решение проблемы синтеза 11-цис-изомера ретиналя в прототипе содержит следующие недостатки:
1) применение на ключевой стадии схемы 1 - реакции олефинирования по Виттигу карбонильного синтона состава С10 высокопожароопасного реагента для генерации илида из фосфониевой соли (2) делает маловероятным возможность ее масштабирования и последующего внедрения в производство,
2) формирование фотолабильной 11-цис-конфигурации молекулы на предпоследней стадии схемы приводит к снижению изомерной чистоты конечного целевого продукта (схема 1, путь А).
Техническим результатом предлагаемого изобретения является усовершенствованный способ стереоселективного получения 11-цис-изомера ретиналя (1) по пути С10+C10=C20 (схема 1, путь В), в котором для устранения обнаруженных в прототипе недостатков с целью повышения суммарного выхода и изомерной чистоты целевого продукта и разработки более надежного и технологически приемлемого метода его получения были предложены: изменение порядка завершающих стадий схемы синтеза и ряд альтернативных вариантов условий проведения ключевой реакции.
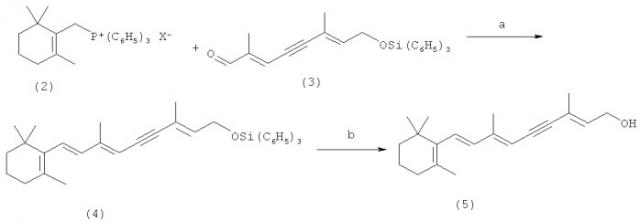
Технический результат достигается тем, что способ получения 11-цис-изомера ретиналя (1) (схема 1, путь В) включает следующие 4 стадии: а) реакцию олефинирования по Виттигу 6Е-изомера карбонильного синтона состава С10 (3) илидом, генерированным in situ из β-циклогеранилтрифенилфосфонийгалогенида (2) в различных экспериментальных условиях (см. примеры 2-4);
б) процедуру удаления трифенилсилильной защиты под действием одной из двух систем реагентов на основе F- ионов (см. примеры 1 и 5);
в) окисление спирта (5) до альдегида (7) при помощи MnO2 (схема 1, путь В);
г) стереоспецифическое восстановление тройной связи в альдегиде (7) до 11-цис-двойной гидрированием на катализаторе Линдлара.
Исходная фосфониевая соль Х=Br- (2) была получена по известному методу [Truscheit E., Eieter K. Verfahren zur Herstellung von neuen ungesattigten aliphatischen Alkoholen. / Patent 220133 (Austria). Заявлен 23.06.60; НКИ K1 12e13]. Кроме бромида (2) в качестве альтернативного аниона возможно также применение соответствующего хлорида (2) Х=Cl-.
Карбонильный синтон состава С10 - 6Е-изомер 2E-2,6-диметил-8-трифенилсилилоксиокта-2,6-диен-4-ин-1-аля (3) был получен по методу, предложенному нами в [Мицнер Б.И., Ходонов А.А., Звонкова Е.Н., Евстигнеева Р.П. Способ получения 6Z- и 6E-изомеров (2E)-8-трифенилсилилокси-2,6-диметилокта-2,6-диен-4-ин-1-аля. // А.с. СССР №1027168. - Приоритет от 30.03.1982. - Бюл. изобр. - 1983. - № 25].
Структура 6Е-изомера 2-Е-2,6-диметил-8-трифенилсилилоксиокта-2,6-диен-4-ин-1-аля (3) была подтверждена спектральными данными и элементным анализом. Синтезированный таким образом 6E-изомер синтона состава С10 отличался высокой стабильностью при хранении при 0°С (до 10 лет), без заметной изомеризации или разрушения.
Для устранения обнаруженных в прототипе недостатков были детально исследованы несколько вариантов проведения ключевой стадии, определяющей успех всего синтеза 11-цис-изомера ретиналя (1) (схема 1), олефинирования по Виттигу соответствующего 6Е-изомера карбонильного синтона состава С10 (3) илидом, генерированным in situ из β-циклогеранилтрифенилфосфонийгалогенида (2) в различных условиях: под действием как классических сильных оснований, так и катализаторов межфазного переноса или системы 1,2-эпоксибутан/CH2Cl2. Было показано, что для достижения максимального выхода в реакции олефинирования по Виттигу необходимо использовать небольшой избыток исходной фосфониевой соли (2), порядка 5%-10% от мольной доли карбонильного синтона состава С10.
При модификации условий процесса олефинирования по Виттигу синтона С10 (3) была успешно продемонстрирована возможность использования для замены раствора н-бутиллития, примененного в прототипе в качестве основания для генерирования илида из β-циклогеранилтрифенилфосфонийгалогенида (2), следующих альтернативных систем реагентов: 1) NaH в тетрагидрофуране; 2) безводного K2CO3/CH2Cl2 в присутствии катализаторов межфазного переноса - четвертичных аммониевых солей (Aliquat 336 или Adogen 440 и др.); 3) 1,2-эпоксибутана/CH2Cl2.
Дополнительные параметры экспериментальных условий проведения процедуры олефинирования по Виттигу представлены в таблице.
Вне зависимости от природы выбранного основания олефинирование протекало стереоселективно, с образованием исключительно 7Е,13Е-изомера силилированного 11,12-дидегидроретинола (4), что строго следовало из значения величин КССВ J7,8 16.0 Гц в 1Н-ЯМР-спектре.
| Таблица | ||||
| Влияние условий на выход продукта олефинирования по Виттигу синтона С10 (3) | ||||
| № опыта | Основание/растворитель | Температура, °С | Время, ч | Выход 13Е-изомера 11,12-дидегидроретинола (5), % |
| 1 | н-бутиллитий/ ТГФ | -40 ÷ -10 | 1-5 | 74±3 |
| 2 | NaH/ТГФ | 0 ÷ -5 | 1-4 | 73±2 |
| 3 | безводный К2СО3/CH2Cl2 - Aliquat 336 | 20÷25 | 50-100 | 67±3 |
| 4 | 1,2-эпоксибутан/CH2Cl2 | 50÷60 | 70-100 | 74±1 |
представлены средние значения выходов из трех независимых экспериментов
Для блокирования гидроксильной группы в исходном соединении (3) была использована трифенилсилильная защита. Этот тип защиты выгодно отличается от других блокирующих групп стабильностью к действию нуклеофильных реагентов в безводной среде, а вводится и удаляется практически с количественным выходом в мягких условиях. Для оптимизации метода удаления трифенилсилильной защиты в предлагаемом техническом решении были исследованы две системы реагентов на основе F- ионов: 20% водный раствор NH4F / ацетон (1:3, по объему) или 0.1 мольного экв. тетрабутиламмония фторида/СН3ОН. В обоих случаях защитная группа удаляется практически с количественным выходом, но в случае системы тетрабутиламмоний фторид/СН3ОН скорость процесса была выше в 3 раза.
Как видно из данных табл., высокие выходы промежуточного 13E-изомера 11,12-дидегидроретинола (5) могут быть получены с использованием не только таких классических сильных оснований, как раствор н-бутиллития и NaH в тетрагидрофуране, но и в условиях межфазного катализа с системами безводный К2СО3/CH2Cl2 - Aliquat 336, или 1,2-эпоксибутан /CH2Cl2.
Конверсию 13E-изомера 11,12-дидегидроретинола (5) в целевой альдегид проводили с измененным порядком проведения двух завершающих стадий процесса (схема 1, путь В): вначале следовало окисление спирта (5) до альдегида (7) при помощи MnO2 (схема 1, путь В), а затем стереоспецифическое восстановление тройной связи в альдегиде (7) с созданием фотолабильной 11-цис-конфигурации молекулы на последней стадии.
Завершающие стадии синтеза проводили, защищая продукты реакции и оборудование от воздействия дневного света с помощью алюминиевой фольги или работая при тусклом красном свете.
Таким образом, разработанный стереоселективный метод (схема 1, путь В) позволяет получать 11-цис-изомер ретиналя (1) в препаративных количествах с изомерной чистотой > 95-97% и суммарным выходом до 60% в расчете на карбонильный синтон состава С10, соответственно.
Преимущества предлагаемого технического решения - способа стереоселективного получения 11-цис-изомера ретиналя (1), по сравнению с прототипом
1. Формирование фотолабильной 11-цис-конфигурации молекулы на последней стадии схемы 1 позволило увеличить как выход целевого альдегида на 4-6%, так и поднять изомерную чистоту конечного целевого продукта до 95% и выше, по данным ВЭЖХ и 1Н-ЯМР-спектров (схема 1, путь В);
2. Усовершенствование условий ключевой стадии синтеза 11-цис-изомера ретиналя (1) - процесса олефинирования по Виттигу синтона С10 (3) продемонстрировало возможность замены раствора н-бутиллития на более мягкие и пожаробезопасные условия его проведения - межфазный катализ или систему 1,2-эпоксибутан/CH2Cl2 без заметного снижения выхода, что делает этот вариант прототипа лабораторной технологии синтеза 11-цис-изомера ретиналя (1) пригодным для масштабирования и последующей передачи в производство.
Для иллюстрации настоящего изобретения ниже рассмотрены следующие примеры экспериментальных процедур.
Пример 1. Способ синтеза 11-цис-изомера ретиналя (1) с использованием н-бутиллития в тетрагидрофуране (прототип) [Ходонов А.А., Ткачевская Е.П., Мицнер Б.И., Звонкова Е.Н., Евстигнеева Р.П. Синтез 11Z-ретиналя. // Биоорган. химия. - 1984. - Т. 10, № 10. - С.1409-1413]
1.1. 13E-Изомер 11,12-дидегидроретинола (5)
К 100 мл 0.4 н. раствора н-бутиллития в гексане при перемешивании в атмосфере аргона и -40° ÷ -30°С добавляли 250 мл сухого тетрагидрофурана и за 30 мин - 13.1 г β-циклогеранилтрифенилфосфонийбромида (2), используя сосуд Шленка. Смесь перемешивали 1-3 ч при -20° ÷ -10°С, охлаждали до -40°С и приливали раствор 9.5 г 6Е-изомера ациклического С10-синтона (3) в 300 мл сухого тетрагидрофурана. Реакционную смесь выдерживали 2 ч, постепенно поднимая температуру до 20°С, выливали в 1000 мл ледяной воды, вещество экстрагировали эфиром (5 раз по 300 мл). Объединенные органические экстракты промывали водой, растворитель удаляли, остаток растворяли в 500 мл смеси ацетон - 20% водный раствор фтористого аммония в воде, 3:1. После пятичасового перемешивания выливали в 1000 мл воды, вещество экстрагировали хлороформом (5 раз по 300 мл). Объединенные органические экстракты промывали водой, сушили сульфатом натрия, растворитель удаляли. Остаток кристаллизовали из гексана, выделившийся трифенилсиланол отделяли на фильтре, фильтрат упаривали и ключевой 13-Е-изомер 11,12-дидегидроретинола (5) выделяли адсорбционной хроматографией на 600 г окиси алюминия IV активности по Брокману в системе гексан - эфир с градиентом последнего от 0 до 30%. Фракции, содержащие вещество с Rf 0.29 (ТСХ на силикагеле, система гексан - эфир 1:1) собирали, объединяли и упаривали. Выход 4.8 г (75%).
ИК-спектр (ν, см-1): 3300 ш., 1070 ср. (-СН2ОН), 2180 сл. (С≡С), 1640 сл., 1270 сл., 970 с. (С=С). УФ-спектр, λмакс, нм, (∈): 317 (31400).
1Н-ЯМР-спектр: 1.01 (6Н, с, 1,1'-СН3), 1.70 (3Н, с, 5-СН3), 1.89 (3Н, с, 9-СН3), 2.06 (3Н, с, 13-СН3), 4.25 (2Н, д, J 7.0, 15-Н), 5,52 (1Н, с, 10-Н), 5.99 (1Н, т кв, J 7.0, J 1.5, 14-Н), 6.10 (1Н, д, J 16.0, 8-H), 6.27 (1Н, д, J 16.0, 7-H).
13С-ЯМР-спектр: 15.52 (9-СН3), 18.12 (13-СН3), 19.76 (3-С), 22.12 (5-СН3), 29.40 (1.1'-СН3), 33.56 (4-С), 34.73 (1-С), 40.14 (2-С), 59.68 (15-С), 87.43 и 98.96 (С≡С). 108.93 (10-С), 121.99 (13-С), 129.98, 134.97, 135.93 (7-С, 8-С и 14-С), 130.50 (5-С), 137.98 (6-С), 147.92 (9-С).
1.2. 11-цис-Изомер ретиналя (1) (путь А, схема 1)
Затем полученный 13-Е-изомер 11,12-дидегидроретинола (5) растворяли в 150 мл гексана, прибавляли 1.2 г катализатора Линдлара и 5 мл 0.37 М раствора хинолина в гексане, гидрировали при 20°С до поглощения 441 мл водорода (105% от теории). Катализатор отделяли, промывали на фильтре гексаном (3 раза по 200 мл), фильтраты объединяли и упаривали. Остаток растворяли в 500 мл пентана, добавляли 30 г активного диоксида марганца и перемешивали 4 ч под аргоном. Реакционную смесь фильтровали через слой окиси алюминия, фильтрат упаривали, вещество выделяли колоночной хроматографией на окиси алюминия в системе гексан - эфир, 95:5 с последующей кристаллизацией из пентана при - 40°С. Выход 3.6 г (73.5%), т.пл. 60-61°С (из пентана), Rf 0.63 (ТСХ на силикагеле, система гексан - эфир 2:1). УФ-спектр, λmax, нм, (∈): 254 (17000), 290 (11500), 377 (24750).
Изомерная чистота образца 90-95% по данным ВЭЖХ. Образцы препаратов 11-цис-изомера (1) хранили при -18°С в запаянных ампулах из коричневого стекла для предотвращения термо- и фотоизомеризации.
1Н-ЯМР-спектр (CDC13): 1.05 (6Н, с, 1,1'-СН3), 1.71 (3Н, с, 5-СН3), 1.98 (3Н, с, 9-СН3), 2.35 (3Н, с, 13-СН3), 5.92 (1Н, д, J 11.5, 12-Н), 6.07 (1Н, д, J 8.0, 14-Н), 6.17 (1Н, д, J 16.0, 8-H), 6.33 (1Н, д, J 16.0, 7-H), 6.52 (1Н, д, J 13.0, 10-H), 6.68 (1Н, дд, J 13.0, J 11.5, 11-H), 10.07 (1Н, д, J 8.0,15-Н).
13С-ЯМР-спектр (ацетон d6): 32.9 (1C), 38.4 (2-С), 17.9 (3-С), 31.6 (4-С), 128.5 (5-С), 136.5 (6-С), 127.9 (7-С), 136.5 (8-С), 139.7 (9-С), 125.0 (10-С), 129.6 (11-С), 129.6 (12-С), 153.9 (13-С), 128.7 (14-С), 189.2 (15-С), 27.3 (16,17-С), 19.9 (18-С), 10.4 (19-С), 15.9 (20-С).
Масс-спектр (М+, m/z): 284.
Данные физико-химических методов анализа образца 11-цис-изомера ретиналя (1) были полностью идентичны спектральным параметрам, приведенным в литературе [Соколова Н.А., Мицнер Б.И., Горина Н.Ю., Евстигнеева Р.П., Щуколюков С.А., Чижевич Е.П., Корчагин В.П. Применение трифенилсилильной защитной группы в синтезе 11-цис-ретиналя и его использование для регенерации родопсина рыб. // Биоорган. химия. - 1977. - Т. 3, № 9. - С.1234-1241; Ходонов А.А., Ткачевская Е.П., Мицнер Б.И., Звонкова Е.Н., Евстигнеева Р.П. Синтез 11Z-ретиналя. // Биоорган. химия. - 1984. - Т. 10, № 10. - С.1409-1413].
Пример 2. Способ синтеза 11-цис-изомера ретиналя (1) с использованием NaH в тетрагидрофуране.
2.1. 13E-Изомер 11,12-дидегидроретинола (5)
К 0.43 г отмытой гексаном 80% суспензии NaH в минеральном масле в 200 мл тетрагидрофурана при перемешивании в атмосфере аргона и 0°С добавляли за 30 мин 5 г β-циклогеранилтрифенилфосфонийбромида (2), используя сосуд Шленка. Смесь перемешивали 2 ч при 0° ÷ -5°С и приливали раствор 4 г 6E-изомера ациклического С10-синтона (3) в 150 мл сухого тетрагидрофурана. Реакционную смесь выдерживали 2 ч, постепенно поднимая температуру до 20°С, выливали в 500 мл ледяной воды и вещество экстрагировали эфиром (5 раз по 200 мл). Объединенные органические экстракты промывали водой, растворитель удаляли, остаток растворяли в 300 мл смеси ацетон - 20% водный раствор фтористого аммония в воде, 3:1. После пятичасового перемешивания выливали в 500 мл воды, вещество экстрагировали хлороформом (5 раз по 200 мл). Объединенные органические экстракты промывали водой, сушили над сульфатом натрия, растворитель удаляли. Остаток кристаллизовали из гексана, выделившийся трифенилсиланол отделяли на фильтре, фильтрат упаривали и 13E-изомер 11,12-дидегидроретинола (5) выделяли адсорбционной хроматографией на 300 г окиси алюминия IV в системе гексан - эфир, с градиентом последнего от 0 до 30%. Фракции, содержащие вещество (5) с Rf 0.29 (ТСХ на силикагеле, система гексан - эфир 1:1), собирали, объединяли и упаривали. Выход 1.97 г (73%).
ИК-спектр (ν, см-1): 3300 ш., 1070 ср. (-CH2OH), 2180 сл. (C≡С), 1640 сл., 1270 сл., 970 с. (С=С). УФ-спектр, λмакс, нм, (∈): 317 (31400).
1ЯМР-спектр: 1.01 (6Н, с, 1,1'-СН3), 1.70 (3Н, с, 5-СНз), 1.89 (3Н, с, 9-СН3), 2.06 (3Н, с, 13-СН3), 4.25 (2Н, д, J 7.0, 15-Н), 5.52 (1Н, с, 10-Н), 5.99 (1Н, т кв, J 7.0, J 1.5, 14-Н), 6.10 (1Н, д, J 16.0, 8-H), 6.27 (1Н, д, J 16.0, 7-H).
13С-ЯМР-спектр: 15.52 (9-СН3), 18.12 (13-СН3), 19.76 (3-С), 22.12 (5-СН3), 29.40 (1,1'-СН3), 33.56 (4-С), 34.73 (1-С), 40.14 (2-С), 59.68 (15-С), 87.43 и 98.96 (С≡С), 108.93 (10-С), 121.99 (13-С), 129.98, 134.97, 135.93 (7-С, 8-С и 14-С), 130.50 (5-С), 137.98 (6-С), 147.92 (9-С).
Данные физико-химических методов анализа образца 13Е-изомера 11,12-дидегидроретинола (5), полученного в примере 2, были полностью идентичны данным, приведенным в литературе [Соколова Н.А., Мицнер Б.И., Горина Н.Ю., Евстигнеева Р.П., Щуколюков С.А., Чижевич Е.П., Корчагин В.П. Применение трифенилсилильной защитной группы в синтезе 11-цис-ретиналя и его использование для регенерации родопсина рыб. // Биоорган. химия. - 1977. - Т. 3, № 9. - С.1234-1241; Ходонов А.А., Ткачевская Е.П., Мицнер Б.И., Звонкова Е.Н., Евстигнеева Р.П. Синтез 11Z-ретиналя. // Биоорган. химия. - 1984. - Т. 10, № 10. - С.1409-1413], и характеристикам образца, полученного по процедуре, описанной в примере 1. Последующая трансформация спирта (5) в целевой альдегид (1) может быть проведена, как описано в прототипе (путь А, см. пример 1, или по пути В, схема 1).
2.2. Синтез 11-цис-изомера ретиналя (1) с измененным порядком проведения двух завершающих стадий процесса (путь В, схема 1).
0.01 Моль 13E-изомера 11,12-дидегидроретинола (5), полученного при помощи одного из вариантов, рассмотренных в примерах 1-5, растворяли в 200 мл гексана, добавляли 15 г активного диоксида марганца и перемешивали 4 ч под аргоном. Реакционную смесь фильтровали через слой целита, промывали 500 мл диэтилового эфира, фильтрат объединяли и упаривали. Выход 13E-изомера 11,12-дидегидроретиналя (7) около 80-82%. Rf 0.66 (ТСХ на силикагеле, система гексан - эфир 2:1). Желтое масло. УФ-спектр, λмакс, нм, (∈): 290 (пл), 364 (26100).
1Н-ЯМР-спектр: 1.00 (6Н, с, 1,1'-СН3), 1.46 (2Н, м, 2-СН2), 1.61 (2Н, м, 3-СН2), 2.00 (2Н, м, 4-СН2), 1.68 (3Н, с, 5-СН3), 2.07 (3Н, с, 9-СН3), 2.32 (3Н, с, 13-СН3), 5.57 (1Н, с, 10-Н), 6.13 (1Н, д, J 16.1, 8-H), 6.18 (1Н, д kв, J 8.0, J 1.5, 14-H), 6.38 (1Н, д, J 16.1, 7-H), 10.01 (1Н, д, J 8.0, 15-H).
К раствору 0.01 моль 13E-изомера 11,12-дидегидроретиналя (7) прибавляли 10-20% катализатора Линдлара по весу и рассчитанное количество раствора хинолина в гексане, гидрировали при 20°С до поглощения необходимого объема водорода (105% от теории). Катализатор отделяли, промывали на фильтре гексаном (3 раза по 100 мл), фильтраты объединяли и упаривали, вещество выделяли колоночной хроматографией на окиси алюминия в системе гексан - эфир (95:5) с последующей кристаллизацией из пентана при - 40°С. Выход (73%), т.пл. 60-61°С (из пентана), Rf 0.63 (ТСХ на силикагеле, система гексан - эфир 2:1). Изомерная чистота образца 95-97% по данным ВЭЖХ. Образцы препаратов 11-цис-изомера (1) хранили при -18°С в запаянных ампулах из коричневого стекла для предотвращения термо- и фотоизомеризации.
Данные физико-химических методов анализа образца 11-цис-изомера ретиналя (1), полученного по пути В (схема 1), были полностью идентичны данным, приведенным в литературе [Соколова Н.А., Мицнер Б.И., Горина Н.Ю., Евстигнеева Р.П., Щуколюков С.А., Чижевич Е.П., Корчагин В.П. Применение трифенилсилильной защитной группы в синтезе 11-цис-ретиналя и его использование для регенерации родопсина рыб. // Биоорган. химия. - 1977. - Т. 3, № 9. - С.1234-1241; Ходонов А.А., Ткачевская Е.П., Мицнер Б.И., Звонкова Е.Н., Евстигнеева Р.П. Синтез 11Z-ретиналя. // Биоорган. химия. - 1984. - Т. 10, №10. - С.1409- 1413].
Пример 3. Способ синтеза 11-цис-изомера ретиналя (1) с использованием системы межфазного катализа К2СО3/CH2Cl2 - Aliquat 336.
3.1. 13E-Изомер 11,12-дидегидроретинола (5)
Суспензию 5 г β-циклогеранилтрифенилфосфонийбромида (2), 4 г 6E-изомера ациклического С10-синтона (3), 3 г безводного К2СО3 и 1 мл Aliquat 336 в 200 мл CH2Cl2 интенсивно перемешивали 50-100 ч в атмосфере аргона и при 20°-25°С, затем выливали в 500 мл ледяной воды и вещество экстрагировали CH2Cl2 (5 раз по 200 мл). Объединенные органические экстракты промывали водой, растворитель удаляли, остаток растворяли в 300 мл смеси ацетон - 20% водный раствор фтористого аммония в воде, 3:1. После пятичасового перемешивания выливали в 500 мл воды, вещество экстрагировали хлороформом (5 раз по 200 мл). Объединенные органические экстракты промывали водой, сушили над сульфатом натрия, растворитель удаляли. Остаток кристаллизовали из гексана, выделившийся трифенилсиланол отделяли на фильтре, фильтрат упаривали и 13E-изомер 11,12-дидегидроретинола выделяли адсорбционной хроматографией на 300 г окиси алюминия IV в системе гексан - эфир с градиентом последнего от 0 до 30%. Фракции, содержащие вещество с Rf 0.29 (ТСХ на силикагеле, система гексан - эфир 1:1), собирали, объединяли и упаривали. Выход 1.78 г (66%).
Данные физико-химических методов анализа образца 13E-изомера 11,12-дидегидроретинола (5), полученного в примере 3, были полностью идентичны данным, приведенным в литературе [Соколова Н.А., Мицнер Б.И., Горина Н.Ю., Евстигнеева Р.П., Щуколюков С.А., Чижевич Е.П., Корчагин В.П. Применение трифенилсилильной защитной группы в синтезе 11-цис-ретиналя и его использование для регенерации родопсина рыб. // Биоорган. химия. - 1977. - Т. 3, № 9. - С.1234-1241; Ходонов А.А., Ткачевская Е.П., Мицнер Б.И., Звонкова Е.Н., Евстигнеева Р.П. Синтез 11Z-ретиналя. // Биоорган. химия. - 1984. - Т. 10, № 10. - С.1409-1413], и характеристикам образца, полученного по одной из процедур, описанных в примерах 1-2.
Последующая трансформация спирта (5) в целевой альдегид (1) была проведена, как описано в примерах 1 или 2.
Пример 4. Способ синтеза 11-цис-изомера ретиналя (1) с использованием системы 1,2-эпоксибутан /CH2Cl2.
4.1. 13Е-Изомер 11,12-дидегидроретинола (5)
Раствор 5 г β-циклогеранилтрифенилфосфонийбромида (2), 4 г 6Е-изомера ациклического С10-синтона (3) и 10 мл 1,2-эпоксибутана в 200 мл CH2Cl2 нагревали при 50°-60°С в атмосфере аргона при интенсивном перемешивании 70-100 ч, затем выливали в 500 мл ледяной воды и вещество экстрагировали CH2Cl2 (4 раз по 200 мл). Объединенные органические экстракты промывали водой, растворитель удаляли, остаток растворяли в 300 мл смеси ацетон - насыщенный раствор фтористого аммония в воде, 3:1. После пятичасового перемешивания выливали в 500 мл воды, вещество экстрагировали хлороформом (5 раз по 200 мл). Объединенные органические экстракты промывали водой, сушили над сульфатом натрия, растворитель удаляли. Остаток кристаллизовали из гексана, выделившийся трифенилсиланол отделяли на фильтре, фильтрат упаривали и 13Е-изомер 11,12-дидегидроретинола (5) выделяли адсорбционной хроматографией на 300 г окиси алюминия IV в системе гексан - эфир с градиентом последнего от 0 до 30%. Фракции, содержащие вещество с Rf0.29 (ТСХ на силикагеле, система гексан - эфир 1:1), собирали, объединяли и упаривали. Выход 2.0 г (74%).
Данные физико-химических методов анализа образца 13E-изомера 11,12-дидегидроретинола (5), полученного в примере 4, были полностью идентичны данным, приведенным в литературе [Соколова Н.А., Мицнер Б.И., Горина Н.Ю., Евстигнеева Р.П., Щуколюков С.А., Чижевич Е.П., Корчагин В.П. Применение трифенилсилильной защитной группы в синтезе 11-цис-ретиналя и его использование для регенерации родопсина рыб. // Биоорган. химия. - 1977. - Т. 3, № 9. - С.1234-1241; Ходонов А.А., Ткачевская Е.П., Мицнер Б.И., Звонкова Е.Н., Евстигнеева Р.П. Синтез 11Z-ретиналя. // Биоорган. химия. - 1984. - Т. 10, № 10. - С.1409-1413], и характеристикам образца, полученного по одной из процедур, описанных в примерах 1-3. Последующая трансформация спирта (5) в целевой альдегид (1) была проведена, как описано в примерах 1 или 2.
Пример 5. Способ синтеза 11-цис-изомера ретиналя (1) с использованием процедуры удаления трифенилсильной защитной группы при помощи системы тетрабутиламмоний фторид/СН3ОН
0.02 Моль силилированного 13E-изомера 11,12-дидегидроретинола (4), полученного после обработки реакционной массы по одному из вариантов, приведенных в примерах 1-4, растворяли в 100 мл метанола, добавляли 10% мольного эквивалента тетрабутиламмоний фторида и интенсивно перемешивали 1-1.5 ч под аргоном и при 20°-25°С. Далее после проведения стандартной обработки, аналогичной процедурам выделения продукта в примерах 1-4, с практически количественным выходом был получен 13Е-изомер 11,12-дидегидроретинола (5).
Данные физико-химических методов анализа образца 13Е-изомера 11,12-дидегидроретинола, полученного в примере 5, были полностью идентичны данным, приведенным в литературе [Соколова Н.А., Мицнер Б.И., Горина Н.Ю., Евстигнеева Р.П., Щуколюков С.А., Чижевич Е.П., Корчагин В.П. Применение трифенилсилильной защитной группы в синтезе 11-цис-ретиналя и его использование для регенерации родопсина рыб. // Биоорган. химия. - 1977. - Т. 3, № 9. - С.1234-1241; Ходонов А.А., Ткачевская Е.П., Мицнер Б.И., Звонкова Е.Н., Евстигнеева Р.П. Синтез 11Z-ретиналя. // Биоорган. химия. - 1984. - Т. 10, № 10. - С.1409-1413], и характеристикам образца, полученного по одной из процедур, описанных в примерах 1-4. Последующая трансформация спирта (5) в целевой альдегид (1) была проведена, как описано в примерах 1 или 2.
1. Способ стереоселективного получения 11-цис-изомера ретиналя, по пути C10+C10=C20, включающий стадии: олефинирования по Виттигу 6E-изомера 2Е-2,6-диметил-8-трифенилсилилоксиокта-2,6-диен-4-ин-1-аля (синтона С10) илидом, генерированным in situ из β-циклогеранилтрифенилфосфонийгалогенида, удаления трифенилсилильной защиты в полученном силилированном 13Е-изомере 11,12-дидегидроретинола, отличающийся тем, что после стадии удаления трифенилсилильной защиты проводят сначала окисление полученного 13E-изомера 11,12-дидегидроретинола до 11,12-дидегидроальдегида при помощи MnO2, без выделения полупродукта в индивидуальном виде и процедуры дополнительной очистки, а затем стереоспецифическое восстановление тройной связи в 11,12-дидегидроальдегиде гидрированием на катализаторе Линдлара с получением целевого 11-цис-изомера ретиналя, при этом генерирование илида из β-циклогеранилтрифенилфосфонийгалогенида осуществляют при использовании следующих условий: a) NaH в тетрагидрофуране при 0 - (-5)°С, б) безводный К2СО3 в дихлорметане, в присутствии катализаторов межфазного переноса - четвертичных аммониевых солей, при 20-25°С, или в) 1,2-эпоксибутан в дихлорметане при 50 до 60°С.
2. Способ по п.1, отличающийся тем, что для удаления трифенилсилильной защиты в силилированном 13Е-изомере 11,12-дидегидроретинола используют 10 мол.% тетрабутиламмония фторида в метаноле при 20-25°С, в атмосфере аргона.