Производные алкилпиридазина в качестве ингибиторов 11 -гидроксистероиддегидрогеназы типа 1 (11 -hsd1)
Иллюстрации
Показать всеВ заявке описаны соединения формулы I
где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
R3, R5, R6 и R7 независимо друг от друга означают водород, С1-С6алкил или С3-С8циклоалкил; а R4 означает 2,2-диметилпропил, 3-метилбутил, изопропил, трет-бутил, циклопропилметил, циклопентилметил, 3,3-диметилбутил или 1-циклопропил-1-метилэтил. Также изобретение относится к фармацевтически приемлемым солям таких соединений и к фармацевтическим композициям, содержащим такие соединения или их соли. Соединения и композиции по настоящему изобретению обладают способностью ингибировать активность фермента 11-β-гидроксистероиддегидрогеназы 1 (11β-HSD1), и, как следствие, могут быть использованы для лечения и профилактики диабета, ожирения, нарушений питания, дислипидемии и гипертензии. 4 н. и 18 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к новым производным пиридазина, которые можно использовать в качестве ингибиторов (T2D) 11b-HSD1. Изобретение прежде всего относится к соединениям формулы I
где R1 означает циклоалкил, арилалкил или арилоксиалкил,
R2 означает циклоалкил, арилалкил или арилоксиалкил, или
R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
R3 означает водород, алкил, циклоалкил или трифторметил,
R4 означает 2,2-диметилпропил, 3-метилбутил, изопропил, трет-бутил, циклопропилметил, циклопентилметил, 3,3-диметилбутил или 1-циклопропил-1-метилэтил,
R5 означает водород, алкил, циклоалкил или алкокси,
R6 означает водород, алкил, циклоалкил или алкокси,
R7 означает водород, алкил, циклоалкил или алкокси,
и к их фармацевтически приемлемым солям или сложным эфирам.
Глюкокортикоиды (кортизол в органиме человека, кортикостерон в организме мышей и крыс) представляют собой важный класс адренокортикостероидов, которые регулируют множество метаболических и гомеостатических процессов и являются ключевым компонентом ответной реакции на стресс. Действие глюкокортикоидов опосредуется внутриклеточными глюкокортикоидными рецепторами и в некоторых тканях минералокортикоидными рецепторами, которые оба являются ядерными факторами транскрипции. Действие глюкокортикоида на ткани-мишени зависит не только от концентраций стероидов в кровотоке и клеточной экспрессии рецепторов, но также от внутриклеточных ферментов, которые в значительной степени определяют долю от общего пула глюкокортикоидов, доступную для рецепторов в активных формах. 11-β-Гидроксистероиддегидрогеназы (11β-HSD) катализируют взаимопревращение главного активного 11-гидроксиглюкокортикоида (кортизола в организме человека) и его неактивного 11-кетопроизводного (кортизон в организме человека).
Фермент, 11-β-гидроксистероиддегидрогеназатипа 1 (11β-HSD1), превращает неактивные глюкокортикоиды в активную форму и благодаря этому играет важную роль в местной модуляции концентрации клеточного агониста и, таким образом, в активации кортикостероидных рецепторов в тканях-мишенях. В последнее время на фирме F. Hoffmann-La Roche проведены исследования генной экспрессии в организме худых и тучных людей с использованием генно-инженерной технологии с целью идентификации специфических изменений генной экспрессии, которые возможно ассоциированы с резистентностью к инсулину или измененным метаболизмом. В результате установлено, что экспрессия мРНК, кодирующей 11β-HSD1, приблизительно вдвое выше в жировой ткани у тучных субъектов. Более того, сверхэкспрессия 1β-HSD1 в адипоцитах мышей приводит к висцеральному ожирению и к фенотипу, подобному синдрому Х (Masuzaki Н. и др., Science, 294 (5549), 2166-2170 (2001, 7 декабря)). В итоге указанные данные убедительно свидетельствуют о важной роли 11β-HSD1 в индукции ожирения, нарушении гомеостаза глюкозы и состава липидов. Таким образом, селективное ингибирование этого фермента может понизить уровень глюкозы в организме пациентов с диабетом типа 2, нормализовать повышенный уровень липидов и/или уменьшить массу тела у тучных субъектов.
Первым фармакологическим указанием на то, что ингибирование 11β-HSD1 в организме человека может оказывать лечебное действие, получено при применении карбеноксолона, противоязвенного средства, которое ингибирует как 11β-HSD1, так и родственный фермент 11β-HSD2. Лечение карбеноксолоном приводит к увеличению чувствительности к инсулину, свидетельствуя о том, что ингибирование 11β-HSD1 может понижать уровень кортизола в клетках и, следовательно свести к минимуму некоторые его побочные действия (Walker и др., J.Clin. Endocrinol. Metab., 80, 31155-3159 (1995)).
11β-HSD1 экспрессируется во многих тканях, включая печень, жировую ткань, гладкую мускулатуру сосудов, поджелудочную железу и мозг. Активность фермента зависит от НАДФ(Н), причем фермент обладает относительно низким сродством к субстрату (по сравнению с 11β-HSD2). В гомогенизированной ткани и после очистки 11β-HSD1 проявляет двойную активность, как 11β-дегидрогеназы, так и 11β-редуктазы, причем более стабильной является активность дегидрогеназы (P.M.Stewart и Z.S.Krozowski, Vitam. Horm., 57, 249-324 (1999)). Однако при определении ферментативной активности в интактных клетках преобладает активность 11β-редуктазы, которая регенерирует активные глюкокортикоиды из инертных 11-кетопроизводных. Такая регенерация глюкокортикоидов повышает эффективный внутриклеточный уровень глюкокортикоидов и, следовательно, усиливает глюкокортикоидную активность. Предполагается, что именно повышенная клеточная концентрация кортизола вызывает повышенное продуцирование глюкозы в печени, дифференциацию адипоцитов и резистентность к инсулину.
Ингибирование 11β-HSD1 не только снижает типичный синдром-Х/диабет-ассоциированные симптомы, но и вместе с тем является безопасным для организма и не сопровождается основными побочными действиями. Исследования с использованием неспецифичного ингибитора карбеноксолона свидетельствуют о необходимости разработки специфичных ингибиторов 11β-HSD1. Ингибирование фермента 11β-HSD2 характеризуется плохой переносимостью в организме и приводит к повышенному кровяному давлению. Напротив, ингибирование 11β-HSD1 характеризуется хорошей переносимостью в организме, поскольку установлено, что состояние нокаут-мышей по 11β-HSD1 оставалось в норме и у таких мышей наблюдается устойчивость к гипергликемии, вызываемой ожирением или стрессом (Kotelevtsev Y. и др., Proc. Natl. Acad. Sci. USA, 94 (26), 14924-14929 (1997, 23 декабря)). Аналогичным образом, после голодания у указанных мышей наблюдалось снижение активации ключевых ферментов печени и развитие глюконеогенеза. Кроме того, у указанных мышей наблюдается улучшенный профиль липидов и липопротеинов, что свидетельствовало о высокой эффективности и безопасности ингибирования HSD1. В последних исследованиях было установлено, что ингибиторы 11β-HSD1 могут также оказывать лечебное действие за счет снижения кровяного давления (Masuzaki Н. и др., J.Clin. Invest., 112 (1), 83-90 (2003, июль), Rauz S. и др., QJM., 96 (7), 481-490 (2003, июль)), улучшения познавательных способностей (Sandeep Т.С. и др., Proc. Natl. Acad. Sci. USA, 27, 101 (17), 6734-6739 (2004, апрель)) или улучшения состояний, ассоциированных с болезнью Альцгеймера. Таким образом, ингибирование 11β-HSD1 может представлять собой безопасный и эффективный подход к лечению симптомов диабета, ожирения и других заболеваний.
Соединения формулы I и их фармацевтически приемлемые соли и сложные эфиры являются новыми и обладают ценными фармакологическими свойствами. Прежде всего они являются ингибиторами 11β-HSD1 (T2D) и проявляют селективность в отношении родственного фермента 11β-HSD2. Следовательно, соединения, которые являются специфичными ингибиторами 11β-HSD1 (T2D), представляют собой средства, пригодные, например, для снижения уровня глюкозы в крови и нормализации липидного состава у пациентов с диабетом типа 2 за счет модулировалия локальной концентрации активного глюкокортикоида кортизола в ткани-мишени (печени и жировой ткани).
Соединения по настоящему изобретению можно использовать при профилактике и/или лечении метаболических нарушений, ожирения, дислипидемии, гипертензии и/или диабета, прежде всего диабета типа II.
Соединения по настоящему изобретению можно также использовать при профилактике и/или лечении высокого глазного давления, улучшения познавательных способностей, лечения болезни Альцгеймера и/или нейродегенерации.
Кроме того, соединения по настоящему изобретению можно использовать для стимулирования ранозаживления, прежде всго при местном применении. Более того, соединения по настоящему изобретению можно использовать для улучшения познавательных способностей, прежде всего недостаточности, обусловленной преклонным возрастом, и улучшения памяти.
Объектами настоящего изобретения являются соединения формулы I и их вышеупомянутые соли и сложные эфиры, как таковые, а также их применение в качестве терапевтически активных веществ, способ получения указанных соединений, промежуточные соединения, фармацевтические композиции, лекарственные препараты, содержащие указанные соединения, их фармацевтически приемлемые соли и сложные эфиры, применение указанных соединений, сложных эфиров и солей для профилактики и/или лечения заболеваний, прежде всего при лечении или профилактике нарушений питания, ожирения, дислипидемии, гипертензии и/или диабета, прежде всего диабета типа II, и применение указанных соединений, солей и сложных эфиров для получения лекарственных препаратов, предназначенных для лечения или профилакики метаболических нарушений, ожирения, дислипидемии, гипертензии и/или диабета, прежде всго диабета типа II.
Соединения по настоящему изобретению можно также использовать совместно с агонистами PPAR (α, γ, δ), DHEA (дегидроэпиандростероном), ингибиторами DPPIV, инсулином и/или ингибиторами липазы, прежде всего орлистатом.
В описании заявки термин "алкил", отдельно или в комбинации,
алкильную группу с прямой или разветвленной цепью, содержащую 1-8 атомов углерода, предпочтительно алкильную группу с прямой или разветвленной цепью, содержащую 1-6 атомов углерода, и более алкильную группу с прямой или разветвленной цепью, содержащую 1-4 атома углерода. В одном варианте изобретения термин "алкил" означает прямую или разветвленную (с одним или несколькими разветвлениями) алкильную цепь, содержащую от 1 до 8 атомов углерода, например, С1-С8алкил, более предпочтительно от 1 до 4 атомов углерода, например, С1-С4алкил. Примерами C1-C8алкильных групп с прямой или разветвленной цепью являются такие группы, как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, изомерные пентилы, изомерные гексилы и изомерные октилы, предпочтительны метил и этил и наиболее предпочтителен метил.
Термин "циклоалкил", отдельно или в комбинации, означает циклоалкил, содержащий 3-8 атомов углерода, предпочтительно циклоалкил, содержащий 3-6 атомов углерода. Примерами С3-С8циклоалкила являются циклопропил, метилциклопропил, диметилциклопропил, циклобутил, метилциклобутил, циклопентил, метилциклопентил, циклогексил, метилциклогексил, диметилциклогексил, циклогептил и циклооктил, предпочтительно метилциклопропил и прежде всего 1-метилциклопропил, более предпочтительно циклопропил.
Термин "алкокси", отдельно или в комбинации, означает группу формулы алкил-O-, в которой термин "алкил" имеет значения, указанные выше, такие как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси, предпочтительно метокси и этокси и наиболее предпочтительно метокси.
Термин "гидроксиалкил", отдельно или в комбинации, означает группу алкил, указанную выше, в которой один или более атомов водорода, предпочтительно один атом водорода, заменен на гидроксигруппу. Примерами группы гидроксиалкил являются гидроксиметил и гидроксиэтил.
Термин "арил", отдельно или в комбинации, означает фенил или нафтил, предпочтительно фенил, необязательно замешен одим или более заместителями, предпочтительно одним-тремя заместителями, каждый из которых независимо выбирают из группы, включающей галоген, трифторметил, трифторметокси, амино, алкил, алкокси, алкилкарбонил, циано, карбамоил, алкоксикарбамоил, метилендиокси, карбокси, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, гидрокси, нитро, алкил-SO2-, амино-SO2-, циклоалкил и т.п. Примерами являются фенил или нафтил, прежде всего фенил, необязательно замещенный одним-тремя, предпочтительно одним или двумя заместителями, независимо выбранными из группы, включающей алкил, галоген, алкокси, трифторметокси, нитро и трифторметил.
Термин "арилокси", отдельно или в комбинации, означает группу арил-O-, в которой термин "арил" имеет значения, указанные выше.
Термин "амино", отдельно или в комбинации, означает первичную, вторичную или третичную аминогруппу, присоединенную через атом азота, причем вторичная аминогруппа замещена группой алкил или циклоалкил и третичная аминогруппа замещена двумя идентичными или различными группами алкил или циклоалкил или два заместителя по атому азота вместе образуют цикл, такую, например, как -NH2, метиламино, этиламино, диметиламино, диэтиламино, метилэтиламино, пирролидин-1-ил или пиперидино и т.п., предпочтительно первичная аминогруппа, диметиламино и диэтиламино и прежде всего диметиламино.
Термин "галоген", отдельно или в комбинации, означает фтор, хлор, бром или иод, предпочтительно фтор, хлор или бром.
Термин "карбонил", отдельно или в комбинации, означает группу -С(O)-.
Термин "окси", отдельно или в комбинации, означает группу -O-.
Термин "нитро", отдельно или в комбинации, означает группу -NO2.
Термин "циано", отдельно или в комбинации, означает группу -CN.
Термин "фармацевтически приемлемые соли" означает соли, которые сохраняют биологическую активность и свойства свободных оснований или свободных кислот, которые не обладают биологической активностью или являются неприемлемыми по иной причине. Такие соли включают соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, и т.п., предпочтительно хлористоводородная кислота, или органических кислот, таких как уксусная кислота, пропионовая кислота, гдиколевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара-толуолсульфоновая кислота, салициловая кислота, N-ацетилцистеин и т.п. Кроме того, указанные соли получают при добавлении неорганического основания или органического основания к свободной кислоте. Соли неорганического основания включают, без ограничения перечисленным, соли натрия, калия, лития, аммония, кальция, магния и т.п. Соли органических оснований включают, без ограничения перечисленным, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и основные ионообменные смолы, таких как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N-этилпиперидин, пиперидин, полиаминовые смолы и т.п. Соединение формулы I может также присутствовать в форме цвиттерионов. Более предпочтительными фармацевтически приемлемыми солями соединения формулы I являются гидрохлориды.
Соединения формулы I могут также присутствовать в сольватированной, например, гидратированной форме. Сольватирование происходит в процессе получения соединения или, например, за счет гигроскопичных свойств первоначально безводного соединения формулы I (гидратация). Термин фармацевтически приемлемые соли включают также фихиологически приемлемые сольваты.
Термин "фармацевтически приемлемые сложные эфиры" означает, что соединения общей формулы (I) можно модифициировать по функциональным группам с образованием производных, которые способны трансформироваться с образованием исходных соединений in vivo. Примеры таких соединений включают физиологически приемлемые и метаболически лабильные сложные эфиры, такие как метоксиметиловые сложные эфиры, метилтиометиловые сложные эфиры и пивалоилоксиметиловые сложные эфиры. Кроме того, изобретение включает любые физиологически приемлемые эквиваленты соединений общей формулы (I), подобные метаболически лабильным сложным эфирам, которые способны продуцировать исходные соединения общей формулы (I) in vivo.
Соединения формулы (I) могут содержать несколько асимметрических центров и могут присутствовать в форме оптически чистых энантомеров, смесей энантиомеров, таких, например, как рацематы, оптически чистые диастереоизомеры, смеси диастереоизомеров, диастереоизомерные рацематы или смеси диастереоизомерных рацематов.
Термин "асимметрический углеродный атом" (С*) означает атом углерода с четырьмя различными заместителями. Согласно правилу Кана-Ингольда-Прелога асимметрический атом углерода может находиться в he "R" или "S" конфигурации.
Предпочтительны соединения формулы I и их фармацевтически приемлемые соли, прежде всего соединения формулы I.
Предпочтительны соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
Кроме того, предпочтительны соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
например, соединения формулы
Предпочтительны также соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
например, соединения формулы
.
Предпочтительны соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
например, соединения формулы
Кроме того, предпочтительны соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
например, соединения формулы
Кроме того, предпочтительны соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
например, соединения формулы
Кроме того, предпочтительны соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
например, соединения формулы
Кроме того, предпочтительны соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
например, соединения формулы
Предпочтительны также соединения формулы I, где R1 и R2 вместе с
атомами углерода Ca и Cb, к которым они присоединены, образуют
например, соединения формулы
Предпочтительны соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
например, соединения формулы
Кроме того, предпочтительны соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
Прежде всего предпочтительны такие соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
Кроме того, предпочтительны такие соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
Более предпочтительны также такие соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
Более предпочтительны также такие соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
Кроме того, предпочтительны соединения формулы I, где R3 означает водород. Предпочтительны также соединения формулы I, где R3 означает метил.
Предпочтительны соединения формулы I, где R4 означает 2,2-диметилпропил, 3-метилбутил, изопропил, трет-бутил, циклопропилметил или циклопентилметил.
Предпочтительны такие соединения формулы I, где R4 означает 2,2-диметилпропил, 3-метилбутил, изопропил иди трет-бутил. Более предпочтительны соединения формулы I, где R4 означает 2,2-диметилпропил или трет-бутил. Кроме того, более предпочтительны такие соединения формулы I, где R4 означает 3-метилбутил.
Другим предпочтительными объектами по настоящему изобретению являются соединения формулы I, где R5, R6 и R7 независимо выбирают из групп водород и метил. Более предпочтительны такие соединения формулы I, где R5, R6 и R7 означают водород.
Предпочтительны хиральные соединения формулы I.
Предпочтительны такие соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
где атом углерода в положении 1 находится в R конфигурации, а атом углерода в положении 8 находится в S конфигурации.
Более предпочтительны такие соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
где атом углерода в положении 1 находится в S конфигурации, а атом углерода в положении 8 находится в R конфигурации.
Кроме того, более предпочтительны такие соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
где атом углерода в положении 1 находится в R конфигурации, а атом углерода в 5 положении 8 находится в S конфигурации.
Кроме того, более предпочтительны соединения формулы I, где R1 и R2 вместе с атомами углерода Ca и Cb, к которым они присоединены, образуют
В указанной выше формуле атом углерода в положении 1 находится в S конфигурации, а атом углерода в положении 8 находится в R конфигурации.
Примерами предпочтительных соединений формулы (I) являются
3-(2,2-диметилпропил)-5,6,7,8,9,10-гексагидроциклоокта[с]пиридазин,
(1SR,8RS)-5-(2,2-диметилпропил)-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1S,8R)-5-(2,2-диметилпропил)-1,11,11-триметил-3,4-диазатрицикло[6.2.1.0 2,7]ундека-2,4,6-триен,
(1S,8R)-5-трет-бутил-1,11,11-триметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
3-(2,2-диметилпропил)-б,6-диметил-6,7-дигидро-5Н-циклопента[с]пиридазин,
(1SR,8RS)-5-(2,2-диметилпропил)-6-метил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
3-трет-бутил-6,6-диметил-6,7-дигидро-5Н-циклопента[с]пиридазин,
(1SR,8RS)-5-(3-метилбутил)-3,4-диазатрицикло[6.21.0.2,7]ундека-2(7),3,5-триен,
(1SR,8RS)-5-трет-бутил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1S,8R)-1,11,11-триметил-5-(3-метилбутил)-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1S,8R)-5-изопропил-1,11,11-триметил-3,4-диазатрицикло [6.2.1.02,7]ундека-2,4,6-триен,
(1SR,8RS)-5-циклопропилметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2(7),3,5-триен,
(1S,8R)-5-циклопропилметил-1,11,11-триметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2(7),3,5-триен,
3-циклопропилметил-6,6-диметил-6,7-дигидро-5Н-циклопента[с]пиридазин и
(1S,8R)-5-циклопентилметил-1,11,11-триметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен.
Примерами более предпочтительных соединений формулы (I) являются
(1SR,8RS)-5-(2,2-диметилпропил)-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1S,8R)-5-(2,2-диметилпропил)-1,11,11-триметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1S,8R)-5-трет-бутил-1,11,11-триметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1SR,8RS)-5-(2,2-диметилпропил)-6-метил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
3-трет-бутил-6,6-диметил-6,7-дигидро-5Н-циклопента[с]пиридазин и
(1S,8R)-1,11,11-триметил-5-(3-метилбутил)-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен.
Другими предпочтительными примерами соединений по настоящему изобретению являются
(1S,8R)-5-(2,2-диметилпропил)-6-метил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1S,8R)-5-(2,2-диметилпропил)-6-метил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1S,8R)-5-(3,3-диметилбутил)-1,11,11-триметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1SR,8RS)-5-трет-бутил-11,11-диметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1S,8R)-5-трет-бутил-11,11-диметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1R.,8S)-5-трет-бутил-11,11-диметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1SR,8RS)-5-(2,2-диметилпропил)-11,11-диметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1SR,8RS)-5-(2,2-диметилпропил)-6,11,11-триметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1SR,8RS)-5-(1-циклопропил-1-метилэтил)-3,4-диазатрицикло[6.2.1.0 2,7]ундека-2,4,6-триен,
(1SR,8RS)-5-циклопентилметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1R,8S)-5-(2,2-диметилпропил)-1,11,11-триметил-3,4-диазатрицикло[6.2.1,02,7]ундека-2(7),3,5-триен,
(1S,8R)-5-(2,2-диметилпропил)-8,11,11-триметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2(7),3,5-триен,
(1R,8S)-5-трет-бутил-1,11,11-триметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2(7),3,5-триен и
(1S,8R)-5-трет-бутил-8,11,11-триметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2(7),3,5-триен.
Другими примерами более предпочтительных соединений формулы (I) являются
(1S,8R)-5-(2,2-диметилпропил)-6-метил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1S,8R)-5-(2,2-диметилпропил)-6-метил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1S,8R)-5-трет-бутил-11,11-диметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1R,8S)-5-трет-бутил-11,11-диметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1SR,8RS)-5-(2,2-диметилпропил)-11,11-диметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2,4,6-триен,
(1S,8R)-5-(2,2-диметилпропил)-8,11,11-триметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2(7),3,5-триен и
(1S,8R)-5-трет-бутил-8,11,11-триметил-3,4-диазатрицикло[6.2.1.02,7]ундека-2(7),3,5-триен.
Объектом изобретения являются также способы получения соединений формулы I.
Соединения формулы I по настоящему изобретению получают последовательными или конвергентными синтезами, показанным на следующих схемах. Квалификация, необходимая для проведения реакции и очитски полученных продуктов, известна специалисту в данной области. Если не указано иное, заместители и индексы, используемые ниже при описании методик, имеют значения, указанные выше.
В общем случае соединения типа I получают при взаимодействии соединений формулы II с гидразином. При этом реакцию конденсации проводят в различных условиях, например (1) соединение II нагревают в смеси с гидразин моногидратом в толуоле в присутствии кислоты, такой как пара-толуолсульфокислота, (2) соединение II нагревают в смеси с моногидратом гидразина в смеси вода/уксусная кислота при температуре кипения растворителя, (3) соединение II нагревают в смеси с моногидратом гидразина в смеси вода/уксусная кислота при температуре кипения растворителя, а затем обрабатывают NaOMe в н-бутаноле при кипячении с обратным холодильником для завершения циклизации с образованием пиридазина.
Условия проведения реакций зависят от соответствующих исходных материалов и приводятся в разделе Примеры. Геометрические изомеры при двойной связи в соединениях типа II могут находиться в Е или Z конфигурации, или в смешанной Е и Z конфигурации. Независимо от геометрии двойной связи из таких соединений можно получить соединения формулы I за счет выбора наиболее пригодных условий проведения реакции, указанных выше и приведенных в разделе Примеры.
Если R1 и R2 образуют 5-8-членные циклы, то при синтезе указанных аналогов соединений формулы II по реакции Хорнера-Виттига (см. в разделе ниже) можно получить изомерные соединения, где двойная связь мигрирована в циклическую систему, как показано в 7-членной циклической системе формулы 11а. Из указанных изомеров также получить соединения II при проведении реакции в условиях, указанных выше.
Схема 1
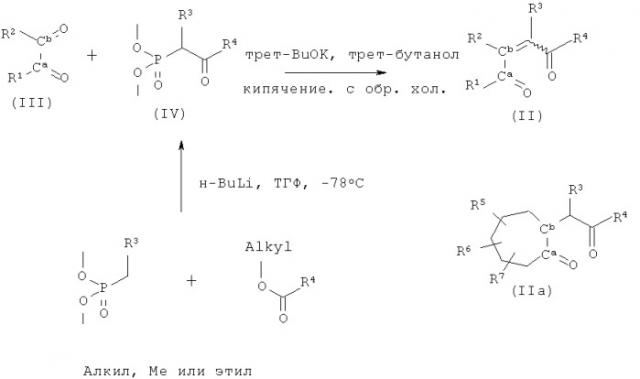
Соединения типа II, используемые на схеме 1 в качестве исходных материалов, получают, как показано на схеме 2.
Таким образом, при взаимодействии 1,2-дикетона формулы III с фосфонатом формулы IV в условиях реакции Хорнера-Эммонса (или Виттига-Хорнера) образуются соединения формулы II. В качестве основания используется, например, трет-бутоксид калия в трет-бутаноле, а реакцию проводят при температуре кипения растворителя. При этом в зависимости от строения исходного материала может происходить миграция двойной связи, как показано в формуле 11а для соединений, в котором R1 и R2 образуют 7-членный цикл, и описано в разделе Примеры.
В зависимости от групп R1, R2, R3, R4 геометрические изомеры при двойной связи в соединениях типа II могут находиться в Е или Z конфигурации, или в смешанной Е и Z конфигурации. Во многих случаях преимущественно образуется только один изомер (термодинамически более стабильный Е изомер). Смеси изомеров разделяют хроматографией или непосредственно используют на стадии циклизации. Стереохимию двойной связи в соединениях формулы II определяют методом ЯМР (см. раздел Примеры). Вместо фосфоната типа IV можно также использовать соответствующий аналг в виде α-галогенкетона и проводить реакцию Реформатского с последующем элиминированием молекулы воды (например, этот тип реакции описан в статье Huang, J.Chem. Soc., Perkin Trans. 1,2397 (1989)).
В случае несимметричных соединений формулы III соединения формулы II получают непосредственно, если Cb карбонильная группа является более реакционно-способной, чем Ca карбонильная группа. Если обе карбонильные группы вступают в реакцию одновременно, то получают смеси, которые разделяют хроматографией, и проводят последующий синтез.
Если Ca карбонильная группа является более реакционно-способной в реакции Хорнера-Эммонса (или Виттига-Хорнера), то соединения формулы II можно получить различными способами, например (1) Ca карбонильную группу првращают в циклический кеталь по реакции, например, с этан-1,2-диолом (аналогичные реакции описаны в статье Boeckman, J. Am. Chem. Soc., 5549 (1986)), проводят реакцию Виттига-Хорнера по Cb группе и расщепляют Ca кеталь, или в другом варианте (2) восстанавливают Ca карбонильную группу до гидроксилгруппы и вводят гидроксизащитную группу, такую, например, как трет-бутилдиметилсилиловый эфир (см., например, статью Boeckman, J. Am. Chem. Soc., 5549 (1986)), затем проводят реакцию Хорнера-Виттига по Cb группе, деблокируют гидроксигруппу и, наконец, окисляют до карбонильной группы, например, в условиях реакции окисления по Сверну (см., например, статью Albright, J. Org. Chem., 30, 1107 (1965)).
Схема 2
1,2-Дикетоны III, используемые в схеме 2, являются коммерческими препаратами, описанными в литературе, или их можно получить за счет комбинации известных методов.
Фосфонаты формулы IV описаны в литературе или их можно получить по стандартным методикам. Примеры получения соединений IV включают взаимодействие диметилового эфира алкилфосфоновой кислоты с основанием, таким как N-бутиллитий, в ТГФ при -78°С, и последующее взаимодействие с алкилкарбоксилатом с образованием соединения IV. В другом варианте в реакции можно использовать диметиловый эфир метилфосфоновой кислоты (R3=H) с последующим алкилированием с целью введения группы R3 по реакции соединения IV (R=H) с алкилирующим реагентом (R3-галошег) в присутствии основания, такого как трет-бутоксид калия или N-бутиллитий или карбонат калия (аеалогичная реакция описана в статье В. Kirschberger, Synthesis, 11,926(1986)).
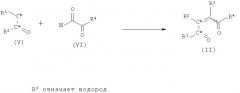
Другие способы получения соединений формулы II включют реакцию кетона формулы V с соединениями формулы VI, как показано на схеме 3. Реакцию проводят аналогично тому, как описано в статье Mukaiyama (J. Am. Chem. Soc., 96, 7503 (1974)), т.е. в условиях перекрестной альдольной конденсации. При этом соединение V в форме предварительно полученного силил-енольного эфира взаимодействует с формильным карбонилом формулы IV в присутствии тетрахлорида титана, а затем проводят дегидратацию первичного продукта конденсации с образованием содинения II. Соединения VI являются коммерческими препаратами или их можно получить методами, аналогичными описанным в литературе, например, из соответствующих метилкетонов при окислении SeO; (см., например, K.С.Joshi, Heterocycles, 16, 1545 (1981)), или из α-галогенкетоов при окислении по Сверну (см., например, D.Swern, Synthesis, 165(1981)).
Схема 3
Соединения формулы V являются коммерческими препаратами, описанными в литературе, или их можно получить по известным методикам.
Другой способ получения соединений формулы I показан на схеме 4. Способ включает взаимодействие 1,4-дикетонов формулы VII с гидразином в указанных выше условиях с образованием дигидропиридазинов формулы VIII (приведена олна из возможных изомерных форм). Затем полученный продукт ароматизируют, например, в присутствии Pd на угле или другого окислителя, такого как Br2 (аналогично следующим методикам: Baumgarten, J. Am. Chem. Soc., 80, 6609 (1058)) с образованием соединений формулы I. 1,4-Дикетоны формулы VII находят широкое применение в качестве синтетических структурных блоков и в литературе описано множество методов их получения (см., например, Corey J. Am. Chem. Soc., 91, 4926 (1969), Katritzky, J. Org. Chem., 56, 6917 (1991)). Более близким примером получения указанных соединения является применение методики, описанной в статье A. Baba (J. Org. Chem., 62, 8282 (1997)). Схема включает взаимодействие кетона V в форме предварительно полученного соответствующего енолята с α-галогенкетоном IX в присутствии каталитичеких количеств ZnCl2 (схема 4)
Схема 4
Предпочтительный способ получения соединения формулы
включает взаимодействие соединения формулы
с гидразином с целью получения соединения формулы I, где R1-R4 имеют значения, указанные выше.
Вышеописанные соединения формулы I для применения в качестве терапевтически активного агента также являются объектом изобретения.
Кроме того, объектом настоящего изобретения являются вышеописанные соединения для получения лекарственных препаратов, предназначенных для профилактики и терапии заболеваний, кот