Домен связывания бактериальной атр-синтазы
Иллюстрации
Показать всеНастоящее изобретение относится к области генетической инженерии и может быть использовано в медико-биологической промышленности при поиске и/или разработке новых антимикобактериальных препаратов. Определены мутации аминокислотной последовательности белка atpE микобактерий (М.tuberculosis и М.smegmatis), определяющие их устойчивость к DARQ J. Получены кодирующие мутантные формы atpE, нуклеиновые кислоты, содержащие их векторы, клетки-хозяева, экспрессирующие мутантные белки. Предложено использование указанных клеток-хозяев в способе идентификации соединений, которые могут быть применены в качестве антимикробных агентов для резистентных к известным препаратам штаммов микобактерий. 5 н.п. ф-лы, 4 ил., 7 табл.
Реферат
Настоящее изобретение обеспечивает выделенный мутантный белок atpE и начинающуюся с указанного мутантного белка atpE идентификацию домена связывания ATP-азы. Настоящее изобретение также обеспечивает связанные с этим нуклеиновые кислоты, векторы, клетки-хозяева, фармацевтические композиции и изделия. Кроме того, настоящее изобретение предоставляет способы определения того, взаимодействует ли исследуемое соединение с белком atpE, то есть с доменом связывания ATP-азы по настоящему изобретению, а также композиции фармацевтических препаратов, содержащие указанное исследуемое соединение, в частности, в качестве антимикробных агентов, более конкретно в качестве антимикобактериального агента, еще более конкретно агента для лечения туберкулеза у субъекта.
Уровень техники
После СПИДа туберкулез (TB) представляет собой ведущую причину смертности у взрослых (2-3 миллиона смертей в год) в мире и представляет собой критический сдерживающий фактор в облегчении глобальной бедности и страданий (1). Факторы, вносящие вклад в возобновление заболевания, включают сложности осуществления антитуберкулезных программ во многих странах, резкое увеличение количества индивидуумов с ослабленным иммунитетом, в основном, в связи с ВИЧ-инфекцией - и перемещение людей через области, где TB является эндемическим, и из них. Эпидемии TB и ВИЧ подпитывают друг друга в людях, инфицированных совместно - в настоящее время 11 миллионов взрослых, - увеличивая как заболеваемость, так и смертность (2, 3). В дополнение к этому, TB представляет собой ведущую причину смерти у людей, инфицированных ВИЧ (4).
Хотя режимы введения противотуберкулезных лекарственных средств первой линии могут достигать более чем 90% долей эффективности, их сложность может приводить к плохой совместимости, когда адекватная медицинская поддержка и программы лечения TB являются недоступными и, кроме того, к появлению резистентности (5). Устойчивые к множеству лекарственных средств (MDR) штаммы TB существенно осложняют лечение (6). The Global Alliance for TB Drug Development рекомендует, чтобы любое новое лечение предлагало, по меньшей мере, одно из трех следующих преимуществ по сравнению с существующими видами терапии: сокращение или упрощение эффективного лечения TB; увеличение эффективности против MDR-TB; и улучшение лечения латентной формы инфекции TB. Такое новое лекарственное средство сильно улучшило бы податливость пациента, при этом понижая стоимость программ лечения TB, подобных стратегии World Health Organization (WHO)'s Directly Observed Treatment Short-course (DOT) (7).
Более новые кандидаты в противотуберкулезные агенты, находящиеся в настоящее время в преклинической и клинической разработке, имеют тенденцию к тому, чтобы либо принадлежать к существующим семействам лекарственных средств (такие как моксифлоксацин), либо к аналогам лекарственных средств первой линии, таких как MJH-98-1-81 (из изониазида), оксазолидиноны и рифапентин (близкий аналог рифампина) (8). Хотя эти новые лекарственные средства могут быть сильнодействующими, аналоговые соединения обеспечивают только временные решения проблем резистентности (9), поскольку они основываются на таком же механизме действия, как и существующие семейства лекарственных средств.
Антибиотики, как правило, обычно ингибируют бактериальную репликацию посредством ингибирования бактериального метаболизма через специфический механизм. Например, изониазид вмешивается в работу ферментативного аппарата, который синтезирует миколиновые кислоты, необходимые компоненты клеточной стенки, в то время как рифампицин вмешивается в деятельность бактериального механизма транскрипции РНК из ДНК. Соответственно, представляет интерес обнаружение новых способов идентификации противотуберкулезных соединений, которые нацелены на другие конкретные микобактериальные аспекты роста клеток и репликации, по сравнению с известными агентами.
Сущность изобретения
Настоящее изобретение предоставляет выделенные мутантные белки atpE, в частности, кодируемые аминокислотными последовательностями, выбранными из (SEQ ID No.1), (SEQ ID No.2), (SEQ ID No.3), (SEQ ID No.4) и (SEQ ID No.5), выделенную нуклеиновую кислоту, кодирующую указанные мутантные белки atpE, в частности выбранную из группы, состоящей из (SEQ ID No.6), (SEQ ID No.7), (SEQ ID No.8), (SEQ ID No.9) и (SEQ ID No.10), и вектор, содержащий рассматриваемую нуклеиновую кислоту. В конкретном варианте осуществления мутантный белок atpE кодируется SEQ ID No.2, и выделенная последовательность нуклеиновой кислоты, кодирующая указанный белок, состоит из SEQ ID No.7.
Кроме того, настоящее изобретение обеспечивает систему хозяин-вектор, включающую клетку-хозяин, содержащую в себе рассматриваемый вектор экспрессии.
Кроме того, настоящее изобретение обеспечивает выделенную клетку, содержащую мутантный белок atpE, где указанный белок индуцирует в клетке антимикробную устойчивость.
Кроме того, настоящее изобретение обеспечивает способ идентификации антимикробного соединения, включающий стадии
(a) контактирования клетки, экспрессирующей белок atpE, с исследуемым соединением в физиологических условиях;
(b) определения того, взаимодействует ли исследуемое соединение с белком atpE.
Кроме того, настоящее изобретение предоставляет способ оценки потенциала исследуемого соединения к взаимодействию с белком atpE, включающий:
(a) использование методов молекулярного моделирования для генерирования трехмерной структуры белка atpE;
(b) использование компьютерных средств для осуществления операции совмещения исследуемого соединения и трехмерной структуры белка atpE; и
(c) анализ результатов указанной операции совмещения для количественного определения ассоциации исследуемого соединения с трехмерной структурой белка atpE.
Целью настоящего изобретения также является создание сайта связывания части F0 ATP-азы, содержащего, по меньшей мере, аминокислоты Ala24, Gly27, Phe53, Val57, Gly58, Glu61, Tyr64 и Phe65 одной субъединицы C; аминокислоты Ser182, Leu183, Ser184, Leu185 и Arg186 одной субъединицы A, и указанные аминокислоты имеют атомные координаты любой из таблиц 3, 4 или 5.
Еще в одном аспекте настоящее изобретение предусматривает использование указанного выше домена связывания в способе идентификации соединений, которые взаимодействуют с частью F0 ATP-азы, и их потенциала в качестве антимикробных соединений, в частности, в способе идентификации антимикобактериальных соединений.
Соответственно, целью настоящего изобретения является создание способа лечения субъекта с микробной инфекцией, включающего введение субъекту соединения, которое взаимодействует с частью F0 ATP-азы, в частности с белком atpE, на сайтах мутации, придающей устойчивость, или с сайтом связывания по настоящему изобретению. Кроме того, настоящее изобретение предусматривает способ лечения субъекта, страдающего туберкулезом, включающий введение субъекту агента, который взаимодействует с белком atpE, используя любой из указанных выше способов скрининга. В способах лечения, включающих использование соединения, которое взаимодействует с частью F0 ATP-азы, в частности с белком atpE, соединения, о которых ранее было известно, что они взаимодействуют с частью F0 ATP-азы, и, в частности с белком atpE, должны быть исключены. Более конкретно, должно быть исключено использование соединений DARQ J, описанных в (11), в любом из описанных способов лечения.
Кроме того, настоящее изобретение обеспечивает фармацевтическую композицию, содержащую агент, который взаимодействует с белком atpE в клетке, и фармацевтически приемлемый носитель. Наконец, настоящее изобретение предусматривает изделие, содержащее упаковку и фармацевтический агент, где (a) фармацевтический агент взаимодействует с белком atpE в клетке и (b) упаковка содержит этикетку, указывающую на использование агента для лечения бактериальной инфекции у субъекта. В конкретном варианте осуществления настоящее изобретение предусматривает использование DARQ J при производстве антимикробного лекарственного средства.
Этот и другие аспекты настоящего изобретения будут обсуждаться более подробно далее.
Краткое описание таблиц и чертежей
Таблица 1. Минимальные ингибирующие концентрации (MIC) ведущего соединения DARQ (J), которые ингибируют 90% роста различных видов микобактерий. Количество исследуемых штаммов было n=1, если не указано иначе.
Таблица 2. Аминокислоты, окружающие сайт связывания для соединения DARQ J.
Таблица 3. Атомные координаты аминокислот, окружающих сайт связывания для соединения DARQ J, полученного как из дикого типа, так и из мутанта DARQ J штамма M.tuberculosis.
Таблица 4. Атомные координаты сайта связывания для соединения DARQ J в диком типе M.tuberculosis.
Таблица 5. Атомные координаты сайта связывания для соединения DARQ J мутантного штамма DARQ J M.tuberculosis.
Таблица 6. Атомные координаты мутантного белка atpE (SEQ ID No.2) M.tuberculosis.
Таблица 7. Атомные координаты белка atpE дикого типа (SEQ ID No.l) M.tuberculosis.
Фиг.1. Абсолютная конфигурация R207910, далее также упоминаемого как J или DARQ J.
Фиг.2. Сравнения последовательностей белка atpE для мутантов M.tuberculosis и M.smegmatis. Mtb_S: чувствительный к лекарственным средствам штамм M.tuberculosis H37Rv, atpE (1-81). Номер доступа: Swiss-Prot Q10598 (SEQ ID No.1). Mtb_R: устойчивый к лекарственным средствам штамм M.tuberculosis BK12, atpE (1-81) (SEQ ID No.2). Msm_S: чувствительный к лекарственным средствам штамм M.smegmatis, atpE (1-86). Последовательность, полученная Institute for Genome Research (SEQ ID No.3). Msm_R09 (SEQ ID No.4) и R10 (SEQ ID No.5): устойчивые к лекарственным средствам штаммы M.smegmatis atpE (1-86). Последовательности, полученные в лаборатории. Для человека: Homo sapiens, ATP5G3 (66-142). Номер доступа: Ensembl ENSP00000284727. Верхняя нумерация: M.tuberculosis и M.smegmatis atpE. Нижняя нумерация: H sapiens ATP5G3 (66-142). Черный цвет указывает сходство аминокислот с использованием матрицы BLOSUM62 (черный = высокое, серый = среднее). Стрелки указывают положения точечных мутаций, наблюдаемых у стойких штаммов.
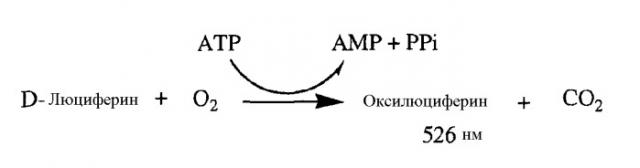
Фиг.3. Измерение общего клеточного ATP M. Tuberculosis в присутствии DARQ J, изониазида и DCCD. Относительные единицы люминесценции оксилюциферина, измеренной при 526 нм, как у дикого типа M.tuberculosis, так и у мутанта DARQ J M.tuberculosis.
Фиг.4. Ленточное представление трех C-субъединиц (цепь A, цепь K и цепь L) и субъединицы A (цепь M), которые вместе образуют сайт связывания для соединения DARQ J.
Подробное описание
Определения
Как используется в настоящей заявке, если только здесь в явном виде не предусматривается иначе, каждый из следующих далее терминов будет иметь значение, приведенное ниже.
"Белок atpE" должен обозначать цепь C субъединицы F0 комплекса ATP-азы, как представлено SwissProt, код доступа Q10598 для M.tuberculosis, или белок, имеющий, по меньшей мере, 70, 80, 90, 95, 97 или 99% идентичность последовательности с указанной последовательностью M.tuberculosis.
"F1F0 ATP-аза", упоминаемая также как ATP-аза, ATP-синтаза или F0F1 ATP-аза, должна обозначать большой комплекс из множества субъединиц, который катализирует синтез или гидролиз ATP. F0F1 ATP-азы состоят из двух доменов: части F1, которая является внешней по отношению к мембране и содержит каталитические сайты, и части F0, которая охватывает бислой и содержит протонный канал. ATP-азы находятся в плазматической мембране бактерий, тилакоидной мембране хлоропластов и во внутренней мембране митохондрии, где они используют энергию электрохимического градиента протонов для осуществления синтеза ATP.
"Введение" должно обозначать доставку способом, который осуществляется или производится с использованием любого из различных способов и систем доставки, известных специалистам в данной области. Введение может осуществляться, например, местно, внутривенно, перикардиально, перорально, посредством импланта, трансмукозально, трансдермально, внутримышечно, подкожно, внутрибрюшинно, интратекально, интралимфатически, в поврежденную ткань или эпидурально. Введение может также осуществляться, например, один раз, много раз и/или в течение одного или нескольких продолжительных периодов.
"Клетки-хозяева" включают, но не ограничиваются этим, бактериальные клетки, дрожжевые клетки, грибковые клетки, клетки насекомых и клетки млекопитающих. Бактериальные клетки могут быть трансфицированы способами, хорошо известными в данной области, такими как кальцийфосфатное осаждение, электропорация и микроинъекция.
"Выделенный", по отношению к белку atpE, должен обозначать препарат фрагмента мембраны, содержащий белок atpE, или другой подходящий для использования препарат, где atpE сохраняет свою природную функцию и является свободным от некоторых или всех иных белков в его нативной окружающей среде. Подразумевается включение препаратов мембран, содержащих часть F0 F0F1 ATP-азы, в частности часть F0, содержащую мутантные белки atpE по настоящему изобретению.
"Бактериальная клетка" должна означать любую бактериальную клетку. Бактериальные клетки включают, без ограничения, клетки, которые являются нормальными, аномальными и трансформированными, и иллюстрируются микобактериями, в частности, Mycobacterium tuberculosis и Mycobacterium smegmatis, corynebacteria, nocardia, грамположительными бактериями, такими как, например, стрептококк, стафилококк и энтерококк или грамотрицательными бактериями, такими как, например, Escherichia coli, Heamophilus influenzae и Helicobacter pylori.
Термины "нуклеиновая кислота" и "полинуклеотид" здесь используются взаимозаменяемо и каждый из них относится к полимеру дезоксирибонуклеотидов и/или рибонуклеотидов. Дезоксирибонуклеотиды и рибонуклеотиды могут быть встречающимися в природе соединениями или их синтетическими аналогами.
Термин "физиологические условия" должен означать по отношению к данной клетке такие условия, которые обычно составляли бы биохимическую окружающую среду клетки. Биохимическая окружающая среда клетки включает, без ограничения, некоторые или все протеазы, для которых клетка обычно экспонируется. Такие условия включают, но не ограничиваются этим, условия in vivo.
Термины "полипептид", "пептид" и "белок" используются здесь взаимозаменяемо и каждый из них означает полимер аминокислотных остатков. Аминокислотные остатки могут быть встречающимися в природе соединениями или их химическими аналогами. Полипептиды, пептиды и белки могут также включать модификации, такие как гликозилирование, присоединение липидов, сульфатирование, гидроксилирование и ADP-рибозилирование.
"Субъект" должен означать любое животное, такое как млекопитающее или птица, включая, без ограничения, корову, лошадь, овцу, свинью, собаку, кошку, грызуна, такого как мышь или крыса, индейку, курицу и примата. В предпочтительном варианте осуществления субъектом является человек.
"Лечение" должно включать, без ограничения, устранение, обращение течения, замедление развития, ослабление симптомов или облегчение другим образом заболевания субъекта.
"Вектор" должен означать любой вектор нуклеиновой кислоты, известный в данной области. Такие векторы включают, но не ограничиваются этим, плазмидные векторы, космидные векторы и векторы бактериофагов.
Термины "вещество-кандидат" и "исследуемое соединение" используются взаимозаменяемо и относятся к веществу, которое, как предполагается, взаимодействует с другим остатком, то есть с белком atpE, в качестве модификатора биологической реакции. Например, репрезентативное вещество-кандидат, как предполагается, взаимодействует с белком atpE и, как предполагается, модифицирует активность ATP-азы. Примеры веществ-кандидатов, которые могут быть исследованы с использованием способов по настоящему изобретению, включают, но не ограничиваются ими, пептиды, ферменты, субстраты ферментов, кофакторы, сахара, олигонуклеотиды, малые молекулы химических соединений и моноклональные антитела.
"Модулировать" должно означать увеличение, уменьшение или другое изменение каких-либо или всех химических и биологических активностей или свойств белка atpE дикого типа или мутантного.
"Взаимодействовать" должно означать детектируемые взаимодействия между молекулами, включая "связывающие" взаимодействия между молекулами. Взаимодействия могут представлять собой, например, взаимодействие белок-белок или белок-нуклеиновая кислота в природе. Такие взаимодействия могут быть выявлены с использованием методик, известных в данной области, например, двухгибридным анализом на дрожжах, иммунопреципитацией, анализом SPA или анализом связывания на фильтре.
Как здесь используется, термин "атомные координаты" или "структурные координаты" относится к математическим координатам, которые описывают положения атомов в формате Protein Data Bank (PDB), включая X, Y, Z и B, для каждого атома. Специалисты в данной области понимают, что набор структурных координат, определенных с помощью рентгеновской кристаллографии, не обходится без стандартной ошибки. Для целей настоящего изобретения любой набор структурных координат для ATP-синтазы из любого источника, имеющий среднеквадратичное отклонение для атомов, отличных от водорода, менее чем 1,5 Å, когда он накладывается на положение соответствующих атомных координат для атомов, отличных от водорода, из таблиц 3, 4, 5, 6 или 7, рассматривается как по существу идентичный или гомологичный. В более предпочтительном варианте осуществления, любой набор структурных координат для ATP-синтазы из любого источника, имеющий среднее квадратичное отклонение для атомов, отличных от водорода, менее чем 0,75 Å, когда он накладывается на положение соответствующих атомных координат атомов, отличных от водорода, из таблиц 3, 4, 5, 6 или 7, рассматривается как по существу идентичный.
Варианты осуществления изобретения
Мутантные белки atpE
Настоящее изобретение обеспечивает выделенные мутантные белки atpE, в частности бактериальные белки atpE, более конкретно, микобактериальные белки atpE, еще более конкретно, белки atpE M.tuberculosis или M.smegmatis. Мутация выбирается из единственной точечной мутации, инсерции или делеции. В одном из вариантов осуществления настоящего изобретения мутация состоит, по меньшей мере, из одной точечной мутации, расположенной в любой из аминокислот 20-40, в частности 30-40, предпочтительно, в аминокислоте 34 или в аминокислотах 60-75, в частности 62-73, предпочтительно, в аминокислоте 69, как показано в сравнении последовательностей на фиг.2. В дополнительном варианте осуществления выделенные мутантные белки atpE выбираются из Mtb_R (SEQ ID No.2), Msm_R09 (SEQ ID No.4) и Msm_R10 (SEQ ID No.5), как показано на фиг.2, или из аминокислотной последовательности, имеющей, по меньшей мере, 70, 80, 90, 95, 97 или 98% идентичность последовательности с любой из указанных выше аминокислотных последовательностей.
Кроме того, настоящее изобретение обеспечивает выделенную нуклеиновую кислоту, кодирующую указанные мутантные белки atpE. В одном из вариантов осуществления указанная последовательность нуклеиновой кислоты состоит из всех генов, которые кодируют часть F0, как описано, например, в J. Biol. Chem., 1994, Vol. 269(10), p.7285-7289, где указанные гены транскрибированы из одного промотора и содержат последовательность нуклеиновой кислоты, кодирующую мутантный белок atpE по настоящему изобретению. Нуклеиновая кислота может представлять собой ДНК или РНК, предпочтительно ДНК, и в дополнительном варианте осуществления они выбираются из последовательностей нуклеиновых кислот, кодирующих Mtb_R (SEQ ID No.7), Msm_R09 (SEQ ID No.9), Msm_R10 (SEQ ID No.10), или последовательности нуклеиновой кислоты, имеющей, по меньшей мере, 70, 80, 90, 95, 97 или 98% идентичность последовательности с любой из указанных выше последовательностей нуклеиновых кислот.
Процент идентичности последовательностей нуклеиновых кислот и полипептидов может быть вычислена с использованием коммерчески доступных алгоритмов, которые сравнивают эталонную последовательность с запрашиваемой последовательностью. Следующие далее программы (поставляемые National Center for Biotechnology Information) могут использоваться для определения гомологий/идентичностей: BLAST, BLAST с пропусками, BLASTN и PSI-BLAST, которые могут использоваться с параметрами по умолчанию.
Алгоритм GAP (Genetics Computer Group, Madison, WI) использует алгоритм Needleman and Wunsch для сравнения двух полных последовательностей, который доводит до максимума количество совпадений и сводит к минимуму количество пропусков. Как правило, используются параметры по умолчанию со штрафом при образовании пропуска = 12 и штрафом при расширении пропуска = 4.
Другой способ для определения наилучшего общего совпадения между последовательностью нуклеиновой кислоты или ее частью и исследуемой последовательностью представляет собой использование компьютерной программы FASTDB, основанной на алгоритме Brutlag et al (Comp. App. Biosci., 6; 237-245 (1990)). Программа обеспечивает общее сравнение последовательностей. Результат указанного общего сравнения последовательностей выражается в проценте идентичности. Подходящие параметры, используемые при поиске FASTDB последовательности ДНК, для вычисления процента идентичности представляют собой: Matrix (Матрица)=унитарная, k-tuple=4 (Кортеж из k=4 элементов), Mismatch Penalty (Штраф за несовпадение)=1, Joining Penalty (Штраф за сращивание)=30, Randomization Group Length (Длина группы рандомизации)=0, Cutoff Score (Балл отбрасывания)=1, Gap Penalty (Штраф за пропуск)=5, Gap Size Penalty (Штраф за размер пропуска)=0,05 и Window Size (Размер окна)=500 или длине исследуемой последовательности в нуклеотидных основаниях, то, что короче. Подходящие параметры для вычисления процента идентичности и сходства сравнения аминокислот представляют собой: Matrix=PAM 150, k-tuple=2, Mismatch Penalty=1, Joining Penalty=20, Randomization Group Length=0, Cutoff Score=1, Gap Penalty=5, Gap Size Penalty=0,05 и Window Size=500 или длине исследуемой последовательности в нуклеотидных основаниях, то, что короче.
Кроме того, настоящее изобретение предоставляет вектор, содержащий рассматриваемую нуклеиновую кислоту. В одном из вариантов осуществления вектор представляет собой плазмидный вектор.
Кроме того, настоящее изобретение предусматривает систему хозяин-вектор, содержащую клетку-хозяин, имеющую рассматриваемый плазмидный вектор. Клетка может быть прокариотической или эукариотической, в одном из вариантов осуществления клетка-хозяин представляет собой бактериальную клетку, в частности микобактериальную клетку, такую как, например, M.tuberculosis или M.smegmatis.
Кроме того, настоящее изобретение обеспечивает выделенную клетку, содержащую мутантный белок atpE, который индуцирует антимикробную устойчивость в клетке. В одном из вариантов осуществления выделенная клетка состоит из клетки M.smegmatis, трансформированной с помощью мутантного микобактериального белка atpE, в частности трансформированную с помощью мутантного микобактериального белка atpE, где мутация состоит, по меньшей мере, из одной точечной мутации, расположенной в любой из аминокислот 20-40, в частности 30-40, предпочтительно, в аминокислоте 34 или в аминокислотах 60-75, в частности 62-73, предпочтительно, в аминокислоте 69, как показано в сравнении последовательностей на фиг.2.
Способы скрининга
Кроме того, настоящее изобретение обеспечивает способ идентификации антимикробного соединения, включающий стадии
(a) контактирования клетки, экспрессирующей белок atpE, с исследуемым соединением в физиологических условиях;
(b) определения того, взаимодействует ли исследуемое соединение с белком atpE.
В одном из вариантов осуществления белок atpE, используемый в указанном выше способе, состоит из бактериального белка atpE, в частности микобактериального белка, и, как предполагается, включает как белки atpE дикого типа, так и также мутантные белки atpE, как описано здесь выше. В дополнительном варианте осуществления настоящего изобретения, микобактериальный белок atpE, используемый в указанном выше способе, состоит из мутантного микобактериального белка atpE в соответствии с настоящим изобретением. В конкретном варианте осуществления указанного выше анализа используется клетка-хозяин, трансформированная с помощью мутантного белка atpE по настоящему изобретению, и взаимодействие исследуемого соединения с указанным белком atpE оценивается путем определения возможного ингибирования ферментативной активности F1F0-ATP-азы, содержащей указанный мутантный белок atpE. Ингибирование активности F1F0-ATP-азы определяется с использованием методик, известных в данной области, например добавлением вещества в систему, содержащую F1F0-ATP-азу и ATP, в качестве субстрата, с детектированием ферментативной активности путем объединения продуцирования ADP с окислением NADH посредством реакций пируваткиназы и лактатгидрогеназы.
В одном из вариантов анализа, белок atpE может использоваться в анализе связывания. Анализы связывания могут быть конкурентными или неконкурентными. Такой анализ может быть приспособлен для быстрого скрининга большого количества соединений, для определения того, какие соединения способны связываться с полипептидами, если они есть.
В этом контексте, настоящее изобретение предусматривает способ идентификации того, связывается ли исследуемое соединение с выделенным белком atpE по настоящему изобретению, и таким образом, является ли оно потенциальным антимикробным соединением, причем указанный способ включает:
a) контактирование клеток, экспрессирующих белок atpE, где такие клетки обычно не экспрессируют указанный белок atpE, с исследуемым соединением, в присутствии и в отсутствие соединения, о котором известно, что оно связывает белок atpE,
b) определение связывания исследуемого соединения с белком atpE, с использованием соединения, о котором известно, что оно связывает белок atpE, в качестве эталона.
Связывание исследуемого соединения или соединения, о котором известно, что оно связывает белок atpE, упоминаемого также ниже как эталонное соединение, оценивается с использованием известных в данной области способов исследования взаимодействий белок-лиганд. Например, такое связывание может быть измерено посредством использования меченого вещества или эталонного соединения. Исследуемое соединение или эталонное соединение, в частности соединение J (фиг.1), можно метить любым удобным способом, известным в данной области, например радиоактивно, флуоресцентно или ферментативно. В конкретном варианте осуществления указанного выше способа, соединение, о котором известно, что оно связывает белок atpE, также известное как эталонное соединение, метят для детектирования и указанная метка используется для определения связывания исследуемого соединения с белком atpE. Указанное эталонное соединение метят, используя радиоактивную метку, флуоресцентную метку или ферментативную метку, более предпочтительно, радиоактивную метку.
В альтернативном варианте осуществления настоящего изобретения, указанные выше анализы связывания осуществляют на клеточной композиции, то есть на клеточном экстракте, клеточной фракции или органеллах клеток, содержащих белок atpE, как определено выше. Более конкретно, указанные выше анализы связывания осуществляют на клеточной композиции, то есть на мембранном препарате, содержащем белок atpE, как определено здесь, где указанная клеточная композиция, то есть мембранный препарат, получен из клеток M.smegmatis, трансформированных с помощью мутантного микобактериального белка atpE, в частности трансформированных с помощью мутантного микобактериального белка atpE, где мутация состоит, по меньшей мере, из одной точечной мутации, расположенной в одной из аминокислот 20-40, в частности 30-40, предпочтительно, в аминокислоте 34 или в аминокислотах 60-75 в частности, 62-73, предпочтительно, в аминокислоте 69, как показано в сравнении последовательностей на фиг.2. Принимая нумерацию Mtb_S (SEQ ID No.1) или Mtb_R (SEQ ID No.2) в качестве эталона, указанные выше области соответствуют аминокислотам 14-34, в частности 24-34, предпочтительно, в аминокислоте 28 или аминокислотах 54-69, в частности 56-67, предпочтительно, в аминокислоте 63.
В одном из вариантов осуществления анализы связывания осуществляют с использованием мембранных препаратов. Эти мембранные препараты могут использоваться в обычных анализах связывания на фильтре (например, с использованием оборудования для анализа на фильтре Brandel) или при высокопроизводительных анализах связывания типа метода близости сцинтилляций (технология SPA и Cytostar-T flashplate; Amersham Pharmacia Biotech) для детектирования связывания радиоактивно-меченных лигандов atpE (включая 3H-меченый DARQ) и замещения таких радиоактивно-меченных лигандов конкурентами за сайт связывания. Радиоактивность может быть измерена с помощью Packard Topcount или сходного инструмента, способного к осуществлению быстрых измерений в форматах 96-, 384-, 1536-луночных микротитровальных планшетов. Технология SPA/Cytostar-T является особенно пригодной для высокопроизводительного скрининга, и по этой причине эта технология является подходящей для использования при скрининге соединений, способных к замещению стандартных лигандов.
Другой подход к исследованию связывания лигандов с белком atpE в окружающей среде, приблизительно воспроизводящей нативную ситуацию, использует эффект поверхностного плазменного резонанса, применяемый инструментом Biacore (Biacore). Белок atpE в мембранных препаратах или в цельных клетках может присоединяться к биосенсорному чипу Biacore, и связывание лигандов исследуется в присутствии и в отсутствие соединений для идентификации конкурентов за сайт связывания.
Молекулярное моделирование
Кроме того, настоящее изобретение предусматривает способ оценки потенциала исследуемого соединения для взаимодействия с белком atpE, включающий:
(a) использование методов молекулярного моделирования для составления трехмерной структуры белка atpE;
(b) использование компьютерных средств для осуществления операции совмещения исследуемого соединения и трехмерной структуры белка atpE; и
(c) анализ результатов указанной операции совмещения для количественного определения ассоциации исследуемого соединения с трехмерной структурой белка atpE.
Методы молекулярного моделирования известны в данной области и включают как аппаратное обеспечение, так и программное обеспечение, пригодное для создания и использования моделей рецепторов и конформаций ферментов.
Многочисленные компьютерные программы являются доступными и подходящими для способов компьютерного моделирования, построения моделей и компьютерной идентификации, выбора и оценки потенциальных соединений, взаимодействующих с atpE, в способах, описанных здесь. Они включают, например, GRID (доступную от Oxford University, UK), MCSS (доступную от Accelrys, Inc., San Diego, CA), AUTODOCK (доступную от Oxford Molecular Group), FLEX X (доступную от Tripos, St Louis. MO), DOCK (доступную от University of California, San Francisco, CA), CAVEAT (доступную от University of California, Berkeley), HOOK (доступную от Accelrys, Inc., San Diego, CA) и системы 3-мерных баз данных, такие как MACCS-3D (доступную от MDL Information Systems, San Leandro, CA), UNITY (доступную от Tripos, St. Louis. MO) и CATALYST (доступную от Accelrys, Inc., San Diego, CA). Потенциальные вещества-кандидаты могут быть также сконструированы с помощью компьютера "de novo" с использованием пакетов программного обеспечения, таких как LUDI (доступного от Biosym Technologies, San Diego, CA), LEGEND (доступного от Accelrys, Inc, San Diego, CA) и LEAPFROG (доступного от Tripos, St. Louis. MO). Энергия деформации соединения и электростатическое отталкивание могут анализироваться с использованием таких программ, как GAUSSIAN 92, AMBER, QUANTA/CHARMM и INSIGHT H/DISCOVER. Эти методы компьютерной оценки и моделирования могут осуществляться на любом соответствующем аппаратном обеспечении, включая, например, рабочие станции, доступные от Silicon Graphics, Sun Microsystems, и другие. Эти методы моделирования, методы, аппаратное обеспечение и пакеты программного обеспечения являются репрезентативными и не предназначены в качестве полного их перечисления. Другие методы моделирования, известные в данной области, также могут использоваться в соответствии с настоящим изобретением. См., например, N.C. Cohen, Molecular Modeling in Drug Design, Academic Press (1996).
В одном из вариантов осуществления настоящего изобретения трехмерная структура белка atpE генерируется с использованием атомных координат Ile28, Glu61 и Ile63 E. coli (Protein Database 1Q01) +/- среднеквадратичное отклонение атомов основной цепи указанных аминокислот не более чем 10 Å, предпочтительно не более чем 5 Å.
Как приведено далее в примерах, целью настоящего изобретения является создание трехмерной структуры белка atpE. В таблицах 6 и 7 приводятся атомные координаты для белка atpE мутантного и дикого типа с SEQ ID No.2 и SEQ ID No.1. Таким образом, в одном из вариантов осуществления трехмерная структура белка atpE генерируется с использованием атомных координат из таблиц 6 или 7. В конкретном варианте осуществления трехмерная структура белка atpE генерируется с использованием атомных координат из таблицы 7. Соединение DARQ J ингибирует взаимодействие Arg186 субъединицы A с Glu61 субъединицы C в его депротонированной форме. Соответственно целью настоящего изобретения является обеспечение использования атомных координат из таблиц 6 или 7 в способе оценки потенциала исследуемого соединения к взаимодействию с белком atpE.
Сайт связывания
В другом варианте осуществления настоящего изобретения предусматривается характеризация сайта связывания в части F0 ATP-азы. Этот сайт связывания, идентифицируемый как способный к связыванию с соединением DARQ J, как обнаружено, совпадает с областями, идентифицированными до этого, как сайты придающих устойчивость мутаций в белках atpE M.tuberculosis и M.smegmatis (17). Следовательно, настоящее изобретение предоставляет сайт связывания в части F0 ATP-азы, отличающийся тем, что он содержит сайты придающих устойчивость мутаций белка atpE. Сайты придающих устойчивость мутаций, как здесь используется, относятся к аминокислотам 14-34, в частности 24-34, и к аминокислотам 53-69, в частности 56-67 белка atpE, принимая нумерацию Mtb_S (SEQ ID No.1) или Mtb_R (SEQ ID No.2) в качестве эталона.
В дополнительном варианте осуществления сайт связывания содержит, по меньшей мере, аминокислоты Ala24, Gly27, Phe53, Val57, Gly58, Glu61, Tyr64 и Phe65 одной субъединицы C и аминокислоты Ser182, Leu183, Leu185 и Arg186 одной субъединицы A (имеющие для субъединицы A, коды Ser 206 - Leu 207-Leu 209 и Arg 210 в таблицах 3, 4 и 5), где указанные аминокислоты имеют атомные координаты одной из таблиц 3, 4 или 5, или гомологичные структурные координаты, содержащие среднеквадратичное отклонение атомов, отличных от водорода, меньше, чем примерно 1,5 Å, предпочтительно, не более чем 0,75 Å, когда накладываются на положения соответствующих атомных координат атомов, отличных от водорода, из таблиц 3, 4 или 5. В конкретном варианте осуществления сайт связывания содержит аминокислоты Ala21, Gly25 первой субъединицы C; аминокислоты Ala24, Gly27, Phe53, Phe54, Val57, Gly58, Glu61, Tyr64, Phe65 второй субъединицы C; аминокислоты Met17, Gly19, Gly20, Ala21, Ile22, Gly23, Ala24, Gly25, Ile26, Gly27, Asp28, Gly29, Ala31, Phe53, Thr56, Val57, Gly58, Leu59, Val60, Glu61, Ala62, Ala63/Pro63, Tyr54, Phe65 третьей субъединицы C и аминокислоты Leu183, Leu185 и Arg186 субъединицы A; где указанные аминокислоты имеют атомные координаты любой из таблиц 3, 4 или 5, или гомологичные структурные координаты, содержащие среднеквадратичное отклонение для атомов, отличных от водорода, меньшее, чем примерно 1,5 Å, предпочтительно не более чем 0,75 Å, когда накладываются на положение соответствующих атомных координат для атомов, отличных от водорода, из таблиц 3, 4 или 5. В еще более конкретном варианте осуществления сайт связывания состоит из аминокислот Ala21, Gly25 первой субъединицы C; аминокислот Ala24, Gly27, Phe53, Phe54, Val57, Gly58, Glu61, Tyr64, Phe65 второй субъединицы C; аминокислот Met17, Gly19, Gly20, Ala21, Ile22, Gly23, Ala24, Gly25, Ile26, Gly27, Asp28, Gly29, Ala31, Phe53, Thr56, Val57, Gly58, Leu59, Val60, Glu61, Ala62, Ala63/Pro63, Tyr64, Phe65 третьей субъединицы C и аминокислот Leu183, Leu185 и Arg186 субъединицы A; где указанные аминокислоты имеют атомные координаты любой из таблиц 3, 4 или 5. В наиболее конкретном варианте осуществления сайт связывания состоит из аминокислот Ala21, Gly