Средство для лечения болезни паркинсона
Иллюстрации
Показать всеИзобретение относится к области медицины и фармацевтики и касается применения 3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола, его изомеров и производных в качестве средства для лечения болезни Паркинсона. Средство обладает высокой активностью, низкой токсичностью и может быть получено из доступного природного соединения а-пинена. 7 табл.
Реферат
Изобретение относится к области медицины, а именно к новым лекарственным средствам, которые могут применяться для лечения болезни Паркинсона.
Болезнь Паркинсона - одно из наиболее распространенных неврологических заболеваний с преимущественно двигательными нарушениями, обусловленное в основном утратой дофаминсодержащих клеток нигростриального пути. Число людей, страдающих болезнью Паркинсона, составляет 1% среди взрослого населения в возрасте до 60 лет, 5-10% - в группе 60-80-летних [1]. Лечение болезни Паркинсона проводят длительно, иногда в течение всей жизни пациентов, комбинируя между собой различные препараты, в основном дофаминомиметики и центральные холиноблокаторы.
Для лечения болезни Паркинсона применяются разные по механизму действия вещества. Более широко и чаще применяются средства, в состав которых входит предшественник дофамина L-ДОФА (леводопа, карбидопа, наком). Эти средства используются как заместительная терапия, т.к. данное заболевание связано с уменьшением уровня дофамина. Применяются также средства, снижающие стимулирующее действие кортикальных глутаматных рецепторов, которое развивается на фоне снижения уровня дофамина (мидантан), либо агонисты дофаминовых (периферических) рецепторов (ропинирол), ингибиторы МАО-В (селегин) и центральные холиноблокирующие средства.
Основным средством для лечения болезни Паркинсона, эффективно снимающим симптомы болезни, является леводопа. Противопаркинсоническое действие леводопы обусловлено ее превращением в дофамин непосредственно в ЦНС, что приводит к восполнению дефицита дофамина в ЦНС. Так как в мозг, где леводопа и оказывает лечебный эффект, попадает только 1-3% от введенной дозы лекарства, то леводопу обычно комбинируют с ингибиторами периферической ДОФА-карбоксилазы (карбидопа и т.д.), что позволяет увеличить долю попадающей в мозг леводопы до 10% [2].
Недостатками препаратов, содержащих леводопу, являются [1, 2]: 1) низкий процент эффективности (при первичном назначении препарат высокоэффективен у 1/3 пациентов и менее эффективен еще у 1/3, остальные либо не переносят препарат, либо не испытывают никакого эффекта); 2) наличие большого количества побочных эффектов (анорексия, рвота, тахикардия, дискинезия, возникающая почти у 80% пациентов, психические нарушения и т.д.); 3) колебания реакции на препарат, заключающиеся во флуктуации двигательных симптомов (синдром «включения-выключения»); 4) привыкание - через 3-4 года терапии эффективность леводопы часто снижается, вплоть до полной потери чувствительности, вне зависимости от исходного состояния пациента в начале лечения, поэтому лечения умеренно выраженного паркинсонизма стараются избегать до тех пор, пока симптомы заболевания не начнут оказывать существенное влияние на образ жизни пациента; в то же время показано [2], что раннее начало терапии снижает смертность из-за болезни Паркинсона.
Для снижения дозы и уменьшения побочных эффектов леводопу обычно комбинируют с другими препаратами, которые, однако, не устраняют полностью указанные недостатки [1, 2], а без леводопы эти препараты не достаточно эффективны.
Что касается веществ, которые известны как проявляющие некоторое потенцирующее влияние на дофаминергическую систему, то наличие такого свойства не позволяет утверждать, что указанное соединение будет оказывать существенное влияние на дофаминергическую систему без L-Дофа и тем более обладать противопаркинсонической активностью.
Таким образом, поиск и создание новых малотоксичных антипаркинсонических средств продолжают оставаться актуальными в настоящее время.
Мы показали, что в качестве эффективного малотоксичного агента для лечения болезни Паркинсона может рассматриваться соединение общей формулы 1, включая его пространственные изомеры, в том числе оптически активные
где R1, R2 могут быть одинаковыми или отличаться и могут быть атомом водорода, остатком C1-С6-карбоновой кислоты, образующим сложноэфирную группу (незамещенным или замещенным атомами галогена, атом галогена может быть любым, выбранным из F, Cl, I, Br).
Соединение 1a (где R1=R2=H) было получено и описано в статьях [3, 4], данные о его противопаркинсонической активности в литературе отсутствуют.
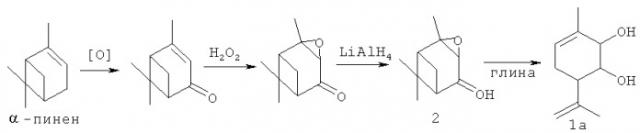
Соединение 1а может быть синтезировано в соответствии со схемой 1, исходя из широкораспространенного в отечественном растительном сырье монотерпена α-пинена с использованием доступных реагентов [3], или другими способами (например, в соответствии с работой [4]).
Схема 1.
Для получения соединения общей формулы 1 в виде различных стереоизомеров, в том числе и оптически активном виде, можно, например, использовать в качестве исходных веществ различные пространственные изомеры исходных соединений, в том числе и обладающие оптической активностью.
Синтез соединений общей формулы 1, где и/или R1, и/или R2≠Н может быть осуществлен из соединения 1а или другими способами.
Для изучения противопаркинсонической активности in vivo широко используется 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (МФТП), вызывающий развитие болезни Паркинсона у людей, обезьян, крыс, мышей [2, 5-7].
Индукцию паркинсонического синдрома осуществляли путем однократного или многократного внутрибрюшинного введения МФТП в дозе 30 мг/кг на мышах-самцах линии С57В1/6 и крысах линии Вистар.
Противопаркинсоническая активность соединения общей формулы 1 изучалась in vivo на модели болезни Паркинсона, индуцированной введением МФТП. В качестве эталона сравнения использовалась леводопа (L-ДОФА).
Противопаркинсоническую активность агентов оценивали по олигокинезии по двигательно-ориентировочной активности в установке TruScan (США) или по проценту летальности.
Показано, что соединение (1R,2R,6S)-1а с энантиомерным избытком (ее) 60%, соответствующем энантиомерному избытку в коммерчески доступном вербеноне и распространенном в отечественном растительном сырье α-пинене, в дозах 10, 20 и 30 мг/кг проявляет выраженную противопаркинсоническую активность на мышах при однократном и многократном введении МФТП, проявляющуюся в усилении двигательной активности (общей двигательной активности, пройденной дистанции, скорости движения, времени двигательной активности) животного, а также в улучшении эмоционального состояния (увеличение количества исследованных отверстий). Наибольший эффект наблюдался при использовании агента в дозе 20 мг/кг.
Агент (1R,2R,6S)-1a с ее 60% в дозе 20 мг/кг проявляет выраженную противопаркинсоническую активность на крысах при тридцатидневном введении агентов и МФТП, проявляющуюся в усилении двигательной активности (общей двигательной активности, пройденной дистанции, скорости движения, времени двигательной активности) животного, а также в улучшении эмоционального состояния (увеличение количества исследованных отверстий и количества вертикальных вставаний).
Агент (1R,2R,6S)-1a с ее 60% в этих тестах в дозе 20 мг/кг не уступает по эффективности препарату сравнения леводопе.
Показано, что стереохимическое строение соединения общей формулы 1 оказывает значительное влияние на его противопаркинсоническую активность. Например, хотя агенты (1R,2R,6S)-1a с ее 94% и (1S,2S,6R)-1а с ее 97% в дозе 20 мг/кг проявляют выраженную противопаркинсоническую активность при однократном введении МФТП, наибольший эффект наблюдался при использовании агента (1R,2R,6S)-1a.
Показано, что соединения общей формулы 1, где и/или R1, и/или R2≠Н также могут обладать противопаркинсонической активностью. Например, агент (1R,2R,6S)-1б (R1=R2=Ac) с ее 60% в дозе 20 мг/кг проявляет выраженную противопаркинсоническую активность при однократном и многократном введении МФТП, проявляющуюся в усилении двигательной активности животного, а также в улучшении эмоционального состояния.
Острая токсичность соединения 1а определялась на белых беспородных мышах массой 20-22 г при однократном внутрижелудочном введении по методу Кербера. Показано, что соединение 1а является умеренно токсичным веществом: LD50 составляет 4250 мг/кг.
Таким образом, можно заключить, что соединение общей формулы 1 сочетает низкую токсичность с высокой противопаркинсонической активностью, не уступающей препарату сравнения леводопе, и может после проведения соответствующих испытаний использоваться в чистом виде или в качестве компонента новых высокоэффективных лекарственных форм для лечения болезни Паркинсона. Назначаемые разовые дозы будут варьировать в зависимости от пола, возраста, веса, тяжести заболевания и могут составлять предпочтительно от 1 до 500 мг.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез 3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола 1а на глине асканит-бентонит
К суспензии 0.5 г глины асканит-бентонит, прокаленной в течение 3 ч при 120°С, в 8 мл CH2Cl2 прибавили раствор 0.200 г эпоксида вербенола 2 в 7 мл CH2Cl2, перемешивали 40 минут при 20°С. Добавили 5 мл диэтилового эфира. Катализатор отфильтровали, растворитель упарили. Полученную реакционную смесь делили на колонке с 10 г силикагеля, элюент - раствор диэтилового эфира в гексане от 10 до 90%. Получали 0.094 г (47%) 3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола 1а.
Пример 2. Синтез (1R,2R,6S)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола ((1R,2R,6S)-1a) с ее 60% на глине К10
К суспензии 30.0 г глины К10 (Fluka), прокаленной в течение 3 ч при 110°С, в 200 мл CH2Cl2 прибавили при перемешивании раствор 11.50 г эпоксида (-)-цис-вербенола (1R,2R,4S,5R,6S)-2 в 150 мл CH2Cl2. Реакционную смесь перемешивали 1 ч при 22°С. Катализатор отфильтровали, промыли этилацетатом, растворитель отогнали. Остаток делили колоночной хроматографией на силикагеле, элюент - раствор этилацетата в гексане от 5 до 100%. Получили 5.10 г (44%) (1R,2R,6S)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола ((1R,2R,6S)-1) (ее 60%, . Энантиомерную чистоту соединения 1а определяли по данным ГЖХ-МС на хиральной колонке.
Пример 3. Синтез (1R,2R,6S)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола ((1R,2R,6S)-1а) с ее 94% на глине К 10
К суспензии 2.00 г глины К10 (Fluka), предварительно прокаленной в течение 3 ч при 110°С, в 15 мл хлористого метилена прибавили при перемешивании раствор 945 мг эпоксида (-)-цис-вербенола (1R,2R,4S,5R,6S)-2 ([α]D 25=-85.6 (с 0.82, CHCl3)) в 12 мл хлористого метилена. Реакционную смесь перемешивали 1 ч при комнатной температуре. Катализатор отфильтровали, промыли этилацетатом, растворитель отогнали. Остаток делили колоночной хроматографией на SiO2 (60-200 µ; Merck), элюент - раствор диэтилового эфира в гексане от 5 до 100%. Получили 270 мг (29%) (1R,2R,6S)-1a (ее 94%, ([α]D 27=-84.0 (с 3.47, CHCl3)). Энантиомерную чистоту соединения 1а определяли по данным ГЖХ-МС на хиральной колонке.
Пример 4. Синтез (1S,2S,6R)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола ((1S,2S,6R)-1a) с ее 94% на глине К10
К суспензии 2.00 г гины К10 (Fluka), предварительно прокаленной в течение 3 ч при 110°С, в 15 мл хлористого метилена прибавили при перемешивании раствор 850 мг (5.05 ммоль) эпоксида (+)-цис-вербенола (1S,2S,4R,5S,6R)-2 в 12 мл хлористого метилена. Реакционную смесь перемешивали 1 ч при комнатной температуре. Катализатор отфильтровали, промыли этилацетатом, растворитель отогнали. Остаток делили колоночной хроматографией на SiO2 (60-200 µ; Merck), элюент - раствор диэтилового эфира в гексане от 5 до 100%. Получили 333 мг (39%) (1S,2S,6R)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола (1S,2S,6R)-1а (ее 97%, [α]D 23+82.7 (с 0.726, CHCl3)). Энантиомерную чистоту соединения 1а определяли по данным ГЖХ-МС на хиральной колонке.
Пример 5. Синтез (1S,2R,6S)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола ((1S,2R,6S)-1а) с ее 94% на глине К10
К суспензии 1.00 г глины К10, предварительно прокаленной в течение 3 ч при 110°С, в 8 мл хлористого метилена прибавили при перемешивании раствор 425 мг эпоксида (-)-транс-вербенола (1R,2R,4S,5S,6S)-2 ([α]D 29=-118.6 (с 4.44, CHCl3)) в 7 мл хлористого метилена. Реакционную смесь перемешивали 1 ч при комнатной температуре. Катализатор отфильтровали, промыли этилацетатом, растворитель отогнали. Остаток делили колоночной хроматографией на SiO2 (60-200 µ; Merck), элюент - раствор диэтилового эфира в гексане от 5 до 100%. Получили 75 мг (11%) (1S,2R,6S)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола (1S,2R,6S)-1а (ее 94%, [α]D 29=-90.1 (с 6.10, CHCl3)). Энантиомерную чистоту соединения 1а определяли по данным ГЖХ-МС на хиральной колонке.
Пример 6. Синтез диацетата (1R,2R,6S)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола (1R,2R,6S)-1б
К 168 мг соединения (1R,2R,6S)-1а добавили 6 мл эфира, 1.00 мл триэтиламина, 0.50 мл уксусного ангидрида и один кристалл N,N-4-диметиламинопиридина (DMAP). Через 4 часа промыли смесь 2×10 мл 3.5% HCl, 2×10 мл 5% NaHCO3 и 10 мл воды, сушили над MgSO4, растворитель отогнали. Получили 252 мг (100%) диацетата (1R,2R,6S)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола (1R,2R,6S)-1б). [α]D 27=-77.0 (с 6.87, CHCl3). Спектр ЯМР 1H в CDCl3, δ, м. д. (J, Гц): 1.64 д. д. д. (С10Н3, J10,5a′ 2.2 Гц, J10,4 1.5 Гц, J10,5e′ 1.5 Гц), 1.74 ш. с. (C9H3), 1.96 с. и 2.07 с. (С12Н3, С14Н3), 2.03 д. д. д. к. (Н5е′, J5e′,5a′ 16.5 Гц, J5e′,4 5.0 Гц, J5e′,6a 4.5 Гц, J5e′,10 1.5 Гц), 2.28 д. д. д. к. д. (Н5а′, J5a′,5e′ 16.5 Гц, J5a′,6a 11.0 Гц, J5a′,4 2.2 Гц, J5a′,10 2.2 Гц, J5a′2е′ 1.2 Гц), 2.38 ш. д. д. (H6a, J6a,5а′ 11.0 Гц, J6a,5e′ 4.5 Гц), 4.69 ш. с. и 4.81 м. (2 Н8), 5.10 уш. д. (Н2е′,J2e′,1е′ 3.0 Гц), 5.15 д. д. (Н1е, J1e,2e′ 3.0 Гц, J1e,6a 1.5 Гц), 5.76 д. д. к. (Н4, J4,5е′ 5.0 Гц, J4,5a′ 2.2 Гц, J4,l0 1.5 Гц).
Пример 7. Исследование противопаркинсонической активности (1R,2R,6S)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола ((1R,2R,6S)-1a) с ее 60% на мышах при однократном введении нейротоксина.
Эксперименты проводились на мышах-самцах линии С57В1/6 в группах по 10 мышей. Индукцию паркинсонического синдрома осуществляли путем внутрибрюшинного введения МФТП в дозе 30 мг/кг, группе интактного контроля вводили физраствор. Агент в дозах 10 и 20 мг/кг вводили перорально через 15 минут после воспроизведения модели паркинсонического синдрома. Олигокинезию оценивали через 1.5 часа после инъекции МФТП по двигательно-ориентировочной активности в установке TruScan (США) в течение 3 минут.
Результаты экспериментов приведены в Таблице 1.
| Таблица 1 | |||||||
| Исследование противопаркинсонической активности соединения (1R,2R,6S)-1a с ее 60% на мышах при однократном введении МФТП | |||||||
| Группа, доза | А | Б | В | Г | Д | Е | Ж |
| Контроль I, физ. р-р | 82±1.97** | 66.6±2.31*** | 309.3±17.94*** | 2.54±0.14*** | 4.7±0.96 | 2.1±0.56 | 11.6±1.4** |
| Контроль II, МФТП 30 мг/кг | 59±3.8 | 39.8±5.8 | 171.4±37 | 1.3±0.3 | 4.9±0.9 | 2.5±0.5 | 5±1.6 |
| МФТП 30 мг/кг и (1R,2R,6S)-1а, 10 мг/кг | 77.2±5** | 57±5.3* | 257.3±29.5 | 2.1±0.25 | 7.7±1.07 | 3.6±0.7 | 5.8±0.6 |
| МФТП 30 мг/кг и (1R,2R,6S)-1а, 20 мг/кг | 80.7±4** | 59±4** | 276.5±24* | 2.25±0.2* | 7.6±1.7 | 4.4±1 | 8.5±2 |
| *Р<0.05; **Р<0.01; ***Р<0.001 достоверность по сравнению с контрольной группой II | |||||||
| А - общая двигательная активность (кол-во актов); Б - двигательная активность (сек); В - дистанция движения (см); Г - скорость движения (см/сек); Д - количество исследованных отверстий; Е - время исследовательских реакций (сек); Ж - количество вертикальных вставаний. |
В результате эксперимента показано, что агент (lR,2R,6S)-1a с ее 60% в дозах 10 и 20 мг/кг проявляет выраженную противопаркинсоническую активность при однократном введении МФТП, проявляющуюся в усилении двигательной активности (общей двигательной активности, пройденной дистанции, скорости движения, времени двигательной активности) животного, а также в улучшении эмоционального состояния (увеличение количества исследованных отверстий). Наибольший эффект наблюдался при использовании агента в дозе 20 мг/кг.
Пример 8. Исследование противопаркинсонической активности (1R,2R,6S)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола ((1R,2R,6S)-1a) с ее 60% на мышах при трехдневном введении нейротоксина.
Эксперименты проводились на мышах-самцах линии С57В1/6 в группах по 10 мышей. Индукцию паркинсонического синдрома осуществляли путем внутрибрюшинного введения МФТП в дозе 30 мг/кг в течение трех дней. Агент (1R,2R,6S)-1a с ее 60% в дозах 20 и 30 мг/кг вводили перорально через 24 часа после последней инъекции МФТП. Олигокинезию оценивали через 1 час после введения агента по двигательно-ориентировочной активности в установке TruScan (США) в течение 3 минут.
Результаты экспериментов приведены в Таблице 2.
| Таблица 2 | |||||||
| Исследование противопаркинсонической активности соединения (lR,2R,6S)-1a с ее 60% на мышах при трехдневном введении МФТП | |||||||
| Группа, доза | А | Б | В | Г | Д | Е | Ж |
| Контроль, МФТП 30 мг/кг | 43.4±4.7 | 55.5±6.0 | 264.5±34.8 | 2.2±0.3 | 1.8±0.6 | 1±0.3 | 12.2±2.0 |
| МФТП 30 мг/кг и (1R,2R,6S)-1а, 20 мг/кг | 81.9±3.7** | 70.1±3.9* | 351.8±26.4* | 2.9±0.2 | 8.8±1.0*** | 3.9±0.5*** | 11.1±0.9 |
| МФТП 30 мг/кг и (1R,2R,6S)-1а, 30 мг/кг | 81.8±2.6** | 66.8±3.7 | 335.5±28.9 | 2.7±0.2 | 3.8±0.6* | 1.6±0.3 | 13±1.7 |
| *Р<0.05; **Р<0.01; ***Р<0.001 достоверность по сравнению с контрольной группой | |||||||
| А - общая двигательная активность (кол-во актов); Б - двигательная активность (сек); В - дистанция движения (см); Г - скорость движения (см/сек); Д - количество исследованных отверстий; Е - время исследовательских реакций (сек); Ж - количество вертикальных вставаний. |
В результате эксперимента показано, что агент (lR,2R,6S)-la с ее 60% в дозах 20 и 30 мг/кг проявляет выраженную противопаркинсоническую активность при трехдневном введении МФТП, проявляющуюся в усилении двигательной активности (общей двигательной активности, пройденной дистанции, скорости движения, времени двигательной активности) животного, а также в улучшении эмоционального состояния (увеличение количества исследованных отверстий). Наибольший эффект наблюдался при использовании агента в дозе 20 мг/кг.
Пример 9. Исследование противопаркинсонической активности (1R,2R,6S)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола ((1R,2R,6S)-1a) с ее 60% на мышах при десятидневном введении нейротоксина и агента.
Эксперименты проводились на мышах-самцах линии С57 В1/6 в группах по 10 мышей. Индукцию паркинсонического синдрома осуществляли путем внутрибрюшинного введения МФТП в дозе 30 мг/кг ежедневно в течение 10 дней. Агент (1R,2R,6S)-1a с ее 60% в дозе 20 мг/кг или леводопу (L-ДОФА) в дозе 10 мг/кг (препарат сравнения) вводили перорально через 4 часа после инъекции МФТП ежедневно в течение 10 дней. Эффект оценивали по количеству выживших животных на 11 день эксперимента.
Результаты экспериментов приведены в Таблице 3.
| Таблица 3 | |||
| Исследование противопаркинсонической активности соединения (1R,2R,6S)-1a с ее 60% на мышах при десятидневном введении агентов и МФТП | |||
| Контроль, МФТП 30 мг/кг | МФТП 30 мг/кг и (1R,2R,6S)-1a, 20 мг/кг | МФТП 30 мг/кг и L-ДОФА, 10 мг/кг | |
| Летальность, % | 60 | 10 | 20 |
В результате эксперимента показано, что агент (1R,2R,6S)-1а с ее 60% в дозе 20 мг/кг при десятидневном введении агентов и МФТП значительно снижает летальность, проявляя тем самым выраженную противопаркинсоническую активность. Агент (1R,2R,6S)-1a с ее 60% в этом тесте не уступает по эффективности препарату сравнения леводопе.
Пример 10. Исследование противопаркинсонической активности (1R,2R,6S)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола ((1R,2R,6S)-1a) с ее 60% на крысах при тридцатидневном введении нейротоксина и агента.
Эксперименты проводились на крысах линии Вистар в группах по 10 крыс. Индукцию паркинсонического синдрома осуществляли путем внутрибрюшинного введения МФТП в дозе 40 мг/кг ежедневно в течение 30 дней. Группе интактного контроля вводили физиологический раствор. Агент (1R,2R,6S)-1a с ее 60% в дозе 20 мг/кг или препарат сравнения леводопу (L-ДОФА) в дозе 10 мг/кг вводили перорально ежедневно через 4 часа после инъекции МФТП. Олигокинезию оценивали на 30 день после начала эксперимента по двигательно-ориентировочной активности в установке TruScan (США) в течение 3 минут.
Результаты экспериментов приведены в Таблице 4.
| Таблица 4 | |||||||
| Исследование противопаркинсонической активности соединения (1R,2R,6S)-1a с ее 60% на крысах при тридцатидневном введении агентов и МФТП | |||||||
| Группа, доза | А | Б | В | Г | Д | Е | Ж |
| Контроль I, физ. р-р | 80.3±2.5** | 69.68±2.11*** | 367.5±21.2*** | 3.02±0.17*** | 4.6±0.87 | 1.85±0.24 | 14.6±1.82*** |
| Контроль II, МФТП 30 мг/кг | 50.36±7.9 | 27.77±4.78 | 110.4±19.5 | 0.87±0.15 | 2.7±0.99 | 1.57±0.68 | 2.55±0.76 |
| МФТП 30 мг/кг и (1R,2R,6S)-1а, 20 мг/кг | 81.89±5.5** | 62.56±5.2*** | 305.58±30.38*** | 2.5±0.25*** | 4.3±0.73 | 1.75±0.5 | 10.67±1.18*** |
| МФТП 30 мг/кг и L-ДОФА, 10 мг/кг | 86±3.86** | 65.09±2.92*** | 31б.77±16.2*** | 2.57±0.13*** | 4.63±0.56 | 1.66±0.25 | 9.63±1.16*** |
| *Р<0.05; **Р<0.01; ***Р<0.001 достоверность по сравнению с контрольной группой II | |||||||
| А - общая двигательная активность (кол-во актов); Б - двигательная активность (сек); В - дистанция движения (см); Г - скорость движения (см/сек); Д - количество исследованных отверстий; Е - время исследовательских реакций (сек); Ж - количество вертикальных вставаний. |
В результате эксперимента показано, что агент (1R,2R,6S)-1a с ее 60% в дозе 20 мг/кг проявляет выраженную противопаркинсоническую активность при тридцатидневном введении агента и МФТП, заключающуюся в усилении двигательной активности (общей двигательной активности, пройденной дистанции, скорости движения, времени двигательной активности) животного, а также в улучшении эмоционального состояния (увеличение количества исследованных отверстий и количества вертикальных вставаний). Агент (1R,2R,6S)-1a с ее 60% в этом тесте не уступает по эффективности препарату сравнения леводопе.
Пример 11. Исследование противопаркинсонической активности соединений (1R,2R,6S)-1a с ее 94% и (1S,2S,6R)-1a с ее 97% на мышах при однократном введении нейротоксина.
Эксперименты проводились на мышах-самцах линии С57В1/6 в группах по 10 мышей. Индукцию паркинсонического синдрома осуществляли путем внутрибрюшинного введения МФТП в дозе 30 мг/кг, группе интактного контроля вводили физ. раствор. Агенты в дозе 20 мг/кг вводили перорально через 15 минут после воспроизведения модели паркинсонического синдрома. Олигокинезию оценивали через 1.5 часа после инъекции МФТП по двигательно-ориентировочной активности в установке TruScan (США) в течение 3 минут.
Результаты экспериментов приведены в Таблице 5.
| Таблица 5 | |||||||
| Исследование противопаркинсонической активности соединений (1R,2R,6S)-1a с ее 94% и (1S,2S,6R)-1a с ее 97% на мышах при однократном введении МФТП | |||||||
| Группа, доза | А | Б | В | Г | Д | Е | Ж |
| Контроль, МФТП 30 мг/кг | 50.6±8.1 | 27.8±4.8 | 107.8±20.6 | 0.87±0.15 | 2.8±1.0 | 1.6±0.7 | 2.6±0.8 |
| МФТП 30 мг/кг и (1R,2R,6S)-1а, 20 мг/кг | 78.6±5.0** | 64.0±5.5*** | 332.6±39.6*** | 2.7±0.3*** | 3.2±0.9 | 1.5±0.4 | 13.1±2.5*** |
| МФТП 30 мг/кг и (1S,2S,6R)-1а, 20 мг/кг | 57.9±6.0 | 34.9±4.3 | 147.8±20.3 | 1.13±0.15 | 2.5±0.9 | 1.2±0.6 | 4.4±1.4 |
| *Р<0.05; **Р<0.01; ***Р<0.001 достоверность по сравнению с контрольной группой | |||||||
| А - общая двигательная активность (кол-во актов); Б - двигательная активность (сек); В - дистанция движения (см); Г - скорость движения (см/сек); Д - количество исследованных отверстий; Е - время исследовательских реакций (сек); Ж - количество вертикальных вставаний. |
В результате эксперимента показано, что агенты (1R,2R,6S)-1a с ее 94% и (1S,2S,6R)-1a с ее 97% в дозе 20 мг/кг проявляют выраженную противопаркинсоническую активность при однократном введении МФТП, проявляющуюся в усилении двигательной активности (общей двигательной активности, пройденной дистанции, скорости движения, времени двигательной активности) животного. Наибольший эффект наблюдался при использовании агента (1R,2R,6S)-1a.
Пример 12. Исследование противопаркинсонической активности диацетата (1R,2R,6S)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола ((1R,2R,6S)-1б) с ее 60% на мышах при однократном введении нейротоксина.
Эксперименты проводились на мышах-самцах линии С57В1/6 в группах по 10 мышей. Индукцию паркинсонического синдрома осуществляли путем внутрибрюшинного введения МФТП в дозе 30 мг/кг, группе интактного контроля вводили физ. раствор. Агент в дозах 10 и 20 мг/кг вводили перорально через 15 минут после воспроизведения модели паркинсонического синдрома. Олигокинезию оценивали через 1.5 часа после инъекции МФТП по двигательно-ориентировочной активности в установке TruScan (США) в течение 3 минут. Результаты экспериментов приведены в Таблице 6.
| Таблица 6 | |||||||
| Исследование противопаркинсонической активности соединения (1R,2R,6S)-1б с ее 60% на мышах при однократном введении МФТП | |||||||
| Группа, доза | А | Б | В | Г | Д | Е | Ж |
| Контроль, МФТП 30 мг/кг | 59±3.8 | 39.8±5.8 | 171.4±37 | 1.3±0.3 | 4.9±0.9 | 2.5±0.5 | 5±1.6 |
| МФТП 30 мг/кг и (1R,2R,6S)-1б, 10 мг/кг | 69.9±6.7 | 51.5±7.5 | 244.4±4.5 | 2.0±0.4 | 3.4±1.1 | 1.3±0.5 | 6.4±1.6 |
| МФТП 30 мг/кг и (1R,2R,6S)-1б, 20 мг/кг | 84.8±4.4** | 58.8±4.5* | 264.9.5±34.6 | 1.9±0.4 | 3.2±0.5 | 2.0±0.3 | 10.8±1.7** |
| *Р<0.05; **Р<0.01; ***Р<0.001 достоверность по сравнению с контрольной группой | |||||||
| А - общая двигательная активность (кол-во актов); Б - двигательная активность (сек); В - дистанция движения (см); Г - скорость движения (см/сек); Д - количество исследованных отверстий; Е - время исследовательских реакций (сек); Ж - количество вертикальных вставаний. |
В результате эксперимента показано, что агент (1R,2R,6S)-1б с ее 60% в дозах 10 и 20 мг/кг проявляет выраженную противопаркинсоническую активность при однократном введении МФТП, проявляющуюся в усилении двигательной активности (общей двигательной активности, пройденной дистанции, скорости движения и времени двигательной активности) животного. Наибольший эффект наблюдался при использовании агента в дозе 20 мг/кг.
Пример 13. Исследование противопаркинсонической активности диацетата (1R,2R,6S)-3-метил-6-(1-метилэтенил)циклогекс-3-ен-1,2-диола ((1R,2R,6S)-1б) с ее 60% на мышах при трехдневном введении нейротоксина.
Эксперименты проводились на мышах-самцах линии С57В1/6 в группах по 10 мышей. Индукцию паркинсонического синдрома осуществляли путем внутрибрюшинного введения МФТП в дозе 30 мг/кг в течение трех дней. Агент (1R,2R,6S)-1б с ее 60% в дозе 20 мг/кг вводили перорально через 24 часа после последней инъекции МФТП. Олигокинезию оценивали через 1 час после введения агента по двигательно-ориентировочной активности в установке TruScan (США) в течение 3 минут.
Результаты экспериментов приведены в Таблице 7.
| Таблица 7 | |||||||
| Исследование противопаркинсонической активности соединения (1R,2R,6S)-1б с ее 60% на мышах при трехдневном введении МФТП | |||||||
| Группа, доза | А | Б | В | Г | Д | Е | Ж |
| Контроль, МФТП 30 мг/кг | 43.4±4.7 | 55.5±6 | 264.5±34.8 | 2.2±0.3 | 1.8±0.6 | 1±0.3 | 12.2±2 |
| МФТП 30 мг/кг и (1R,2R,6S)-1б, 20 мг/кг | 83.9±3.5** | 64.1±5.0 | 310.0±35.6* | 2.5±0.3 | 6.0±1.0** | 3.2±0.8* | 10.4±1.5 |
| *Р<0.05; **Р<0.01; ***Р<0.001 достоверность по сравнению с контрольной группой | |||||||
| А - общая двигательная активность (кол-во актов); Б - двигательная активность (сек); В - дистанция движения (см); Г - скорость движения (см/сек); Д - количество исследованных отверстий; Е - время исследовательских реакций (сек); Ж - количество вертикальных вставаний. |
В результате эксперимента показано, что агент (1R,2R,6S)-1б с ее 60% в дозе 20 мг/кг проявляет выраженную противопаркинсоническую активность при трехдневном введении МФТП, проявляющуюся в усилении двигательной активности животного, а также в улучшении эмоционального состояния.
Источники информации
1. Венгеровский А.И. Лекции по фармакологии для врачей и провизоров. Томск: STT. 1998. С.181-186.
2. Аминофф М.Д. Фармакотерапия паркинсонизма и других двигательных нарушений. В кн.: Базисная и клиническая фармакология. Т.1. Под ред. Катцунга Б.Г. М.: Бином. 2007. С.539-555.
3. Il'ina I.V., Volcho K.P., Korchagina D.V., Barkhash V.A., Salakhutdinov N.F. Helv. Chim. Acta, 2007, V.90, №2, P.353-368.
4. Ратнер В.В., Исаева З.Г., Поводырева И.П., Горячкина Н.Ф., Ефремов Ю.А., Арбузов Б.А. Окисление 2-карена ацетатом таллия (III). Известия академии наук СССР. Серия химическая. 1983. №8. С.1824-1828.
5. Kawasaki Т., Ago Y., Kitao Т., Nashida Т., Takagi A., Takuma K., Matsuda Т.А neuroprotective agent, T-817MA (1-{3-[2-(1-benzothiophen-5-yl)ethoxy]propyl}azetidin-3-ol maleate), prevents 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-induced neurotoxicity in mice. Neuropharmacology. 2008. V.55. P.654-660.
6. Dingemanse J. Catechol-O-methyltransferase Inhibitors: Clinical Potential in the Treatment of Parkinson′s Disease. Drug Development Research. 1997. V.42. P.1-25.
7. Quik М., Bordia Т., O'Leary К. Nicotinic receptors as CNS targets for Parkinson′s disease. Biochemical Pharmacology. 2007. V.74. P.1224-1234.
Применение соединения общей формулы 1, включая его пространственные изомеры, в том числе оптически активные, где R1, R2 могут быть одинаковыми или отличаться и могут быть атомом водорода, остатком C1-С6-карбоновой кислоты, образующим сложноэфирную группу, незамещенным или замещенным атомами галогена, атом галогена может быть любым, выбранным из F, Сl, I, Вr, в качестве средства для лечения болезни Паркинсона.