Новая гидросульфатная соль
Иллюстрации
Показать всеНастоящее изобретение относится к гидросульфатной соли соединения 1
ее сольватам, кристаллических формам и аморфным формам, а также к способу их получения. Кроме того, изобретение относится к применению данной соли в изготовлении лекарственного средства, для лечения болезненных состояний, опосредованных МЕК, и к способам лечения данных состояний. 4 н. и 12 з.п., 3 табл., 3 ил.
Реферат
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Родственная заявка
Настоящая заявка утверждает приоритет предварительной заявки США №60/752781, поданной 21 декабря 2005 года, которая включена в данное описание изобретения путем этой ссылки по всей своей полноте.
Область изобретения
Настоящее изобретение относится к новой соли и, более конкретно, к новой соли (2-гидроксиэтокси)амида 6-(4-бром-2-хлорфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты (далее называемого как "соединение 1"), которая представляет собой ингибитор МЕК (киназа митогенактивируемой протеинкиназы), полезный в лечении и/или профилактике профилеративных болезненных состояний, таких как рак, у млекопитающего. Более конкретно настоящее изобретение относится к гидросульфатной соли соединения 1 и способам получения указанной соли. Также предложены фармацевтические композиции, содержащие гидросульфатную соль соединения 1, и применение этой соли в изготовлении лекарственных средств для лечения и/или профилактики пролиферативных болезненных состояний, таких как рак, в организме человека или животного и способы лечения пролиферативных болезненных состояний, таких как рак, у млекопитающего путем введения терапевтически эффективного количества гидросульфатной соли соединения 1.
Описание состояния предшествующего уровня техники
Передача сигналов в клетках через рецепторы факторов роста и протеинкиназы является важным регулятором клеточного роста, пролиферации и дифференциации. При нормальном клеточном росте факторы роста посредством активации рецепторов (то есть PDGF (тромбоцитарный фактор роста) или EGF (эпидермальный фактор роста) или другие) активируют MAP (митогенактивируемая протеинкиназа)-киназные пути метаболизма. Одним из наиболее важных и наиболее хорошо изученных МАР-киназных путей, вовлеченных в нормальный и неконтролируемый клеточный рост, является Ras/Raf-киназный путь метаболизма. Активный GTP (гуанозин-трифосфат)-связанный Ras приводит к активации и непрямому фосфорилированию киназы Raf. Затем Raf фосфорилирует МЕК1 и 2 по двум остаткам серина (S218 и S222 для МЕК1 и S222 и S226 для МЕК2) (Ann et al., Methods in Enzymology, 2001, 332: 417-431). Далее активированная MEK фосфорилирует единственные известные субстраты, МАР-киназы ERK1 и 2. Фосфорилирование ERK посредством МЕК происходит по Y204 и Т202 для ERK1 и Y185 и Т183 для ERK2 (Ahn et al., Methods in Enzymology 2001, 332: 417-431). Фосфорилированная ERK димеризуется и затем транслоцируется в ядро, где происходит ее накопление (Khokhlatchev et al., Cell 1998, 93: 605-615). В ядре ERK вовлечена в ряд важных клеточных функций, включая ядерный транспорт, трансдукцию сигнала, репарацию ДНК, сборку и транслокацию нуклеосом, процессинг и трансляцию транспортной РНК, но не ограничивается ими (Ahn et al., Molecular Cell, 2000, 6: 1343-1354). В целом, обработка клеток факторами роста приводит к активации ERK1 и 2, что вызывает пролиферацию и в некоторых случаях дифференциацию (Lewis et al., Adv. Cancer Res. 1998, 74: 49-139).
При пролиферативных заболеваниях генетические мутации и/или сверхэкспрессия рецепторов факторов роста, нижерасположенных сигнальных белков или протеинкиназ, вовлеченных в ERK-киназный путь метаболизма, приводит к неконтролируемой клеточной пролиферации и, в итоге, к образованию опухоли. Например, некоторые виды рака содержат мутации, вызывающие постоянную активацию этого пути вследствие непрерывной выработки факторов роста. Другие мутации могут являться причиной дефектов в дезактивации активированного комплекса GTP-связанного Ras, что снова приводит к активации МАР-киназного пути. Мутированные онкогенные формы Ras обнаружены в 50% случаев рака ободочной кишки и более 90% случаев рака поджелудочной железы, а также при многих других типах рака (Kohl et al., Science, 1993, 260: 1834-1837). Недавно bRaf мутации были обнаружены более чем в 60% случаев злокачественной меланомы (Davies, Н., et al., Nature 2002, 417: 949-954). Эти мутации в bRaf приводят к конститутивно-активному МАР-киназному каскаду. Изучения образцов первичных опухолей и клеточных линий также показали конститутивную или повышенную активацию МАР-киназного пути метаболизма при раке поджелудочной железы, ободочной кишки, легкого, яичника и почки (Hoshino, R. et al., Oncogene 1999, 18: 813-822). Следовательно, существует строгая взаимосвязь между видами рака и повышенной активацией МАР-киназного пути метаболизма, происходящей в результате генетических мутаций.
Так как конститутивная или повышенная активация МАР-киназного каскада играет решающую роль в клеточной пролиферации и дифференциации, то полагают, что ингибирование этого пути будет оказывать благоприятное воздействие при гиперпролиферативных заболеваниях. МЕК является ключевым участником в этом пути, поскольку расположена ниже Ras и Raf. Кроме того, она является привлекательной терапевтической мишенью, поскольку единственными известными субстратами фосфорилирования МЕК являются МАР-киназы, ERK1 и 2. В отдельных исследованиях было показано, что ингибирование МЕК оказывает потенциальное терапевтическое благоприятное воздействие. Например, было показано, что ингибиторы МЕК, представляющие собой небольшие молекулы, подавляют рост человеческих опухолей в ксенотрансплантатах бестимусных мышей с мутацией nude (Sebolt-Leopold et al., Nature-Medicine 1999, 5(7): 810-816; Trachet et al., AACR April 6-10, 2002, Poster #5426; Tecle, H., IBC 2nd International Conference of Protein Kinases, September 9-10, 2002), блокируют статическую аллодинию у животных (WO 01/05390) и ингибируют рост клеток при остром миелоидном лейкозе (Milella et al., J. Clin. Invest. 2001, 108 (6): 851-859).
Известны ингибиторы МЕК, представляющие собой небольшие молекулы. За последние несколько лет появилось по меньшей мере тринадцать заявок на патент: US 5525625; WO 98/43960; WO 99/01421; WO 99/01426; WO 00/41505; WO 00/42002; WO 00/42003; WO 00/41994; WO 00/42022; WO 00/42029; WO 00/68201; WO 01/68619 и WO 02/06213.
Ингибиторы МЕК также описаны в WO 03/077914. (2-Гидроксиэтокси)-амид 6-(4-бром-2-хлорфениламино)-7-фтор-3-метил-3Н-бензимидазол-5-карбоновой кислоты, или "соединение 1", приведен в качестве примера в WO 03/077914 и обладает следующей структурной формулой:
соединение 1
Было показано, что соединение 1 обладает ингибирующей активностью в отношении МЕК и, следовательно, полезно в лечении гиперпролиферативного заболевания, такого как рак.
В WO 03/077914 раскрыты, в общих чертах, некоторые фармацевтически приемлемые соли соединений, описанных там. В частности, в WO 03/077914 утверждается, что фармацевтически приемлемые соли раскрытых там соединений, обладающих достаточно основной группировкой и которые могут образовывать соли присоединения кислот, содержат фармацевтически приемлемые анионы, и ряд таких анионов перечислен. Аналогично, подходящие соли соединений, обладающих кислотной группировкой, следует получать путем обработки соединения основным соединением, в частности неорганическим основанием.
Удобной формой фармацевтически активного соединения, применяемой в лекарственных средствах, является форма, которая предусматривает подходящие технологические свойства, позволяющие обрабатывать ее и приготавливать фармацевтическую композицию. Однако также необходимо обеспечить оптимальные биологические свойства конечной композиции, такие как скорость растворения таблеток и биодоступность активного ингредиента, и часто при выборе конкретной формы, которая наилучшим образом отвечает всем этим различным требованиям, приходится идти на компромиссы. Однако в некоторых случаях соли образуются не просто и/или являются нестабильными вероятно вследствие низких значений рКа. Значение рКа выражает силу кислоты и основания, то есть склонность кислоты к потере протона или основания к присоединению протона (Bronsted J.N., Rec. Trav. Chim. (1923) 47: 718). В частности, это справедливо для соединения 1.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложены гидросульфатная соль (лекарство:H2SO4 1:1) соединения 1 и ее различные формы, которые все включены в объем изобретения. Соль может находиться в различных формах, которые все включены в объем изобретения. Эти формы включают как безводные формы, так и сольваты. Дополнительная форма может быть получена путем десольватации сольватов. В конкретном воплощении соль находится в безводной форме.
Согласно дополнительному аспекту настоящего изобретения предложен способ применения гидросульфатной соли соединения 1 в качестве лекарственного средства для лечения гиперпролиферативного заболевания или состояния.
Дополнительный аспект изобретения представляет собой применение гидросульфатной соли соединения 1 в получении лекарственного средства для лечения или предотвращения гиперпролиферативного заболевания или состояния.
Дополнительные преимущества и новые признаки этого изобретения частично будут изложены в следующем ниже описании и частично будут очевидны специалистам в данной области техники после изучения следующего ниже подробного изложения или могут быть понятны при практическом использовании изобретения. Преимущества этого изобретения могут быть реализованы и достигнуты с помощью средств, комбинаций, композиций и способов, конкретно указанных в прилагаемой формуле изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Сопроводительные рисунки, которые включены здесь и образуют часть подробного изложения, иллюстрируют неограничивающие воплощения этого изобретения и совместно с описанием служат для объяснения принципов настоящего изобретения.
В графических материалах:
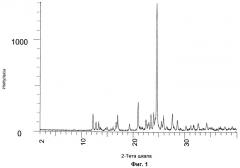
на Фиг.1 показана дифракция рентгеновских лучей на порошке (XRPD) гидросульфатной соли соединения 1;
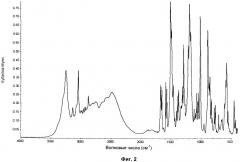
на Фиг.2 показан инфракрасный спектр гидросульфатной соли соединения 1, полученный с использованием метода отбора проб инфракрасной спектроскопии диффузного отражения с преобразованием Фурье (DRIFTS, Diffuse Reflectance Infrared Fourier Transform Spectroscopy), и
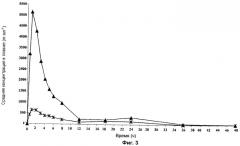
на Фиг.3 представлены результаты уровней концентрации соединения 1 в плазме после введения собакам натощак пероральных дисперсных доз соединения 1 (×) и гидросульфатной соли (▲), эквивалентных 150 мг свободного основания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Ниже будет представлена подробная ссылка на некоторые воплощения этого изобретения, примеры которых проиллюстрированы в сопутствующих структурах и формулах. Хотя настоящее изобретение будет описано в комбинации с пронумерованными воплощениями, следует понимать, что они не предназначены для ограничения изобретения этими воплощениями. Наоборот, подразумевается, что изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем настоящего изобретения, как оно определено формулой изобретения. Специалист в данной области техники узнает множество способов и материалов, подобных или эквивалентных описанным здесь, которые могли бы быть использованы при практическом осуществлении настоящего изобретения. Настоящее изобретение никоим образом не ограничено описанными способами и материалами. В случае, если один или более чем один включенный литературный источник, патент и подобный материал отличается от этой заявки или противоречит ей, включая оговоренные термины, употребление терминов, описанные методики или тому подобное, но не ограничиваясь ими, то настоящая заявка имеет преимущественную силу.
Согласно настоящему изобретению предложена гидросульфатная соль (лекарство к H2SO4 1:1) соединения 1 и ее различные формы, которые все включены в объем изобретения. Соль может находиться в различных формах, которые все включены в объем изобретения. Эти формы включают как безводные формы, так и сольваты. Дополнительная форма может быть получена путем десольватации сольватов. В конкретном воплощении соль представляет собой безводную гидросульфатную соль соединения 1. Дополнительно, в настоящем изобретении предложена гидросульфатная солевая форма соединения 1, которая демонстрирует уникальные физические и фармацевтические свойства, что делает ее особенно подходящей для применения в лекарственных средствах.
В некоторых воплощениях соли соединения 1 являются кристаллическими. Было обнаружено, что кристаллические соли лучше свободного основания исходя из их технологических свойств, с производственной точки зрения, в частности их статических и реологических свойств. Образование солей может предусмотреть метод очистки, так как можно отделить примеси, образовавшиеся в процессе, а соли обычно легче выделить, чем свободное основание.
В одном воплощении изобретения гидросульфатная соль соединения 1 представляет собой кристаллическую соль, которая, как было неожиданно обнаружено, обладает улучшенными фармацевтическими свойствами по сравнению со свободным основанием соединения 1 и некоторыми другими солевыми формами соединения 1. В частности, скорость растворения этой кристаллической соли, а также ее биодоступность, как было обнаружено, особенно высоки по сравнению со свободным основанием и другими солями, что проиллюстрировано в примерах ниже. Увеличенная биодоступность гидросульфатной соли соединения 1 по сравнению со свободным основанием, как было показано, не зависит от фармацевтической композиции, применяемой для введения. Биодоступность свободного основания и гидросульфатных форм сравнивали в этом описании изобретения после дозирования в одинаковых дисперсных композициях, но аналогичные различия в биодоступности также наблюдали и для простых таблеточных композиций.
Если утверждается, что настоящее изобретение относится к соли соединения 1, которая является кристаллической солью, то удобно, чтобы степень кристалличности была более чем приблизительно 60%, более удобно - более чем приблизительно 80%, предпочтительно - более чем приблизительно 90% и более предпочтительно - более чем приблизительно 95%. Наиболее предпочтительно степень кристалличности выше, чем приблизительно 98%.
Величина увеличенной биодоступности, предлагаемая гидросульфатной солью, является неожиданной и очень полезной, так как свободное основание соединения 1 классифицируется как соединение Класса 4 BCS (биофармацевтическая классификационная система). Соединения Класса 4 BCS обычно имеют низкую биодоступность вследствие как низкой скорости растворения, так и проницаемости, а ограничение проницаемости при абсорбции означает, что от таких солей обычно не стоит ожидать проявления существенного влияния на абсорбцию (Смотри, например, Dressman et al. (2001) Pharm Tech. July: 68).
Подходящие сольваты гидросульфатной соли соединения 1 образуются из широкого ряда растворителей, в частности органических растворителей, таких как тетрагидрофуран (ТГФ), ацетонитрил (АЦН), этанол (ЕtOН) и метанол (МеОН). Подходящие органические растворители включают сложные эфиры, такие как C1-6 алкиловые сложные эфиры, например этилацетат, и кетоны, такие как С1-6 алкилкетоны, например метилэтилкетон (2-бутанон).
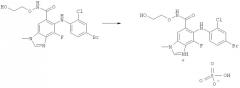
Получение соли может быть осуществлено путем взаимодействия суспензии соединения 1 в органическом растворителе и воде с серной кислотой. Для получения соли 1:1 используют приблизительно 1 эквивалент серной кислоты. Таким образом, в дополнительном аспекте изобретения предложен способ получения гидросульфатной соли соединения 1, включающий:
1) взаимодействие суспензии соединения 1 в органической жидкости и воде с приблизительно 1 эквивалентом серной кислоты;
2) выделение соли из получаемого раствора; и
3) после этого, если желательно или необходимо, образование ее сольвата.
Молярное отношение количества серной кислоты к количеству соединения 1 является подходящим в диапазоне от 1,00:1 до 2:1, например в диапазоне от 1,05:1 до 1,15:1. Применение серной кислоты в форме концентрированной серной кислоты является подходящим. В конкретном воплощении молярное отношение серной кислоты к соединению 1 составляет 1,10:1,0.
Подходящее количество воды, добавляемое на стадии (1), ограничено тем количеством, которое необходимо для обеспечения образования соли. Точные применяемые количества будут зависеть от конкретной природы растворителя, концентрации серной кислоты и так далее, но обычно вода будет присутствовать в количестве менее чем 20% (об./об.) от общего количества присутствующей жидкости, например от 13-17% (об./об.).
В конкретном воплощении органический растворитель, применяемый на стадии (1), представляет собой 2-бутанон (метилэтилкетон), вода составляет приблизительно 15% от объема жидкости, и общее количество применяемой жидкости относительно соединения 1 составляет около 8 мл на грамм соединения 1.
Подходящим является осуществление добавления серной кислоты на стадии (1) контролируемым способом, например при температуре ниже 10°С, а остальную часть стадии (1) затем осуществляют при повышенной температуре, например при 30-90°С, как дополнительный пример - в диапазоне между 55-75°С и как еще один дополнительный пример - при приблизительно 65°С.
Подходящие органические жидкости включают органические растворители, в которых соединение 1 и его соли умеренно растворимы. Выражение "умеренно растворимы", используемое в данном описании изобретения, означает имеющие растворимость менее чем 100 мл растворителя на грамм растворенного вещества, например между 30 и 100 мл растворителя на грамм растворенного вещества. Такие растворители включают алкилкетоны, например С1-6 алкилкетоны, такие как 2-бутанон, спирты, такие как C1-6 спирты, например метанол или этанол, и сложные эфиры, такие как С1-6 алкиловые эфиры, например этилацетат. В одном воплощении органический растворитель представляет собой метилэтилкетон (2-бутанон).
Подходящим является фильтрование реакционной смеси между стадиями (1) и (2) для удаления каких-либо примесей. Остаток, возможно, промывают, например, смесью органической жидкости и воды, и желаемую соль кристаллизуют из фильтрата, который может быть возможно объединен с промывным раствором.
В некоторых воплощениях гидросульфатную соль выделяют на стадии (2) путем охлаждения реакционной смеси, возможно, при добавлении дополнительной органической жидкости, так что гидросульфатная соль выпадает в осадок. Дополнительная органическая жидкость может быть такой же органической жидкостью, которая применялась на стадии (1), или она может быть другой органической жидкостью при условии, что действует на гидросульфатную соль соединения 1 как антирастворитель. Затравка раствора кристаллами гидросульфатной соли соединения 1 может способствовать процессу осаждения.
В одном из воплощений до охлаждения фильтрат сначала подвергают стадии дистилляции для удаления воды и обеспечения выделения соли с приемлемым выходом. В конкретном воплощении растворитель представляет собой 2-бутанон и фильтрат перегоняют при атмосферном давлении.
После охлаждения из получаемой суспензии может быть выделена соль, например, фильтрованием. Выделенный материал затем может быть высушен, например, при повышенной температуре, например от 40-60°С, и в качестве другого примера - при приблизительно 50°С, до достижения постоянной массы. Если продукт представляет собой сольват с органической жидкостью, такой как метанол, то он на этой стадии при желании может быть десольватирован путем нагревания.
Физические свойства гидросульфатной соли были исследованы и далее описаны в примерах.
Настоящее изобретение также включает соединения, меченные изотопами, которые идентичны изложенным в настоящем изобретении, но в которых один или более чем один атом заменен атомом, имеющим атомную массу или атомное число, отличающиеся от атомной массы или атомного числа, которые обычно встречаются в природе. Примеры изотопов, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как 2Н, 3Н, 13С, 14С, 15N, 18O, 17O, 31Р, 32Р, 35S, 18F и 36Cl соответственно. Гидросульфатная соль соединения 1 и ее полиморфные формы, которые содержат упомянутые выше изотопы и/или другие изотопы других атомов находятся в объеме этого изобретения. Некоторые соединения по настоящему изобретению, меченные изотопами, например такие, в которые включены радиоактивные изотопы, такие как 3Н и 14С, полезны в анализах распределения лекарственного средства и/или субстрата в тканях. Тритиевые изотопы, то есть 3Н, и углерод-14, то есть 14С, являются особенно широко используемыми вследствие легкости их получения и детектирования. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, то есть 2Н, может давать некоторые терапевтические преимущества, вытекающие из повышенной метаболической стабильности, например увеличенный период полувыведения in vivo или потребность в сниженной дозировке, и следовательно, может использоваться в некоторых конкретных обстоятельствах. Соли по настоящему изобретению, меченные изотопами, обычно могут быть получены посредством осуществления методик, раскрытых в WO 03/077914, путем замещения реагента, немеченного изотопом, легко доступным реагентом, меченным изотопом, в процессе получения соли, или, при желании, путем использования серной кислоты, меченной изотопом, при получении соли.
Композиция может находиться в форме подходящей для перорального введения (например, в виде таблеток, лепешек, твердых или мягких капсул, эмульсий, диспергируемых порошков или гранул, сиропов, эликсиров или масляных, или приготовленных для немедленного приема водных суспензий), для введения путем ингаляции (например, в виде мелкоизмельченного порошка или жидкого аэрозоля), для введения путем инсуффляции (например, в виде мелкоизмельченного порошка), для парентеральной инъекции (например, в виде стерильного раствора, суспензии или эмульсии для внутривенной, подкожной, внутримышечной, внутрисосудистой или инфузионной дозировки), для местного введения (например, в виде кремов, мазей, гелей, масляных растворов или суспензий или приготовленных для немедленного приема водных суспензий) или для ректального введения (например, в виде суппозитория). В одном из воплощений гидросульфатную соль соединения 1 вводят перорально. Композиции, упомянутые выше, обычно могут быть получены традиционным способом с применением общепринятых эксципиентов.
Количество вводимого активного соединения будет зависеть от субъекта, подвергаемого лечению, тяжести расстройства или состояния, скорости введения, наличия соединения в распоряжении и выбора лечащего врача. Тем не менее, эффективная дозировка находится в диапазоне от приблизительно 0,01 до приблизительно 100 мг на кг массы тела в течение суток, предпочтительно от приблизительно 1 до приблизительно 35 мг/кг/сутки, в однократной или разделенных дозах. Для человека массой 70 кг это количество будет составлять от приблизительно 0,7 до 7000 мг/сутки, предпочтительно от приблизительно 70 до приблизительно 2500 мг/сутки. В некоторых случаях уровни дозировок ниже нижнего предела упомянутого выше диапазона могут быть более чем достаточными, в то время как в других случаях могут быть использованы более высокие дозы без какого либо вредного побочного эффекта при условии, что такие увеличенные дозы сначала делят на несколько малых доз для введения в течение дня. Стандартная лекарственная форма, такая как таблетка или капсула, обычно будет содержать, например, 1-1000 мг активного ингредиента и предпочтительно 5-420 мг активного ингредиента. Предпочтительно применяют суточную дозу в диапазоне 0,03-6 мг/кг.
Согласно дополнительному аспекту настоящего изобретения предложена гидросульфатная соль соединения 1, как она определена здесь, для применения в способе лечения или профилактики организма человека или животного путем терапии. Дополнительным признаком настоящего изобретения является гидросульфатная соль соединения 1, как она определена здесь, для применения в качестве лекарственного средства. В дополнительном аспекте настоящего изобретения предложена гидросульфатная соль соединения, как она определена здесь, для применения в качестве лекарственного средства для лечения болезненных состояний, опосредованных МЕК, в частности пролиферативных расстройств, или аномального клеточного роста, такого как рак, у теплокровного млекопитающего, такого как человек. Соответственно, согласно дополнительному аспекту изобретения предложено применение гидросульфатной соли соединения 1, как она определена здесь, в изготовлении лекарственного средства для применения в лечении болезненных состояний, опосредованных МЕК, в частности пролиферативных расстройств, или аномального клеточного роста, такого как рак, у теплокровного млекопитающего, такого как человек.
Согласно дополнительному признаку изобретения предложен способ лечения болезненных состояний, опосредованных МЕК, в частности пролиферативных расстройств, или аномального клеточного роста, такого как рак, у теплокровного млекопитающего, такого как человек, нуждающегося в таком лечении, включающий введение указанному млекопитающему эффективного количества гидросульфатной соли соединения 1, как она определена здесь, или фармацевтической композиции, как она определена здесь.
Конкретные примеры пролиферативных расстройств, которые можно лечить, применяя соли или композиции по изобретению, включают гиперпролиферативные расстройства млекопитающего. Конкретными видами рака являются рак головного мозга, легкого, чешуйчато-клеточный, пузыря, желудка, поджелудочной железы, молочной железы, головы, шеи, ренальный, почки, яичника, предстательной железы, колоректальный, эзофагеальный, рак яичка, гинекологический рак или рак щитовидной железы.
Однако соединения и композиции по изобретению также можно применять в лечении неракового гиперпролиферативного расстройства, такого как доброкачественная гиперплазия кожи (например, псориаз), рестеноз или гиперплазия предстательной железы (например, доброкачественная гипертрофия предстательной железы (ВРН)).
Другие примеры заболеваний, опосредованных МЕК, которые можно лечить, применяя соединения или композиции по изобретению, включают панкреатит или почечное заболевание (включая пролиферативный гломерулонефрит и заболевание почек, вызванное диабетом) или боль у млекопитающего.
Соединения и композиции также можно применять для предупреждения имплантации бластоцитов у млекопитающего или для лечения заболевания, связанного с образованием и развитием сосудов или ангиогенезом у млекопитающего. Такие заболевания могут включать опухолевый ангиогенез, хроническое воспалительное заболевание, такое как ревматоидный артрит, атеросклероз, воспалительное заболевание кишечника, кожные заболевания, такие как псориаз, экзема и склеродермия, диабет, диабетическую ретинопатию, ретролентальную фиброплазию, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Капоши и рак яичника, молочной железы, легкого, поджелудочной железы, предстательной железы, ободочной кишки и эпидермоидный рак.
Термины "аномальный клеточный рост" и "гиперпролиферативное расстройство" применяются в настоящей заявке взаимозаменяемым образом и относятся к клеточному росту, который не зависит от нормальных регуляторных механизмов (например, утрате контактного ингибирования). Он включает, например, аномальный рост: (1) опухолевых клеток (опухолей), которые пролиферируют путем экспрессии мутированной тирозинкиназы или сверхэкспрессии рецепторной тирозинкиназы; (2) доброкачественных и злокачественных клеток при других пролиферативных заболеваниях, при которых происходит абберантная активация тирозинкиназы; (3) любых опухолей, которые пролиферируют посредством рецепторных тирозинкиназ; (4) любых опухолей, которые пролиферируют путем абберантной активации серин/треонинкиназы; и (5) доброкачественных и злокачественных клеток других пролиферативных заболеваний, при которых происходит активация серин/треонинкиназы.
Термин "лечение", используемый в данном описании изобретения, если не указано особо, означает изменение направления, облегчение, ингибирование прогрессирования или предупреждение расстройства или состояния, в отношении которых такой термин применяется, или одного или более чем одного симптома такого расстройства или состояния. Термин "лечение", используемый в данном описании изобретения, если не указано особо, также относится к акту лечения, определенному непосредственно выше как "лечение".
Таким образом, пациенты, которых можно лечить соединениями или композициями по настоящему изобретению, включают, например, пациентов, которым был поставлен диагноз псориаз, рестеноз, атеросклероз, ВРН, рак легкого, немелкоклеточный рак легкого, рак кости, CMML (хронический миеломоноцитарный лейкоз), рак поджелудочной железы, колоректальный рак, рак кожи, рак головы и шеи, меланома (в частности, кожная или внутриглазная меланома), рак матки, рак яичника, рак прямой кишки, рак анальной области, рак желудка, рак ободочной кишки, рак молочной железы, рак яичка, гинекологические опухоли (например, саркомы матки, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища или карцинома вульвы), рак яичника, множественная миелома, гепатоцеллюларная карцинома, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы (например, рак щитовидной железы, паращитовидной железы или надпочечников), саркомы мягких тканей, рак уретры, рак пениса, рак предстательной железы, хронический или острый лейкоз, в частности острый миелоидный лейкоз, солидные опухоли в детстве, лимфоцитарные лимфомы, рак мочевого пузыря, рак почки или мочеточника (например, почечно-клеточный рак, карцинома почечной лоханки) или неоплазмы центральной нервной системы (ЦНС) (например, первичная лимфома ЦНС, опухоли оси позвоночника, глиомы ствола головного мозга или аденомы гипофиза).
Гидросульфатную соль соединения 1 можно применять в качестве единственной терапии или она может включать, в дополнение к гидросульфатной соли соединения 1, одно или более чем одно вещество и/или лечение. Такого совместного лечения можно достичь путем одновременного, последовательного или раздельного введения индивидуальных компонентов лечения. В области медицинской онкологии является нормальной практикой применение комбинации различных форм лечения для лечения каждого пациента с раком. В медицинской онкологии другим(и) компонентом(ами) такого совместного лечения, в дополнение к гидросульфатной соли соединения 1, могут быть хирургия, радиотерапия или химиотерапия. Такая химиотерапия может охватывать такие категории терапевтического агента, как:
(1) антиангиогенные агенты, такие как агенты, которые ингибируют эффекты фактора роста эндотелия сосудов (VEGF) (например, антитело против фактора роста эндотелиальных клеток сосудов бевацизумаб [Avastin™] и ингибиторы VEGF рецепторной тирозинкиназы, такие как 4-(4-бром-2-фторанилино)-6-метокси-7-(1-метилпиперидин-4-илметокси)хиназолин (ZD6474; Пример 2 в WO 01/32651), 4-(4-фтор-2-метилиндол-5-илокси)-6-метокси-7-(3-пирролидин-1-илпропокси)хиназолин (AZD2171; Пример 240 в WO 00/47212), ваталаниб (РТК787; WO 98/35985) и SU 11248 (сунитиниб; WO 01/60814), такие соединения, как раскрытые в международных заявках на патент WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354, и такие, которые работают по механизмам, отличным от механизмов, описанных здесь (например, линомид, ингибиторы функции интегрина αvβ3, ангиостатин, разоксин, талидомид, ингибиторы ММР-2 (матриксной металлопротеиназы 2), ингибиторы ММР-9 (матриксной металлопротеиназы 9) и ингибиторы СОХ-II (циклооксигеназы II)), и
(2) агенты, нацеленные на сосуды (например, комбретастатин фосфат и соединения, раскрытые в WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и WO 02/08213), и агенты, вызывающие повреждение сосудов, описанные в публикации международной заявки на патент No. WO 99/02166 (например, N-ацетилколхинол-О-фосфат);
(3) цитостатические агенты, такие как антиэстрогены (например, тамоксифен, торемифен, ралоксифен, дролоксифен и иодоксифен), негативные регуляторы эстрогеновых рецепторов (например, фулвестрант), прогестогены (например, ацетат мегестрола), ингибиторы ароматазы (например, анастрозол, летразол, воразол и экземестан), антипрогестогены, антиандрогены (например, флутамид, нилутамид, бикалутамид и ципротерон ацетат), агонисты и антагонисты LHRH (лютеинизирующего гормона высвобождающий гормон) (например, гозерелин ацетат, лейпрорелин и бузерелин), ингибиторы 5α-редуктазы (например, финастерид);
(4) противоинвазивные агенты (например, ингибиторы металлопротеиназы, подобные маримастату, и ингибиторы функционирования рецепторов урокиназного активатора плазминогена или антитела к Heparanese;
(5) ингибиторы функции фактора роста (такие факторы роста включают в себя, например, тромбоцитарный фактор роста и гепатоцитарный фактор роста), такие ингибиторы включают антитела к факторам роста, антитела к рецепторам факторов роста (например, анти-еrbb2-антитело трастузумаб [Herceptin™], антитело к EGFR (рецепторам эпидермального фактора роста) панитумумаб, анти-еrbВ1-антитело цетуксимаб [С225]), а также любые антитела к факторам роста или рецепторам факторов роста, раскрытые Stern et al. в Critical reviews in oncology/haematology, 2005, Vol.54, pp.11-29); такие ингибиторы также включают в себя ингибиторы тирозинкиназы, такие как ингибиторы семейства эпидермальных факторов роста (например, ингибиторы тирозинкиназы семейства EGFR, такие как N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолинопропокси)-хиназолин-4-амин (гефитиниб, AZD1839), N-(3-этинилфенил)-6,7-бис (2-метокмиэтокси)хиназолин-4-амин (эрлотиниб, OSI-774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3-морфолинопропокси)хиназолин-4-амин (Cl 1033)), и ингибиторы тирозинкиназы еrbВ2, такие как лапатиниб, ингибиторы семейства гепатоцитарных факторов роста, ингибиторы семейства тромбоцитарных факторов роста, такие как иматиниб, ингибиторы серин/треонинкиназ (например, ингибиторы передачи сигнала Ras/Raf, такие как ингибиторы фарнезилтрансферазы, например сорафениб (BAY 43-9006)), ингибиторы клеточного сигнала посредством МЕК и/или АКТ киназ, ингибиторы c-kit, ингибиторы abl киназы, ингибиторы рецепторной киназы IGF (инсулиноподобного фактора роста); ингибиторы аврора-киназы (например, AZD1152, РН739358, VX-680, MLN8054, R763, МР235, МР529, VX-528 и АХ39459) и ингибиторы циклин-зависимой киназы, такие как ингибиторы CDK2 и/или CDK4;
(6) антипролиферативные/антинеопластические лекарственные средства и их комбинации, применяемые в медицинской онкологии, такие как антиметаболиты (например, антифолаты, такие как метотрексат, фторпиримидины, такие как 5-фторурацил, тегафур, пурин и аналоги аденозина, и цитозинарабинозид, гидроксимочевина или, например, один из антиметаболитов, конкретно раскрытых в заявке на Европейский патент No. 239362, такой как N-(5-[N-(3,4-дигидро-2-метил-4-оксохиназолин-6-илметил)-N-метиламино-2-теноил)-L-глутаминовая кислота]; противоопухолевые антибиотики (например, антрациклины, такие как адриамицин, блеомицин, доксорубицин, дауномицин, эпирубицин и идарубицин, митомицин-С, дактиномицин и митрамицин); производные платины (например, цисплатин и карбоплатин); алкилирующие агенты (например, азотная горчица (nitrogen mustard), мелфалан, хлорамбуцил, бусульфан, циклофосфамид, ифосфамид, нитрозомочевины и тиотепа); антимитотические агенты (например винка-алкалоиды, такие как винкристин, винбластин, виндезин и винорелбин, и таксоиды, такие как таксол и таксотер); ингибиторы топоизомеразы (например, эпидофиллотоксины, такие как этопозид и тенипозид, амсакрин, топотекан, камптотецин и иринотекан); ферменты (например, аспарагиназа) и ингибиторы тимидилат-синтазы (например, ралтитрексед);
и дополнительные типы химиотерапевтического агента, включая:
(7) модификаторы биологического ответа (например, интерферон);
(8) антитела (например, эдреколомаб (edrecolomab));
(9) антисмысловые терапии, например такие, которые направлены на мишени, перечисленные выше, такие как ISIS 2503, и анти-ras антисмысловая терапия;
(10) генотерапевтические подходы, включая, например, подходы для замены аберрантных генов, таких как аберрантный р53 или аберрантный BRCA1 или BRCA2, подходы GDEPT (ферментная пролекарственная терапия, направленная на гены), такие как использующие цитозиндезаминазу, тимидинкиназу или бактериальный фермент нитроредуктазу, и подходы по увеличению переносимости пациентом химиотерапии или лучевой терапии, такие как генная терапия множественной лекарственной ус