Производные нафтиридина
Иллюстрации
Показать всеНастоящее изобретение относится к гетероциклическим производным общей формулы (I)
где R1 представляет собой водород, галоген, циано, низший алкокси или низший алкил; R2 представляет собой арил или 5- или 6-членный гетероарил; R3 представляет собой водород, арил, 5- или 6-членный гетероарил, где арильные, циклоалкильные, гетероциклоалкильные или 5- или 6-членные гетероарильные группы для R2 и R3 могут быть не замещены или замещены галогеном, циано, низшим алкилом, возможно, замещенным одним и более чем одним галогеном, низшим алкокси, S(O)2-алкилом, -C(O)R', где R' представляет собой низший алкил, низший алкокси; а также к его фармацевтически приемлемым солям. Кроме того, изобретение относится к лекарству на основе этих соединений для лечения и предотвращения заболеваний, опосредованных mGluR5 рецептором, и к применению соединений формулы (I) для изготовления лекарств. Технический результат: получены и описаны новые соединения, которые являются антагонистами метаботропных глутаматных рецепторов. 3 н. и 14 з.п. ф-лы.
Реферат
Настоящее изобретение относится к гетероциклическим производным общей формулы
где
R1 представляет собой водород, галоген, циано, низший алкокси, низший алкил или низший алкил, замещенный галогеном, циклоалкил, -(СН2)n-O-низший алкил, -C(O)R', где R' представляет собой низший алкил, низший алкокси или NR2;
R представляет собой водород или низший алкил;
R2 представляет собой арил или 5- или 6-членный гетероарил;
R3 представляет собой водород, OR, NR2, низший алкил, циклоалкил, арил, гетероциклоалкил, 5- или 6-членный гетероарил, C(O)NR2, низший алкил, замещенный галогеном, или -C(O)R', где R' представляет собой низший алкил, низший алкокси или NR2;
где арильные, циклоалкильные, гетероциклоалкильные или 5- или 6-членные гетероарильные группы для R2 и R3 могут быть не замещены или замещены галогеном, циано, низшим алкилом, возможно, замещенным одним и более чем одним галогеном, низшим алкокси, S(O)2-алкилом, S(O)-алкилом, -C(O)R', где R' представляет собой низший алкил, низший алкокси или NR2;
n представляет собой 0,1 или 2;
а также к их фармацевтически приемлемым солям.
Было неожиданно обнаружено, что соединения общей формулы I являются антагонистами метаботропных глутаматных рецепторов. Соединения формулы I отличаются ценными терапевтическими свойствами. Они могут быть использованы при лечении или предотвращении заболеваний, опосредованных mGluR5 рецептором.
Подобные заболевания представляют собой острые и/или хронические неврологические нарушения, в частности острую или хроническую боль, недержание мочи, гастроэзофагеальную рефлюксную болезнь, поражение или расстройство печени, вызванное либо лекарством, либо болезнью, ожирение, синдром ломкой Х-хромосомы или аутизм, острые, травматические и хронические дегенеративные процессы нервной системы, такие как болезнь Альцгеймера, старческое слабоумие, болезнь Паркинсона, хорея Хантингтона, боковой амиотрофический склероз и рассеянный склероз, психиатрические заболевания, такие как шизофрения и тревога, депрессия и наркотическая зависимость.
В центральной нервной системе (ЦНС) передача стимулов происходит через взаимодействие нейромедиатора, посылаемого нейроном, с нейрорецептором.
Глутамат является главным возбуждающим нейромедиатором в мозге и играет решающую роль в целом ряде процессов центральной нервной системе (ЦНС). Рецепторы, зависящие от глутаматных стимулов, делятся на две основные группы. Первую основную группу, а именно группу ионотропных рецепторов, образуют контролируемые лигандом ионные каналы. Метаботропные глутаматные рецепторы (mGluR, от metabotropic glutamate receptors) принадлежат ко второй основной группе и, кроме того, принадлежат семейству рецепторов, связанных с G-белками.
В настоящее время известно восемь разных типов рецепторов mGluR, и некоторые из них еще разделены на подтипы. На основании гомологии их последовательностей, механизмов передачи сигналов и селективности к агонистам эти восемь рецепторов могут быть подразделены на три подгруппы:
mGluR1 и mGluR5 принадлежат к группе I, mGluR2 и mGluR3 принадлежат к группе II и mGluR4, mGluR6, mGluR7 и mGluR8 принадлежат к группе III.
Лиганды метаботропных глутаматных рецепторов, принадлежащих к первой группе, могут быть использованы для лечения или предотвращения острых и/или хронических неврологических нарушений, таких как психоз, эпилепсия, шизофрения, болезнь Альцгеймера, когнитивные расстройства и нарушения памяти, а также хроническая и острая боль.
Другие состояния, которые можно лечить при этом, представляют собой ограниченную функцию мозга, вызванную операциями шунтирования или трансплантациями, недостаточное мозговое кровоснабжение, травмы спинного мозга, травмы головы, гипоксию, вызванную беременностью, остановку сердца и гипогликемию. Кроме того, состояниями, которые можно лечить, являются ишемия, хорея Хантингтона, боковой амиотрофический склероз (ALS, от amyotrophic lateral sclerosis), слабоумие, вызванное СПИДом, травмы глаз, ретинопатия, идиопатический паркинсонизм или лекарственный паркинсонизм, а также состояния, которые ведут к глутамат-недостаточным функциям, таким как, например, спазмы мышц, конвульсии, мигрени, недержание мочи, никотиновая зависимость, опиатная зависимость, тревога, рвота, дискенезия, гастроэзофагеальная рефлюксная болезнь и депрессии.
Заболеваниями, которые полностью или частично опосредованы mGluR5, являются, например, острые, травматические и хронические дегенеративные процессы нервной системы, такие как болезнь Альцгеймера, старческое слабоумие, болезнь Паркинсона, хорея Хантингтона, боковой амиотрофический склероз и рассеянный склероз, психиатрические заболевания, такие как шизофрения и тревога, депрессия, боль и наркотическая зависимость (Expert Opin. Ther. Patents (2002), 12, (12)).
Данное изобретение относится к соединениям формулы I, применению соединений формулы I и их фрамацевтически приемлемых солей для получения лекарств для лечения заболеваний, опосредованных mGluR5 рецептором, таких как острые и/или хронические неврологические расстройства, в частности острая или хроническая боль, недержание мочи, гастроэзофагеальная рефлюксная болезнь, поражение или расстройство печени, вызванное либо лекарством, либо болезнью, ожирение, синдром ломкой Х-хромосомы или аутизм, острые, травматические и хронические дегенеративные процессы нервной системы, такие как болезнь Альцгеймера, старческое слабоумие, болезнь Паркинсона, хорея Хантингтона, боковой амиотрофический склероз и рассеянный склероз, психиатрические заболевания, такие как шизофрения и тревога, депрессия и наркотическая зависимость. Кроме того, изобретение относится к лекарствам, содержащим одно или более соединений формулы I и способам получения подобных соединений.
Следующие определения общих терминов, используемых в настоящем описании, применяются независимо от того, встречаются ли эти термины отдельно или в комбинации.
Термин «низший алкил», используемый в настоящем описании, обозначает насыщенные углеводородные остатки с неразветвленной или разветвленной цепью от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, такие как метил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил и т.п.
Термин «низший алкокси» обозначает низший алкильный остаток по вышеизложенному определению, связанный через атом кислорода. Примеры остатков «низший алкокси» включают метокси, этокси, изопропокси и т.п.
Термин «галоген» обозначает фтор, хлор, бром и йод.
Термин «низший алкил, замещенный галогеном» обозначает низшую алкильную группу, как определено выше, которая замещена одним или более чем одним атомом галогена. Примеры подобных групп включают, но не ограничиваются этим, метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил или н-гексил, замещенные одним или более атомами Cl, F, Вr или I, а также группы, особо проиллюстрированные здесь ниже примерами. Предпочтительными группами являются дифтор- или трифтор-метил или этил.
«Арил» означает ароматическую карбоциклическую группу, состоящую из одного отдельного цикла или одного или нескольких конденсированных циклов, среди которых по меньшей мере один цикл является ароматическим по природе. Предпочтительной арильной группой является фенил.
Термин «5- или 6-членный гетероарил» относится к ароматическому кольцу, содержащему один или более гетероатомов, выбранных из азота, кислорода или серы. Предпочтительными являются гетероарильные группы с азотом. Примеры подобных гетероарильных групп представляют собой имидазолил, изоксазолил, пиразинил, пиразолил, пиридазинил, пиридинил, пиримидинил, тиадиазолил или тиазолил.
Термин «гетероциклоалкил» относится к насыщенному неароматическому циклу, содержащему один или более гетероатомов, выбранных из азота, кислорода или серы. Предпочтительными являются гетероциклоалкильные группы с азотом. Примеры подобных групп представляют собой морфолинил, тетрагидропиранил, тиоморфолинил, пиперазинил, пирролидинил или пиперидил.
Термин «циклоалкил» обозначает насыщенную карбоциклическую группу, содержащую 3-12 атомов углерода, предпочтительно 3-6 углеродных атомов.
Термин «фармацевтически приемлемая соль» относится к любой соли полученной из неорганической или органической кислоты или основания. Подобные соли включают: кислотно-аддитивные соли, образованные с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота; или образованные с органическими кислотами, такими как уксусная кислота, бензолсульфоновая кислота, бензойная кислота, камфорсульфоновая кислота, лимонная кислота, этансульфоновая кислота, фумаровая кислота, глюкогептоновая кислота, глюконовая кислота, глутаминовая кислота, гликолевая кислота, гидроксинафтойная кислота, 2-гидроксиэтансульфоновая кислота, молочная кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфоновая кислота, муконовая кислота, 2-нафталинсульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, винная кислота, п-толуолсульфоновая кислота или триметилуксусная кислота.
Предпочтительные соединения формулы I представляют собой соединения
где
R1 представляет собой водород или низший алкил;
R2 представляет собой арил или 5- или 6-членный гетероарил;
R3 представляет собой водород, арил или 5- или 6-членный гетероарил;
где арильные или 5- или 6-членные гетероарильные группы для R2 и R3 могут быть не замещены или замещены галогеном, низшим алкилом, возможно, замещенным одним и более чем одним галогеном, низшим алкокси, -С(O)O-низшим алкилом или циано.
Другие предпочтительные соединения формулы I представляют собой соединения, где R3 представляет собой водород и R2 представляет собой 5- или 6-членный замещенный гетероарил, например следующие соединения:
(6-метил-пиридин-2-ил)-[1,7]нафтиридин-8-ил-амин,
(4-метил-тиазол-2-ил)-[1,7]нафтиридин-8-ил-амин,
(2-метил-[1,7]нафтиридин-8-ил)-(4-метил-тиазол-2-ил)-амин,
(5-хлор-пиридин-2-ил)-(2-метил-[1,7]нафтиридин-8-ил)-амин,
(5-фтор-пиридин-2-ил)-(2-метил-[1,7]нафтиридин-8-ил)-амин,
(2-хлор-пиридин-4-ил)-(2-метил-[1,7]нафтиридин-8-ил)-амин,
(2-метил-[1,7]нафтиридин-8-ил)-(1-метил-1Н-пиразол-3-ил)-амин,
(2-метил-[1,7]нафтиридин-8-ил)-(2-метил-тиазол-4-ил)-амин,
(2-хлор-[1,7]нафтиридин-8-ил)-(4-метил-тиазол-2-ил)-амин,
(2-хлор-[1,7]нафтиридин-8-ил)-(2-метил-тиазол-4-ил)-амин,
(2-метокси-[1,7]нафтиридин-8-ил)-(4-метил-тиазол-2-ил)-амин и
(2-этил-[1,7]нафтиридин-8-ил)-(4-метил-тиазол-2-ил)-амин.
Кроме того, предпочтительными являются соединения, где R3 представляет собой водород и R2 представляет собой замещенный арил, например следующие соединения:
(3-хлор-фенил)-[1,7]нафтиридин-8-ил-амин и
(3-хлор-фенил)-(2-метил-[1,7]нафтиридин-8-ил)-амин.
Еще более предпочтительными соединениями формулы I являются, кроме того, соединения, где и R3, и R2 представляют собой 5- или 6-членный возможно замещенный гетероарил, например следующие соединения:
(6-метил-пиридин-2-ил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин,
(2-хлор-пиридин-4-ил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин,
(5-метил-пиридин-2-ил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин,
(5-фтор-пиридин-2-ил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин,
(2-хлор-пиридин-4-ил)-[5-(6-метокси-пиридин-3-ил)-[1,7]нафтиридин-8-ил]-амин,
(2-хлор-пиридин-4-ил)-[5-(5-фтор-пиридин-3-ил)-[1,7]нафтиридин-8-ил]-амин,
(5-фтор-пиридин-2-ил)-[5-(5-фтор-пиридин-3-ил)-[1,7]нафтиридин-8-ил]-амин,
(5-фтор-пиридин-2-ил)-[5-(5-метокси-пиридин-3-ил)-[1,7]нафтиридин-8-ил]-амин,
(2-хлор-пиридин-4-ил)-(5-пиримидин-5-ил-[1,7]нафтиридин-8-ил)-амин,
(5-фтор-пиридин-2-ил)-(5-пиримидин-5-ил-[1,7]нафтиридин-8-ил)-амин,
(4-метил-тиазол-2-ил)-(5-пиримидин-5-ил-[1,7]нафтиридин-8-ил)-амин,
(4-метил-тиазол-2-ил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин,
(1-метил-1Н-пиразол-3-ил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин,
(2-метил-тиазол-4-ил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин,
(2-метил-тиазол-4-ил)-(5-пиримидин-5-ил-[1,7]нафтиридин-8-ил)-амин,
(2-метил-5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-(4-метил-тиазол-2-ил)-амин,
(5-фтор-пиридин-2-ил)-(2-метил-5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин,
(2-метил-5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-(2-метил-тиазол-4-ил)-амин,
(2-хлор-пиридин-4-ил)-(2-метил-5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин,
(2-метил-5-пиримидин-5-ил-[1,7]нафтиридин-8-ил)-(2-метил-тиазол-4-ил)-амин,
[5-(6-хлор-пиридин-3-ил)-2-метил-[1,7]нафтиридин-8-ил]-(2-метил-тиазол-4-ил)-амин,
[5-(6-хлор-пиридин-3-ил)-2-метил-[1,7]нафтиридин-8-ил]-(4-метил-тиазол-2-ил)-амин,
[5-(3,5-диметил-изоксазол-4-ил)-2-метил-[1,7]нафтиридин-8-ил]-(4-метил-тиазол-2-ил)-амин,
[5-(2,5-диметил-2Н-пиразол-3-ил)-2-метил-[1,7]нафтиридин-8-ил]-(4-метил-тиазол-2-ил)-амин,
5-[2-метил-8-(4-метил-тиазол-2-иламино)-[1,7]нафтиридин-5-ил]-пиридин-2-карбонитрил,
(2-метил-5-пиримидин-5-ил-[1,7]нафтиридин-8-ил)-(4-метил-тиазол-2-ил)-амин,
(2-метил-5-пиридин-4-ил-[1,7]нафтиридин-8-ил)-(4-метил-тиазол-2-ил)-амин,
[2-метил-5-(4-метил-пиридин-3-ил)-[1,7]нафтиридин-8-ил]-(4-метил-тиазол-2-ил)-амин,
[5-(6-фтор-пиридин-3-ил)-2-метил-[1,7]нафтиридин-8-ил]-(4-метил-тиазол-2-ил)-амин,
[5-(6-метокси-пиридин-3-ил)-2-метил-[1,7]нафтиридин-8-ил]-(4-метил-тиазол-2-ил)-амин,
[5-(5-метокси-пиридин-3-ил)-2-метил-[1,7]нафтиридин-8-ил]-(4-метил-тиазол-2-ил)-амин,
[2-метил-5-(3-метил-пиридин-2-ил)-[1,7]нафтиридин-8-ил]-(4-метил-тиазол-2-ил)-амин,
(2-метил-5-пиримидин-5-ил-[1,7]нафтиридин-8-ил)-(4-трифторметил-тиазол-2-ил)-амин,
(4-хлор-тиазол-2-ил)-(2-метил-5-пиримидин-5-ил-[1,7]нафтиридин-8-ил)-амин,
[5-(5-фтор-пиридин-3-ил)-2-метил-[1,7]нафтиридин-8-ил]-(4-метил-тиазол-2-ил)-амин,
[2-метил-5-(6-метил-пиридин-3-ил)-[1,7]нафтиридин-8-ил]-(4-метил-тиазол-2-ил)-амин,
(2-метил-пиримидин-4-ил)-(2-метил-5-пиримидин-5-ил-[1,7]нафтиридин-8-ил)-амин,
(2-хлор-пиридин-4-ил)-(2-метил-5-пиримидин-5-ил-[1,7]нафтиридин-8-ил)-амин,
[5-(2,5-диметил-2Н-пиразол-3-ил)-2-метил-[1,7]нафтиридин-8-ил]-(2-метил-тиазол-4-ил)-амин,
(2-метил-5-пиримидин-2-ил-[1,7]нафтиридин-8-ил)-(2-метил-тиазол-4-ил)-амин,
[2-метил-5-(2-метил-пиридин-3-ил)-[1,7]нафтиридин-8-ил]-(2-метил-тиазол-4-ил)-амин,
(1-метил-1Н-пиразол-3-ил)-(2-метил-5-пиримидин-5-ил-[1,7]нафтиридин-8-ил)-амин,
[5-(5-фтор-пиридин-3-ил)-2-метил-[1,7]нафтиридин-8-ил]-(1-метил-1Н-пиразол-3-ил)-амин,
[2-метил-5-(6-метил-пиридин-2-ил)-[1,7]нафтиридин-8-ил]-(2-метил-тиазол-4-ил)-амин,
(4-метил-тиазол-2-ил)-(2-метил-5-тиазол-2-ил-[1,7]нафтиридин-8-ил)-амин,
[2-метил-5-(3-метил-3Н-имидазол-4-ил)-[1,7]нафтиридин-8-ил]-(4-метил-тиазол-2-ил)-амин,
[2-метил-5-(3-метил-3Н-имидазол-4-ил)-[1,7]нафтиридин-8-ил]-(2-метил-тиазол-4-ил)-амин,
[2-метил-5-(3-метил-[1,2,4]тиадиазол-5-ил)-[1,7]нафтиридин-8-ил]-(2-метил-тиазол-4-ил)-амин,
[2-метил-5-(2-метил-пиримидин-5-ил)-[1,7]нафтиридин-8-ил]-(2-метил-тиазол-4-ил)-амин,
(2-метил-5-пиразин-2-ил-[1,7]нафтиридин-8-ил)-(2-метил-тиазол-4-ил)-амин,
[5-(5-фтор-пиридин-3-ил)-2-метил-[1,7]нафтиридин-8-ил]-(2-метил-тиазол-4-ил)-амин,
(2-метил-5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-(4-трифторметил-тиазол-2-ил)-амин,
(4-дифторметил-тиазол-2-ил)-(2-метил-5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин,
(4-метил-тиазол-2-ил)-[2-метил-5-(5-трифторметил-пиридин-3-ил)-[1,7]нафтиридин-8-ил]-амин и
(4-метил-тиазол-2-ил)-[2-метил-5-(6-трифторметил-пиразин-2-ил)-[1,7]нафтиридин-8-ил]-амин.
Кроме того, предпочтительными соединениями формулы I являются дополнительные соединения, где R3 представляет собой 5- или 6-членный замещенный гетероарил и R2 представляет собой замещенный арил, например следующие соединения:
(3-хлор-фенил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин и
(3-хлор-фенил)-[5-(6-хлор-пиридин-3-ил)-[1,7]нафтиридин-8-ил]-амин.
Другие предпочтительные соединения формулы I представляют собой соединения, где R3 представляет собой замещенный арил и R2 представляет собой 5- или 6-членный замещенный гетероарил, например следующие соединения: [5-(3-метокси-фенил)-2-метил-[1,7]нафтиридин-8-ил]-(4-метил-тиазол-2-ил)-амин, (4-метил-тиазол-2-ил)-[2-метил-5-(3-трифторметил-фенил)-[1,7]нафтиридин-8-ил]-амин,
[5-(3-метансульфонил-фенил)-2-метил-[1,7]нафтиридин-8-ил]-(4-метил-тиазол-2-ил)-амин и
[5-(3-фтор-фенил)-2-метил-[1,7]нафтиридин-8-ил]-(1-метил-1H-пиразол-3-ил)-амин.
Соединения формулы I по изобретению могут быть получены разными способами.
В воплощении способ по изобретению включает следующие варианты, согласно которым
а) подвергают взаимодействию соединение формулы
с соединением формулы
чтобы получить соединение формулы
где R1, R2 и R3 являются такими, как определено выше, и при желании переводят полученные соединения в фармацевтически приемлемые кислотно-аддитивные соли, или
б) подвергают взаимодействию соединение формулы
с соединением формулы
чтобы получить соединение формулы
где R1, R2 и R3 являются такими, как определено выше, и при желании переводят полученные соединения в фармацевтически приемлемые кислотно-аддитивные соли.
Разные способы по изобретению описаны более подробно на следующих схемах 1-3 и в примерах 1-81.
Схема 1
где заместители R1, R2 и R3 являются такими, как описано выше.
Более подробно, соединения формулы I могут быть получены следующим образом:
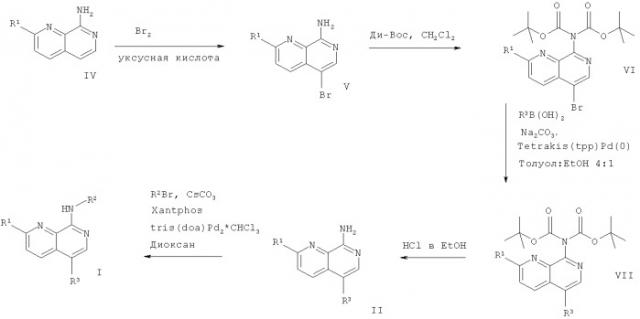
В соответствии со схемой 1 соединения формулы V можно получить согласно известным в данной области способам и из имеющихся в продаже исходных веществ, например, как описано в Journal of Heterocyclic Chemistry, 1978, 15(5), 731-6.
Кроме того, соединения формулы V, например 5-бром-[1,7]нафтиридин-8-иламин, ди-трет-бутилдикарбонат и 4-(N,N-диметиламино)пиридин подвергают N-защите, например, с ди-Вос группой, например, растворяя в дихлорметане и нагревая с обратным холодильником в течение приблизительно 2 часов с получением соединения формулы VI. Затем тетракис(трифенилфосфин)палладий(0) (tetrakis(tpp)Pd(0)) растворяют в толуоле. Соединение формулы VI, например трет-бутиловый эфир (5-бром-[1,7]нафтиридин-8-ил)-ди-карбаминовой кислоты, соединение формулы R3B(OH)2, например 3-пиридинбороновую кислоту, карбонат натрия и этанол добавляют и смесь перемешивают при 80°С в течение приблизительно 16 часов, получая соединение формулы VII. Кроме того, с соединения VII, например трет-бутилового эфира (5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-ди-карбаминовой кислоты, снимают N-защитные группы, например, растворяя его в этилацетате и добавляя HCl в этаноле. Реакционную смесь перемешивают в течение приблизительно 2 часов при комнатной температуре, получая соединение формулы II.
Требуемое соединение формулы I можно получить следующим образом: Соединение формулы II и соединение формул R2Br, например 2-бром-6-метилпиридин, растворяют в безводном диоксане. 4,5-Бис(дифенилфосфино)-9,9-диметилксантен (Xantphos), карбонат цезия и комплекс три(дибензилиденацетон)дипалладия и хлороформа (tris(dba)Pd2*CHCl3) добавляют и реакционную смесь перемешивают в течение приблизительно 20 часов при 130°С, получая соединение формулы I, где заместители R1, R2 и R3 являются такими, как описано выше.
Схема 2
где заместители R1, R2 и R3 являются такими, как описано выше.
Более подробно, соединения формулы I могут быть получены следующим образом:
Согласно схеме 2 соединения формулы III можно получить следующим образом: Соединение формулы VIII суспендируют в оксихлориде фосфора и перемешивают около 5 часов при приблизительно 90°С, получая соединение формулы III. Требуемое соединение формулы I можно получить следующим образом: Соединение формулы III и соединение формул R2NH2, например 2-амино-4-метилтиазол, растворяют в безводном диоксане. 4,5-Бис(дифенилфосфино)-9,9-диметилксантен, карбонат цезия и комплекс три(дибензилиденацетон)дипалладия и хлороформа добавляют и реакционную смесь перемешивают около 20 часов при приблизительно 130°С, получая соединение формулы I.
Схема 3
где заместители R1 и R2 являются такими, как описано выше.
Более подробно, соединения формулы I могут быть получены следующим образом:
Согласно схеме 3 соединение формулы X, 1-окси-7Н-[1,7]нафтиридин-8-он, можно получить следующим образом: Соединение формулы IX, 7Н-[1,7]нафтиридин-8-он, перемешивают в течение приблизительно 70 часов при комнатной температуре в хлороформе с 3-хлорпербензойной кислотой (m-СРВА), получая соединение формулы X. К суспензии 1-окси-7H-[1,7]нафтиридин-8-она в безводном N,N-диметилформамиде добавляют по каплям оксалилхлорид при 0°С. Завершив добавление, смесь нагревают до комнатной температуры и перемешивают в течение приблизительно 30 минут, получая соединение формулы XI, 2-хлор-[1,7]нафтиридин-8-ол. К раствору 2-хлор-[1,7]нафтиридин-8-ола в пиридине добавляют ангидрид трифторметансульфоновой кислоты приблизительно при -10°С. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение приблизительно 1 часа, получая соединение формулы XII, 2-хлор-[1,7]нафтиридин-8-иловый эфир трифторметансульфоновой кислоты. Кроме того, соединение формулы XII и соединение формул R2NH2, например 2-амино-4-метилтиазол, растворяют в безводном диоксане. 4,5-Бис(дифенилфосфино)-9,9-диметилксантен, карбонат цезия и комплекс три(дибензилиденацетон)дипалладия и хлороформа добавляют и реакционную смесь перемешивают около 20 часов при приблизительно 130°С, получая соединение формулы XIII. Требуемое соединение формулы I может быть получено следующим образом: К соединению формулы XIII в безводном тетрагидрофуране добавляют тетракис(трифенилфосфин)палладий и приблизительно 1,0 М раствор диэтилцинка в н-гексане. Реакционную смесь нагревают с обратным холодильником в течение приблизительно 1 часа, получая соединение формулы I.
Фармацевтически приемлемые соли соединений формулы I можно легко изготовить согласно известным способам непосредственно, и принимая во внимание природу соединения, которое будет превращено в соль. Неорганические или органические кислоты, такие как, например, соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота или лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота и подобные подходят для образования фармацевтически приемлемых солей основных соединений формулы I. Соединения, которые содержат щелочные металлы или щелочноземельные металлы, например натрий, калий, кальций, магний или подобные, основные амины или основные аминокислоты подходят для образования фармацевтически приемлемых солей кислотных соединений.
Как уже упоминалось выше, соединения формулы I и их фармацевтически приемлемые соли являются антагонистами метаботропных глутаматных рецепторов и могут быть использованы для лечения или предотвращения заболеваний, опосредованных mGluR5 рецепторами, таких как острая или хроническая боль, недержание мочи, поражение или расстройство печени, вызванное либо лекарством, либо болезнью, ожирение, синдром ломкой X-хромосомы или аутизм, острые, травматические и хронические дегенеративные процессы нервной системы, такие как болезнь Альцгеймера, старческое слабоумие, болезнь Паркинсона, хорея Хантингтона, боковой амиотрофический склероз и рассеянный склероз, психиатрические заболевания, такие как шизофрения и тревога, депрессия и наркотическая зависимость.
Ссылки:
"European Journal of Pharmacology (2004), 497(1), 25-27."
"Journal of Hepatology (2003), 38(2), 179-187".
"Hepatology (Philadelphia) (2000), 31(3), 649-655".
Соединения формулы I и их фармацевтически приемлемые соли особенно полезны в качестве анальгетиков. Болевые состояния, которые можно лечить, включают боль при воспалении, такую как артрит и ревматоидный артрит, васкулит, невропатическую боль, такую как тригеминальная невралгия или невралгия при опоясывающем лишае, диабетическую невропатическую боль, каузалгию, гипералгезию, сильную хроническую боль, послеоперационную боль и боль, связанную с различными состояниями, подобными раку, стенокардии, почечным или печеночным коликам, менструации, мигрени и подагре.
Фармакологическую активность соединений тестировали, используя следующий метод:
Для экспериментов по связыванию кДНК, кодирующей mGlu 5а рецептор человека, временно трансфицировали в EBNA клетки, используя описанную Schlaeger и Christensen процедуру [Cytotechnology 15:1-13 (1998)]. Гомогенаты клеточных мембран хранили при -80°С до дня эксперимента, когда их оттаивали, ресуспендировали и гомогенизировали с помощью Политрона в 15 мМ Tris-HCl, 120 мМ NaCl, 100 мМ KCl, 25 мМ CaCl2, 25 мМ MgCl2 связывающем буфере при рН 7,4 до конечной концентрации для анализа 20 мкг белка на лунку.
Изотермы насыщения определяли добавлением двенадцати концентраций [3Н]МРЕР (0,04-100 нМ) к этим мембранам (в общем объеме 200 мкл) в течение 1 часа при 4°С. Эксперименты по конкуренции осуществляли с фиксированной концентрацией [3Н]МРЕР (2 нМ) и определяли величины ИК50 тестируемых соединений, используя 11 концентраций (0,3-10000 нМ). Инкубировали в течение 1 часа при 4°С.
По окончании инкубации мембраны фильтровали через унифильтр (96-луночный белый микропланшет со связанным GF/C фильтром предварительно инкубировали 1 час в 0,1% PEI в буфере для промывки, Packard Bioscience, Meriden, СТ) с коллектором Filtermate 96 (Packard Bioscience) и промывали 3 раза холодным 50 мМ Tris-HCl, рН 7,4 буфером. Неспецифическое связывание измеряли в присутствии 10 мкМ МРЕР. Радиоактивность на фильтре подсчитывали (3 минуты) на сцинтилляционном счетчике для микропланшетов Packard Top-count с коррекцией гашения после добавления 45 мкл microscint 40 (Canberra Packard S.A., Zürich, Switzerland) и покачивания в течение 20 минут.
Для функциональных анализов осуществляли измерения [Ca2+]i, как ранее описали Porter с соавт. [Br. J. Pharmacol. 128:13-20 (1999)], на НЕК-293 клетках с рекомбинантными mGlu 5а рецепторами человека. Эти клетки насыщали красителем, используя Fluo 4-АМ (получен от FLUKA, конечная концентрация 0,2 мкМ). Измерения [Са2+]i проводили с использованием флуориметрического планшетного анализатора (FLIPR, Molecular Devices Corporation, La Jolla, CA, USA). Оценку антагониста осуществляли через 5 минут преинкубации с тестируемыми соединениями, после чего добавляли субмаксимальное количество агониста.
Кривые ингибирования (антагонисты) подгоняли под четырехпараметрическое логистическое уравнение, задавая ИК50 и коэффициент Хилла, с использованием программного обеспечения для итеративного нелинейного подбора кривых (Xcel fit).
Для экспериментов по связыванию задают величины Ki тестируемых соединений. Величины Ki определяют по следующей формуле:
Ki=ИК50/[1+L/Кd],
в которой величины ИК50 представляют собой концентрации тестируемых соединений, которые вызывают 50%-е ингибирование конкурирующего радиолиганда ([3Н]МРЕР). L представляет собой концентрацию радиолиганда, используемого в экспериментах по связыванию, и величина Kd радиолиганда определяется эмпирически для каждой партии приготовленных мембран.
Соединения по настоящему изобретению являются антагонистами mGluR 5а рецепторов. Активности соединений формулы I, измеренные в описанном выше анализе и представленные в таблице ниже, находятся в пределах Ki<200 нМ.
| Пример | Ki (нМ) | Пример | Ki (нМ) |
| 1 | 25 | 14 | 66 |
| 2 | 89 | 15 | 66 |
| 5 | 62 | 17 | 41 |
| 6 | 33 | 18 | 41 |
| 7 | 18 | 19 | 44 |
| 8 | 38 | 42 | 56 |
| 9 | 86 | 43 | 51 |
| 10 | 19 | 68 | 38 |
| 11 | 8 | 81 | 51 |
| 12 | 56 |
Соединения формулы I и их фармацевтически приемлемые соли могут быть использованы в качестве лекарств, например в форме фармацевтических препаратов. Фармацевтические препараты можно вводить перорально, например в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако эффективным также может быть ректальное введение, например в форме суппозиториев, или парентеральное, например в форме растворов для инъекций.
Соединения формулы I и их фармацевтически приемлемые соли могут быть переработаны с фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических препаратов. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.п. могут быть использованы, например, в качестве таких носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п.; однако в зависимости от природы активного вещества носители обычно не требуется для мягких желатиновых капсул. Подходящими носителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.п. Адъюванты, такие как спирты, полиолы, глицерин, растительные масла и т.п., могут быть использованы для водных инъекционных растворов водорастворимых солей соединений формулы I, но, как правило, не являются необходимыми. Подходящими носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие вещества, эмульгаторы, подсластители, красители, корригенты, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать и другие терапевтически ценные вещества.
Как упоминалось ранее, лекарства, содержащие соединение формулы I или его фармацевтически приемлемые соли и терапевтически инертный эксципиент, также являются предметом настоящего изобретения, как и способ получения подобных лекарств, при котором одно или более соединений формулы I или их фармацевтически приемлемых солей и, при желании, одно или более других терапевтически ценных веществ превращают в лекарственную форму вместе с одним или более чем одним терапевтически инертным носителем.
Дозировка может варьировать в широких пределах и, конечно, должна быть подобрана по индивидуальным потребностям в каждом конкретном случае. В общем, эффективная дозировка для перорального или парентерального введения находится в интервале 0,01-20 мг/кг/день, при дозировке 0,1-10 мг/кг/день, являющейся предпочтительной для всех описанных показаний. Суточная дозировка для взрослого человека весом 70 кг, соответственно, находится в интервале 0,7-1400 мг в день, предпочтительно между 7 и 700 мг в день.
Следующие примеры приводятся для дальнейшего пояснения изобретения:
Пример 1
(6-Метил-пиридин-2-ил)-[1,7]нафтиридин-8-ил-амин
8-Хлор-[1,7]нафтиридин (Пример А) (0,2 г, 1,2 ммоль) и 2-амино-6-метилпиридин (0,13 г, 1,2 ммоль) растворяли в 8 мл безводного диоксана. 4,5-Бис(дифенилфосфино)-9,9-диметилксантен (145 мг, 0,24 ммоль), карбонат цезия (0,63 г, 1,95 ммоль) и комплекс три(дибензилиденацетон)дипалладия и хлороформа (0,13 г, 0,12 ммоль) добавляли и реакционную смесь перемешивали в условиях микроволнового излучения в течение 50 минут при 150°С. Затем реакционную смесь выпаривали и очищали с помощью флэш-хроматографии на силикагеле (гептан / этилацетат 95:5->70:30 градиент). Требуемый продукт получали в виде светло-желтого твердого вещества (98 мг, 34%), MS:m/e=237,1(М+Н+).
Пример 2
(3-Хлор-фенил)-[1,7]нафтиридин-8-ил-амин
Указанное в заголовке соединение, MS:m/e=256,0(М+Н+), получали согласно общему способу примера 1 из 8-хлор-[1,7]нафтиридина и 3-хлоранилина.
Пример 3
(5-Фтор-пиридин-2-ил)-[1,7]нафтиридин-8-ил-амин
Указанное в заголовке соединение, MS:m/e=241,2(M+H+), получали согласно общему способу примера 1 из 8-хлор-[1,7]нафтиридина и 2-амино-5-фторпиридина.
Пример 4
[1,7]Нафтиридин-8-ил-пиримидин-4-ил-амин
Указанное в заголовке соединение, MS:m/e=224,3(М+Н+), получали согласно общему способу примера 1 из 8-хлор-[1,7]нафтиридина и 2-аминопиримидина.
Пример 5
(4-Метил-тиазол-2-ил)-[1,7]нафтиридин-8-ил-амин
Указанное в заголовке соединение, MS:m/e=243,3(М+Н+), получали согласно общему способу примера 1 из 8-хлор-[1,7]нафтиридина и 2-амино-4-метилтиазола.
Пример 6
(6-Метил-пиридин-2-ил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин
Стадия 1: трет-Бутиловый эфир (5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-ди-карбаминовой кислоты
Тетракис(трифенилфосфин)палладий(0) (570 мг, 0,5 ммоль) растворяли в 200 мл толуола. тpeт-Бутиловый эфир (5-бром-[1,7]нафтиридин-8-ил)-ди-карбаминовой кислоты (4,2 г, 10 ммоль) (Пример Б), 3-пиридинбороновую кислоту (1,46 г, 11,9 ммоль), 2 М карбонат натрия (29,7 мл, 59 ммоль) и 50 мл этанола добавляли и смесь перемешивали при 80°С в течение 16 часов. Реакционную смесь экстрагировали водой и два раза этилацетатом. Органические экстракты промывали водой и солевым раствором, высушивали с сульфатом натрия, фильтровали и выпаривали. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (гептан / этил ацетат 1:1->0:100 градиент). Требуемое соединение получали в виде светло-желтого твердого вещества (4,1 г, 98%), MS:m/e=423,3(М+Н+).
Стадия 2: 5-Пиридин-3-ил-[1,7]нафтиридин-8-иламин
тpeт-Бутиловый эфир (5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-ди-карбаминовой кислоты (4,1 г, 9,7 ммоль) растворяли в 10 мл этилацетата и 8 М HCl в этаноле (48,5 мл, 380 ммоль) добавляли. Реакционную смесь перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь выпаривали и осторожно экстрагировали насыщ. раствором NaHCO3 и два раза этилацетатом. Объединенные органические экстракты промывали солевым раствором, высушивали с сульфатом натрия, фильтровали и выпаривали. Требуемое соединение получали в виде желтого твердого вещества (2,06 г, 96%), MS:m/e=223,2(М+Н+).
Стадия 3: (6-Метил-пиридин-2-ил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин
5-Пиридин-3-ил-[1,7]нафтиридин-8-иламин (0,1 г, 0,45 ммоль) и 2-бром-6-метилпиридин (0,14 г, 0,8 ммоль) растворяли в 4 мл безводного диоксана. 4,5-Бис(дифенилфосфино)-9,9-диметилксантен (52 мг, 0,09 ммоль), карбонат цезия (0,23 г, 0,72 ммоль) и комплекс три(дибензилиденацетон)дипалладия и хлороформа (47 мг, 0,045 ммоль) добавляли и реакционную смесь перемешивали в течение 20 часов при 130°С. Затем реакционную смесь выпаривали и очищали с помощью флэш-хроматографии на силикагеле (гептан / этилацетат 1:1->0:100 градиент). Требуемый продукт получали в виде светло-желтого твердого вещества (66 мг, 47%), MS:m/e=314,0(М+Н+).
Пример 7
(3-Хлор-фенил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин
Указанное в заголовке соединение, MS:m/e=333,1(М+Н+), получали согласно общему способу стадии 3 примера 6 из 5-пиридин-3-ил-[1,7]нафтиридин-8-иламина и 1-хлор-3-йодбензола.
Пример 8
(2-Хлор-пиридин-4-ил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин
Указанное в заголовке соединение, MS:m/e=334,2(М+Н+), получали согласно общему способу стадии 3 примера 6 из 5-пиридин-3-ил-[1,7]нафтиридин-8-иламина и 2-хлор-4-йодпиридина.
Пример 9
(5-Метил-пиридин-2-ил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин
Указанное в заголовке соединение, MS:m/e=314,0(М+Н+), получали 5 согласно общему способу стадии 3 примера 6 из 5-пиридин-3-ил-[1,7]нафтиридин-8-иламина и 2-бром-5-метилпиридина.
Пример 10
(5-Фтор-пиридин-2-ил)-(5-пиридин-3-ил-[1,7]нафтиридин-8-ил)-амин
Указанное в заголовке соединение, MS:m/e=318,1(М+Н+), получали согласно общему способу стадии 3 примера 6 из 5-пиридин-3-ил