Способ получения новых 3 -ацетокси-17 -гидроперокси-16 -метилпрегнанов из 16-20-кетостероидов и способ получения 3 -ацетокси-17 -гидрокси-16 -метилпрегнанов с использованием 3 -ацетокси-17 -гидроперокси-16 -метилпрегнанов
Иллюстрации
Показать всеИзобретение относится к синтезу органических веществ, в частности к получению стероидов, используемых в химической, микробиологической и фармацевтической отраслях промышленности. Изобретение конкретно относится к получению новых 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов из Δ16-20-кетостероидов и получению 17α-гидрокси-16α-метилпрегнанов с использованием 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов. Получают 3β-ацетокси-17α-гидроперокси-16α-метилпрегнаны способом, включающим реакцию каталитического 1,4-присоединения метилмагнийгалогенида к Δ16-20-кетостероиду в среде апротонного растворителя (или смеси растворителей) и последующее аутоокисление образовавшегося магнийгалоидпроизводного 3β-ацетокси-20-гидрокси-Δ17(20)-16α-метилпрегнана молекулярным кислородом атмосферного воздуха в гетерогенной среде. 17α-Гидрокси-16α-метилпрегнаны получают из 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов обработкой последних восстанавливающим агентом, при этом 17α-гидрокси-16α-метилпрегнаны могут быть также получены из Δ16-20-кетостероидов последовательностью химических превращений без выделения 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов из раствора. 2 н. и 18 з.п. ф-лы, 5 ил.
Реферат
Настоящее изобретение относится к области органического синтеза, конкретно касается получения стероидных соединений (прегнанов), содержащих 17α-гидроксильную и 16α-метильную группы, и может быть использовано в химической, микробиологической и фармацевтической отраслях промышленности для производства кортикостероидных препаратов.
Кортикостероидные препараты занимают важное место в ряду синтетических лекарственных средств. Широкое применение получили 16α-метилкортикоиды, такие как дексаметазон, мометазон, флуметазон, флутиказон и их производные, благодаря высокой противовоспалительной и антиаллергической активности.
Исходными субстратами в синтезе подобных кортикостероидов могут служить прогнаны, имеющие Δ16-20-кетосистему связей, необходимую для введения 17α-гидроксильной и 16α-метильной групп.
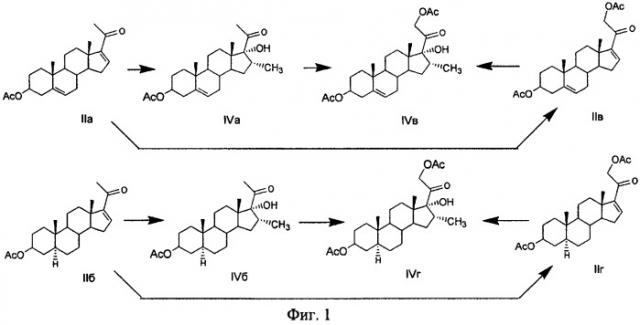
Ацетат 16-дегидропрегненолона (ДПА, IIa) и ацетат 16-дегидропрегнанолона (ПА, IIб) являются наиболее предпочтительными исходными субстратами в синтезе стероидных препаратов ряда прегнана, так как характеризуются наличием прегнановой цепи, имеющей Δ16-20-кетофрагмент. Эта структурная особенность позволяет использовать их в синтезе 17α-гидрокси-16α-метилпрегаанов без предварительной модификации.
ДПА (IIa) может быть получен расщеплением диосгенина - Δ5-стероидного сапогенина [Камерницкий А.В., Абубакиров Н.К., Горовиц М.Б., Воллернер Ю.Е., Войшвилло Н.Е., Решетова И.Г., Пасешниченко В.А. Химия спиростанолов. М.: Наука, 1986, 176, с.37-57]. ПА (IIб) получают из тигогенина - сапонина 5а-ряда, который может быть выделен, например, из листьев растения Jucca gloriosa известным методом [Э.П.Кемертелидзе и Т.А.Пхеидзе. Хим.-фарм.ж., 1972, 7(12), 44-47; SU 389087, 05.07.1973].
Соединения IIв и IIг являются модификациями соединений IIa и IIб соответственно. 21-Ацетоксилирование, например, соединения IIа может быть проведено через образование 21-йод-производного с последующей реакцией его с ацилатом щелочного металла [US2791593, 07.05.1957]. Этим или другими известными методами соединения IVa и IVб могут быть превращены в их 21-ацетоксипроизводные. (Фиг.1).
Известны способы получения 17α-гидрокси-16α-метилпрегнанов. Введение 17α-гидрокси- и 16α-метил-заместителей в Δ16-20-кетостероиды осуществляют, как правило, двухступенчатым процессом, первоначально проводя 16α-алкилирование. Введение 16α-метильной группы к Δ16-20-кетофрагменту обычно осуществляют реакцией каталитического 1,4-присоединения метилмагнийгалогенида [US3072686, 08.01.1963]. Последующее 17α-гидроксилирование может быть проведено различными известными методами. В основе этих методов лежит идея окисления Δ17(20)-20-гидроксипроизводного, полученного предварительной енолизацией кетогруппы при атоме C20.
Методы окисления Δ17(20)-20-гидроксипроизводных можно разделить на две группы.
К первой группе относятся методы окисления двойной 17(20)-связи действием органической надкислоты с последующим щелочным гидролизом образованного 17α,20-эпоксида и образованием 17α-гидрокси-20-кетосоединения [Gallagher Т.F. and Kritchevsky Т.Н. US2562030, 24.07.1951]. Енолизацию проводят действием органической кислоты, как правило, n-толуолсульфокислоты, в среде уксусного ангидрида с одновременным ацетилированием in situ образующегося Δ17(20)-20-гидрокси-интермедиата. Однако енолацетилирование 20-кетогруппы у 16α-метилстероидов затруднено. Реакция протекает медленно и с низким выходом [US3072686, 08.01.1963]. Так, енолизация 3-гидрокси-16α-метил-16,17-дигидропроизводного ДПА проходит лишь при продолжительном кипячении реакционной массы в уксусном ангидриде с медленной дистилляцией (от 6 ч [US3379745, 23. 04.1968 (пример 5)] до 18 ч [GB890475, 28.02.1962 (пример 1)]). Последующее эпоксидирование Δ17(20)-20-связи 16α-метил-20-енолацетата надкислотой также требует большой продолжительности реакции, значительно большей, чем окисление 20-енолацетата с незамещенным атомом C16 (от 18 ч при комнатной температуре [US3379745, 23. 04.1968 (пример 5)] до 4 дней при температуре 25°C [GB924251, 24.04.1963 (пример 6)] вместо 2 ч при комнатной температуре [US2562030, 24.07.1951 (примеры 1 и 2)]).
Модификацией метода Галлахера и Кричевского является метод прямого ацилирования металл-енолятов, который заключается в обработке ацилирующим агентом 16α-метил-Δ17(20)-20-галоидмагниевого интермедиата (III), образующегося при взаимодействии Δ16-20-кетостероида и метилмагнийгалогенида в присутствии соединения меди как катализатора 1,4-присоединения. В качестве ацилирующего агента могут быть использованы ангидриды и хлорангидриды кислот, в качестве катализатора используют, как правило, хлорид меди (I).
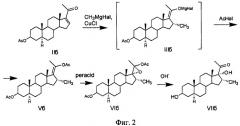
Так, известен способ получения 3β,17α-дигидрокси-16α-метил-5α-прегн-20-она (VIIб) - дезацетилированного производного соединения IVб, заключающийся в том, что 3β-ацетокси-Δ16-5α-прегнан-20-он (IIб) подвергают взаимодействию с метилмагнийиодидом в присутствии хлористой меди в среде тетрагидрофурана и инертного газа при температуре 20-30°C, образующийся комплекс Гриньяра (IIIб) последовательно ацетилируют хлористым ацетилом и разлагают хлористым аммонием при комнатной температуре, полученную смесь продуктов хроматографируют на окиси алюминия, выделенный диацетат (Vб) окисляют надфталевой кислотой в среде хлороформа при комнатной температуре (в течение 24 ч), полученный 16α-метил-17α,20-оксидоэфир (VIб) подвергают щелочному гидролизу при кипячении (64-70°C) метанольного раствора с поташом [SU389087, 05.07.1973; Н.И.Меньшова, Н.П.Сорокина, Г.С.Гриненко, Н.Н.Суворов, Ю.Р.Гуревич, Е.П.Кемертелидзе, Т.А.Пхеидзе. Хим.-фарм.ж., 1974, 8(7), 15-17]. (Фиг.2).
Недостатком этого способа является низкий молярный выход целевого продукта (48,7% с учетом возвращенного исходного), считая на соединение IIб, и потеря сложноэфирной защиты 3β-гидроксильной группы в процессе щелочного гидролиза 17α,20-оксидоэфира (VIб).
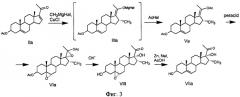
Известен способ получения 3β17α-дигидрокси-16α-метил-Δ5(6)-прегн-20-она (VIIа) - дезацетилированного производного соединения IVa, заключающийся в том, что ДПА (IIа) подвергают взаимодействию с метилмагнийбромидом в присутствии хлористой меди в среде тетрагидрофурана и инертного газа при температуре от -10°C до 20°C, образующийся комплекс Гриньяра (IIIa) последовательно ацетилируют хлористым ацетилом и разлагают реакционную массу хлористым аммонием при температуре 15-20°C, полученный енолацетат (Va) окисляют надфталевой кислотой в среде хлороформа при температуре 25-30°C (в течение 15 ч), образованный 5α,6α;17α,20-диэпоксид (VIa) подвергают щелочному гидролизу при комнатной температуре (в течение 2 ч). Полученный 5α,6α-эпоксид (VIII) восстанавливают (в течение 6 ч) цинком в среде уксусной кислоты при комнатной температуре в присутствии иодида натрия [GB994743.1965; Красильникова Т.И., Шнер В.Ф., Турчин К.Ф., Анисимова О.С. и Гриненко Г.С. Хим.-фарм.ж. 1982, 16(5), 590-594]. (Фиг.3).
Недостатком этого способа является низкий молярный выход целевого продукта (57%), считая на соединение IIa. Существенным недостатком этого способа является то, что эпоксидирование 17(20)-связи протекает неселективно с одновременным окислением другой олефиновой связи, имеющейся в молекуле стероида - Δ5-связи, что требует проведения дополнительной реакции ее регенерации. Кроме того, в процессе щелочного гидролиза 17α,20-эпоксида, как и в предыдущем способе, происходит удаление сложноэфирной защиты 3β-гидроксильной группы.
Общим недостатком указанных выше способов является многостадийность и использование надкислот.
Известно, что 3β,21-диацетокси-17α-гидрокси-Δ5-прегн-20-он может быть превращен в Δ4-3-кетопроизводное методом микробиологической трансформации [US3030278, 17.04.1962]. Поэтому сохранение 3β-ацетоксигруппы при последующем переходе от 3β,21-диацетоксисоединения IVa к его Δ4-3-кетопроизводному биотехнологическим методом имеет большое значение, тем более, что трансформация 3-ацетатов стероидов в Δ4-3-кетоны более эффективна, чем свободных спиртов [V.Datcheva, A.Kamernitskii, R.Vlahov, N.Voishvillo, V.Levi, I.Reshetova, E.Chemobwova. Appl. microbiol. biotechnol., 1986, 25(1), 14-17]. Ацетилирование 3β-гидроксильной группы может быть проведено или у соединения VIIa с образованием соединения IVa, или до регенерации Δ5-связи у соединения VIII [GB890475, 28.02.1962 (Пример 1)].
Чтобы избежать нежелательной эпоксидации Δ5-связи, структуру колец А и В ДПА предварительно защищают, превращая, например, в 6-алкокси-3,5-цикло-производное (или i-систему). Так, известен способ получения 16α-метил-3β,17α-дигидрокси-Δ5(6)-прегнен-20-она и его 3-ацетата, заключающийся в том, что 6-алкокси- или 6-гидрокси-3,5-цикло-Δ16(17)-прегнен-20-он подвергают взаимодействию с метилмагнийгалогенидом в инертном органическом растворителе, образующийся 16α-метил-20-аддукт Гриньяра обрабатывают с галогенидом или ангидридом карбоновой кислоты, содержащей от 2 до 10 атомов углерода, полученный 20-ацилдериват Δ17(20)-енолсоединения эпоксидируют, образовавшийся 17,20-эпоксид обрабатывают раствором щелочи и полученный 6-алкокси- или 6-гидрокси-16α-метил-17α-гидрокси-3,5-циклопрегнан-20-он обрабатывают кислотой в водной среде с образованием 16α-метил-3β,17α-дигидрокси-Δ5(6)-прегнен-20-она или уксусной кислотой с образованием 16α-метил-3β-ацетокси-17α-гидрокси-Δ5(6)-прегнен-20-она (IVa) [DE 1293158, 31.07.1969]. Однако выход соединения IVa не указан.
Иногда Δ5-связь защищают, превращая ее, например, в 5,6-дихлорпроизводное [US3030389, 17.04.1962; Batres E., Cardenas Т., Edvards J.A, Monroy G., Mancera O., Djerassi Caeri, Ringold H.J. J. Org. Chem. 1961,26 (3), 871]. В некоторых случаях Δ5-связь гидрируют над палладиевым катализатором для перехода к соединению 5α-ряда [US3379745, 23.04.1968 (пример 1); US3026336, 20.03.1962].
Ко второй группе относятся методы прямого окисления двойной 17(20)-связи молекулярным кислородом с образованием 17α-гидропероксипродукта (метод прямого окисления по Бартону), который далее восстанавливают в 17-гидроксипроизводое [US3056809, 02.10.1962]. Енолизации подвергают 20-кетогруппу стероида, которую проводят в сильнощелочной среде.
Известны способы, в которых енолизации подвергают 20-кетогруппу 16α-метил-20-кетостероида. Образовавшийся Δ17(20)-20-гидрокси-интермедиат обрабатывают молекулярным кислородом с образованием 17α-гидроперокси-16α-метилсоединения.
Восстановление образующейся 17α-гидропероксигруппы в 17α-гидроксигруппу может быть проведено in situ без выделения 17α-гидроперокси-16α-метилсоединения действием триалкилфосфита. Так, например, известен способ получения 3β-ацетокси-17α-гидрокси-16α-метил-5α-прегнан-20-она (IVб), заключающийся в том, что гидрид натрия растворяют в смеси трет-бутилового спирта и диметилформамида при комнатной температуре и выдерживают в течение 1 ч до растворения, затем добавляют смесь диметилформамида и триэтилфосфита, после охлаждения раствора до температуры -25°C пропускают через него кислород, добавляют раствор 3β-ацетокси-16α-метил-5α-прегнан-20-она в тетрагидрофуране и пропускают кислород в течение 45 мин при температуре -25°C. Затем кислород заменяют на азот и добавляют раствор гидроксида натрия в смеси метанола и воды, после чего перемешивают в течение 70 мин при комнатной температуре, добавляют уксусную кислоту и смесь выливают в воду. Осадок отделяют фильтрацией, сушат, ацетилируют в избытке смеси пиридин-уксусный ангидрид при комнатной температуре и хроматографируют на флоризиле в гексане, используя градиентное элюирование с добавлением эфира. При этом из 5 г исходного 3β-ацетокси-16α-метил-5α-прегнан-20-она получают 33 мг соединения IVб (молярный выход 0,63%) [G.N.Gardner, F.E.Carlon and O.Gnoj. J.Org.Chem., 1968, 33(8), 3294-3297].
Недостатками данного способа являются: низкая эффективность 17α-гидроксилирования, вероятно, связанная со стерическими затруднениями, вызванными присутствием метильной группы при атоме C16 в α-конфигурации, а также удаление сложноэфирной группировки в процессе реакции и применение дополнительной операции ацетилирования 3β-гидроксильной группы, применение для очистки соединения IVб колоночной хроматографии с градиентным элюированием, существенно усложняющей технологический процесс; и, как следствие, крайне низкий выход целевого соединения.
Известны способы 17-гидроксилирования, в которых окислению молекулярным кислородом подвергают 16α-метил-Δ17(20)-20-галоидмагниевый интермедиат, образующийся в результате взаимодействии Δ16-20-кетостероида и метилмагнийгалогенида в присутствии соединения меди в качестве катализатора 1,4-присоединения.
Так, известен способ 17-гидроксилирования 16α-метил-Δ17(20)-20-галоидмагниевого интермедиата, заключающийся в том, что к раствору Δ16-20-кетосоединения в тетрагидрофуране при температуре -30±5°C добавляют по каплям реактив Гриньяра, после чего при температуре 0±5°C добавляют раствор хлорида аммония и перекись водорода, перемешивают в течение 2 ч, экстрагируют, растворитель упаривают в вакууме при температуре 60±5°C, осадок отфильтровывают, сушат в вакууме и получают 17α-гидрокси-16α-метил-20-кетопрегнан [CN 1013 97320, 01.04.2009]. Однако известным способом получают 17α-гидрокси-16α-метилпрегна-1,4,9(11)-триен-3,20-дион и в нем не описано получение 3β-ацетокси-17α-гидрокси-16α-метилпрегнанов общей формулы IV.
Известен также способ получения 3-кислородсодержащих 16α-метил-17α-гидрокси-20-кетопроизводных прегнана, который включает реакцию соединения, выбранного из группы, содержащей 3-OR'-Δ16-20-кето-прегнен, 3-OR'-Δ16-20-кето-аллопрегнен, 3-OR'-Δ5,16-20-кето-прегнадиен и 3-OR'-Δ5,16-20-кето-прегнатриен, где R' - водород или ацильная группа с менее чем 12 атомов углерода, с метилмагнийгалогенидом, окислением образованного 16α-метил-Δ17(20)-енолята окисляющим агентом, выбранным из группы, содержащей кислород и воздух, и последующим гидролизом с образованием 16α-метил-17α-гидрокси-20-кетопроизводного прегнана [US3080393, 05.03.1963]. Согласно этому способу (пример I) к раствору метилмагнийбромида в тетрагидрофуране, охлажденному до 10°C, добавляют хлорид меди и раствор ДПА (IIа) в тетрагидрофуране, выдерживают при температуре 20-30°C в течение 1 ч, охлаждают до 0°C и пропускают через реакционную смесь сухой кислород (свободный от углекислоты) в течение 1 ч. Затем смесь выливают в водный 10% раствор хлорида аммония и экстрагируют эфиром, экстракт промывают водой, упаривают досуха, остаток обрабатывают уксусным ангидридом пиридином при комнатной температуре и после обработки реакционного раствора получают соединение IVa. Согласно этому способу (пример IX) вместо кислорода используют воздух, который пропускают через реакционную смесь в течение 3 ч.
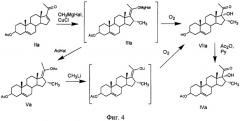
Другой вариант этого способа заключается в том, что 16α-метил-Δ17(20)-енолят (IIIa), образованный по примеру I, обрабатывают раствором ацетилхлорида в тетрагидрофуране, полученную после выделения смесь эпимеров Va обрабатывают эфирным раствором метиллития в токе азота при комнатной температуре в течение 3 ч, затем реакционную массу охлаждают до 0°C и пропускают кислород в течение 1 ч, после чего обрабатывают, как описано в примере I, включая стадию ацетилирования (Фиг.4).
Однако оценить эффективность этого способа не представляется возможным, так как выход соединения IVa не указан ни в одном примере. Недостатком этого способа является образование примеси продукта Д-гомо-перегруппировки и необходимость проведения стадии ацетилирования.
Известны способы введения 17α-гидрокси-16α-метилфрагмента в Δ16-20-кетостероиды восстановлением 17α-гидропероксипродуктов, полученных аутоокислением 16α-метил-Δ17(20)-20-галоидмагниевых интермедиатов.
Известен способ получения 17α-гидроперокси-16α,18-диметил-20-кетостероидов, заключающийся в том, что 18-метил-Δ16-20-кетостероид обрабатывают метилмагнийгалогенидом в присутствии хлорида меди (I) и кислорода воздуха. Согласно этому способу (пример 1) к раствору метилмагнийиодида в тетрагидрофуране при температуре 20°C добавляют хлорид меди (I), медленно прикапывают раствор Δ16-20-кетостероида в тетрагидрофуране в течение 5 мин, охлаждают до 0°C, затем прикапывают насыщенный раствор хлористого аммония и экстрагируют эфиром. Эфирный раствор промывают 10% раствором тиосульфата натрия и водой и после упаривания и кристаллизации получают 17α-гидроперокси-16α-метилпроизводное Δ5-20-кетопрегнана с молярным выходом 66% (1,4 г из 1,9 г загруженного исходного стероида) [DE1921396, 12.11.1970].
Однако известным способом получают 17α-гидроперокси-3,3-(2',2'-диметилпропилендиокси)-16α,18-диметил-5-прегнен-2-он и 17α-гидроперокси-3-ацетокси-16α,18-диметил-5-прегнен-2-он и в нем не описано получение 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов общей формулы I.
Наиболее близким по сущности к предложенному способу получения 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов является способ получения 16α-метилпреднизолона и соответствующих 6α- и 9α-фтор-производных, включающий обработку 21-ацетокси-Δ16-20-кетосоединения со стандартным реактивом Гриньяра, включающим метилмагнийбромид или метилмагнийиодид, в тетрагидрофуране и присутствии хлорида меди в атмосфере азота с образованием соответствующего 16α-метил-20-енол-производного, которое контактирует с водным хлоридом аммония в присутствии этилового эфира, а также в присутствии перекиси водорода (для 9-фторсодержащих субстратов), с образованием соответствующего 16α-метил-17α-гидропероксидного производного, которое восстанавливают или цинковой пылью в уксусной кислоте или йодидом щелочного металла в C1-C6-алифатическом кетоне (конкретно с йодидом натрия в присутствии ацетона) [GB 2001990, 14.02.1979]. Согласно этому способу (пример 1) к суспензии 21-ацетата Δ16-производного преднизолона добавляют раствор метилмагнибромида в тетрагидрофуране, перемешивают в течение 10 мин и добавляют диэтиловый эфир в токе азота, перемешивают при температуре 0°С в течение 10 мин, затем суспензию выливают в 10% раствор хлорида аммония, после отделения слоя растворителя, его промывают, концентрируют в вакууме, остаток выливают в петролейный эфир. После фильтрации и сушки осадка получают 16α-метил-17α-гидроперокси-1,4-прегнадиен-11β,21-диол-3,20-дион 21-ацетат с молярным выходом 83,6% (4,7 г из 5 г исходного Δ16-20-кетосоединения). Однако известным способом получают 21-ацетат 17α-гидроперокси-16α-метилпроизводное преднизолона и 21-ацетат 16α-метилпреднизолона и их 6α- и 9α-фтор-аналоги и в нем не описано получение 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов общей формулы I и 3β-ацетокси-17α-гидрокси-16α-метилпрегнанов общей формулы IV.
Недостатком описанного в [GB 2001990, 14.02.1979] процесса является отсутствие физико-химической характеристики полученных 17α-гидроперокси-16α-метил-20-кетостероидов, что не позволяет оценить качество указанных соединений.
Промежуточными соединениями в синтезе 3β-ацетокси-17α-гидрокси-16α-метилпрегнанов из Δ16-20-кетостероидов согласно настоящему изобретению являются 3β-ацетокси-17α-гидроперокси-16α-метилпрегнаны.
Известны способы восстановления 17α-гидропероксигруппы 17α-гидроперокси-20-кетосоединений с образованием 17α-гидрокси-20-кетопрегнанов.
Наиболее близким по сущности к предложенному способу получения 3β-ацетокси-17α-гидрокси-16α-метилпрегнанов с использованием 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов является способ восстановления 17α-гидропероксигруппы 17α-гидроперокси-16α-метил-20-кетосоединения, который заключается в том, что 16α-метил-17α-гидроперокси-9α-фтор-1,4-прегнадиен-11β,21-диол-3,20-дион 21-ацетат, полученный после обработки реакционной массы, полученной в результате взаимодействия 21-ацетата 9α-фтор-Δ16-производного преднизолона и метилмагнийбромида при температуре -15°С, смесью 10% раствора хлорида аммония, диэтилового эфира и перекиси водорода, обрабатывают цинковой пылью в растворе ледяной уксусной кислоты при температуре 20°С в течение 40 мин, цинковую пыль отфильтровывают и фильтрат выливают в воду. После отделения осадка и кристаллизации его из эфира получают 21-ацетат дексаметазона с молярным выходом 38% (5,5 г из 15 г загруженного 17α-гидропероксида) [GB 2001990, 14.02.1979 (примеры 4 и 6)]. Согласно этому же способу (пример 2) к раствору 4 г 16α-метил-17α-гидроперокси-1,4-прегнадиен-11β,21-диол-3,20-диона 21-ацетата в ацетоне добавляют йодид натрия, реакционную смесь перемешивают при температуре 18-20°С в течение 5 мин и добавляют 5% водный раствор сульфата натрия, полученный раствор выливают в 8% раствор хлорида натрия, осадок отфильтровывают, промывают и сушат в вакууме. При этом выход 21-ацетата 17α-гидрокси-16α-метилпроизводного преднизолона не указан. Однако известным способом получают 21-ацетат дексаметазона и 21-ацетат 17α-гидрокси-16α-метилпроизводного преднизолона и в нем не описано получение 3β-ацетокси-17α-гидрокси-16α-метилпрегнанов общей формулы IV.
Недостатками описанного в [GB 2001990, 14.02.1979] процесса являются:
- Низкий выход (38%) целевого продукта - 21-ацетокси-11β,17α-дигидрокси-9α-фтор-16α-метилпрегн-1,4-диен-3,20-диона (21-ацетата дексаметазона).
- Отсутствие информации о выходе другого целевого продукта - 21-ацетокси-11β,17α-дигидрокси -16α-метилпрегн-1,4-диен-3,20-диона 21-ацетата 16α-метилпреднизолона, что не позволяет оценить эффективность процесса.
Технической задачей в заявленной группе изобретений является, таким образом, повышение эффективности и технологичности проведения процессов, а именно увеличение выхода целевых продуктов путем повышения селективности протекания реакции аутоокисления 3β-ацетокси-16α-метил-Δ17(20)-20-галоидмагниевых интермедиатов Δ5- и 5α- рядов и получение 3β-ацетокси-17α-гидроперокси-16α-метил-20-кетопрегнанов; повышение эффективности протекания реакции восстановления 17α-гидроперокси-группы в 17α-гидроксильную и получение 3β-ацетокси-17α-гидрокси-16α-метил-20-кетопрегнанов способами, лишенными вышеуказанных недостатков.
Техническая задача решается способом получения 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов общей формулы (1)
Где: R1=R2=H, а R3=Н или ОАс; или R1, R2 вместе двойная связь, а R3=Н или ОАс, из Δ16-20-кетостероидов общей формулы (II),
Где: R1=R2=Н, а R3=Н или ОАс; или R1, R2 вместе двойная связь, а R3=Н или ОАс, включающим реакцию каталитического 1,4-присоединения метилмагнийгалогенида в среде апротонного растворителя (или смеси растворителей) и последующее аутоокисление образовавшегося магнийгалоидпроизводного 3β-ацетокси-20-гидрокси-Δ17(20)-16α-метилпрегнана общей формулы (III),
Где: R1=R2=Н, а R3=Н или ОАс; или R1, R2 вместе двойная связь, а R3=Н или ОАс, молекулярным кислородом атмосферного воздуха в гетерогенной среде.
Еще одним изобретением заявленной группы является получение 3β-ацетокси-17α-гидрокси-16α-метилпрегнанов обработкой восстанавливающим агентом 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов, полученных вышеописанным способом по изобретению.
Техническая задача в части получения 3β-ацетокси-17α-гидрокси-16α-метил-20-кетопрегнанов с использованием в качестве исходных (промежуточных) соединений полученных 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов достигается получением 3β-ацетокси-17α-гидрокси-16α-метил-20-кетопрегнанов общей формулы (IV)
Где: R1=R2=Н, а R3=Н или ОАс; или R1, R2 вместе двойная связь, а R3=Н или ОАс, из 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов общей формулы (I),
Где: R1=R2=H, а R3=Н или ОАс; или R1, R2 вместе двойная связь, а R3=Н или ОАс, методом восстановления с использованием в качестве восстанавливающего агента или йодида щелочного металла (натрия или калия) в присутствии диалкилкетона (например, ацетона) или уксусной кислоты, или цинковой пыли в присутствии уксусной кислоты, или солей тиосерной кислоты (например, тиосульфатов натрия или калия), или водорода в присутствии никеля Ренея, с выделением или без выделения 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов из раствора.
Таким образом, сущность заявленной группы изобретений, в которую входят получение 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов из Δ16-20-кетостероидов и далее 3β-ацетокси-17α-гидрокси-16α-метилпрегнанов с их использованием, заключается в том, что Δ16-20-кетостероиды сначала подвергают реакции каталитического 1,4-присоединения метилмагнийбромида, а затем проводят аутоокисление образовавшегося магнийгалоидпроизводного 3β-ацетокси-20-гидрокси-Δ17(20)-16α-метилпрегнана молекулярным кислородом атмосферного воздуха в гетерогенной среде с последующим проведением восстановления 17α-гидропероксигруппы в 17α-гидроксильную.
С целью повышения выхода и упрощения процесса получение 3β-ацетокси-17α-гидрокси-16α-метилпрегнанов из Δ16-20-кетостероидов может быть осуществлено последовательностью химических превращений без выделения 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов из раствора.
Кроме того, в качестве среды для проведения реакции 1,4-присоединения метилмагнийгалогенида могут быть использованы циклические эфиры (например, тетрагидрофуран), алкилнитрилы (например, ацетонитрил), гетероароматические соединения (например, пиридин), или их смеси с ароматическими соединениями (например, бензолом, толуолом), хлорорганическими соединениями (например, дихлорметаном), алифатическими эфирами (например, диэтиловым эфиром).
Кроме того, реакция 1,4-присоединения метилмагнийгалогенида может быть проведена при температуре от минус 5 до плюс 5°С.
Кроме того, реакция аутоокисления в гетерогенной среде самопроизвольным окислением молекулярным кислородом воздуха может быть проведена при температуре от минус 5 до плюс 5°С.
Кроме того, восстановление иодидом щелочного металла может быть проведено в среде ароматического углеводорода (например, бензола, толуола) в присутствии диалкилкетона (например, ацетона) в эффективном количестве.
Кроме того, восстановление цинковой пылью может быть проведено в среде ароматического углеводорода (например, бензола, толуола) в присутствии карбоновой кислоты (например, уксусной) в эффективном количестве.
Кроме того, восстановление солями тиосерной кислоты может быть проведено в среде смеси ацетона и метанола,
Преимущества заявляемого способа состоят в следующем:
- Значительно более короткий путь к 3β-ацетокси-17α-гидрокси-16α-метилпрегнанам из Δ16-20-кетостероидов через 3β-ацетокси-17α-гидроперокси-16α-метилпрегнаны.
- Высокий и стабильный выход 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов и 3β-ацетокси-17α-гидрокси-16α-метилпрегнанов.
- Отсутствие необходимости использования многократной кристаллизации основного продукта или хроматографирования с целью его очистки.
- Значительно сокращаются потери основного продукта при осуществлении последовательности химических превращений Δ16-20-кетостероидов в 3β-ацетокси-17α-гидрокси-16α-метилпрегнаны без выделения 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов из раствора.
- Общий выход 3β-ацетокси-17α-гидрокси-16α-метилпрегнанов из Δ16-20-кетостероидов составляет от 75 до 92% в зависимости от исходного субстрата.
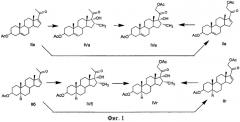
Получение 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов общей формулы (I) и 3β-ацетокси-17α-гидрокси-16α-метилпрегнанов общей формулы (IV) осуществляется по схеме, изображенной на Фиг.5, где:
у соединений Ia, IIa, IIIa и IVa R1 и R2 вместе двойная связь, а R3=H;
у соединений Iб, IIб, IIIб и IVб R1=R2=R3=Н;
у соединений Iв, IIв, IIIв и IVв R1 и R2 вместе двойная связь, а R3=ОАс;
у соединений Iг, IIг, IIIг и IVг R1=R2=H; а R3=ОАс.
Ниже приводится в качестве примера подробное описание сущности изобретения. Δ16-20-Кетостероиды общей формулы (II),
Где: R1=R2=H, а R3=Н или ОАс; или R1, R2 вместе двойная связь, а R3=Н или ОАс, подвергают взаимодействию с метилмагнийбромидом в присутствии катализатора количества хлорида меди (I) в среде апротонного растворителя (или смеси растворителей) с образованием и магнийгалоидпроизводного 3β-ацетокси-20-гидрокси-Δ17(20)-16α-метилпрегнана (III), который подвергают аутоокислению кислородом воздуха в гетерогенной среде с образованием 3β-ацетокси-17α-гидроперокси-16α-метилпрегнана (I). Полученный с выходом до 95% 17α-гидропероксид (I) подвергают взаимодействию с восстанавливающим агентом с использованием в качестве восстанавливающего агента или йодида щелочного металла (натрия или калия) в присутствии ацетона или уксусной кислоты, или цинковой пыли в присутствии уксусной кислоты, или солей тиосерной кислоты (например, тиосульфатов натрия или калия) в среде метанола и ацетона, или водорода в присутствии никеля Ренея, с выделением или без выделения 3β-ацетокси-17α-гидроперокси-16α-метилпрегнанов из раствора. Выход 3β-ацетокси-17α-гидрокси-16α-метилпрегнанов (IV) на стадии восстановления составляет до 98%. Общий выход 3β-ацетокси-17α-гидрокси-16α-метилпрегнанов (IV) из Δ16-20-кетостероидов (II) составляет от 75 до 92% в зависимости от использованного исходного соединения.
Заявленная группа изобретений иллюстрируется следующими примерами, не ограничивающими ее.
В качестве катализатора 1,4-присоединения метилмагнийбромида используют хлорид меди (I) в количестве 2.5% вес (0.9-0,97 моля на 1 моль стероида), минимально необходимом для проведения 1,4-алкилирования.
В качестве среды для проведения реакции 1,4-присоединения используют смешивающиеся с водой растворители из группы, включающей тетрагидрофуран, пиридин, ацетонитрил или их смеси с несмешивающимися с водой растворителями из группы, включающей бензол, толуол, дихлорметан, диэтиловый эфир.
В качестве гетерогенной среды для проведения реакции аутоокисления молекулярным кислородом атмосферного воздуха используют смеси растворителей из группы, включающей тетрагидрофуран, пиридин, ацетонитрил, с растворителями из группы, включающей бензол, толуол, дихлорметан, диэтиловый эфир, и воды или 20% водного раствора хлорида аммония.
Реакцию 1,4-присоединения метилмагнийбромида проводят при температуре 0±5°C в инертной атмосфере.
Реакцию аутоокисления проводят при температуре при температуре 2.5±2.5°C в атмосфере воздуха окружающей среды.
Реакцию восстановления проводят при комнатной температуре.
В качестве восстанавливающего агента может быть использован йодид щелочного металла (например, натрия или калия) в весовом количестве не более 40% от веса 17α-гидропероксида или исходного Δ16-20-кетостероида (при проведении реакции без выделения 17α-гидропероксида из раствора).
Реакция восстановления йодидом щелочного металла может быть проведена в среде карбоновой кислоты (например, уксусной), или в среде алифатического кетона (например, ацетона), или в среде ароматического углеводорода (бензола или толуола) присутствии алифатического кетона в количестве не более чем 40% объемных от количества раствора 17α-гидропероксида в ароматическом углеводороде.
В качестве восстанавливающего агента может быть использована цинковая пыль в весовом количестве не более 50% от веса исходного 17α-гидропероксида или исходного Δ16-20-кетостероида (при проведении реакции без выделения 17α-гидропероксида из раствора).
Реакция восстановления цинковой пылью может быть проведена в среде карбоновой кислоты (например, уксусной) или в среде ароматического углеводорода (бензола или толуола) в присутствии кислоты в количестве не более чем 2 объема на весовую часть цинковой пыли.
В качестве восстанавливающего агента может быть использован водород в присутствии никеля Ренея (водная паста) в весовом количестве не более чем 100% от веса исходного 17α-гидропероксида или исходного Δ16-20-кетостероида (при проведении реакции без выделения 17α-гидропероксида из раствора).
Реакция восстановления водородом в присутствии никеля Ренея может быть проведена в среде алифатического спирта (например, метанола) или в среде ароматического углеводорода (бензола или толуола) в присутствии не более чем 10% объемных метанола от количества раствора 17α-гидропероксида в ароматическом углеводороде.
В качестве восстанавливающего агента может быть использован тиосульфат натрия в весовом количестве не более 100% от веса исходного 17α-гидропероксида.
Пример 1. Получение 3β-ацетокси-17α-гидроперокси-16α-метилпрегн-5-ен-20-она (Ia).
Вариант 1.
К суспензии 10 г 3β-ацетоксипрегна-5,16-диен-20-она (ДПА, IIa) и 0.25 г хлорида меди (I) в 140 мл ТГФ при перемешивании и температуре -5±5°C в токе инертного газа медленно (~ в течение 15 мин) добавляют 60 мл 1.68 н раствора CH3MgBr (3.6 молей на 1 моль стероида) в ТГФ.
Реакционную массу выдерживают при этой же температуре в течение 20 мин и медленно добавляют 200 мл сухого бензола при температуре не выше -5°C. Реакционную массу перемешивают 20 мин и выливают при интенсивном перемешивании в 0.5 л 20% раствора NH4Cl, охлажденного до температуры 0°C. Смесь перемешивают интенсивно в течение 20 мин при температуре 2.5±2.5°C. Органический слой отделяют, промывают 20% водным раствором NH4Cl и водой. Растворитель упаривают в вакууме при температуре не выше 40°C. Остаток растирают с гексаном, осадок отфильтровывают, промывают на фильтре гексаном. Выход соединения (Ia) 9.64 г (85%), т.пл. 156°C (с разл.).
После перекристаллизации из ЭА т.пл. 169°C (с разл.). [α]20D=-35.9°.
Найдено, %: С 71.47, Н 8.80. C24H36O5. Вычислено, %: С 71.25, Н 8.96.
Масс-спектр, m/z: 404 [М]+.
ИК-спектр (1% раствор в CH2Cl2), ν, см-1: 3530 (ООН).
ИК-спектр (суспензия в вазелиновом масле), ν, см-1: 3350 (ООН), 1740 (С=O), 1685 (С=O), 1240 (С-O).
Спектр ЯМР 1Н, δ, м.д.: 0.86 с (3Н, 18-СН3); 1.16 с (3Н, 19-СН3); 1.32 д (3Н, 16-СН3, J 7.3 Гц); 2.19 с (3Н, 3-ОСОСН3); 2.44 с (3Н, 21-СН3); 4.7 м (1Н, 3-Н); 5.5 (1Н, 6-Н); 8.26 с (1Н, 17-ООН).
Вариант 2.
К реакционной массе после проведения реакции 1,4-присоединения реактива Гриньяра с 10 г ДПА (IIа) в условиях, описанных в варианте 1, добавляют 500 мл диэтилового эфира. После обработки, описанной в варианте 1, получают 10.2 г (89,9%) соединения (Ia) с т.пл. 167°C (с разл.).
Вариант 3.
К раствору 10 г ДПА (IIa) в смеси 140 мл ТГФ и 200 мл бензола, содержащему 0.25 г хлорида меди (I), при перемешивании и температуре 2.5±2.5°C в токе инертного газа добавляют 60 мл 1.68 н раствора CH3MgBr в ТГФ. Через 20 мин реакционную массу выливают при интенсивном перемешивании и температуре 1±1°C в 500 мл 20% раствора NH4Cl и выдерживают 20 мин. После обработки, описанной в варианте 1, получают 9.98 г (87,9%) соединения (Ia) с т.пл. 157.5°C (с разл.).
Вариант 4.
К раствору 10 г ДПА (IIa) в смеси 60 мл ацетонитрила и 84 мл толуола, содержащему 0,23 г хлорида меди (I), при перемешивании и температуре 2,5±2,5°C в токе инертного газа добавляют 60 мл 1,68 н раствора CH3MgBr в ТГФ. Реакционную массу выдерживают при этой же температуре в течение 15-20 мин. Затем реакционную массу выливают при интенсивном перемешивании в 500 мл 20% раствора хлорида аммония, охлажденного до температуры 0°C. Реакционную массу перемешивают в течение 20 мин, органический слой отделяют, промывают 20% водным раствором хлорида аммония и водой. К органическому слою после промывки добавляют при перемешивании 300 мл гексана (или петролейного эфира с т.кип. 40-60°C) и смесь перемешивают в течение 2 часов при температуре 2,5±2,5°C. Осадок отфильтровывают, промывают на фильтре гексаном (или петролейным эфиром). Получают 10,8 г (95,2%) соединения (Ia) с т.пл. 169°C (сразл.).
Вариант 5.
К раствору 2,5 г ДПА (IIa) в 85 мл смеси пиридина и бензола (1:1,4 об.), содержащему 0,06 г хлорида меди (I), при перемешивании и температуре 2,5±2,5°C в токе инертного газа добавляют 15 мл 1,68 н раствора CH3MgBr в ТГФ. Через 15 минут реакционную массу обрабатывают, как описано в варианте 1, получают 1,15 г (40,5%) соединения (Ia) с т.пл. 154,5°C (с разл.).
Вариант 6.
К раствору 1 г ДПА (IIa) в смеси 14 мл ТГФ и 20 мл хлористого метилена, содержащему 0.025 г хлорида меди (I), при перемешивании и температуре 2.5±2.5°C в токе инертного газа добавляют 6 мл 1.68 н раствора CH3MgBr в ТГФ. Через 20 мин реакционную массу выливают при интенсивном перемешивании и температуре 1±1°C в 50 мл 20% раствора NH4Cl и выдерживают 20 мин. После обработки, описанной в варианте 4, получают 0,86 г (75,8%) соединения (1а) с т.пл. 167.5°C (с разл.).
Пример 2. Получение 3β-ацетокси-17α-гидрокси-16α-метилпрегн-5-ен-20-она (IVa).
Вариант 1.
К раствору 5 г соединения (Ia) в 35 мл ледяной уксусной кислоты добавляют 2.5 г цинковой пыли. Реакционную массу перемешивают 1 ч при комнатной температуре. Суспензию выливают в 300 мл воды, осадок отфильтр