Пищевая добавка для пациентов с вич (варианты)
Иллюстрации
Показать всеИзобретение относится к пищевому продукту для пациентов с ВИЧ. Предложена пищевая композиция, включающая один или более кислые и один или более нейтральные олигосахариды и цистеин и/или источник цистеина. При этом кислые олигосахариды получены из пектина, пектата, альгината, хондроитина, гиалуроновых кислот, гепарина, гепарана, сиалогликанов, фукоидана, фукоолигосахаридов или каррагинана. Нейтральный олигосахарид выбран из группы, состоящей из галактоолигосахарида, фруктоолигосахарида, трансгалактоолигосахарида, ксилоолигосахарида, лактосахарозы и арабиноолигосахаридов, и где указанный источник цистеина представляет собой N-ацетилцистеин и/или диацетилцистеин, сыворотку, молозиво, яичные белки или их сочетание. Изобретение позволяет предупредить и предотвратить дисфункции, относящиеся к ВИЧ. 3 н. и 9 з.п. ф-лы, 1 табл., 2 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к пищевому продукту для пациентов с ВИЧ. Более конкретно, изобретение относится к пищевой композиции, которая предоставляет тщательно выбранные питательные ингредиенты, специфически поддерживающие пациентов с ВИЧ с симптомами, относящимися к питанию. Данное изобретение также относится к производству пищевой добавки для пациентов с ВИЧ.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Инфекции с вирусом иммунодефицита человека (ВИЧ) и развитие синдрома приобретенного иммунодефицита (СПИД) имеют значительное воздействие на отечественное и глобальное здоровье, социальные, политические и экономические последствия. Во всем мире количество ВИЧ-1 инфицированных людей превышает 40 миллионов, большинство из которых живут в Азии, Африке (южнее Сахары) и Южной Америке. Несмотря на все терапевтические преимущества, достигнутые в течение последнего десятилетия, включающие разработку высоко активной антиретровирусной терапии (“HAART”), как только отдельный человек становится инфицированным, уничтожение вируса все еще остается невозможным.
В настоящее время признается важность пищевой поддержки ВИЧ-инфицированных людей. Инфицированные пациенты могут иметь увеличенные потребности в основной энергии, белках и микроэлементах вследствие метаболического стресса, который они переносят. Этот стресс в сочетании с анорексией и нарушением всасывания, ассоциированных с заболеванием, способствует развитию нарушения питания. Нарушение питания в целом воздействует, например, на иммунокомпетентность, (рабочую) производительность и восприятие. Предоставление дополнительного питания помогает этим пациентам улучшить их общий пищевой статус.
В настоящее время на рынке представлено несколько продуктов для пищевой поддержки пациентов с ВИЧ. Различные торговые поставщики имеют несколько клинических пищевых продуктов на рынке, которые перечислены ниже.
1. Advera, Ross Abbott
Распределение калорий:
Белок: 18,7% (гидролизат соевого белка, казеинат натрия)
Углевод: 65,5% (мальтодекстрин, сахароза, клетчатка сои)
Жир: 15,8% (Canola, MCT, рафинированное деодорированное масло сардины 1,5 э%)
Калорийность: 1,28 ккал/мл
2. Resource, Novartis
Распределение калорий:
Белок: 14% (казеинаты натрия и кальция, изолят соевого белка)
Углевод: 64% (кукурузный сироп, сахар)
Жир: 22% (масло подсолнечника с высоким содержанием олеиновой кислоты, кукурузное масло)
Калорийность: 1,06 ккал/мл
3. Benecalorie, Novartis
Распределение калорий:
Белок: 9% (казеинат кальция)
Углевод: 0%
Жир: 91% (масло подсолнечника с высоким содержанием олеиновой кислоты, моно- и диглицериды)
Калорийность: 7 ккал/мл
4. Boost, Mead Johnson, в данное время продукт поставляется Novartis
Распределение калорий:
Белок: 24% (концентрат молочного белка, казеинаты Ca & Na)
Углевод: 55% (твердые вещества кукурузного сиропа, сахар)
Жир: 21% (канола, масла подсолнечника и кукурузы с высоким содержанием олеиновой кислоты)
Калорийность: 1,01 ккал/мл
Однако несмотря на доступность продуктов, которые поддерживают общие пищевые требования ВИЧ-инфицированных пациентов, не существует доступных пищевых продуктов, которые дополнительно значительно снижают или предотвращают специфические симптомы, относящиеся к ВИЧ-инфекции, в особенности иммунную дисфункцию, кишечную дисфункцию и/или статус глутатиона у пациентов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Существующие в настоящее время пищевые требования пациентов с ВИЧ имеют тот недостаток, что они не дают общего решения для всех относящихся к питанию медицинских проблем пациентов с ВИЧ, в особенности относящихся к инфекции иммунной дисфункции, кишечной дисфункции и/или статуса глутатиона. В одном варианте осуществления настоящее изобретение относится к применению олигосахаридов и цистеина и/или источника цистеина в производстве композиции для применения в способе лечения и/или профилактики ВИЧ или СПИД, причем указанный способ включает в себя введение указанному млекопитающему указанной композиции, содержащей терапевтически эффективное количество олигосахарида и цистеина и/или источника цистеина. В еще одном варианте осуществления композиции дополнительно содержат одну или более полиненасыщенных жирных кислот (ПНЖК) и/или одно или более биологически активных соединений, в особенности соединений, произведенных из молока.
Настоящее изобретение предоставляет полные пищевые добавки, пригодные для пищевого лечения пациентов с ВИЧ. Пищевые добавки настоящего изобретения содержат, по меньшей мере, 2, предпочтительно, по меньшей мере, 3 компонента, поддерживающих функцию кишечника у пациента, статус глутатиона (GSH) и/или иммунную функцию. Неожиданно было обнаружено, что путем тщательного выбора сочетаний пищевых ингредиентов некоторые относящиеся к питанию побочные эффекты ВИЧ-инфекции (т.е. симптомы, относящиеся к инфекции) могут быть предотвращены и/или значительно снижены. Обнаружено, что эффект является намного лучшим, когда несколько симптомов, относящихся к заболеванию, были выбраны в качестве цели, чем тогда, когда пациент получал только один их индивидуальных ингредиентов, как практиковалось прежде.
Здоровый кишечник и здоровая флора кишечника сложным образом связаны со здоровой иммунной функцией. Потенциальные иммуномодулирующие эффекты посредством специфических клетчаток/олигосахаридов могут являться опосредованным результатом влияния на состав кишечной флоры (документально подтверждены иммунные эффекты типов бифидобактерий и молочнокислых бактерий) и/или функцию (ферментация клетчаток продуцирует соединения, такие как жирные кислоты с короткой цепью, которые влияют на общую и иммунологическую функцию клеток кишечника). Неожиданно авторы изобретения обнаружили, что молекула DC-SIGN дендритных клеток может блокироваться некоторыми олигосахаридами. Поскольку блокировка этой молекулы может потенциально предотвращать передачу ВИЧ, применение этих олигосахаридов для блокировки рецептора DC-SIGN и для производства композиций для профилактики и/или лечения заболеваний, опосредованных DC-SIGN (особенно ВИЧ и СПИД), предоставлено в одном варианте осуществления изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Общие определения
“Олигосахариды” относится к углеводным цепям из моносахаридных единиц с длиной цепи между 1 и 5000, более предпочтительно между 2 и 250, более предпочтительно между 2 и 50, наиболее предпочтительно между 2 и 10.
“Степень полимеризации” или “СП” относится к общему числу сахаридных единиц в олигосахаридной цепи. “Средняя СП” относится к средней СП олигосахаридных цепей в композиции, не принимая в рассчет возможные моно- или дисахариды (которые предпочтительно удаляют в случае присутствия). Средняя СП композиции применяют для различения композиций. Предпочтительно средняя степень полимеризации олигосахаридных цепей составляет между 2 и 100, более предпочтительно между 3 и 250, например между 3 и 50.
“Совместное введение” двух или более веществ относится к введению этих веществ одному лицу, либо в одной композиции или в раздельных композициях (набор частей; в виде комбинированной композиции), которые вводятся в одно и то же время (одновременно) или в пределах небольшого промежутка времени (раздельное или последовательное применение, например, в пределах минут или часов).
Термин “содержащий” следует интерпретировать, как обозначающий присутствие установленных частей, стадий или компонентов, но не исключает присутствие одной или более дополнительных частей, стадий или компонентов.
“Процентное содержание” или “среднее” в общем случае относится к процентному содержанию или среднему от массы, пока иначе не указывают или до тех пор, пока не становится ясно, что подразумевают другую основу.
“ГОС” или “галактоолигосахариды” или “транс- галактоолигосахариды” или “ТОС” относятся к олигосахаридам, составленным из единиц галактозы.
“Лечение и/или предупреждение ВИЧ” относится к значительному снижению или предотвращению одного или более симптомов/дисфункций, относящихся к ВИЧ-инфекции, выбранных из иммунной дисфункции, кишечной дисфункции и/или низкого статуса глутатиона. В одном варианте осуществления лечение или предупреждение ВИЧ относится к значительному снижению (или полному предотвращению) распространения ВИЧ вследствие блокады рецептора DC-SIGN, как будет ясно из контекста.
“Значительное снижение или предотвращение” относится к снижению симптома (или распространения ВИЧ) на, по меньшей мере, 5, 10, 15, 30, 50 или даже 100% по сравнению с контрольными пациентами, которым не вводятся композиции в соответствии с изобретением. Симптомы могут быть измерены, как известно в области техники, например иммунную дисфункцию можно оценить посредством измерения счетов клеток CD4+. Блокировка рецептора DC-SIGN может быть определена, как в Примере 1.
Задача, на решение которой направлено настоящее изобретение, состоит в предоставлении пищевых композиций, пригодных для лечения ВИЧ-пациентов, для улучшения их пищевого статуса и, по меньшей мере, двух, предпочтительно, по меньшей мере, трех симптомов, относящихся к ВИЧ. Композиции в соответствии с изобретением являются особенно применимыми для пациентов со счетом CD4+ Т клеток, который является ниже критического уровня, равного приблизительно 700 клеток/мкл крови, когда в общем случае терапия HAART еще не является необходимой, но когда пациенты уже проявляют или испытывают одну или более из иммуно-, кишечных- и/или относящихся к глутатиону дисфункций.
Таким образом, настоящие композиции являются пригодными для предупреждения и/или лечения одной или более из дисфункций, относящихся к ВИЧ, особенно:
1. Иммунной дисфункции, т.е. снижения счета CD4+ Т клеток, ведущего, к нарушенной иммунной функции;
2. Кишечной дисфункции, т.е. проблем с кишечником, конкретно ВИЧ-индуцированных нарушений всасывания и диареи; и/или
3. Низкого статуса глутатиона, особенно низких уровней глутатиона в крови и внутриклеточно в Т-клетках.
В предпочтительном варианте осуществления композиции являются пригодными для лечения или предупреждения, по меньшей мере, иммунной дисфункции и низкого статуса глутатиона. Эти композиции содержат подходящие количества обоих олигосахаридов и цистеина и/или источника цистеина. В еще одном варианте осуществления композиции дополнительно содержат подходящие количества одной или более ПНЖК и/или одно или более биологически активных соединений и являются пригодными для лечения или предотвращения всех трех из приведенных выше дисфункций.
Поскольку CD4+ Т-лимфоциты инфицируются и разрушаются ВИЧ, развитие ВИЧ может быть рутинным образом и регулярно регистрироваться посредством измерения счета CD4+ Т-лимфоцитов в циркуляции. Начальный период после инфекции ВИЧ, который может длиться от трех до более чем десяти лет, характеризуется медленным, но постепенным спадом общего счета CD4+ Т-клеток, без очевидных симптомов сниженной сопротивляемости инфекциям. Первые признаки инфекционных осложнений обычно происходят, когда счеты CD4+ Т-клеток становятся ниже 700 клеток/мкл крови. В этой точке ВИЧ-сероположительный человек может переносить респираторные (кашель, озноб, лихорадка) и/или желудочно-кишечные (дискомфорт кишечника, диарея) симптомы. Эти симптомы являются еще относительно мягкими и могут рассматриваться как субклинические; хотя досаждающие человеку, они обычно не являются достаточно тяжелыми, чтобы привести к госпитализации или началу высокоактивного антиретровирусного лечения (HAART).
Одним из типов клеток первоначально сталкивающихся с вирусом иммунодефицита человека типа 1 (ВИЧ-1) после передачи половым способом являются дендритные клетки (DC). DC захватывают ВИЧ-1 посредством лектиновых рецепторов С-типа, из которых наиболее изученным примером является DC-SIGN, который опосредует интернализацию ВИЧ-1. DC может выдерживать вирусную инфекцию в течение нескольких дней и способен передавать ВИЧ-1 CD4(+) T-клеткам. Как описано в Примере 1, авторы настоящего изобретения неожиданно обнаружили, что олигосахариды могут связываться с DC-SIGN.
Композиции и применения в соответствии с изобретением
Композиции в соответствии с изобретением являются пригодными для лечения и/или предупреждения ВИЧ и/или СПИД у млекопитающего. Пациенты представляют собой предпочтительно людей, инфицированных ВИЧ и содержащих счет клеток CD4+, равный приблизительно 700 клеток на мкл крови или менее, более предпочтительно в интервале между приблизительно 200 и 700 клеток на мкл крови, например между приблизительно 200 и 500 клеток или приблизительно 200 и 600 или 500 и 700 клеток на мкл крови. В одном варианте осуществления пациенты имеют счет клеток CD4+, равный 700 или менее, но не те, кто проходит высокоактивную антиретровирусную терапию (HAART).
В одном варианте осуществления пищевые композиции представляют собой предпочтительно пищевые добавки и содержат олигосахариды и цистеин и/или источник цистеина.
Олигосахариды
Композиции в соответствии с изобретением содержат терапевтически эффективное количество олигосахаридов, предпочтительно кислых олигосахаридов и/или нейтральных олигосахаридов, как описано ниже.
Кислые олигосахариды содержат, по меньшей мере, одну кислотную группу, в то время как нейтральные олигосахариды не имеют такой кислотной группы. Разрабатываются пищевые клетчатки в значительной степени для оказания ими воздействий, благоприятных для здоровья. Некоторые клетчатки являются нерастворимыми и не подверженными воздействию ферментов и проходят неизмененными через кишечник. Другие типы клетчаток могут служить в качестве пребиотиков, т.е. они используются бактериями кишечника и стимулируют их рост. Таким образом, документально подтверждается, что клетчатки, такие как инулин или олигосахариды, такие как галактоолигосахариды (ГОС) и фрукто-олигосахариды (ФОС) стимулируют рост бифидобактерий и молочнокислых бактерий, которые являются важными для здоровой кишечной флоры.
Кислые олигосахариды
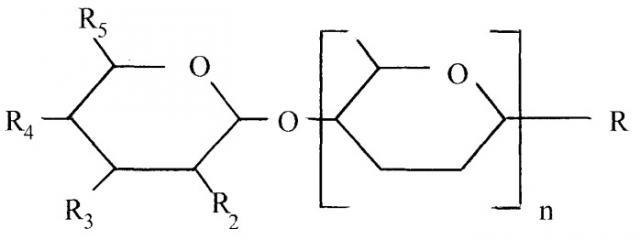
Термин “кислые олигосахарид(ы)” относится к олигосахаридам, содержащим, по меньшей мере, одну кислотную группу, выбранную из группы, состоящей из N-ацетилнейраминовой кислоты, N-гликолоилнейраминовой кислоты, свободной или этерифицированной карбоновой кислоты, группы серной кислоты и группы фосфорной кислоты. В одном варианте осуществления кислый олигосахарид предпочтительно представляет собой полигексозу. Предпочтительно, по меньшей мере, одна из вышеупомянутых кислотных групп расположена на концевой единице гексозы кислого олигосахарида. Предпочтительно, кислый олигосахарид имеет структуру, как изображено на Фиг.1, где концевая гексоза (левая) предпочтительно содержит двойную связь. Предпочтительно, кислый олигосахарид содержит карбоновую кислоту на концевой единице гексозы, где указанная группа карбоновой кислоты может быть свободной или этерифицированной. Способы производства этерифицированных гидролизатов пектина, которые могут подходящим образом использоваться в настоящих способе и композиции, предоставлены в WO 01/60378 и/или WO 02/42484, которые включены в данное описание в качестве ссылки. Единицы гексозы, отличные от концевых единиц(ы) гексозы, могут предпочтительно являться единицами уроновой кислоты, даже более предпочтительно единицами галактуроновой кислоты. Группы карбоновой кислоты на этих единицах могут быть свободными или (частично) этерифицированными и предпочтительно, по меньшей мере, на 10% метилированы (см. ниже).
Фиг.1. Полимерный кислый олигосахарид
где:
R предпочтительно выбирают из группы, состоящей из водорода, гидрокси или кислотной группы, предпочтительно гидрокси; и
по меньшей мере, один заместитель, выбранный из группы, состоящей из R2, R3, R4 и R5, представляет собой N-ацетилнейраминовую кислоту, N-гликолоилнейраминовую кислоту, свободную или этерифицированную карбоновую кислоту, группу серной кислоты и группу фосфорной кислоты, а оставшиеся R2, R3, R4 и R5 представляют собой гидрокси и/или водород. Предпочтительно один заместитель, выбранный из группы, состоящей из R2, R3, R4 и R5, представляет собой N-ацетилнейраминовую кислоту, N-гликолоилнейраминовую кислоту, свободную или этерифицированную карбоновую кислоту, группу серной кислоты и группу фосфорной кислоты, а оставшиеся представляют гидрокси и/или водород. Еще более предпочтительно один заместитель, выбранный из группы, состоящей из R2, R3, R4 и R5, представляет свободную или этерифицированную карбоновую кислоту, а оставшиеся R2, R3, R4 и R5 представляют гидрокси и/или водород; и
n представляет собой целое число и относится к количеству единиц гексозы (см. также Степень Полимеризации, ниже), которые могут являться любой единицей гексозы. Подходящим образом, n представляет собой целое число в интервале 1-5000. Предпочтительно единица (единицы) гексозы являются единицей уроновой кислоты.
Наиболее предпочтительно R1, R2 и R3 представляют собой гидрокси, R4 представляет водород, R5 представляет карбоновую кислоту, n является числом между 1 и 250, предпочтительно между 1 и 10 и единица гексозы представляет собой галактуроновую кислоту.
Обнаружение, измерение и анализ кислых олигосахаридов, как используют в настоящем способе, даны в более ранней патентной заявке заявителя, относящейся к кислым олигосахаридам, т.е. WO 01/60378, которая включена в данное описание в качестве ссылки.
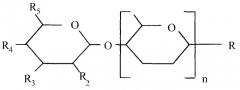
Предпочтительно, кислый олигосахарид имеет одну, предпочтительно две, концевых единиц уроновой кислоты, которые могут быть свободными или этерифицированными. Предпочтительно, концевую единицу уроновой кислоты выбирают из группы, состоящей из галактуроновой кислоты, глюкуроновой кислоты, гулуроновой кислоты, идуроновой кислоты, маннуроновой кислоты, рибуроновой кислоты и альтуроновой кислоты. Эти единицы могут быть свободными или этерифицированными. В одном варианте осуществления концевая единица гексозы имеет двойную связь, которая предпочтительно расположена между положениями С4 и С5 концевой единицы гексозы. Предпочтительно одна из концевых единиц гексозы содержит двойную связь. Концевая гексоза (например, уроновая кислота) предпочтительно имеет структуру в соответствии с Фиг.2.
Фиг.2. Предпочтительная концевая кислотная группа гексозы
где:
R предпочтительно выбирают из группы, состоящей из водорода, гидрокси или кислотной группы, предпочтительно гидрокси (см. выше); и
по меньшей мере, один заместитель, выбранный из группы, состоящей из R2, R3, R4 и R5, представляет собой N-ацетилнейраминовую кислоту, N-гликолоилнейраминовую кислоту, свободную или этерифицированную карбоновую кислоту, группу серной кислоты и группу фосфорной кислоты, а оставшиеся R2, R3, R4 и R5 представляют собой гидрокси и/или водород. Предпочтительно один заместитель, выбранный из группы, состоящей из R2, R3, R4 и R5, представляет собой N-ацетилнейраминовую кислоту, N-гликолоилнейраминовую кислоту, свободную или этерифицированную карбоновую кислоту, группу серной кислоты и группу фосфорной кислоты, а оставшиеся из R2, R3, R4 и R5 представляют собой гидрокси и/или водород. Еще более предпочтительно один заместитель, выбранный из группы, состоящей из R2, R3, R4 и R5, представляет свободную или этерифицированную карбоновую кислоту, а оставшиеся R2, R3, R4 и R5 представляют собой гидрокси и/или водород; и n представляет собой целое число и относится к количеству единиц гексозы (см. также Степень Полимеризации, ниже), которые могут являться любой единицей гексозы. Подходящим образом, n представляет собой целое число в интервале 1-5000, представляя количество единиц гексозы, причем указанные единицы гексозы предпочтительно являются единицами уроновой кислоты, даже более предпочтительно единицами галактуроновой кислоты. Группы карбоновой кислоты на этих единицах могут быть свободными или (частично) этерифицированными и предпочтительно, по меньшей мере, частично метилированными.
Наиболее предпочтительно R2 и R3 представляют собой гидрокси, R4 представляет водород и R5 представляет свободную или этерифицированную карбоновую кислоту.
В одном варианте осуществления композиции содержат единственный тип кислого олигосахарида (имеющего однородную степень полимеризации), в то время как в еще одном варианте осуществления композиции содержат смесь кислых олигосахаридов, которые имею различные Степени Полимеризации (СП) и/или содержат как насыщенную, так и ненасыщенную концевую единицу гексозы. Предпочтительно, по меньшей мере, 5%, более предпочтительно, по меньшей мере, 10%, даже более предпочтительно, по меньшей мере, 25% концевых единиц глюкозы кислого олигосахарида составляет ненасыщенная единица гексозы (см., например, Фиг.2). Поскольку каждый индивидуальный кислый олигосахарид предпочтительно содержит только одну ненасыщенную концевую единицу гексозы, предпочтительно не более чем 50% из концевых единиц гексозы составляет ненасыщенная единица гексозы (т.е. содержит двойную связь).
Смесь кислых олигосахаридов предпочтительно содержит между 2 и 50% ненасыщенных единиц гексозы в расчете от общего количества единиц гексозы, предпочтительно между 10 и 40%.
Кислый олигосахарид, как использован в настоящем способе, имеет степень полимеризации (СП) от 1 до 5000, предпочтительно от 1 до 1000, более предпочтительно от 2 до 250, даже более предпочтительно от 2 до 50, наиболее предпочтительно от 2 до 10. Если используют смесь кислотных олигосахаридов с различными степенями полимеризации, средняя СП смеси кислого олигосахарида равна предпочтительно от 2 до 1000, более предпочтительно от 3 до 250, даже более предпочтительно от 3 до 50. См. также Фиг.1, где сумма “n” и концевой единицы (т.е. n+1) представляет собой степень полимеризации. Было найдено, что более низкая СП олигосахаридов улучшает вкусовую привлекательность и приводит к пониженной вязкости продукта, если кислый олигосахарид вводят в жидкой форме. Кислый олигосахарид может представлять собой гомогенный или гетерогенный углевод.
Кислые олигосахариды, применяемые в изобретении, предпочтительно получают из пектина, пектата, альгината, хондроитина, гиалуроновых кислот, гепарина, гепарана, бактериальных углеводов, сиалогликанов, фукоидана, фукологосахаридов или каррагинана, предпочтительно из пектина и/или альгината. Кислые олигосахариды могут быть получены способами, описанными в WO 01/60378, например химическим или ферментативным гидролизом или частичным гидролизом, см. страницу 8 и 9, которая включена здесь в качестве ссылки.
Альгинаты представляют собой линейные неразветвленные полимеры, содержащие остатки β-(1→4)-связанной D-маннуроновой кислоты и α-(1→4)-связанной L-гулуроновой кислоты с широким интервалом средних молекулярных масс (100-100000 остатков). Подходящие источники альгината включают водоросли и бактериальные альгинаты.
Пектин разделяют на две основные категории: высокометоксилированный пектин, который характеризуется степенью метоксилирования выше 50%, и низкометоксилированный пектин, имеющий степень метоксилирования ниже 50%. Как использовано здесь, подразумевают, что “степень метоксилирования” (также именуемая СЭ или “степень этерификации”) означает степень, до которой группы свободной карбоновой кислоты, содержащейся в цепи полигалактуроновой кислоты, были этерифицированы (например, посредством метилирования). Представленный кислый олигосахарид предпочтительно получают из высокометоксилированного пектина.
Кислый(е) олигосахариды предпочтительно характеризуются степенью метоксилирования выше 20%, предпочтительно выше 50%, даже более предпочтительно выше 70%. Предпочтительно кислые олигосахариды имеют степень метилирования выше 20%, предпочтительно выше 50%, даже более предпочтительно выше 70%.
Кислые олигосахарид(ы) предпочтительно вводят в количестве от приблизительно 10 мг до 100 грамм в день, предпочтительно от приблизительно 100 мг до 50 грамм в день, даже более предпочтительно от приблизительно 0,5 до 20 грамм в день.
Нейтральные олигосахариды
Как упомянуто выше, композиции могут также содержать один или более нейтральных олигосахаридов, либо вместо или в добавление к одному или более из кислых олигосахаридов. Один или более нейтральных олигосахаридов выбирают из группы, состоящей из целлобиозы, целлодекстринов, В-циклодекстринов, неперевариваемого декстрина, гентиоолигосахаридов, глюкоолигосахаридов, изомальтоолигосахаридов, изомальтозы, изомальтриозы, панозы, лейкрозы, палатинозы, теандерозы, D-агатозы, D-lyxo-гексулозы, лактосахарозы, α-галактоолигосахаридов, β-галактоолигосахаридов, трансгалактоолигосахаридов, лактулозы, 4'-галатозиллактозы, синтетического галактоолигосахарида, фруктанов - Леван-типа, фруктанов - Инулин-типа, 1 f-β-фруктофуранозилниктозы, лакто N-тетраозы, лакто N-неотетраозы, ксилоолигосахарида, лафинозы, лактосахарозы и арабиноолигосахаридов.
Предпочтительно нейтральный олигосахарид выбирают из группы, состоящей из галактоолигосахарида, фруктоолигосахарида, трансгалактоолигосахарида, ксилоолигосахарида, лактосахарозы и арабиноолигосахаридов. Даже более предпочтительно нейтральный олигосахарид выбирают из группы, состоящей из галактоолигосахарида, фруктоолигосахарида и трансгалактоолигосахарида.
Предпочтительно композиция содержит два химически различных нейтральных олигосахарида, один из которых выбирают из группы, состоящей из нейтрального олигосахарида на основе галактозы, а другой выбирают из группы олигосахарида на основе фруктозы и/или глюкозы.
Более предпочтительно композиция содержит фруктоолигосахарид и, по меньшей мере, один олигосахарид, выбранный из трангалактоолигосахарида и галактоолигосахарида.
Предпочтительные суточные количества нейтральных олигосахаридов составляют от приблизительно 10 мг до 100 грамм в день, предпочтительно от приблизительно 100 мг до 50 грамм в день, даже более предпочтительно от приблизительно 0,5 до 20 грамм в день.
Предпочтительно применяют композицию, содержащую нейтральные и кислые олигосахариды, где, по меньшей мере, 15% от общих олигосахаридов состоят из кислых олигосахаридов, более предпочтительно от 10 до 90% и наиболее предпочтительно от 25 до 75%. Предпочтительно применяют композицию, где, по меньшей мере, 25% от олигосахаридов представляют собой кислые олигосахариды, содержащие, по меньшей мере, одну концевую единицу уроновой кислоты.
Цистеин или источник цистеина
Предоставленные композиции содержат в дополнение к одному или более олигосахаридам, как описано выше, подходящее количество цистеина и/или источника цистеина. Фраза “источник цистеина” относится здесь ко всем соединениям, которые содержат биологически доступный цистеин, в любой форме, и рассчитывают как количество аминокислоты цистеина, которая присутствует в соединении или может быть произведена из соединения в организме после приема внутрь, на молярной основе.
Ниже здесь “цистеиновый эквивалент” относится к количеству цистеина как таковому или количеству цистеина, которое присутствует в источнике цистеина. Например, 100 мг NAC (N-ацетилцистеин; ММ=163,2) эквивалентно 74 мг цистеина (ММ 121,15). Таким образом, 100 мг NAC равно 74 мг цистеинового эквивалента. Сходным образом, это может применяться к белкам или пептидам. Когда пептид (ММ = хДальтон) содержит 3 аминокислоты цистеина (3уДальтон), тогда 100 мг этого пептида эквивалентно 100х3Y/X мг цистеина. Таким образом, 100 мг этого пептида равно 300 у/х мг цистеинового эквивалента.
Пригодные источники цистеина в соответствии с изобретением представляют собой, например, белки в денатурированной и/или неденатурированной форме, такие как белки молока, например белки сыворотки или казеина. Яичные белки богаты цистеином и, следовательно, также являются применимыми. Растительные белки, такие как из гороха, картофеля, сои и риса могут также применяться для предоставления цистеина. Также могут применяться гидролизаты этих белковых источников или фракции, обогащенные белками или пептидами богатыми цистеином (например, как описано в ЕР1201137). Кроме того, могут применяться синтетические цистеиновые эквиваленты, например производные цистеина, такие как цистеин, соли цистеина, N-ацетилцистеин и/или диацетилцистеин.
ВИЧ-инфицированным пациентам подходящим образом вводят суточную дозу, равную, по меньшей мере, приблизительно 100 мг цистеинового эквивалента, предпочтительно, по меньшей мере, приблизительно 200, 400 или 600 мг цистеинового эквивалента в день. Понимают, что суточная дозировка может быть подразделена на 2, 3 или более дозированных единиц, принимаемых несколько раз в день.
В еще одном варианте осуществления композиции в соответствии с изобретением содержат одно или более соединений, которые стимулируют уровни глутатиона, например липоевая кислота, пируват, оксалоацетат, оксалоаспартат обладают способностью к стимуляции уровней глутатиона. Такие соединения, стимулирующие уровень глутатиона, могут применяться в дополнение к цистеину, но также вместо цистеина. В еще одном варианте осуществления композиции, содержащие один или более олигосахаридов и цистеин и/или источник цистеина дополнительно содержат одну или более ПНЖК и/или одно или более биологически активных соединений, такие как соединения, найденные в молоке, или пробиотические микроорганизмы.
Пробиотический микроорганизм
Пробиотический микроорганизм означает микроорганизм, который благоприятно влияет на ВИЧ-пациента посредством улучшения его кишечного микробного баланса (Fuller, R. J. Applied Bacteriology, 1989; 66:365-378). Пробиотический микроорганизм может быть выбран из одного или более микроорганизмов, пригодных для потребления человеком и которые обладают способностью улучшать микробный баланс в кишечнике. Предпочтительно, настоящая композиция содержит от 104 до 1012, более предпочтительно от 105 до 1011, наиболее предпочтительно от 107 до 5×1010 колонийобразующих единиц (кое) пробиотических бактерий на грамм олигосахарида с уроновой кислотой со СП между 2 и 100. Настоящая композиция предпочтительно содержит от 102 до 1013 колонийобразующих единиц (кое) пробиотических бактерий на грамм сухой массы настоящей композиции, предпочтительно от 104 до 1012, более предпочтительно от 105 до 1010, наиболее предпочтительно от 105 до 1×109 кое. Дозировка пробиотических бактерий в соответствии с настоящим изобретением составляет предпочтительно между 102 до 1013, более предпочтительно от 105 до 1011, наиболее предпочтительно от 108 до 5×1010 колонийобразующих единиц (кое) в день. Предпочтительно используют живые или жизнеспособные бактерии, но могут также применяться мертвые бактерии или бактериальные фрагменты.
Предпочтительно настоящая композиция содержит бактерии рода Lactobacillus и/или Bifidobacterium. Предпочтительно композиция содержит Bifidobacterium, выбранные из группы, состоящей из B. longum, B. breve и B.bifidum и/или Lactobacillus, выбранные из L. casei, L. paracasei, L. rhamnosus, L. acidophilis и L. plantarum. Наиболее предпочтительно настоящая композиция содержит Bifidobacterium breve и/или Lactobacillus paracasei.
Bifidobacterium breve представляет собой грамположительную анаэробную, палочковидную бактерию. Настоящая B. breve предпочтительно имеет, по меньшей мере, 95% идентичность последовательности нуклеиновой кислоты от последовательности 16 S rРНК при сравнении с типовым штаммом B. breve АТСС 15700, более предпочтительно, по меньшей мере, 97%, 98%, 99% или более идентичность последовательности, как определено у Stackebrandt & Goebel, 1994, Int. J. Syst. Bacteriol. 44:846-849. Идентичность последовательности нуклеиновой кислоты рассчитывают для двух нуклеотидных последовательностей, когда они оптимально выровнены, используя программы GAP или BESTFIT с использованием параметров по умолчанию. Применяют параметры по умолчанию GAP c штрафом за создание зазора = 50 (нуклеотидов)/ 8 (белков) и штрафом за создание зазора = 3 (нуклеотида)/ 2 (белка). Для нуклеотидов использумой матрицей обсчета по умолчанию является nwsgapdna (Henikoff & Henikoff, 1992, PNAS 89, 915-919). Очевидно, когда говорят, что последовательности РНК являются по существу сходными или имеют определенную степень идентичности последовательности с последовательностями ДНК, тимин (Т) в последовательности ДНК считается равным урацилу (U) в последовательности РНК. Выравнивания последовательностей и оценки процента идентичности последовательности могут определяться с использованием компьютерных программ, таких как GCG Wisconsin Package, Version 10.3, доступная от Accelrys Inc., 9685 Scranton Road, San Diego, CA 92121-3752, USA или EMBOSSwin. v. 2.10.0. Bifidobacterium, применяемая в настоящем изобретении предпочтительно гибридизируется с зондом B. breve и дает сигнал в способе анализа с 5'-нуклеазой, как описано в рассматриваемых одновременно с настоящей заявкой международной патентной заявке PCT/NL2004/000748 и европейской патентной заявке 05075486.0 настоящего заявителя. В соответствии с предпочтительным вариантом осуществления настоящая композиция содержит, по меньшей мере, одну B. breve, выбранную из группы, состоящей из B. breve Bb-03 (Rhodia), B. breve M16-V (Morinaga), B. breve R0070 (Institute Rosell, Lallemand), DSM 20091 и LMG 11613. Наиболее предпочтительно, B. breve представляет собой B. breve M16-V (Morinaga).
В предпочтительном варианте осуществления настоящая композиция содержит Lactobacillus paracasei. Предпочтительно настоящий штамм L. paracasei имеет, по меньшей мере, 95%, более предпочтительно по меньшей мере 97%, 98%, 99% или более идентичность последовательности нуклеиновой кислоты от последовательности 16 S rРНК при сравнении с типовым штаммом L. paracasei АТСС 25032, как определено выше. Lactobacillus, применяемая в настоящем изобретении, предпочтительно гибридизируется с зондом L. paracasei и дает сигнал в способе анализа с 5'-нуклеазой, как описано в рассматриваемой одновременно с настоящей заявкой европейской патентной заявке 05075486.0 настоящего заявителя. В соответствии с предпочтительным вариантом осуществления, настоящая композиция содержит, по меньшей мере, L. paracasei, выбранную из группы L. paracasei F19 (Arla, Sweden), L. paracasei LAFTI L26 (DSM Food Specialties, the Netherlands) и L. paracasei CRL 431 (Chr. Hansen, Denmark), LMG 12165 и LMG 11407.
Полиненасыщенные жирные кислоты:
Авторы настоящего изобретения обнаружили, что эйкозапентаеновая кислота (ЭПК, n-3) и гамма-линоленовая кислота (ГЛК, n-6) эффективно снижают воспалительно опосредованную кишечную проницаемость при плотном контакте. Следовательно, предоставлена композиция, пригодная для улучшения целостности кишечного барьера, которая содержит (в дополнение к олигосахаридам и цистеину и/или источнику цистеина) ЭПК и/или ГЛК. Основываясь на биохимических путях, можно предложить гипотезу, что также другие сочетания жирных кислот являются также эффективными. Таким образом, также предоставлены композиции, содержащие одну или более других ПНЖК или их смеси. Например, может применяться смесь любых из ЭПК, докозагексаеновой кислоты (ДГК, n-3), дигомо-гаммалиноленовой кислоты (ДГЛК, С20:3n-6), стеаридоновой кислоты (СТК, С18:4n-4), альфа-линоленовой кислоты (АЛК, С18:3n-3), докозапентаеновой кислоты (ДПК, С22:5n-3), эйкозатетраеновой кислоты (С20:4n-3) и/или арахидоновой кислоты (АК, n-6).
Подходящим образом применяют относительно высокую суточную дозу полиненасыщенных жирных кислот. В одном варианте осуществления используют, по меньшей мере, приблизительно 25 эн%, предпочтительно, по меньшей мере, приблизительно 30 эн%, более предпочтительно, по меньшей мере, приблизительно 35 эн% жировой смеси, содержащей n-3 и/или n-6 жирные кислоты (эн% является краткой формой выражения процентного распределения энергии и представляет относительное количество, которое каждый компонент вносит в общую калорийность препарата). Предпочтительные суточ