Антивирусные нуклеозиды
Иллюстрации
Показать всеНастоящее изобретение относится к соединениям формулы (I), где R1 выбран из этила, н-пропила, изо-пропила или изобутила, и к его фармацевтически приемлемым солям. Кроме того, изобретение относится к фармацевтической композиции на основе указанных соединений, предназначенной для лечения заболевания, опосредованного вирусом гепатита С (HCV), а также к способу лечения заболевания, опосредованного вирусом гепатита С (HCV), и к способу избирательного O-ацилирования нуклеозида II для получения O-ацил нуклеозида I в щелочных реакционных условиях, включающему стадии: (i) растворение II и DMAP в гетерогенной смеси воды и растворителя и добавление водного основания для регулирования рН от около 7,5 до около 12; (ii) необязательное добавление достаточного количества насыщенного водного NaCl для получения двухфазной реакционной смеси; (iii) добавление ацилирующего агента и дополнительного основания, достаточного для сохранения рН от около 7,5 до около 12; (iv) мониторинг реакции и прерывание добавления указанного ацилирующего агента и указанного основания при достижении конверсии достаточного уровня; (v) необязательное контактирование O-ацилнуклеозида с фармацевтически приемлемой кислотой для образования фармацевтически приемлемой соли. 4 н. и 5 з.п. ф-лы, 2 табл.
Реферат
Настоящее изобретение относится к ацилированным нуклеозидам, которые представляют собой пролекарства-предшественники ингибитора РНК-зависимой полимеразы вирусной РНК вируса гепатита С (HCV). При введении этих соединений оральным путем они легко абсорбируются из желудочно-кишечного тракта и эффективно превращаются в крови в исходную форму нуклеозида. Эти лекарства являются ингибиторами репликации РНК-зависимой вирусной РНК и используются в качестве ингибиторов HCV NS5B полимеразы, в качестве ингибиторов HCV репликации и для лечения гепатита С у млекопитающих.
Изобретение относится к нуклеозидным пролекарствам, которые являются ингибиторами HCV репликации. В частности, изобретение касается применения ацилированных производных пиримидиновых нуклеозидов, которые обеспечивают улучшенную абсорбацию лекарства при оральном введении нуклеозида.
Вирус гепатита С во всем мире представляет собой значительную проблему для здоровья и является основной причиной хронических заболеваний печени (Воуеr N. et al., J. Hepatol. 2000, 32:98-112). Для пациентов, инфицированных HCV, существует угроза развития цирроза печени и затем гепатоцеллюлярной карциномы, поэтому HCV является основным фактором для пересадки печени.
Согласно данным Всемирной Организации Здравоохранения во всем мире инфицировано 200 миллионов человек и каждый год инфицируется, по крайней мере, 3-4 миллиона человек. Около 20% инфицированных лиц побеждают инфекцию и освобождаются от вируса, а остальные могут оставаться носителями вируса HCV всю оставшуюся жизнь. У 10-20% инфицированных людей в конце концов развиваются цирроз или рак, разрушающие печень. Заражение вирусом происходит парентерально при использовании зараженной крови или ее составляющих (продуктов), инфицированных матерей или матерей-носителей к их потомству. Современное лечение HCV инфекций, которое сводится к иммунотерапии с помощью рекомбинантного интерферона-α самого по себе или в сочетании с нуклеозидным аналогом рибавирином, приносит ограниченную лечебную пользу, так как быстро развивается невосприимчивость. Таким образом, существует неотложная потребность в улучшенных терапевтических средствах, которые эффективно побороли бы хроническое HCV заболевание.
Согласно классификации HCV являются членом семейства вирусов Flaviviridae, которое включает роды flaviviruses, pestiviruses и hepaciviruses, которые включают вирусы гепатита С (Rice, RAU/02.10.2006 C.M.Flaviviridae: The viruses and their replication, b: Fields Virology, Editors: Fields B.N., Knipe D.M., Howley P.M., Lippincott-Raven Publishers, Philadelphia, Pa., Chapter 30, 931-959, 1996). HCV представляет собой оболочечный вирус, содержащий геном из позитивно направленной одноцепочечной РНК в приблизительно 9,4 кб. Геном вируса состоит из 5′-нетранслируемого региона (UTR), протяженной открытой рамки считывания (ORF), кодирующей предшественник полипротеина приблизительно из 3011 аминокислот, и короткий 3′ UTR. 5′ UTR является самой высококонсервативной частью генома HCV и важна для инициации и контроля трансляции полипротеина.
Генетическим анализом HCV было определено шесть основных генотипов, показывающих>30% отличий в последовательностях ДНК. Каждый генотип включает серию нескольких близкородственных подтипов, которые показывают 20-25% отличий в нуклеотидных последовательностях (Simmonds P., 2004, J. Gen. Vilor., 85:3173-88). Более 80 подтипов уже охарактеризованы. В США примерно 70% инфицированных заражено типом 1а и 1b. Тип 1b - наиболее распространенный подтип в Азии. (X. Forns, J. Bukh, Clinics in Liver Disease, 1999, 3:6930716; J. Bukh et al., Semin. Liv. Dis. 1995, 15:41-63). К сожалению, заражения Типом 1 более устойчивы к терапии, чем генотипы Типа 2 или 3 (N.N.Zein, Clin. Microbiol. Rev., 2000, 13:223-235).
Генетическая организация и полипротеиновый процессинг части ORF, относящейся к неструктурному белку, у пестивирусов и гепатовирусов очень похожи. Эти вирусы с положительно-направленными цепочками РНК имеют одну обширную ORF, кодирующую все вирусные белки, необходимые для вирусной репликации. Эти белки экспрессируются как полипротеин, который ко- и посттрансляционно создается как клеточными, так и кодируемыми вирусом протеиназами с получением в результате зрелых вирусных белков. Эти вирусные белки, которые отвечают за репликацию вирусной геномной РНК, локализованы ближе к С-концу. Две третьих ORF называются неструктурными (NS) белками. И у пестивирусов, и у гепатовирусов в зрелых неструктурных (NS) белках на участке от аминоконца региона, кодирующего неструктурные белки, до карбоксиконца ORF, последовательно содержатся р7, NS2, NS3, NS4A, NS4B, NS5A и NS5B.
NS белки пестивирусов и гепатовирусов распределяются в последовательностях доменов, которые характерны для определенных функциональных белков. Например, NS3 белки вирусов обеих групп включают основные аминокислотные последовательности (мотивы), характерные для сериновых протеиназ и геликаз (Gorbalenya et al. Nature 1988, 333:22, Bazan and Fletterick, Virology, 1989, 171:637-639; Gorbalenya et al., Nucleic Acid Res. 1989, 17. 3889-3897). Аналогично NS5B белки пестивирусов и гепатовирусов несут последовательности, характерные для РНК-направленных РНК-полимераз (Koonin E.V., Dolja V.V., Grit. Rev. Biochem. Molec. Biol. 1993, 28:375-430).
Фактическое предназначение и функции NS белков пестивирусов и гепатовирусов в жизненном цикле вирусов, в основном, аналогичны. В обоих случаях NS3 сериновая протеиназа ответственна за протеолитический процессинг предшественников полипротеина ниже его положения в ORF (Wiskerchen, Collet, Virology, 1991, 184:341-350; Bartenschlager et al. J. Virol. 1993 67:3835-3844; Eckart et al. Biochem. Biophys. Res. Comm. 1993 192:399-406; Grakoui et al. J.Virol. 1993 67:2832-2843; Grakoui et al. Proc. Natl. Acad. Sci. USA 1993 90:10583-10587; Ilijikata et al. J.Virol. 1993 67:4665-4675; Tome et al. J. Virol. 1993 67:4017-4026). NS4A белок в обоих случаях действует как кофактор NS3 сериновой протеиназы (Bartenschlager et al. J. Virol. 1994 68:5045-5055; Failla et al. J. Virol. 1994 68:3753-3760; Xu et al. J. Virol. 1997 71:53 12-5322). NS3 белок обоих типов вирусов также функционирует как геликаза (Kim et al. Biochem. Biophys. Res. Comm. 1995 215:160-166; Jin, Peterson Arch. Biochem. Biophys. 1995, 323:47-53; Warrener, Collett J. Virol. 1995 69:1720-1726). Наконец, NS5B белки пестивирусов и гепатовирусов обладают предсказанной заранее активностью РНК-направленных РНК-полимераз (Behrens et al. ЕМВО 1996 15:12-22; Lechmann et al. J. Virol. 1997 71:8416-8428; Yuan et al. Biochem. Biophys. Res. Comm. 1997 232:231-235; Hagedom, PCTWO 97/12033; Zhong et al. J. Virol. 1998 72:9365-9369).
В настоящее время существует ограниченное количество одобренных терапевтических методов, которые повсеместно были бы признаны пригодными для лечения HCV инфекции. Новые и уже существующие терапевтические подходы для лечения HCV и ингибирования HCV NS5B полимеразы описаны в следующих работах: R.G.Gish, Sem. Liver. Dis., 1999 19:5; Di Besceglie, A.M. And Bacon, B. R., Scientific American, October: 1999 80-85; G. Lake-Bakaarm Current and Future Therapy for Chronic Hepatitis С Virus Liver Disease, Curr. Drug Targ Infect Dis. 2003 3(3):247-253; P. Hoffmann et al. Recent patents on experimental therapy for hepatitis С vims infection (1999-2002), Exp.Opin. Ther. Patents 2003 13(11):1707-1723; F. F. Poordad et al. Developments in Hepatitis С therapy drug during 2000-2002, Exp.Opin. Emerging Drugs 2003 8(1):9-25; M.P. Walker et al.. Promising Candidates for the treatment of chronic hepatitis C, Exp.Opin. Investig. Drugs 2003 12(8): 1269-1280; S. - L. Tan et al. Hepatitis С Therapeutics: Current Status and Emerging Strategies, Natire Rev. Drug Discov. 2002 1:867-881; R. De Francesco et al. Approaching a new era for hepatitis С virus therapy: inhibitors of the NS3-4A serine protease and the NS5B RNA-dependent RNA polymerase. Antiviral Res. 2003 58:1-16; Q.M. Wang et al. Hepatitis С virus encoded proteins: targets for antiviral therapy. Drugs of the Future 2000 25(9):933-8-944; J. A. Wu and Z. Hong, Targeting NS5B-Dependent RNA Polymerase forAnti-HCV Chemotherapy Cur. Dmg Targ.-Inf. Dis. 2003 3:207-219.
В этих работах упоминаются соединения сразу же по мере их создания. Сочетанная (комбинационная) терапия на основе двух или трех средств, направленных на одни и те же или различные цели, стала стандартной терапией для подавления или замедления распространения устойчивых штаммов вируса, а соединения, раскрытые в вышеупомянутых работах, могут использоваться при сочетанной терапии вместе с соединениями настоящего изобретения.
Рибавирин (1а; амид 1-((2R, 3R, 4S, 5R)-3,4-Дигидрокси-5-гидроксиметил-тетрагидро-фуран-2-ил)-1Н-[1,2,4]триазол-3-карбоновой кислоты; VIRAZOLE®) является синтетическим неиндуцирующим интерферон аналогом нуклеозида с антивирусной активностью широкого спектра действия. Рибавирин обладает in vitro активностью в отношении ряда ДНК- и РНК-вирусов, включая Flaviviridae (Gary L. Davis, Gastroenterology 2000 118:S104-S114). При монотерапии рибавирин снижает уровни сывороточной амино-трансферазы до нормального у 40% пациентов, но он не снижает в сыворотке уровни HCV-RNA. Рибавирин показывает также значительную токсичность, и известно, что он вызывает анемию. Рибавирин не утвержден к применению против HCV как средство монотерапии, но применение этого соединения одобрено в сочетанной терапии вместе с интерфероном α-2а и интерфероном α-2b. Вирамидин 1b является пролекарством, превращающимся в 1а в гепатоцитах.
Интерфероны (IFNs) уже применяются для лечения хронического гепатита в течение примерно десяти лет. IFNs представляют собой гликопротеины, вырабатываемые иммунными клетками в ответ на вирусное заражение. Распознают два различных типа интерферонов: Тип 1 включает несколько интерферонов альфа и один интерферон β, Тип 2 включает интерферон γ. Интерферон Типа 1 продуцируется, главным образом, инфицированными клетками и предохраняет соседние клетки от de novo заражения. IFNs ингибируют репликацию многих вирусов, включая HCV, и при использовании в качестве монотерапевтического средства для лечения гепатита С IFN подавляет сывороточную HCV-RNA до недетектируемых уровней.
Кроме этого, IFN нормализует уровни аминотрансферазы в сыворотке. К сожалению, действие IFN временное. Прекращение (перерыв) лечения приводит к 70% случаев рецидивов и только в 10-15% случаях наблюдается устойчивая длительная вирологическая реакция с нормальными уровнями сывороточной аланинтрансферазы (L. - B. Davis, см. выше).
Неким ограничением ранней IFN терапии является быстрое выведение (клиренс) белка из крови. Химическая дериватизация IFN с помощью полиэтиленгликоля (PEG) привела к существенно улучшенным фармакокинетическим свойствам белков. PEGASIS® представляет собой конъюгат интерферона α-2b и 12 кДа моно-метокси PEG. (В.A. Luxon et al., Clin. Therap.2002 24(9): 13631383; A. Kozlowski and J.M.Harris, J. Control. Release, 2001, 72:217-224).
Интерферон α-2а и интерферон α-2b недавно были одобрены как средства для монотерапии при лечении HCV, ROFERON-A® является рекомбинантной формой интерферона α-2а. PEGASIS® (Roche) является пэгилированной (т.е. модифицированной полиэтиленгликолем) формой интерферона α-2а. INTRON-A® (Sobering Corporation) является рекомбинантной формой интерферона α-2b, a PEG-INTRON® (Schering Corporation) является пэгилированной формой интерферона α-2b.
Другие формы интерферона α, так же, как и интерферона β, γ, τ и ω, в настоящее время находятся на стадии клинических испытаний в целях лечения HCV. Например, INFERGEN® (интерферон альфакон-1) от biterMune, OMNIFERON® (природный интерферон) от Viragen, ALBUFERON® от Human Genome Sciences, REBIF® (интерферон (3-1 а) от Ares-Serono, Omega Interferon от BioMedicine, Oral Interferon Alpha от Amarillo Bosciences, а также интерферон γ-1b от InterMune проходят испытания,
Сочетанная терапия HCV рибавирином и интерфероном-α в настоящее время показала себя как оптимальная терапия. Сочетание рибавирина и PEG-IFN (см. ниже) приводит к продолжительной реакции на вирус у 54-56% пациентов. SVR достигает 80% для Типа 2 и 3 HCV. (Walker, см. выше). К сожалению, это сочетание дает также и побочные эффекты, которые вызывают клинические проблемы. С подкожным введением IFN-a связывают такие симптомы, как депрессия, гриппоподобные симптомы и кожные реакции, а гемолитическую анемию связывают с рибавирином, вводимым непрерывно.
Другими макромолекулярными соединениями, которые проходят в настоящее время предклинические и клинические испытания, в плане лечения вирусного гепатита С, являются: Interleukin-10 от Schering-Plough, IPSO 1 от bitermenron, Merimebodlib (VX-497) от Vertex, HEPTAZYME® от RPI, IDN-6556 от Idun Pharma, XTL-002 от XTL, HCV/MFS9 от Chiron, CIVACIR® (иммуноглобулин к гепатиту С) от NABI, ZADAXIN® (тимозин α-1) от SciClone, тимозин плюс пегилированный интерферон от SciClone, CEPLENE®; терапевтическая вакцина от Epimmune/Genencor, терапевтическая вакцина от Merix, терапевтическая вакцина, ChronVacC, от Tripep.
Другие микромолекулярные методы включают рибозимы, нацеленные на HCV RNA. Рибозимы - это небольшие молекулы природного происхождения с эндонуклеазной активностью, которые катализируют секвенс-специфичное расщепление РНК. Альтернативный подход заключается в применении антисмысловых олигонуклеотидов, связывающих РНК и стимулирующих опосредованное РНК-азойН расщепление.
В настоящее время уже идентифицирован ряд потенциальных молекулярных мишеней для разработки и испытания их в качестве анти-HCV терапевтических средств, например, NS2-NS3 аутопротеаза, N3 протеаза, N3 геликаза и NS5B полимераза. РНК-зависимая РНК-полимераза абсолютно необходима для репликации одноцепочечной смысловой РНК генома, и поэтому этот энзим вызывает значительный интерес у медиков и фамацевтов.
Нуклеозидные ингибиторы NS5B полимеразы могут действовать либо как субстрат неприродного происхождения, что приводит в результате к терминации цепи, либо как конкурентный ингибитор, который конкурирует со связыванием нуклеотида с полимеразой. Для того чтобы функционировать как терминатор цепи, нуклеозидный аналог должен быть поглощенным клеткой и превращенным in vivo в трифосфат, чтобы конкурировать за сайт нуклеотидного связывания полимеразы. Эта конверсия в трифосфат обычно происходит при участии клеточных киназ, что обуславливает дополнительные структурные требования к потенциальному нуклеозидному ингибитору полимеразы. К сожалению, это ограничивает прямую оценку нуклеозидов как ингибиторов HCV репликации в исследованиях, проводимых на клетках, поддающихся in situ фосфорилированию.
В=аденин, тимидин, урацил, цитидин, гуанин и гипоксантин.
В WO 0190121, опубликованной 29 ноября 2001 г., J.-P.Sommadossi и Р.Lacolla описали и дали примеры активности анти-HCV полимеразы в части 1′-алкил- и 2′-алкилнуклеозидов формул 2 и 3. В WO 01/92282, опубликованной 6 декабря 2001, J.-P.Sommadossi и Р.Lacolla раскрыли и описали примеры лечения Flaviviruses и Pestiviruses 1′-алкил- и 2′-алкилнуклеозидами формул 2 и 3. В WO 03/026675, опбликованной 3 апреля 2003 г., G. Gosselin описал применение 4′-алкилнуклеозидов формулы 4 для лечения Flaviviruses и Pestiviruses.
В WO 2004003000, опубликованной 8 января 2004 г., J.-P.Sommadossi et al. описали 2′- и 3′-пролекарства на основе 1′-, 2′-, 3′- и 4′-замещенных β-D и β-L-нуклеозидов. В WO 2004/002422, опубликованной 8 января 2004 г., описан 2′-С-метил-3′-O-валиновый эфир рибофуранозилцитидина для лечения заражения Flaviviridae. Idenix сообщил о клинических испытаниях родственного соединения NM283, которое, как полагают, является эфиром валина 5 и аналога 2 цитидина (В=цитозин). В WO 2004/002999, опубликованной 8 января 2004 г., J.-P.Sommadossi et al. описали серию 2′ или 3′ пролекарств из 1′, 2′, 3′ или 4′-разветвленных нуклеозидов для лечения заражений флавивирусами, в том числе HCV инфекций.
В WO 2004/046331, опубликованной 3 июня 2004 г., J.-P.Sommadossi et al. описали 2′-разветвленные нуклеозиды и мутацию Flaviviridae. В WO 03/026589, опубликованной 3 апреля 2003 г., G.Gosselin et al. описали способы лечения вирусного гепатита C с помощью 4′-модифицированных нуклеозидов. В WO 2005009418, опубликованной 3 февраля 2005 г., R.Storer et al. описали пуриновые нуклеозидные аналоги для лечения заболеваний, вызываемых, в том числе, Flaviviridae.
Другие патентные заявки раскрывают применение определенных нуклеозидных аналогов для лечения вирусного гепатита С. В WO 01/32153, опубликованной 10 мая 2001 г., R.Storer описал производные нуклеозидов для лечения вирусных заболеваний. В WO 01/60315, опубликованной 23 августа 2001 г., Н.Ismaili et al. описали способы лечения или профилактики заражений, вызванных Flaviviruses, с помощью производных нуклеозидов. В WO 02/18404, опубликованной 7 марта 2002 г., R.Devos et al. описали 4′-замещенные нуклеозиды для лечения вирусного HCV. В WO 01/79246, опубликованной 25 октября 2001 г., К.A.Watanabe описал производные 2′ или 3′-гидроксиметил-нуклеозидов для лечения вирусных заболеваний. В WO 02/32920, опубликованной 25 апреля 2002 г., и в WO 02/48165, опубликованной 20 июня 2002 г., L.Stuyver et al. описали производные нуклеозидов для лечения вирусных заболеваний.
В WO 03/105770, опубликованной 24 декабря 2003 г., В. Bhar et al. описали ряд карбоциклических нуклеозидных производных, которые ингибируют РНК-зависимую РНК-полимеразу вируса. Нуклеозиды, раскрытые в этой публикации, являются, в основном, 2′-метил-2′-гидроксизамещенными нуклеозидами. В WO 2002/057425, опубликованной 25 июля 2002 г., S.S.Carroll et al. описали производные нуклеозидов, которые ингибируют РНК-зависимую вирусную полимеразу, и способы лечения HCV заболеваний.
В WO 02/057287, опубликованной 25 июля 2002 г., S.S.Carroll et al. описали родственные 2α-метил и 2β-метилрибозные производные, в которых основания необязательно замещены 7Н-пирроло[2,3-(1]пиримидиновым радикалом 6. В той же самой заявке приведен один пример на 3β-метил-нуклеозид. S.S.Carroll et al. (J.Biol.Chem. 2003 278(14):11979-11984), описали ингибирование полимеразы HCV 2′-O-метилцитидином (6а). В WO 2004/009020, опубликованной 29 января 2004 г., D.В.Olsen et al. описали ряд тионуклеозидных производных как ингибиторов РНК-зависимой РНК-полимеразы вируса.
РСТ публикация №WO 99/43691, на имя Emory University, озаглавленная «2′-Фторнуклеозиды», описывает применение определенных 2′-фторнуклеозидов для лечения HCV. US патент №6348587, выданный Emory University, озаглавленный «2′-Фторнуклеозиды», раскрывает ряд семейств 2′-фторнуклеозидов, полезных при лечении гепатита В, HCV, HIV и анормальной клеточной пролиферации. Обе конфигурации 2′-фторзаместителя раскрыты.
Eldrup et al. (Oral Session V, Hepatitis С Virus, Flaviviridae; 16th International Conference on Antiviral Research (Apr. 27, 2003, Savannah, Ga.)) охарактеризовали взаимосвязь между структурой и активностью для 2′-модифицированных нуклеозидов в плане ингибирования HCV.
Bhat et al. (Oral Session V, Hepatitis С Virus, Flaviviridae; 16th International Conference on Antiviral Research (Apr. 27, 2003, Savannah, Ga.) p A75) описали синтез и фармакокинетические свойства нуклеозидных аналогов как возможных ингибиторов репликации РНК HCV. Авторы сообщили, что 2′-модифицированные нуклеозиды показывают высокую ингибирующую активность в исследованиях на клеточных репликонах.
Olsen et al. (Oral Session V, Hepatitis C Virus, Flaviviridae; 16th International Conference on Antiviral Research (Apr. 27, 2003, Savannah, Ga.) p A76) также показали действие 2'-модифицированных нуклеозидов на репликацию РНК HCV.
Ненуклеозидные аллостерические ингибиторы обратной транскриптазы HIV обладают доказанным эффективным терапевтическим действием как сами по себе, так и в сочетании с нуклеозидными ингибиторами и с ингибиторами протеазы. Несколько классов ненуклеозидных HCV NS5B ингибиторов уже описаны и находятся в настоящее время на стадии испытаний, включая бензимидазолы (Н.Hashimoto et al. WO 01/47833, Н.Hashimoto et al. WO 03/000254, P.L.Beaulien et al. WO 03/020240:A2; P.L.Beaulien et al. US 6448281 Bl P.L.Beaulien et al. WO 03/007945 A1); индолы (P.L.Beaulien et al. WO 03/0010141 A2); бензотиадиазины, например 7 (D.Dhanak et al. WO 01/85172 A1; D. Dhanak et al. WO 03/037262 A2; К.J.Duffy et al. WO 03/099801 A1; D.Chai et al. WO 2004052312, D.Chai et al. WO 2004052313, D.Chai et al. WO 02/098424, J.K.Pratt et al. WO 2004/041818 A1; J.K.Pratt et al. WO 2004/087577 A1), тиофены, например 8 (С.К.Chan et al. WO 02/100851)
Бензотиофены (D.С.Young and T.R.Bailey WO 00/18231); β-кетопируваты (S.Attamura et al. US 6492423 B1, A.Attamura et al. WO 00/06529); пиримидины (С.Gardelli et al. WO 02/06246 A1); пиримидиндионы (T.R.Bailey and D.C.Young WO 00/13708); триазины (K.-H. Chung et al. WO 02/079187 A1); производные роданина (T.R.Bailey and D.C.Young WO 00/10573, J.C.Jean et al. WO 01/77091 A2); 2,4-диоксопираны (R.A.Love et al. EP 256628 A2); производные фенилаланина (M.Wang et al. J.Biol. Chem. 2003 278:2489-2495).
Для разработки новой стратегии анти-HCV терапии целенаправленно была выбрана NS3 протеаза. В WO 98/22496, опубликованной 28 мая 1998 г., M.R.Attwood et al. описали механизм, в основе которого ингибирование активных центров протеазы (M.R.Attwood et al. Antiviral Chemistry and Chemotherapy 1999 10:259-273; M.R.Attwood et al. Preparation and use of amino acid derivatives as anti-viral agents, German Patent Pub. DE 19914474). В WO 98/17679, опубликованной 30 апреля 1998 г., R.D.Tung et al. раскрыли механизм действия пептидных ингибиторов на NS3 протеазу.
В WO 99/07734, опубликованной 18 февраля 1999 г., и в WO 00/09543, опубликованной 9 августа 1999 г., M. Llinas-Brunet et al. описали пептидные ингибиторы протеазы. В WO 00/59929, опубликованной 12 октября 2000 г., Y.S.Tsantrizos et al. описали макроциклические трипептиды, являющиеся мощными ингибиторами HCV NS3 протеазы. Серия родственных патентов Boehringer-Ingleheim раскрывает сходные между собой ингибиторы протеазы и уже привела к идентификации трипептидного производного BILN 2061 (M. Llinas-Brunet et al. Bioorg. Med. Chem. Lett. 2000 10(20):2267-70; J.Med.Chem. 2004 47(26): 6584-94; J.Med.Chem. 2004 47(7): 1605-1608; Angew. Chem. Int. Ed. Eng. 2003 42(12): 1356-60).
Другие трипептидные ингибиторы, обнаруженные Bristol-Myers Squibb, были описаны, между прочим, в WO 03/099274, опубликованной 4 декабря 2003 г., в WO 2004/032827, опубликованной 22 апреля 2004 г., в WO 03/053349, опубликованной 3 июля 2003 г., в WO 2005/046712, опубликованной 26 мая 2005 г. и в WO 2005/051410, опубликованной 9 июня 2005 г. В WO 2004/072234, опубликованной 26 августа 2004 г. и в WO 2004/093798, опубликованной 4 ноября 2004 г., Enanta Pharmaceuticals были описаны и другие трипептидные ингибиторы протеазы. В WO 2005/037214, опубликованной 28 апреля 2005 г., L.M.Blatt et al. описали другие трипептидные производные, ингибирующие HCV NS3 протеазу В WO 2005/030796, опубликованной 7 апреля 2005 г., S.Venkatraman et al. описали макроциклические ингибиторы NS3 сериновой протеазы HCV. В WO 2005/058821, опубликованной 30 июня 2005 г., F.Velazquer et al. описали ингибиторы HCV NS3/NS4a сериновой протеазы. В WO 02/48172, опубликованной 20 июня 2007 г., Z. Zhu описал диарилпептиды как ингибиторы NS3 протеазы. В WO 02/08187 и в WO 02/08256, опубликованных 31 января 2002 г., A.Saksena et al. описали пептидные ингибиторы HCV NS3 протеазы. В WO 02/08251, опубликованной 31 января 2002 г., M.Lim-Wilby et al. описали пептидные ингибиторы NS3 протеазы. В US 6004933, опубликованном 21 декабря 1999 г., L.W.Spruce et al. описали гетероциклические производные пептидов, которые ингибируют цистеиновые протеазы, включая эндопептидазу HCV.
Исследуются также и несубстратспецифичные ингибиторы NS3 протеазы, такие как производные 2,4,6-тригидрокси-3-нитробензамида (Sudo К. et al., BBRC 1997 238:643-647; Sudo К. et al. Antiviral Chemistry and Chemotherapy 1998 9:186), включая RD3-4082 и RD3-4078, причем первый из названных замещен по амиду 14С-цепочкой, а последний подвергнут обработке пара-феноксифенильной группы.
SCH 68631, фенантренхинон, является ингибитором HCV протеазы (Chu M. et al., Tetrahedron Lett. 1996 37:7229-7232). В другом примере теми же самыми авторами SCH 351633, выделенный из гриба Penicillium griseofulvum, был охарактеризован как ингибитор протеазы (Chu M. et al. Bioorg. Med. Chem. Lett. 1999 9:1949-1952). Наномолекулярная эффективность действия против HCV NS3 протеазного энзима уже достигнута конструированием селективных ингибиторов на основе макромолекулы eglin с.Eglin с, выделенной из пиявки, является сильным ингибитором нескольких сериновых протеаз, таких как протеазы А и В из S. griseus, а-химотрипсин, химаза и субтилизин (Qasim M. A. et al., Biochemistry 1997 36:1598-1607).
Тиазолидиновые производные, которые показывают релевантное ингибирование в исследовании HPLC с обращенной фазой в отношении слитого белка NS3/4A и субстрата NS5A/5B (Sudo К. et al. Antiviral Research 1996 32:9-18), особенно соединение RD-1-6250, несущее слитый циннамоильный остаток, замещенный длинноцепочечным алкилом, представляют собой RD4 6205 и RD4 6193. Тиазолидины и бензанилиды идентифицированы N. Kakiuchi et al. в FEBS Let. 1998 421:217-220 и N. Takeshita et al. Anal. Biochem. 1997 247:242-246.
Имидазолидиноны как ингибиторы NS3 сериновой протеазы HCV раскрыты в WO 02/08198 от Sobering Corporation, опубликованной 31 января 2002 г., и в WO 02/48157 от Bristol Myers Squibb, опубликованной 20 июня 2002. В WO 02/48116, опубликованной 20 июня 2002 г., P. Glunz et al. описали пиримидиноновые ингибиторы NS3 протеазы.
Другие энзимные мишени для противо-НСУ-терапии включают HCVIRES сайт (Internal Entry Site) и HCV геликазу. Об IRES ингибиторах уже были сообщения от Immusol, Rigel Pharmaceuticals (R803) и Anadys (ANA 245 и ANA 246). Vertex описал ингибитор геликазы HCV.
Сочетанная терапия, при которой могут подавляться устойчивые мутантные штаммы, стала общепринятьм подходом в антивирусной химиотерапии. Описанные здесь нуклеозидные ингибиторы могут быть скомбинированы с другими нуклеозидными ингибиторами HCV полимеразы, ненуклеозидными ингибиторами HCV полимеразы и ингибиторами HCV протеазы. Так как возникли и разрабатываются другие классы лекарственных против HCV, например, ингибиторы внедрения вируса, ингибиторы геликазы, IRES ингибиторы, рибозимы и антисмысловые олигонуклеотиды, они также могут быть отличными кандидатами для использования в сочетанной терапии. Производные интерферона уже успешно скомбинированы с рибавирином, и интерфероны и химически модифицированные интерфероны окажутся полезными в сочетании с описанными здесь нуклеозидами.
Производные нуклеозидов часто представляют собой эффективные антивирусные (например, HIV, HCV, Herpes simplex, CMV) и антираковые химиотерапевтические средства. К сожалению, их практическое использование часто ограничено двумя факторами. Во-первых, скудные фармакокинетические свойства часто ограничивают абсорбцию нуклеозида из пищеварительного тракта и внутриклеточную концентрацию нуклеозидных производных, а во-вторых, субоптимальные физические свойства ограничивают выбор лекарственного состава, который мог бы быть использован для увеличения степени выделения активного ингредиента.
Albert ввел термин «пролекарство», чтобы охарактеризовать соединение, которое само по себе не обладает биологической активностью, но способно метаболически трансформироваться и превращаться в активную лекарственную субстанцию (A.Albert, Selective Toxicity, Chapman and Hall, London, 1951). За последнее время появилось много обзоров о пролекарствах (Р.Ettmayer et al. J.Med.Chem. 2004 47(10):2393-2404; К.Beaumont et al. Curr. Dmg Metab. 2003 4:461-485; H.Bundgaard, Design of Prodrugs: Bioreversible derivatives for various functional groups and chemical entities in Design of Prodrugs, H.Bundgaard (ed) Elsiver Science Publishers, Amsterdam 1985; G.M.Paulette et al. Adv. Drug Deliv. Rev. 1997 27:235-256; R.J.Jones and N.Bischofberger, Antiviral Res. 1995 27:1-15, и С.R.Wagner et al., Med. Res. Rev. 2000 20:417-45).
Несмотря на то, что метаболическая трансформация может катализироваться специальными ферментами, часто - гидролазами, активное вещество может также быть регенерировано в результате неспецифических химических процессов.
К фармацевтически приемлемым пролекарствам относят соединения, которое метаболизируется, например, гидролизуется или окисляется, в хозяине с образованием соединения настоящего изобретения. При биоконверсии не должно быть образования токсикологически обремененных фрагментов. Типичные примеры пролекарств включают соединения, которые имеют биологические лабильные защитные группы, связанные с функциональным остатком активного соединения. Алкилирование, ацилирование и другая липофильная модификация гидроксильной группы (групп) в остатке сахара применяются при создании пронуклеотидов. Эти пронуклеотиды можно гидролизовать или деалкилировать in vivo для получения активного соединения.
Факторами, ограничивающими оральную биодоступность, зачастую являются абсорбция из желудочно-кишечного тракта и выделение при первом прохождении кишечными стенками и печенью. Оптимизация трансцеллюлярной абсорбции при прохождении через ЖКТ требует D(7,4) больше нуля. Оптимизация коэффициента распределения, однако, не обеспечивает успеха. Может быть, пролекарство должно избегать в энтероцитах активных факторов переноса при просачивании. Внутриклеточный метаболизм в энтероците может приводить к пассивному транспорту или активному транспорту метаболита насосами просачивания обратно внутрь кишечной полости. Пролекарство должно также быть устойчивым по отношению к нежелательным биотрансформациям в крови перед тем, как достигнуть мишени - клеток или рецепторов.
Хотя предполагаемые пролекарства иногда могут быть созданы с помощью рационального мышления, основываясь на химической функциональности данной молекулы, химическая модификация активного компонента приводит к совершенно иной, новой молекулярной структуре, которая может проявить нежелательные физические, химические и биологические свойства, отсутствующие в соединении-предшественнике. Установленные требования для идентификации метаболитов могут ставить сложные задачи, если многочисленные пути метаболизма приводят к множеству разных метаболитов. Так что идентификация пролекарств остается сомнительным и порождающим проблемы занятием. Более того, оценка фармакологических свойств потенциальных пролекарств является сложным и дорогостоящим делом. Фармакокинетические результаты, полученные на модельных животных, могут иметь отличия, если экстрагировать их для человека.
Объектом настоящего изобретения является обеспечение новых соединений, способов и композиций для лечения субъекта-хозяина, зараженного вирусом гепатита С.
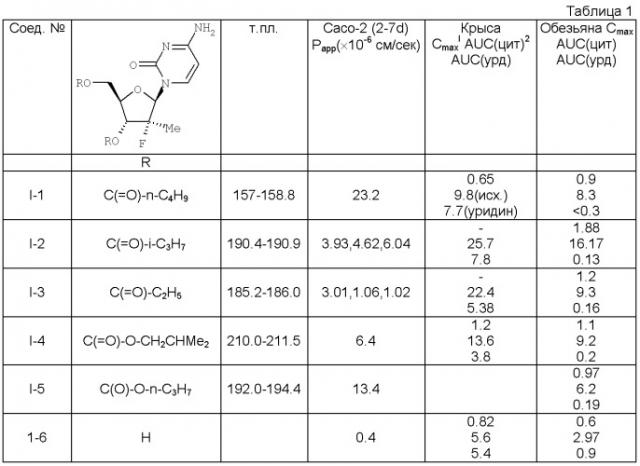
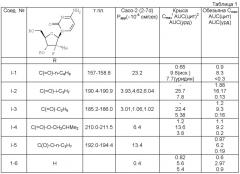
Настоящее изобретение касается новых диацильных производных 4-амино-1-((2R, 3R, 4R, 5R)-3-фтор-4-гидрокси-5-гидроксиметил-3-метил-тетрагидро-фуран-2-ил)-1Н-пиримидин-2-она (называемого также (2R)2′-дезокси-2-метил-2-фтор-цитидин).
Соединения данного изобретения обладают структурой согласно формуле I.
где R1 выбран из группы, состоящей из С2-5 неразветвленного или разветвленного амина, C2-5 неразветвленного или разветвленного алкенила, C2-5 неразветвленного или разветвленного алкинила, C2-5 низшего галоалкила, С3-6 циклоалкила и C2-4 алкокси; или представляют собой соответствующие ей гидраты, сольваты или соли в результате присоединения кислот.
Соединения настоящего изобретения полезны при лечении расстройства, вызванного HCV.
Изобретение, кроме того, включает способы лечения HCV, описываемые в данном изобретении соединениями и фармацевтическими композициями, включающими эти соединения.
В одном из вариантов данного изобретения предлагается соединение согласно формуле I, где R1 имеет указанные выше значения.
В другом варианте настоящего изобретения предлагается соединение согласно формуле I, где R1 представляет собой этил, н-пропил, изо-пропил, н-бутил или изобутил.
Еще в одном варианте настоящего изобретения предлагается соединение согласно формуле I, где R1 представляет собой этил или изопропил.
Еще в одном варианте настоящего изобретения предлагается соединение согласно формуле I, где R1 представляет собой изопропил, а соединение является гидрохлоридной или сульфатной солью.
Еще в одном варианте настоящего изобретения предлагается соединение согласно формуле I, где R1 представляет собой изопропил, а соединение является гидрохлоридной солью.
Еще в одном варианте настоящего изобретения предлагается соединение согласно формуле I, где R1 представляет собой этокси, н-пропокси или изопропокси.
Еще в одном варианте настоящего изобретения предлагается соединение согласно формуле I для применения в терапии, особенно для применения в лечении заболевания, вызванного вирусом HCV.
Еще один вариант изобретения касается применения соединения формулы I для изготовления лекарственного средства для лечения заболевания, вызванного вирусом HCV.
Соединение формулы I может, в частности, использоваться для приготовления лекарственного средства для введения нуждающемуся в этом пациенту в терапевтически эффективной зоне, предпочтительно в дозе от 0,1 до 10 г в день, более предпочтительно в дозе от 0,5 до 7 г в день и наиболее предпочтительно в дозе от 1,0 г до 6,0 г в день.
Соединение формулы I может также использоваться для приготовления лекарственного средства, которое может дополнительно включать терапевтически эффективное количество, по меньшей мере, одного модулятора иммунной системы, например, интерферона, химически дериватизированного интерферона, интерлейкина, фактора некроза опухоли или колониестимулирующего фактора и/или, по меньшей мере, одного антивирусного агента, который ингибирует репликацию HCV, такого как ингибитор протеазы HCV, другой нуклеозидный ингибитор полимеразы HCV, ненуклеозидный ингибитор полимеразы HCV, ингибитор геликазы HCV, ингибитор примазы HCV или слитый ингибитор HCV.
Еще один вариант настоящего изобретения предусматривает способ лечения заболевания, опосредованного вирусом HCV, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективной дозы соединения согласно формуле I, которое охарактеризовано выше.
Еще один вариант настоящего изобретения предусматривает способ лечения заболевания, опосредованного вирусом HCV, включающий введение пациенту, нуждающемуся в этом, дозы от 0,1 г до 10 г в день соединения согласно формуле I, которое охарактеризовано выше.
Еще в одном варианте изобретения доза составляет 0,5-7 г в день, а еще в другом варианте доза составляет 1,0-6,0 г в день.
В другом варианте настоящего изобретения предусматривается способ лечения заболевания, опосредованного вирусом HCV, включающий совместное введение пациенту, нуждающемуся в этом, терапевтически эффективной дозы соединения согласно формуле I, которое охарактеризовано выше, и терапевтически эффективного количества по меньшей мере, одного модулятора иммунной системы и/или, по меньшей мере, одного антивирусного агента, который ингибирует репликацию HCV.
В другом варианте настоящего изобретения предусматривается способ лечения заболевания, опосредованного вирусом HCV, включающий совместное введение пациенту, нуждающемуся в этом, терапевтически эффективной дозы соединения согласно формуле I, которое охарактеризовано выше, и терапевтически эффективного количества, по меньшей мере, одного модулятора иммунной системы, причем этот модулятор иммунной системы представляет собой интерферон, интерлейкин, фактор некроза опухоли или колониестимулирующий фактор.
Другой вариант настоящего изобретения предусматривает способ лечения заболевания, опосредованного вирусом HCV, включающий совместное введение пациенту, нуждающемуся в этом, терапевтически эффективной дозы соединения согласно формуле I, которое охарактеризовано выше, и терапевтически эффективного количества, по меньшей мере, одного модулятора иммунной системы, причем этот модулятор иммунной системы представляет собой интерферон или химически дериватизированный интерферон.
Другой вариант настоящего изобретения предусматривает способ лечения заболевания, опосредованного вирусом HCV, включающий совместное введение пациенту, нуждающемуся в этом, терапевтически эффективной дозы соединения согласно формуле I, которое охарактеризовано выше, и терапевтически эффективного количества, по меньшей мере, одного иного антивирусного соединения.
Другой вариант настоящего изобретения предусматривает способ лечения заболевания, опосредованного вирусом HCV, включающий совместное введение пациенту, нуждающемуся в этом, терапевтически эффективной дозы соединения согласно формуле I, которое охарактеризовано выше, и терапевтически эффективного количества по меньшей мере, одного иного антивирусного соединения, которое является ингибитором протеазы HCV, другим нуклеозидным ингибитором полимеразы HCV, ненуклеозидным ингибитором полимеразы HCV, ингибитором геликазы HCV, ингибитором примазы HCV или слитым ингибитором HCV.
Другой вариант настоящего изобретения предусматривает фармацевтическую композицию, включающую соединение согласно формуле I, которое охарактеризовано выше, смешанное с по меньшей мере одним фармацевтически приемлемым носителем, разбавителем или наполнителем.
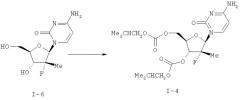
Другой вариант настоящего изобретения предусматривает способ получения соединения согласно формуле I, которое охарактеризовано выше, причем способ включает стадии (i)-(v), перечисленные в пункте 15 формулы изобретения и проиллюстрированные в примерах. Способ включает обработку I в основной водной органической среде, которая может быть гомогенной или двухфазной с ацилирующим агентом, как определено здесь, в присутствии DMAP и достаточного количества основания для поддержания рН раствора при рН, по крайней мере, около 7,5.
Данный способ позволяет проводить ацилирование без сопутствующей реакции гетероциклического основания.
Выражение «а» или «an» величина, в используемом здесь смысле, означает одну или несколько таких единиц, например, соединение имеет отношение к одному или нескольким соединениям или, по меньшей мере, одному соединению. Так что термины «а» (или «an»), «один или несколько» и «по меньшей мере, один» могут использоваться здесь взаимозаменяющим образом.
Термины «необязательный» или «необязательно» в том смысле, в котором они здесь используются, означают, что впоследствии описываемое событие или обстоятельство может происходить, но необязательно, потому описание включает примеры, когда это событие или обстоятельство имеет место, и примеры, когда оно не происходит. Например, «необязательная связь» означает, что связь может присутствовать и может не быть, и описание тогда включает одинарные, двойные или тройные связи.
Термин «независимо» используется здесь, чтобы показать, что переменная (величина) используется в любом примере без