Способ получения экспрессионного плазмидного вектора, обладающего повышенной стабильностью наследования в клетках escherichia coli
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии. Предлагается способ получения экспрессионного вектора, который стабильно наследуется в клетках E.coli. Повышенная стабильность наследования вектора достигается за счет введения в его состав нуклеотидной последовательности SEQ ID NO:1. Эффект стабильного наследования не зависит от положения и ориентации вставки. Введение данной последовательности существенно сокращает частоту потерь как низкокопийных, так и высококопийных векторов. Данное изобретение может найти применение при селекции штаммов, несущих плазмиду, причем при культивировании данных штаммов нет необходимости использовать селективную среду. 1 ил., 1 табл.
Реферат
Область применения
Настоящее изобретение относится к биотехнологии, в частности к разработке способов продукции в клетках Escherichia coli рекомбинантных белков для медицины и промышленности.
Актуальность
Одним из наиболее ярких и убедительных достижений современной биотехнологии стало создание и бурное развитие в последние десятилетия новой области мировой экономики - биофармацевтической промышленности, направленной на производство принципиально нового класса лекарств, - рекомбинантных генно-инженерных белковых препаратов, предназначенных для лечения людей.
Различные интерфероны, эритропоэтины, факторы роста, антитела, вакцинные белки, промышленные ферменты, доступные ранее лишь в аналитических количествах, входят теперь в перечень жизненно важных медицинских препаратов, производятся в объемах до нескольких тонн в год и прочно вошли в повседневную практику современной медицины, пищевой и фармацевтической промышленности. Многие из этих белков могут быть получены путем суперэкспрессии в клетках бактерий кишечной палочки (Е.coli) - недорогой, эффективной, проверенной временем и технологичной системы к гетерологичной экспрессии.
Из-за возможной нестабильности поддержания и наследования клетками штамма - продуцента целевых экспрессионных векторов, в процессе наращивания продуцента, равно как и во время непосредственно самой ферментации, клетки, спонтанно утратившие плазмиду (экспрессионный вектор), получают значительное селективное преимущество перед клетками, сохраняющими способность производить требуемый гетерологичный белок. Для предотвращения накопления в производственной культуре большого количества неактивных «пустых» клеток, снижающего выходы продукта, сейчас чаще всего применяют поддерживающую селекцию с помощью антибиотиков, вводимых в питательную среду ферментера.
В связи с этим встает проблема очистки конечного продукта от введенных антибиотиков, так как они могут способствовать возникновению и распространению устойчивых к антибиотикам микроорганизмов, в том числе патогенных, и оказывать негативное влияние на организм человека, в частности вызывать сенсибилизацию, приводящую к аллергическим реакциям (Schmid et al. 2006, Rodriguez-Репа et. al 2006). Поэтому является актуальным создание новых способов стабилизации наследования экспрессионных векторов при отсутствии внешнего селективного давления.
Уровень техники
Стабилизация наследования естественных или искусственных плазмид в клетках бактерий, в том числе и векторов, обеспечивающих экспрессию биотехнологически важных рекомбинантных белков, может осуществлять за счет нескольких разных механизмов. Самым простым из них является поддержание достаточно высокого числа (обычно 10-50) копий плазмидной ДНК в расчете на одну копию бактериальной хромосомы. В этом случае случайное распределение плазмид по дочерним клеткам в процессе цитокинеза обеспечивает с высокой вероятностью попадание хотя бы одной копии плазмиды в каждую из дочерних клеток. Однако с некоторой небольшой частотой бесплазмидные сегреганты все же образуются и всегда присутствуют в популяции (Nodstrom & Austin. 1989). Эти бесплазмидные сегреганты могут получать селективное преимущество в условиях, когда наличие плазмиды создает существенную метаболическую нагрузку на клетку, в частности, за счет направления значительной части ресурсов клетки на синтез рекомбинантного белка (который также может обладать определенной токсичностью для клетки-продуцента). Поэтому для поддержания такого типа плазмид в условиях ферментации необходимо применение средств, подавляющих развитие потерявших плазмиду клеток. В большинстве случаев такими средствами являются антибиотики, гены устойчивости к которым имеются на плазмиде.
Стабилизация низкокопийных плазмид, присутствующих в количестве менее 10 копий на хромосому, осуществляется за счет механизмов активной сегрегации плазмид. Обычно этот процесс осуществляется за счет деятельности цитоскелетных элементов, белки которых кодируются соответствующими плазмидами (Schumacher, 2008). В ряде случаев точные механизмы активной сегрегации не известны. Примерами плазмид, обладающих системами активной сегрегации, служат природные низкокопийные плазмиды, например F-фактор, а также некоторые профаги, поддерживающиеся в виде плазмид (Р1, N15). На основе репликона фага N15 создано несколько различных экспрессионных векторов, присутствующих в клетке в виде кольцевых или линейных плазмид с ковалентно замкнутыми концами (Mardanov et al. 2007, Ravin et al., 1999). Такие векторы обладают очень высокой стабильностью наследования, однако, при достижении значительных размеров бактериальной популяции некоторое количество бесплазмидных клеток обычно формируется, по-видимому, вследствие мутаций в области ориджина репликации или генов системы активной сегрегации. Полная стабилизация низкокопийных векторов с активной сегрегацией может достигаться за счет селекции антибиотиками или за счет применения дополнительных стабилизирующих генетических модулей. Например, одним из типов таких модулей, встречающихся в естественно возникших плазмидах бактерий, являются так называемые «addiction»-системы, называемые иногда также токсин-антитоксиновыми модулями (Hayes, 2003; Zielenkiewicz & Ceglowski, 2001). Эти генетические элементы представляют собой оперон (см.чертеж), содержащий ген белка токсина и ген антитоксина, который может иметь как белковую, так и небелковую природу (в частности, антисмысловые РНК; Jensen & Gerdes, 1995). Антитоксин всегда вырабатывается в количестве, превосходящем количество токсина. В клетке токсин является более стабильным, чем антитоксин, поэтому в случае спонтанной потери плазмиды, несущей данный генетический модуль, токсин, утративший ингибитор, взаимодействует со своей клеточной мишенью, и клетка погибает. Для кишечной палочки известно не менее 6 различных типов токсин-антитоксиновых модулей.
Кроме «addiction»-модулей в плазмидах могут содержаться и иные молекулярные системы, предотвращающие их потерю.
Наиболее близким аналогом существующего изобретения, также направленным на повышение частоты наследования плазмидных векторов посредством интеграции кассет с addiction-системами, является патент США №7,141,408, выданный в 2006 году. Он касается разработки векторов для экспрессии гетерологичных антигенов в клетках Salmonella typhimurium, содержащих одновременно белковую систему постсегрегационной смерти клетки, сходную по механизму с предлагаемой нами, и систему активного партиционирования плазмид. Важным отличием предложенной нами системы стабилизации наследования плазмидных векторов от уже имеющейся патентованной системы является более высокая достигаемая степень наследования векторов и повышенная выживаемость клеток бактерии-хозяина, вероятно происходящая из-за отсутствующей в нашей системе кассеты генов hok-sok, снижающей жизнеспособность клеток. Кроме этого, полученная нами последовательность ДНК SEQ ID NO:1 обладает повышенной по сравнению с аналогом способностью стабилизировать наследование наследования, согласно нашим экспериментальным данным.
Раскрытие изобретения
В настоящем изобретении ставилась задача разработки способа повышения стабильности наследования экспрессионных векторов за счет введения в их состав последовательности SEQ1.
Фактически задача была решена путем:
а) конструирования на основе коммерческого вектора pGEM-T высококопийной плазмиды pSM-T, содержащей последовательность SEQ1;
б) сравнения уровней стабильности плазмиды, содержащей последовательность SEQ1, с контрольной плазмидой, созданной на основе вектора pGEM-T, но несущей неактивную вставку в условиях конкурентного вытеснения несовместимых плазмид;
в) путем конструирования низкокопийного вектора на основе вектора, содержащего последовательность SEQ1;
г) сравнения уровней стабильности полученного вектора и исходного вектора, не содержащего последовательности SEQ1.
Первым аспектом изобретения является конструирование высококопийной плазмиды, содержащей последовательность SEQ1, что позволяет провести быструю качественную проверку эффективности стабилизирующего наследование плазмид действия последовательности SEQ1.
Второй аспект изобретения связан с конструированием низкокопийного вектора, содержащего последовательность SEQ1, и анализом его стабильности в штамме, исключающем функциональную активность собственной системы распределения копий вектора.
Краткое описание чертежей
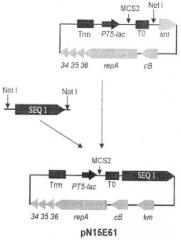
На чертеже представлена схема репортерного конструирования низкокопийного вектора pN15E61. SeqID 01 - элемент, содержащий последовательность SeqID 01. РТ5-lас - промотор фага Т5, снабженный оператором лактозного оперона. Т0 - терминатор транскрипции.
Осуществление изобретения
Пример 1. Конструирование плазмиды pSM-T, содержащей стабилизирующую последовательность SEQ1
В качестве основы для создания вектора был использован вектор pGEM-T (Promega, USA), основанный на репликоне плазмиды ColE1. Этот вектор поставляется в составе набора T-system для клонирования ПЦР-фрагментов методом ТА - клонинг. Фрагмент ДНК вставки был получен в результате проведения ПЦ с использованием праймеров (I) 5'-ATGAAGCAGCGTATTACTGTC и (II) 5'-TTATATTCCCCAGAACATCAG. В качестве матрицы использовали суммарную плазмидную ДНК, экстрагированную из смыва приблизительно 500 колоний колиформных бактерий, полученных в результате посева на среду Эндо образца фекалий лошади, подвергавшейся терапии путем пероральной дачи энрофлоксацина. ПЦ проводили при следующих условиях: (1) 94°С - 40 сек, (2) 55°С - 40 сек, (3)72°С - 40 сек, (4) 72°С - 3 мин. Шаги 1-3 повторяли 30 раз. После электрофоретического разделения продуктов реакции выделяли основной продукт (наиболее интенсивную полосу) размером приблизительно 600 п.н. и клонировали его в вектор pGEM-T в соответствии с инструкцией набора T-System (Promega, USA). В одном из отобранных клонов, содержащем вставку нужного размера, последовательность вставки была проверена секвенированием с использованием стандартного праймера М13 Forward. Полученная последовательность была обозначена как SeqID 01, ее ориентация в плазмиде pSM-T совпадает с направлением фрагмента гена lacZ.
Пример 2. Сравнение уровней стабильности плазмиды pSM-T с контрольной плазмидой в условиях конкурентного вытеснения несовместимых плазмид
В качестве контрольной плазмиды использовали плазмиду pHD, созданную на основе вектора pGEM-T, содержащую последовательность фрагмента гена главного белка капсида бактериофага Т5, размером около 600 п.н., не обладающую свойством стабилизировать наследование плазмид.
Для сравнения уровней стабильности плазмиды pSM-T и контрольной плазмиды клетки Е.coli Z84 трансформировали одной из исследуемых плазмид и одновременно конкурирующей плазмидой pUK21, созданной также на основе репликона ColE1 и несущей ген устойчивости к канамицину. Двойные трансформанты отбирали на среде агаризованной, содержащей 20 мкг/мл канамицина и 100 мкг/мл ампициллина.
5-7 колоний двойных трансформантов переносили в пробирки с 5 мл жидкой среды LB и подращивали в течение ночи при интенсивной аэрации при 37°С для освобождения от выживших клеток, не содержащих одну из плазмид. Полученную ночную культуру разводили в 100 раз средой LB без антибиотика и инкубировали в тех же условиях. Последний этап повторяли дважды. Из таким образом полученных культур готовили разведения до 10-7 в физиологическом растворе и высевали по 50 мкл на чашки со средой LB, со средой LB с 20 мкг/мл канамицина, со средой LB с 20 мкг/мл канамицина и 100 мкг/мл ампициллина и со средой LB 100 мкг/мл ампициллина. Чашки инкубировали при 37°С в течение ночи и выросшие на них колонии подсчитывали. Этот эксперимент проводили для каждой из плазмид (pSM-T и контрольной) в трех повторностях.
Таблица 1. Количество колоний, полученных в результате эксперимента по определению стабильности плазмид в условиях конкурентного вытеснения
| Повторность | pSM-T/pUK2l | pHD/pUK21 | ||||||
| LB | Km+Ap | Km | Ар | LB | Km+Ap | Km | Ap | |
| 1 | 652 | 150 | 132 | 500 | 700 | 184 | 240 | 287 |
| 2 | 597 | 141 | 153 | 512 | 551 | 173 | 191 | 184 |
| 3 | 583 | 118 | 1127 | 464 | 667 | 98 | 315 | 226 |
Результаты, представленные в Таблице 1, показывают, что в присутствии стабилизирующей последовательности SEQ1 практически все сегреганты, содержащие только одну из двух плазмид, содержать плазмиду pSM-T, несущую маркер устойчивости к ампициллину. Тогда как в эксперименте с контрольной плазмидой доля сегрегантов, несущих плазмиды pHD и рUK21, примерно одинакова.
Пример 3. Конструирование низкокопийного вектора
Для конструирования низкокопийного вектора pN15E61 (см.чертеж) последовательность SeqID 01 амплифицировали с помощью реакции ПЦР с использованием праймеров (I, II), описанных в примере 1, и M13F, используя в качестве матрицы ДНК плазмиды pSM-T. Условия ПЦР были аналогичны описанным в Примере 1. Полученный фрагмент содержал два сайта узнавания рестриктазы "NotI, фланкирующие последовательность SEQ1 (левый сайт происходит из полилиикера плазмиды pSM-Т, а правый вводится на праймере (праймер III, 5'-TGTAAAACGACGGCCAGT-3')). Полученый фрагмент клонировали в уникальный сайт Not плазмиды pN15E6 (Mardanov et al. 2007).
Для определения уровня стабильности наследования плазмид рN15Е6 и pN15E61 в неселективных условиях мы вводили их в штаммы DH10B и DH31sopLacI и выращивали до стационарного состояния в LB с добавлением селективных антибиотиков. Затем свежую культуру разводили в 103 раз и выращивали в LB-бульоне без антибиотиков до стационарного состояния, что соответствовало 10 генерациям. После этого высеивали клетки на чашки без антибиотика, а затем делали реплики на чашки с антибиотиком - вырастали только те колонии, которые содержали плазмиду. Эксперимент повторяли на протяжении 40 генераций. Процент потерянных клетками плазмид на генерацию (L) определяли по формуле L=(1-(Ff/Fi)1/N)×100, где Fi - количество плазмид вначале, Ff - количество плазмид после N генераций в неселективных условиях, причем считали количество наследуемых плазмид равным числу выросших в селективных условиях колоний бактерий.
В результате проведенных измерений частота потери плазмиды рN15Е6 составляла 3,8% на генерацию, а плазмиды pN15E61 0.6%, что свидетельствует о наличии стабилизирующей активности введенной последовательности SeqID 01. Дополнительно проведенные исследования, направленные на выявление значения ориентации и положения стабилизирующей вставки в векторе, не позволили выявить существенных различий стабилизирующей активности вставки в прямой и обратной ориентации рамки.
Способ получения экспрессионного плазмидного вектора, обладающего повышенной стабильностью наследования плазмидных векторов в клетках E.coli, состоящий во введении в состав вектора нуклеотидной последовательности SEQ ID NO:1.