Синтез ингибиторов ренина с использованием реакции циклоприсоединения
Иллюстрации
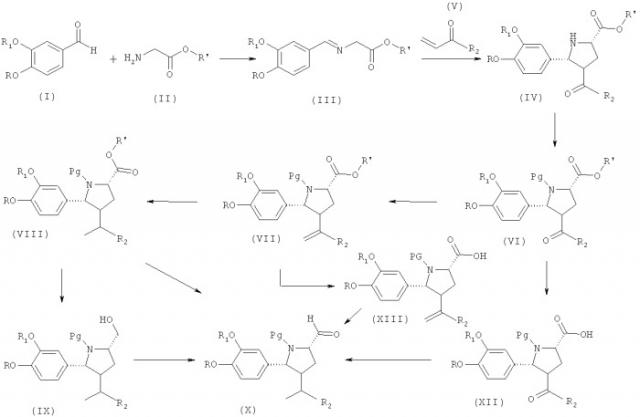
Показать всеИзобретение относится к способу получения соединений формулы IV
в которой R обозначает водород, алкил или алкоксиалкил, предпочтительно С1-С7-алкил, особенно метил; R1 обозначает водород, алкил или алкоксиалкил, предпочтительно С1-С7-алкокси-С1-С7-алкил, особенно 3-метоксипропил; R′ обозначает водород, алкил или арилалкил, предпочтительно С1-С7-алкил, C1-С3-алкилфенил, более предпочтительно C1-С4-алкил или бензил, особенно этил; R2 обозначает алкил, или его соли, который включает введение соединения формулы III
где R, R1 и R′ являются такими, как определено здесь для соединения формулы IV, в реакцию циклоприсоединения с α,β-ненасыщенной карбонильной системой формулы (V)
где R2 является таким, как определено для соединения формулы IV выше. Изобретение также относится к применению соединения формулы III, к соединениям формулы IV, к способу получения соединений формулы VI, к соединениям формулы VI, а также к способу получения соединения формулы XXIII.
Технический результат - новый способ получения соединения формулы XXIII, применимым для синтеза фармацевтически активных соединений, ингибиторов ренина. 7 н. и 6 з.п. ф-лы.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому способу, новым стадиям способа и к новым промежуточным продуктам, применимым для синтеза фармацевтически активных соединений, предпочтительно - ингибиторов ренина.
Уровень техники
Ренин из почек попадает в кровь, где он влияет на расщепление ангиотензина, выделяя декапептид ангиотензин I, который затем расщепляется в легких, почках и других органах с выделением октапептида ангиотензина II. Этот октапептид повышает артериальное давление и непосредственно, путем сужения артерий, и косвенно, путем высвобождения из надпочечников удерживающего ионы натрия гормона альдостерона, что сопровождается увеличением объема внеклеточной жидкости, и это увеличение можно приписать воздействию ангиотензина II. Ингибиторы ферментативного воздействия ренина уменьшают образование ангиотензина I и вследствие этого образуется меньшее количество ангиотензина II. Снижение концентрации этого активного пептидного гормона является непосредственной причиной гипотензивного эффекта ингибиторов ренина.
С использованием таких соединений, как (международное непатентованное название) алискирен ((2S,4S,5S,7S)-5-амино-N-(2-карбамоил-2-метилпропил)-4-гидрокси-2-изопропил-7-[4-метокси-3-(3-метоксипропокси)бензил]-8-метилнонанамид), разработаны новые гипотензивные средства, которые препятствуют функционированию системы ренин-ангиотензин в самом начале биосинтеза ангиотензина II.
Поскольку соединение содержит 4 хиральных атома углерода, синтез энантиомерно чистого соединения весьма затруднителен. Поэтому необходимы измененные пути синтеза, которые позволят удобнее провести синтез молекул такого сложного типа.
Поэтому в основу настоящего изобретения была положена задача разработки новых путей синтеза и получения новых промежуточных продуктов, обеспечивающих удобный и эффективный доступ к этому классу соединений.
При поиске более удобных путей получения ингибиторов ренина, таких как алискирен, было установлено, что пирролидины, указанные ниже, и их производные могут быть весьма полезными промежуточными продуктами при синтезе таких ингибиторов ренина.
где
R обозначает водород, алкил или алкоксиалкил;
R1 обозначает водород, алкил или алкоксиалкил;
Ry обозначает водород или, предпочтительно, защитную группу гидроксигруппы;
Rz обозначает водород или незамещенный или замещенный алкил; и
PG обозначает защитную группу аминогруппы, предпочтительно - удаляемую путем гидролиза, например низш. алкоксикарбонил, такой как трет-бутоксикарбонил или бензилоксикарбонил.
Эти пирролидины и способы синтеза ингибиторов ренина подробно описаны в заявке GB 05116868 и соответствующей заявке РСТ РСТ/ЕР2006/005370. Пирролидиновое кольцо фиксирует стереохимическую конфигурацию для последующего превращения и в конечном счете образуются аминный и гидроксильный фрагменты, обладающие необходимой стереохимической конфигурацией. Однако, хотя этот способ эффективен и обладает некоторыми преимуществами, промежуточные пирролидины получают из аминоспиртов следующей формулы
Эти соединения получают по довольно длинной схеме синтеза с использованием пироглутаминовой кислоты в качестве исходного вещества. В заявке РСТ ЕР 2005/009347, опубликованной как WO 2006/024501, получают кетоаминопроизводные таких соединений, которые можно превратить в соответствующий аминоспирт.
Краткое изложение сущности изобретения
Согласно изобретению было установлено, что полезные промежуточные пирролидины можно получить намного более простым путем, что весьма существенно уменьшает полное количество стадий, необходимых для получения подходящих ингибиторов ренина.
В первом и наиболее важном варианте осуществления настоящее изобретение относится к способу получения соединения формулы III,
в которой
R обозначает водород, алкил или алкоксиалкил;
R1 обозначает водород, алкил или алкоксиалкил; и
R′ обозначает водород, алкил или арилалкил;
или его соли;
указанное получение включает (предпочтительно - содержит) взаимодействие соединения формулы I,
в которой R и R1 являются такими, как определено для соединения формулы III, с глицином формулы II
в которой R′ является таким, как определено для соединения формулы III, для образования иминогруппы. Эта стадия способа сама по себе, а также соединение формулы III (и предпочтительные варианты его осуществления, описанные ниже) или его соль также образуют варианты осуществления настоящего изобретения.
Оба реагента формулы I и II или продают такие поставщики, как Aldrich или Fluka, или их можно получить по методикам, хорошо известным в данной области техники. Например, альдегид формулы I можно получить по методикам, описанным в публикациях Goeschke R. et al, Helv. Chimica Acta, 2003, 86(8), 2848 и Goeschke R. EP-A-678503.
Образование имина проводят по любой известной методике получения соединения формулы III. Реакцию предпочтительно проводить в щелочной или кислой среде, более предпочтительно - в щелочной среде. Подходящие основания включают органические или неорганические основания, предпочтительно - органические основания, более предпочтительно - азотистое основание, еще более предпочтительно - третичное азотистое основание. Примеры третичного азотистого основания включают триметиламин, ДБУ (1,8-диазабикло[5.4.0]ундец-7-ен), триэтиламин и диизопропилэтиламин. Реакцию можно проводить в любом подходящем растворителе, предпочтительно - в апротонном растворителе, таком как ароматический или галогенированный растворитель, более предпочтительно - метиленхлорид или толуол. Реакцию предпочтительно проводить так, чтобы удалить всю воду, образовавшуюся во время реакции, предпочтительно - удалять воду одновременно. Подходящие средства удаления воды включают использование любых осушающих агентов, таких как сульфат магния или сульфат натрия, или молекулярных сит, или азеотропной перегонки. Длительность проведения и температуру реакции выбирают так, чтобы завершить реакцию за минимальное время без образования нежелательных побочных продуктов. Обычно реакцию можно проводить при температуре от 0°С до температуры кипения, предпочтительно - от 0 до 40°С, более предпочтительно - от 15 до 30°С, такой как комнатная температура, в течение от 1 до 48 ч, предпочтительно - от 5 до 36 ч, наиболее предпочтительно - от 17 до 30 ч, например, в течение 24 ч.
В другом важном варианте осуществления настоящее изобретение относится к соединению формулы III, определенному выше, или его соли. Соединение формулы III можно использовать, в частности, для синтеза фармацевтически активных веществ, предпочтительно - ингибиторов ренина, таких как алискирен, предпочтительно - как описано ниже.
В другом предпочтительном варианте осуществления настоящего изобретения этот синтез в качестве дополнительной стадии или в качестве отдельного синтеза включает получение соединения формулы IV
в которой R, R1 и R′ являются такими, как определено для соединения формулы III выше, и в которой R2 обозначает алкил, или его соли для образования пирролидинового кольца, указанное получение включает (предпочтительно содержит)
введение соединения формулы III, предпочтительно - синтезированного на предыдущей стадии, в реакцию циклоприсоединения с α,β-ненасыщенной карбонильной системой формулы (V)
в которой R2 является таким, как определено для соединения формулы IV выше. Эта стадия способа сама по себе, а также соединение формулы IV (и предпочтительные варианты его осуществления, описанные ниже) или его соль также образуют варианты осуществления настоящего изобретения.
Циклоприсоединение обычно представляет собой реакцию 1,3-дипольного циклоприсоединения. Ее проводят по любой известной методике получения соединения формулы IV. В частности, реакции циклоприсоединения описаны в следующих публикациях: Coldham I and Hufton R., Chem. Rev., 2005, 105, 2765-2810, Husinec S and Savic, V., Tetrahedron Asymmetry 2005, 16, 2047-2061, Barr D. A. et al, Tetrahedron, 51, 273-294, Dikshit D. K. et al Tetrahedron Letters 2001, 42, 7891-7892, Nyerges M., et al Synthesis, 2002, 1823-1828, Garner, P. et al, Tetrahedron Letters, 2005, 46, 5181-5185, которые включены в настоящее изобретение в качестве ссылки. В публикации Coldham I and Hufton R. следует особо отметить главу 3, в которой описаны различные методики использования иминов в качестве исходных веществ, в частности прототропия и металирование, из которых предпочтительным является металирование. Таким образом, особенно подходящей является любая из методик, описанная в главе 3.2, и они включены в настоящее изобретение в качестве ссылки.
Реакцию предпочтительно проводить в щелочной среде. Подходящие основания включают органические или неорганические основания, предпочтительно - органические основания более предпочтительно - азотистое основание, еще более предпочтительно - третичное азотистое основание. Примеры третичного азотистого основания включают триэтиламин, ДБУ, диизопропилэтиламин, хинин, ТМЭДА (тетраметилэтидендиамин) и триметиламин. Реакцию можно проводить в любом подходящем растворителе, предпочтительно - в апротонном растворителе, таком как ароматический, простой эфирный или галогенированный растворитель, более предпочтительно - метиленхлорид, ДМСО (диметилсульфоксид), ацетонитрил, тетрагидрофуран или толуол. Кроме того, реакцию предпочтительно проводить в присутствии подходящего катализатора, такого как металлсодержащий катализатор. Подходящие металлсодержащие катализаторы описаны в цитированной выше литературе. Металлсодержащим катализатором обычно является соль, предпочтительно - соль Li, Ag, Cu, Zn, Со или Mn, такая как соль LiI, AgI, CuII, ZnII, CoII или MnII, более предпочтительно - соль Cu или Ag. Анионом может быть любой подходящий анион, известный в данной области техники, такой как галогенидный, включая хлоридный и фторидный, трифторметансульфонатный (трифлатный, или OTf) и ацетатный (ОАс). Таким образом, подходящие металлсодержащие катализаторы включают AgF, AgOAc, AgOTf, LiBr, Cu(OTf)2, Zn(OTf)2, Zn(OAc)2, CoCl2, CoBr2, MnBr2, более предпочтительно - AgOAc, AgOTf, Cu(OTf)2 и Zn(OTf)2, еще более предпочтительно - AgF, AgOAc и AgOTf, наиболее предпочтительно - AgOAc. Длительность проведения и температуру реакции выбирают так, чтобы завершить реакцию за минимальное время без образования нежелательных побочных продуктов. Обычно реакцию можно проводить при температуре от -70°С до температуры кипения, предпочтительно - от 0 до 40°С, более предпочтительно - от 15 до 30°С, такой как комнатная температура, в течение от 15 мин до 24 ч, предпочтительно - от 30 мин до 12 ч, наиболее предпочтительно - 1 до 5 ч, например, в течение 3-4 ч. Соединение можно превратить в соль соответствующей кислоты по методикам, хорошо известным в данной области техники. Обычно выбранную кислоту прибавляют к амину. Кислотой может быть любая органическая или неорганическая кислота, предпочтительно - неорганическая кислота, такая как HCl, или органическая кислота, такая как винная кислота, или ее производные, например, ди-O-толуилвинная кислота.
При проведении стадии реакции, описанной выше, полученные продукты являются рацемическими и все заместители находятся в цис-положении друг по отношению к другу. Это означает, что конфигурация в положениях С2 и С5 всегда является цис-конфигурацией и конфигурация в положении С4 является цис-конфигурацией по отношению к С2 и С5. Предпочтительно, если соединение формулы IV обладает стереохимической конфигурацией, представленной ниже формулой IVA.
Хиральность можно придать путем проведения описанной выше реакции циклоприсоединения в присутствии хирального катализатора, полученного путем обработки подходящей добавкой, см. публикацию Husinec S and Savic, V., Tetrahedron Asymmetry 2005, 16, 2047-2061, которая включена в настоящее изобретение в качестве ссылки. Таким образом, подходящие добавки включают хиральные фосфины и бифосфины, в частности, такие бифосфины, как соединения 25, 29, 30, 31, 32, 33, 39, 46, 47, 48, описанные в публикации Husinec S and Savic, V., хиральные оксазолины, такие как соединения 56 и 57, описанные в публикации Husinec S and Savic, V., лиганды, полученные из эфедрина, такие как соединение 15, описанное в публикации Husinec S and Savic, V, и другие хиральные лиганды, такие как соединения 20, 21, 22 и 23, описанные в публикации Husinec S and Savic, V. Соответствующий лиганд предпочтительно использовать вместе с соответствующим катализатором, как это описано в публикации Husinec S and Savic, V., или как это описано в публикации Schreiber S. etal, J. Amer. Chem. Soc., 2003, 125, 10174, или как это описано в публикации Zhang X., etal J. Amer. Chem. Soc., 2002, 124, 13400, или как это описано в публикации Jorgensen К.A. etal, J. Org. Chem., 2003, 68, 2583, или как это описано в публикации Pfalz.A. etal Synthesis, 2005, 1431. Лиганды, которые описаны в этих публикациях, являются предпочтительными и они выбраны для настоящего изобретения. Как показано в публикациях Schreiber S, etal или Zhang etal, известно, что выбор катализатора влияет на стереохимическую конфигурацию заместителя, введенного в положения 2, 4 и 5 кольца. Таким образом можно селективно получить оптические изомеры. Оптические изомеры также можно получить с помощью классических методик разделения, например, фракционной кристаллизации подходящей соли или с помощью хроматографического разделения оптических изомеров путем использования хроматографии на хиральной колонке.
Как отмечено выше, при проведении реакции циклоприсоединения с использованием или без использования хиральной добавки стереохимическая конфигурация заместителя в положении С4 пирролидинового кольца противоположна необходимой для SPP100. При использовании в реакции циклоприсоединения соединения V, предпочтительно - метилвинилкетона, заместители в положениях С2 и С4 различаются (в литературе их считают разными сложными эфирами). Это позволяет с удобством проводить селективные изменения заместителя в положении С4.
Другие методики придания хиральности включают использование хирального эфира глицина, например, L- или D-ментилового эфира, который делает реакцию хиральной, и соединение формулы IV получают с энантиомерным избытком. Затем обогащение энантиомера проводят путем фракционной кристаллизации.
В другом важном варианте осуществления настоящее изобретение относится к соединению формулы IV, определенному выше, или его соли. Соединение формулы IV можно использовать, в частности, для синтеза фармацевтически активных веществ, предпочтительно - ингибиторов ренина, таких как алискирен, предпочтительно - как описано ниже.
В другом предпочтительном варианте осуществления настоящего изобретения этот синтез в качестве дополнительной стадии или в качестве отдельного синтеза включает получение соединения формулы VI
в которой R, R1 и R′ являются такими, как определено для соединения формулы III выше, R2 является таким, как определено для соединения формулы IV выше, и PG обозначает защитную группу аминогруппы, или его соли, указанное получение включает (предпочтительно - содержит) введение защитной группы аминогруппы по пирролидиновому атому азота соединения формулы IV, предпочтительно - синтезированного на предыдущей стадии. Эта стадия способа сама по себе, а также соединение формулы VI (и предпочтительные варианты его осуществления, описанные ниже) или его соль также образуют варианты осуществления настоящего изобретения.
Предпочтительно, если соединение формулы VI обладает стереохимической конфигурацией, представленной ниже формулой VIA.
Это превращение проводят в стандартных условиях и так, как это описано, например, в стандартных руководствах, таких как J.F.W.McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London and New York 1973, in T.W.Greene and P.G.M.Wuts, "Protective Groups in Organic Synthesis", Third edition, Wiley, New York 1999, in "The Peptides"; Volume 3 (editors: E.Gross and J.Meienhofer), Academic Press, London and New York 1981, in "Methoden der organischen Chemie" (Methods of Organic Chemistry), Houben Weyl, 4th edition, Volume 15/1, Georg Thieme Verlag, Stuttgart 1974, in H.-D.Jakubke and H.Jeschkeit, "Aminosauren, Peptide, Proteine" (Amino acids, Peptides, Proteins), Verlag Chemie, Weinheim, Deerfield Beach, and Basel 1982, and in Jochen Lehmann, "Chemie der Kohlenhydrate: Monosaccharide und Derivate" (Chemistry of Carbohydrates: Monosaccharides and Derivatives), Georg Thieme Verlag, Stuttgart 1974.
В частности, если PG обозначает алкоксикарбонильную группу, так что образуется карбамат, реакцию предпочтительно проводить в щелочной или кислой среде, более предпочтительно - в щелочной среде. Подходящие основания включают органические или неорганические основания, предпочтительно - органические основания, более предпочтительно - азотистое основание, еще более предпочтительно - третичное азотистое основание. Примеры третичного азотистого основания включают триэтиламин, диизопропилэтиламин, ДБУ, ТМЭДА и триметиламин. Реакцию можно проводить в любом подходящем растворителе, предпочтительно - в полярном растворителе, таком как этилацетат или галогенированный растворитель, более предпочтительно - метиленхлорид или этилацетат. Длительность проведения и температуру реакции выбирают так, чтобы завершить реакцию за минимальное время без образования нежелательных побочных продуктов. Обычно реакцию можно проводить при температуре от 0°С до температуры кипения, предпочтительно - от 0 до 40°С, более предпочтительно - от 15 до 30°С, такой как комнатная температура, в течение от 10 мин до 12 ч, предпочтительно - от 20 мин до 6 ч, наиболее предпочтительно - от 30 мин до 4 ч, например в течение 1 ч.
В другом важном варианте осуществления настоящее изобретение относится к соединению формулы VI, определенному выше, или его соли. Соединение формулы VI можно использовать, в частности, для синтеза фармацевтически активных веществ, предпочтительно - ингибиторов ренина, таких как алискирен, предпочтительно - как описано ниже.
В другом предпочтительном варианте осуществления настоящего изобретения этот синтез в качестве дополнительной стадии или в качестве отдельного синтеза включает получение соединения формулы VII
в которой R, R1 и R' являются такими, как определено для соединения формулы III выше, R2 является таким, как определено для соединения формулы IV выше, и PG обозначает защитную группу аминогруппы, или его соли, указанное получение включает (предпочтительно - содержит) превращение карбонильного соединения формулы VI, предпочтительно - синтезированного на предыдущей стадии, в олефин. Эта стадия способа сама по себе, а также соединение формулы VII (и предпочтительные варианты его осуществления, описанные ниже) или его соль также образуют варианты осуществления настоящего изобретения.
Превращение можно провести по методике, известной специалисту в данной области техники. Предпочтительной реакцией является реакция Виттига, или типа Виттига, или олефинирование по Петерсену, или реакция с реагентом Петасиса. Обычными реагентами для реакции Виттига являются фосфорилиды, получаемые из соответствующей фосфониевой соли и основания. Фосфониевую соль предпочтительно получают из фосфина, например арилфосфина или алкилфосфина, и метилгалогенида, такого как MeBr. Использующимся фосфином является трифенилфосфин. Илид также можно получить не только из фосфинов, но и из фосфонатов, фосфиноксидов, бисамидов фосфоновой кислоты и алкилфосфонатов. В этом контексте предпочтительными являются фосфонаты и реакцию называют реакцией Хорнера-Эммонса. Основанием, использующимся для получения илидов, предпочтительно является сильное основание, выбирающееся в соответствии с использующейся солью. Примеры включают гидрид натрия, бутиллитий, диизопропиламид лития, амид натрия и алкоксид натрия, предпочтительно - гидрид натрия, бутиллитий и диизопропиламид лития. Илид предпочтительно получают in situ до прибавления соединения формулы VI. Реакцию Виттига или типа Виттига предпочтительно проводить в инертном растворителе. Более предпочтительно - в тетрагидрофуране или толуоле. Длительность проведения и температуру реакции выбирают так, чтобы завершить реакцию за минимальное время без образования нежелательных побочных продуктов. Обычно реакцию можно проводить при температуре от -78°С до температуры кипения, предпочтительно - от -30 до 30°С, более предпочтительно - от -15 до 10°С, такой как равная 0°С, от 10 мин до 12 ч, предпочтительно - от 20 мин до 6 ч, наиболее предпочтительно - от 30 мин до 4 ч, например в течение от 1 до 2 ч.
Реакцию Петерсона можно проводить по стандартным методикам, см., например, Peterson D.J., J, Org. Chem. 1968, 33, 780. Примером применения реагента Петасиса является, например, использование методики, описанной в публикациях Petsisi. N.A. etal J. Amer. Chem. Soc., 1990, 112, 6392, и Petasis N. A., etal Tetrahedron Letters, 1995, 36, 2393 и Payack J, F., Org. Process Research & dev. 2004, 8, 256.
В щелочной среде, в которой проводят реакцию Виттига, можно наблюдать эпимеризацию заместителя в положении С4. Поэтому при использовании предпочтительного диастереоизомера, образованного из соединения формулы IVA, приведенной выше, можно обеспечить необходимую стереохимическую конфигурацию, представленную ниже формулой VIIA, и, как это необходимо, например, для алискирена, можно получить:
В другом важном варианте осуществления настоящее изобретение относится к соединению формулы VII, определенному выше, или его соли. Соединение формулы VII можно использовать, в частности, для синтеза фармацевтически активных веществ, предпочтительно - ингибиторов ренина, таких как алискирен, предпочтительно - как описано ниже.
В другом предпочтительном варианте осуществления настоящего изобретения этот синтез в качестве дополнительной стадии или в качестве отдельного синтеза включает получение соединения формулы VIII
в которой R, R1 и R′ являются такими, как определено для соединения формулы III выше, R2 является таким, как определено для соединения формулы IV выше, и PG обозначает защитную группу аминогруппы, или его соли, указанное получение включает (предпочтительно - содержит) гидрирование олефинового соединения формулы VII, предпочтительно - синтезированного на предыдущей стадии. Эта стадия способа сама по себе, а также соединение формулы VIII (и предпочтительные варианты его осуществления, описанные ниже) или его соль также образуют варианты осуществления настоящего изобретения.
Предпочтительно, если соединение формулы VIII обладает стереохимической конфигурацией, представленной ниже формулой VIIIA.
Эту реакцию предпочтительно проводить в условиях, при которых не изменяются другие функциональные группы молекулы, в частности, защитная группа аминогруппы PG. Гидрирование обычно проводят в присутствии катализатора, выбранного из числа гомогенных катализаторов или гетерогенных катализаторов, таких как катализатор Уилкинсона, предпочтительно - гетерогенного катализатора. Примеры катализаторов включают никель Ренея, палладий/С, борид никеля, металлическую платину или оксид платины, родий, рутений и оксид цинка, более предпочтительно - палладий/С, металлическую платину или оксид платины, наиболее предпочтительно - палладий/С. Катализатор предпочтительно используют в количестве, составляющем от 1 до 20%, более предпочтительно - от 5 до 10%. Реакцию можно проводить при атмосферном или повышенном давлении, таком как давление, равное 2-10 бар, например 5 бар, более предпочтительно проводить реакцию при атмосферном давлении. Гидрирование предпочтительно проводить в инертном растворителе, более предпочтительно - в тетрагидрофуране или толуоле. Длительность проведения и температуру реакции выбирают так, чтобы завершить реакцию за минимальное время без образования нежелательных побочных продуктов. Обычно реакцию можно проводить при температуре от 0°С до температуры кипения, предпочтительно - от 0 до 40°С, более предпочтительно - от 15 до 30°С, такой как комнатная температура, в течение от 10 мин до 12 ч, предпочтительно - от 20 мин до 6 ч, наиболее предпочтительно - от 30 мин до 4 ч, например в течение от 1 до 3 ч.
В другом важном варианте осуществления настоящее изобретение относится к соединению формулы VIII, определенному выше, или его соли. Соединение формулы VIII можно использовать, в частности, для синтеза фармацевтически активных веществ, предпочтительно - ингибиторов ренина, таких как алискирен, предпочтительно - как описано ниже.
В другом предпочтительном варианте осуществления настоящего изобретения этот синтез в качестве дополнительной стадии или в качестве отдельного синтеза включает получение соединения формулы IX
в которой R и R1 являются такими, как определено для соединения формулы III выше, R2 является таким, как определено для соединения формулы IV выше, и PG обозначает защитную группу аминогруппы, или его соли, указанное получение включает (предпочтительно - содержит) восстановление сложноэфирного фрагмента соединения формулы VIII, предпочтительно - синтезированного на предыдущей стадии, в спирт. Эта стадия способа сама по себе, а также соединение формулы IX (и предпочтительные варианты его осуществления, описанные ниже) или его соль также образуют варианты осуществления настоящего изобретения,
Предпочтительно, если соединение формулы IX обладает стереохимической конфигурацией, представленной ниже формулой IXA.
Эту реакцию предпочтительно проводить в условиях, при которых не изменяются другие функциональные группы молекулы, в частности защитная группы аминогруппы PG. Такая реакция хорошо известна специалисту в данной области техники и описана, например, в публикации Methoden der organischen Chemie" (Methods of Organic Chemistry), Houben Weyl, 4th edition, Volume IV/c, Reduction I & II. Georg Thieme Verlag, Stuttgart 1974. Восстановление обычно проводят в присутствии подходящего восстановительного реагента, выбранного из группы, включающей LiAlH4, триалкоксиалюминийгидриды лития, например, три-трет-бутилоксиалюминийгидрид лития, DIBALH, Red-Al, триэтилборогидрид лития, ВН3-SMe2, LiBH4, триалкиламмонийборогидриды и NaBH4. Предпочтительным примером этого реагента является NaBH4, что обусловлено его селективностью.
Восстановление предпочтительно проводить в инертном растворителе, более предпочтительно - в тетрагидрофуране или толуоле. Длительность проведения и температуру реакции выбирают так, чтобы завершить реакцию за минимальное время без образования нежелательных побочных продуктов. Обычно реакцию можно проводить при температуре от -78°С до температуры кипения, предпочтительно - от -30 до 30°С, более предпочтительно - от -15 до 10°С, такой как равная 0°С, в течение от 10 мин до 12 ч, предпочтительно - от 20 мин до 6 ч, наиболее предпочтительно - от 30 мин до 4 ч, например в течение от 1 до 3 ч.
Соединение формулы IX после этого можно использовать в различных схемах синтеза ингибиторов ренина, таких как алискирен. Предпочтительно использовать соединение на разных стадиях, подробно описанных в заявке GB 05116868, как это показано ниже.
Таким образом, способ синтеза ингибитора ренина, такого как алискирен, включает окисление соединения формулы IX, предпочтительно - синтезированного на предыдущих стадиях, в оксосоединение формулы X,
в которой R и R1 являются такими, как определено для соединения формулы III выше, R2 является таким, как определено для соединения формулы IV выше, и PG обозначает защитную группу аминогруппы.
Предпочтительно, если соединение формулы Х обладает стереохимической конфигурацией, представленной ниже формулой ХА.
Реакцию предпочтительно проводить при обычных условиях, которые обеспечивают окисление гидроксигруппы в оксогруппу, и с использованием обычных окислительных реагентов (окислителей). В этой реакции можно использовать такие окислители, которые обеспечивают прямое превращение соединения формулы IX в соответствующий альдегид формулы Х или его соль, или на первой стадии окисления приводят к карбоксильному соединению формулы XI,
в которой R и R1 являются такими, как определено для соединения формулы III выше, R2 является таким, как определено для соединения формулы IV выше, и PG обозначает защитную группу аминогруппы, которое затем можно восстановить восстановительными реагентами в альдегид формулы X. Прямая реакция с превращение в альдегид формулы Х может, например, протекать в присутствии окислителя, который обеспечивает окисление спирта в альдегид без нежелательного образования кислоты формулы XI, например, при условиях проведения реакции Оппенауэра (например, с использованием циклогексанона, коричного альдегида или анисового альдегида в качестве окислителя в присутствии алкоголята алюминия, такого как трет-бутоксиалкоголят алюминия), предпочтительно - с использованием хромовой кислоты, смеси дихромат/серная кислота, пиридинийхлорхромата, пиридинийдихромата, азотной кислоты, диоксида марганца или диоксида селена или путем каталитического дегидрирования, или, более предпочтительно - с использованием окислителей, применимых при мягких условиях проведения реакции, таких как окисление с помощью TEMPO (TEMPO = 2,2,6,6-тетраметилпиперидиннитроксил) с использованием гипохлорита, например, гипохлорита натрия или гипохлорита кальция, предпочтительно - в присутствии бромида, например бромида калия, в подходящем растворителе, таком как метиленхлорид и/или вода, или с помощью диацетоксийодбензола в подходящем растворителе, например метиленхлориде, при температуре, равной, например, от 0 до 50°С; при условиях реакции Шверна, например, с использованием диметилсульфоксида в присутствии оксалилхлорида, например, при пониженных температурах, таких как равные от -90 до 0°С, предпочтительно - в присутствии третичного азотистого основания, такого как триэтиламин; при условиях реакции Кори-Кима, например, с использованием диметилсульфида в присутствии N-хлорсукцинимида; при условиях реакции Моффата-Пфитцнера, например, окисление диметилсульфоксидом в присутствии дициклогексилкарбодиимида; окисление по Дессу-Мартину в присутствии перйодинана Десса-Мартина (1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3(1H)-она) в подходящем растворителе, таком как метиленхлорид, например, при температуре, равной от 0 до 50°С; или с использованием комплекса SO3/пиридин в диметилсульфоксиде при отсутствии или в присутствии подходящего растворителя, такого как метиленхлорид, при температуре, равной, например, от -30 до 30°С; или, менее предпочтительно, с помощью каталитического дегидрирования, например, в присутствии серебра, меди, оксида хрома или оксида цинка. При необходимости количество окислителя выбирают таким, чтобы избежать чрезмерного окисления.
Окисление соединения формулы IX (или также альдегида соединения формулы X, предпочтительно полученного, как описано выше) в соединение формулы XI можно, например, проводить с использованием реагента Джона (CrO3 в смеси водный раствор серной кислоты/ацетон), с помощью диоксида марганца, пиридинийдихромата или, предпочтительно, при условиях окисления по Пиннику, например, путем окисления гипохлоритом натрия или кальция в присутствии основания, предпочтительно - дигидрофосфата щелочного металла, например дигидрофосфата натрия, в подходящем растворителе или в смеси растворителей, например, в спирте, таком как трет-бутанол, 2-метил-2-бутене и/или воде, при температуре, равной, например, от 0 до 50°С. Затем восстановление кислоты формулы XI можно проводить с использованием восстановительных реагентов, которые обеспечивают селективное восстановление в альдегид формулы X. Востановительные реагенты можно, например, выбрать из числа подходящих комплексных гидридов, таких как ВН3-SMe2, и соединение формулы XI также можно использовать в форме с активированной карбоксигруппой, например, в виде галогенангидрида кислоты, активного сложного эфира, (например, смешанного) ангидрида или путем активации in situ, например, в активной форме, или путем активации, описанной ниже для сочетания соединения формулы XI и соединения формулы XIV, это соединение описано ниже. Например, в случае хлорангидрида кислоты формулы XI восстановление в альдегид формулы Х можно проводить с помощью LiAlH(трет-бутокси)3 (три(трет-бутокси)алюмогидрид лития) в подходящем растворителе, например, 2-метоксиэтиловом эфире (диглим), или можно использовать борогидрид натрия или его комплексы. Альтернативно, окисление можно проводить путем гидрирования в присутствии частично отравленных катализаторов гидрирования, например, при условиях восстановления по Розенмунду с использованием катализатора палладий/сульфат бария и водорода в подходящем растворителе, таком как вода, спирт, такой как метанол или этанол, диоксан, ацетилацетат или смесь двух или большего количества таких растворителей, при обычных температурах, например, равных от 0 до 80°С.
Альтернативно, соединение формулы Х можно получить другими путями. Один подход в качестве дополнительной стадии или в качестве отдельного синтеза включает получение соединения формулы XII
в которой R и R1 являются такими, как определено для соединения формулы III выше, R2 является таким, как определено для соединения формулы IV выше, и PG обозначает защитную группу аминогруппы, указанное получение включает (предпочтительно - содержит) гидролиз сложноэфирного фрагмента соединения формулы VI, предпочтительно - синтезированного на предыдущей стадии, в кислоту.
Реакцию предпочтительно проводить в щелочной или кислой среде, более предпочтительно - в щелочной среде. Подходящие основания включают органические или неорганические основания, предпочтительно - неорганические основания, более предпочтительно - гидроксиды или карбонаты щелочных металлов. Примеры предпочтительных оснований включают LiOH, гидроксид натрия, гидроксид калия, карбонат калия. Реакцию можно проводить в любом подходящем растворителе, предпочтительно - в водной системе растворителей, такой как вода/тетрагидрофуран, или водные растворы спиртов, например смеси метанола, этанола с водой, более предпочтительно - вода/тетрагидрофуран. Длительность проведения и температуру реакции выбирают так, чтобы завершить реакцию за минимальное время без образования нежелательных побочных продуктов. Обычно реакцию можно проводить при температуре от 0°С до температуры кипения, предпочтительно - от 0 до 40°С, более предпочтительно - от 15 до 30°С, такой как комнатная температура, в течение от 1 до 48 ч, предпочтительно - от 6 до 36 ч, наиболее предпочтительно - от 12 до 36 ч, например в течение 24 ч.
В щелочной среде, в которой проводят реакцию Виттига, можно наблюдать эпимеризацию заместителя в положении С4. Поэтому при использовании предпочтительного диастереоизомера, образованного из соединения формулы IVA, приведенной выше, можно обеспечить необходимую стереохимическую конфигурацию, представленную ниже формулой XIIA, и, как это необходимо, например, для алискирена, можно получить:
Соединение формулы XII можно использовать, в частности, для синтеза фармацевтически активных веществ, предпочтительно - ингибиторов ренина, таких как алискирен, предпочтительно - как описано ниже.
В другом предпочтительном варианте осуществления настоящего изобретения этот синтез в качестве дополнительной стадии или в качестве отдельного синтеза включает получение соединения формулы X, описанного выше, указанное получение включает (предпочтительно - содержит) проведение для соединения формулы XII стадий превращения кетона в олефин по мет