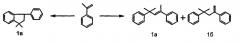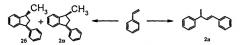Способ совместного получения линейных и циклических гомо- и содимеров стирола и альфа-метилстирола
Иллюстрации
Показать всеНастоящее изобретение относится к способу совместного получения циклических и линейных гомо- и содимеров стирола и α-метилстирола. Описан способ совместного получения циклических и линейных гомо- и содимеров стирола и α-метилстирола путем содимеризации мономеров в присутствии кислотного катализатора, отличающийся тем, что в качестве катализатора используют цеолит H-ZSM-12 в количестве 5-30 мас.% и реакцию проводят в хлорбензоле при температуре 80-130°С. Технический результат - упрощенный, экологически безопасный способ совместной олигомеризации стирола и α-метилстирола. 1 з.п. ф-лы, 1 ил., 2 табл.
Реферат
Изобретение относится к области нефтехимического синтеза, а именно к способу получения линейных и циклических гомо- и содимеров стирола и α-метилстирола.
Циклические и линейные гомодимеры стирола и α-метилстирола применяются в качестве пластификаторов полимеров и каучуков, регуляторов молекулярной массы полимеров, сырья для получения топлив, компонентов синтетических масел и смазочных материалов, растворителей для лакокрасочных материалов, высокотемпературных теплоносителей [Патенты США 3161692, 3792096, 3994816, 4302618, 442027, 20040242441, А.С. СССР 1036727; Патенты РФ 2071460, 2129043, 2149862; Maier G.Angew. Chem. Im. Ed. 1998, 37, p.2960-2974].
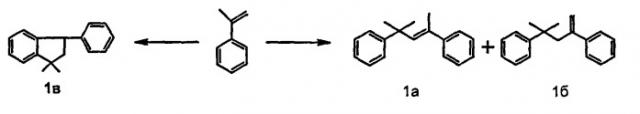
Синтез гомодимеров α-метилстирола проводят с использованием различных кислотных катализаторов: минеральных или органических кислот [Патент Великобритании 1507600, Патент РФ 2088561], катионообменных смол [B.Chaudhuri, M.M.Sharma. Ind. Eng. Chem. Res. 1989, v.28, N12, p.1757-1763. M.Fujiwara, K.Kuraoka, T.Yazawa. Chem. Commun. 2000, p.1523-1524], обработанных кислотой глин [Патент США 3161692, 1964]. В зависимости от условий реакции и природы катализатора основными продуктами реакции являются линейные (ЛДМС 1а, б) или циклический димер α-метилстирола (ЦДМС 1в)
Схема реакций
Эффективными катализаторами для получения линейных димеров α-метилстирола являются цеолиты и цеолитоподобные материалы.
В работе [Я.И.Исаков, Х.М.Миначев, В.З.Шарф и др. Нефтехимия, 1999, т.39, №4, с.278-283] описан способ получения линейных димеров α-метилстирола в присутствии кристаллических алюмофосфатов. На катализаторе, полученном из немодифицированного кристаллита AlPO4-8, при атмосферном давлении, 75-100°C и объемной скорости 1,5 ч-1 конверсия α-метилстирола составляет 80-83%, селективность образования линейных димеров 93,6-96,3%.
Авторы [В.П.Талзи, В.П.Доронин, Т.П.Сорокина. ЖПХ, 2000, т.13, №5, с.787] осуществили димеризацию α-метилстирола на цеолите Y в среде метиленхлорида при 25-40°C. Конверсия α-метилстирола составляет 98,4-99,9 мас.%, селективность образования линейных димеров достигает 76,1-87,0%.
В патентах приведены способы получения линейных димеров α-метилстирола без растворителя в присутствии цеолитов HNaY [Патенты РФ №2189963, 2189964, 2313511] Beta [Патент РФ №2322429], ZSM-12 [Патент РФ №2312095].
Для синтеза циклического димера α-метилстирола 1,1,3-триметил-3-фенилиндана (ЦДМС) использовали цеолиты типа морденит и СаХ в среде растворителей - нитробензола или нитрометана [А.с. СССР №829606. 1979, БИ 1981, №18]. Содержание растворителя составляет 41-45 об.%, содержание катализатора 18-19 мас.% на шихту (или 35-40% катализатора на α-метилстирол); температура реакции 80°C, время - 2-2,5 ч. Выход ТМФИ оставляет 99,0 мас.%. Конверсия α-метилстирола не указана, но поскольку в описании говорится о том, что при выделении ТМФИ отгоняют непрореагировавший α-метилстирол, то можно сделать вывод о неполном превращении мономера.
Известен способ получения ЦДМС, осуществляемый путем димеризации α-метилстирола в присутствии цеолитсодержащего катализатора крекинга Ц-10 в количестве 5-50 мас.% при температуре 60-150°C. Конверсия α-метилстирола достигает 100 мас.%, выход ТМФИ составляет 92-98,8% [Патент РФ 2223937]. Столь же успешно ЦДМС может быть получен в присутствии цеолита Beta [Патент РФ 2327969].
Гомодимеризация стирола проходит с образованием линейного (ЛДС 2а) и циклических димеров (ЦДС 2б, в)
Схема реакций
Линейный димер стирола (транс-1,3-дифенилбутен-1) предложено получать путем димеризации стирола в присутствии цеолита HY со степенью ионного обмена 10%, прошедшего термическую обработку при 400°C в течение 2 ч под вакуумом. Реакцию проводили в атмосфере аргона в растворителе при соотношении растворитель: стирол = 50:1 (об.), количество катализатора составляет 55,5 мас.%. Выход линейного димера составляет 81% [K.B.Joon, J.L.Lim, J.K.Kochi. J. Mol. Catal. 1989, 52, p.375-386].
Использование цеолита H- ZSM-12 позволяет получать линейные димеры стирола с селективностью 68-75% в присутствии нонана при отношении стирол:растворитель = 1:2-4 (об.) [Патент РФ №2349567] или с близкой селективностью в отсутствие растворителя [Патент РФ №2349568].
Для синтеза циклических димеров стирола цис- и транс-1-метил-3-фенилинданов (ЦДС) предложено проводить димеризацию стирола в присутствии фосфорной кислоты [Патент Великобритании 1343 445], фосфорной кислоты на угле [B.B.Corson, Ju. Dorsky, J.E.Nickels. J. Org. Chem. 1954, v.9, p.17-26], катионообменной смолы H-Nafion [Hasegawa H., Higashimura T. Polim.J., 1979, 11, p.737].
Известен способ получения циклического димера стирола в присутствии цеолита Beta. Реакцию проводят в растворителе CCl4, количество которого составляет от 227 до 454 объемных частей на 1 об. часть стирола. Катализатор используют в количестве 500-1000 мас.% в расчете на стирол. Температура реакции 72°C, время - 3 ч. Селективность образования циклического димера составляет 84-90% при конверсии стирола 95 мас.% [Benito A., Corma A., Garcia H. Appl. Catal. A: General. 1994, 116, р.127-135].
В отличие от широко изученной гомодимеризации стирола и α-метилстирола, их совместная димеризация исследована мало.
Описана совместная олигомеризация стирола с α-метилстиролом под действием фосфорной кислоты с получением смеси циклических гомо- и содимеров [Р.Н.Волков, Ю.С.Цыбин, В.В.Кузенков. Нефтехимия, 1970, т.X, №4, с.541-545]. Реакцию проводили, добавляя 150 г смеси мономеров к 150 мл упаренной фосфорной кислоты, постепенно поднимая температуру от 130 до 155°C, в течение 3 ч. Выход димеров составляет 80% при мольном соотношении стирол: α-метилстирол = 1:1. В составе димеров образуются циклический димер α-метилстирола (ЦДМС); циклические димеры стирола (НДС); два циклических содимера (ЦСД) - 1,1-диметил-3-фенилиндан и 1,3-диметил-3-фенилиндан.
К недостаткам данного способа относится использование большого количества агрессивного, коррозионноактивного реагента - фосфорной кислоты, сложность ее отделения от продуктов реакции (необходимость в нейтрализации, отмывке, осушке органической части перед перегонкой), появление большого количества стоков. Кроме того, продуктами реакции являются только циклические гомо- и содимеры.
Задачей настоящего изобретения является разработка малостадийного, экологически безопасного способа совместной олигомеризации стирола и α-метилстирола.
Решение поставленной задачи достигается тем, что способ получения смеси гомо- и содимеров стирола и α-метилстирола осуществляют взаимодействием стирола и α-метилстирола в присутствии цеолита ZSM-12. Реакцию проводят в хлорбензоле при мольном соотношении стирол:α-метилстирол = 1:1, температуре 80-130°C и количестве катализатора 5-30 мас.% (в расчете на смесь мономеров). Начальная концентрация мономеров в хлорбензоле составляет 2-8 моль/л.
Цеолит ZSM-12 используют в водородной форме H-ZSM-12.
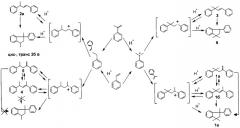
Конверсия стирола и α-метилстирола составляет 96,2-100 мас.%. Выход димеров в присутствии цеолита ZSM-12 достигает 84 мас.%. В составе димеров образуются циклические и линейные димеры стирола (ЦДС и ЛДС), α-метилстирола (ЦДМС и ЛДМС), а также циклический содимер (ЦСД) - 1,1-диметил-3-фенилиндан (6) и линейные содимеры - транс-3-метил-1,3-дифенилбут-1-ен (3), 2,4-дифенил-пент-2-ен (4), 2,4-дифенил-пент-1-ен (5). Содержание содимеров в димерной фракции достигает 50,2 мас.%. Соотношение циклический содимер:линейные содимеры составляет 0,8-1,2:1. Кроме димеров образуются олигомеры с числом мономерных звеньев n=3-5.
Схема содимеризации стирола и α-метилстирола:
Сравнительный анализ заявляемого решения с прототипом показывает, что заявляемый способ отличается от прототипа тем, что в процессе содимеризации стирола и α-метилстирола в качестве катализатора используется цеолит ZSM-12. Процесс содимеризации осуществляют в присутствии 5-30 мас.% катализатора при температуре 80-130°C. Конверсия стирола и α-метилстирола достигает 100 мас.%, а выход димеров, в состав которых входят гомо- и содимеры указанных виниларенов - 84%.
Катализатор цеолит ZSM-12 легко отделяется фильтрованием. Может использоваться многократно без потери активности.
Предлагаемый способ осуществляют следующим образом. Катализатор цеолит ZSM-12 синтезировали в Н-форме в ОАО «Ангарский завод катализаторов и органического синтеза» по ДК 04-213030-008-2004. Мольное соотношение SiO2/Al2O3=34, степень кристалличности 96%. Перед опытами катализатор прокаливают в атмосфере воздуха про 540°C в течение 4 ч.
Соолигомеризацию проводили в периодическом термостатированном реакторе, в присутствии 5-30 мас.% катализатора, при 100-130°C в среде хлорбензола. Реакционную массу перемешивают при температуре реакции в течение определенного времени. После окончания реакции реакционную массу отделяли от катализатора фильтрованием. Степень превращения исходных виниларенов и состав димерной фракции анализировали методом газожидкостной хроматографии. Состав образующихся олигомеров анализировали методом высокоэффективной жидкостной хроматографии. Для калибровки выделяли вакуумной перегонкой димеры и тримеры.
ГЖХ-анализ выполняли на хроматографе HRGS 5300 Mega Series ("Carlo Erba") с пламенно-ионизационным детектором (капиллярная колонка 25 м, фаза SE-30, программирование нагревания от 50 до 280°C со скоростью подъема 8°C/мин, температура детектора 250°C, температура испарителя 300°C, газ-носитель - гелий, 30 мл/мин). ВЭЖХ-анализ выполняли на хроматографе HP-1090 с рефрактометрическим детектором и полистирольной колонкой Plgel 100Å, элюент-толуол, скорость подачи толуола 0,8 мл/мин, скорость ленты 1,5 см-1.
Предлагаемый способ иллюстрируется следующими примерами (см. чертеж и табл. 1 и 2).
ПРИМЕР 1. В стеклянный обогреваемый реактор с мешалкой, обратным холодильником и термометром помещали смесь 5,2 г (0,05 моля) стирола и 5,9 г (0,05 моля) α-метилстирола в 25 мл хлорбензола. При 120°C прибавляли 0,55 г цеолита ZSM-12 и перемешивали при этой температуре 5 ч. После охлаждения от реакционной смеси отфильтровывали катализатор, затем при пониженном давлении удаляли растворитель и непрореагировавшие виниларены. Получали 10,1 г олигомеров состава, мас.%: димеры - 71,2; олигомеры n≥3 - 28,8. В составе димеров содержится, мас.%: содимеры циклический (ЦСД - 20,2) и линейные (ЛСД - 21,9); димеры стирола (ЦДС - 3,9 и ЛДС - 13,1), димеры α-метилстирола (ЦДМС - 7,2 и ЛДМС - 33,7).
Транс-3-метил-1,3-дифенилбут-1-ен (3). Спектр ЯМР. 1H (δ, м.д.); 1.70 (с. CH3; 6Н); 6,60-6,65 (м. СН=СН; 2Н); Спектр ЯМР 13C (δ, м.д):
28,89 (CH3); 40,94 (CH); 126,09 (=CH); 140,30 (=СН). Масс-спектр, m/z: 222; индекс Ковача 1820.
2.4-Дифенил-пент-2-ен (4). Спектр ЯМР 1H (δ, м.д.): 1.60 (д. CH3; 3H); 2,26 (с; CH3; 3H); 4,03 (м, CH; 1Н); 6,11 (д, =СН; 1H. Спектр ЯМР 13C (δ, м.д): 16,26 (CH3); 22,61(CH3); 38,47 (СН); 133,59 (HC=); 143,83 (=C); Масс-спектр, m/z: 222; индекс Ковача 1830.
2,4-Дифенилпент-1-ен (5). Масс-спектр, m/z: 222; индекс Ковача 1746.
1,1-Диметил-3-фенилиндан (6). Спектр ЯМР 1H (δ, м.д.): 1,36 (с, 3H, CH3), 1,40 (с, 3H, СН3), 1,79 (м, 1Н, CH2); 2.06 (м, 1Н, CH2); 4.43 (т, 1Н, СН). Спектр ЯМР 13С (δ, м.д.): 29.70 (-СН3); 29.10 (-СН3); 46.64 (-C(СН3)2); 49.04 (CPh); 52.79 (-СН2-). Масс-спектр, m/z: 222; индекс Ковача 1713.
Примеры 2-7 приведены в табл. 1, 2 аналогично примеру 1.
1. Способ совместного получения циклических и линейных гомо- и содимеров стирола и α-метилстирола путем содимеризации мономеров в присутствии кислотного катализатора, отличающийся тем, что в качестве катализатора используют цеолит H-ZSM-12 в количестве 5-30 мас.% и реакцию проводят в хлорбензоле при температуре 80-130°С.
2. Способ по п.1, отличающийся тем, что концентрация смеси стирола и α-метилстирола в хлорбензоле составляет 2-8 моль/л.