Пептид, индуцирующий цитотоксические т-клетки (цтл), способ индукции цтл, антитело, связывающееся с этим пептидом, применение пептида в фармацевтической композиции и для лечения или предупреждения рака, антигенпредставляющая клетка
Иллюстрации
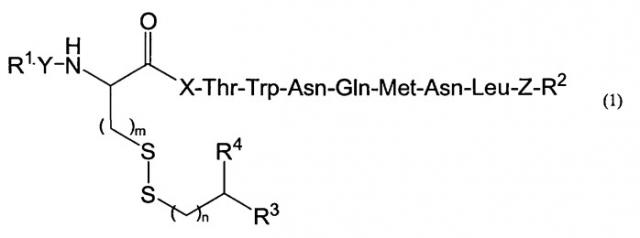
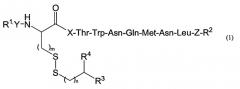
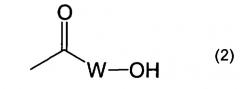
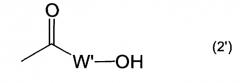
Показать всеИзобретение относится к пептидам, индуцирующим цитотоксические Т-клетки, общей формулы (1), где Х представляет собой тирозиновый остаток или метиониновый остаток; каждый из Y и Z представляют собой простую связь; R1 представляет собой атом водорода; R2 представляет собой гидроксил; R3 представляет собой водород, амино, C1-6 алкилкарбониламино, замещенный 1-2 заместителями, выбранными из группы, состоящей из карбокси и амино; R4 представляет собой карбокси или группу формулы (2), где W представляет собой аминокислотный остаток; m равен 1 и n равен целому числу 0-1, при условии, что когда n равен 0, R3 представляет собой водород; их фармацевтически приемлемым солям, и их применению в иммунотерапии рака. 11 н. и 6 з.п. ф-лы, 9 ил., 2 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к лечению противораковой вакциной, в особенности, к новому пептиду, применимому в качестве лечебного средства для иммунотерапии рака. В частности, настоящее изобретение относится к производному пептида ракового антигена, полученного из WT1, который обладает активностью по индукции ЦТЛ (CTL) in vivo и применим в качестве противораковой вакцины.
Уровень техники
Клеточно-опосредованный иммунитет, в особенности, цитотоксическими Т-клетками (далее в данном описании называемыми "ЦТЛ") играет существенную роль в отклонении in vivo раковых клеток или клеток, инфицированных вирусами. ЦТЛ узнают на раковой клетке комплекс пептида антигена ("пептида ракового антигена"), образовавшегося из белка ракового антигена, и антигена класса I ГКС (главного комплекса гистосовместимости), который называют "антигеном HLA" в случае человека, и атакуют и убивают клетку.
Вообще известно, что пептид ракового антигена, который связывается с молекулой класса I ГКС, представляет собой пептид из 8-12 аминокислотных остатков, полученный внутриклеточным процессингом белка. Таким образом, вообще, пептид с 8-12 аминокислотными остатками, образовавшийся из белка ракового антигена, может являться кандидатом в пептиды ракового антигена. Когда в пептиде ракового антигена присутствует глутаминовый остаток или цистеиновый остаток, такие аминокислотные остатки, как правило, спонтанно окисляются в воздушной атмосфере. Сообщается, что такое спонтанное окисление снижает аффинность связывания пептида с Т-клеточным рецептором (см. непатентные ссылки 1 и 2).
Опухолевый ген-супрессор WT1 опухоли Вильмса (ген WT1) выделен из хромосомы 11р13 как один из причинных генов опухоли Вильмса на основе анализа синдрома WAGR, который имеет место как осложнение опухоли Вильмса, аниридии, мочеполовых анормальностей, врожденного слабоумия и т.д., и аминокислотная последовательность WT1 достаточно известна (см. непатентную ссылку 3). Ген WT1 экспрессируется с высокой частотой при лейкозе человека, и когда лейкозные клетки обрабатывают антисмысловыми олигомерами WT1, рост клеток ингибируется. Таким образом, полагают, что ген WT1 действует, промотируя рост лейкозных клеток. Более того, ген WT1 также обильно экспресируется при солидных раковых опухолях, таких как рак желудка, рак толстой кишки, рак легких, рак молочной железы, эмбриональный рак, рак кожи, рак мочевого пузыря, рак предстательной железы, рак матки, цервикальный рак и рак яичников, и показано, что ген WT1 является новым белком ракового антигена при лейкозе и солидных раковых опухолях (см. непатентные ссылки 4 и 5). Кроме того, идентифицирован пептид ракового антигена с неполной последовательностью белка WT1, который является пептидом ракового антигена дикого типа (см. патентные ссылки 1 и 2).
В частности, WT1235-243 (Cys-Met-Thr-Trp-Asn-Gln-Met-Asn-Leu; SEQ ID NO:1), который представляет собой пептид, перекрывающий позиции 235-243 белка ракового антигена WT1, является пептидом ракового антигена, обладающим активностью по индукции ЦТЛ по HLA-А24-ограниченному типу (см. непатентную ссылку 6 и патентную ссылку 1). Модифицированный пептид (Cys-Tyr-Thr-Trp-Asn-Gln-Met-Asn-Leu; SEQ ID NO:2, далее в описании он может называться WT1235-243 (2М→Y)), в котором метиониновый остаток в позиции 2 WT1235-243 заменен на тирозиновый остаток, имеет более высокую аффинность связывания в отношении антигена HLA-A24, чем пептид дикого типа (см. патентную ссылку 3). Предвещается разработка как пептида дикого типа WT1235-243, так и модифицированного пептида WT1235-243 (2М→Y) в качестве иммунотерапевтического средства.
Кроме того, известно, что каждый из указанного пептида дикого типа и указанного модифицированного пептида имеет цистеиновый остаток в N-концевом сайте, окисление которого в воздушной атмосфере приводит к димерной связи через сульфидную связь, и указанный димер также может работать как пептид ракового антигена (см. патентную ссылку 4).
Патентная ссылка 1: WO 00/06602.
Патентная ссылка 2: WO 00/18795.
Патентная ссылка 3: WO 02/079253.
Патентная ссылка 4: WO 2004/063217.
Непатентная ссылка 1: Immunity, 6: 273, 1997.
Непатентная ссылка 2: J. Immunol., 160: 2099, 1998.
Непатентная ссылка 3: Cell, 60: 509, 1990.
Непатентная ссылка 4: J. Immunol., 164: 1873-80, 2000.
Непатентная ссылка 5: J. Clin. Immunol., 20: 195-202, 2000.
Непатентная ссылка 6: Clin. Cancer Res., 8: 2626, 2002.
Раскрытие изобретения
Проблема, которую решает изобретение
Проблемой, которую решает настоящее изобретение, является новый пептид, обладающий активностью по индукции ЦТЛ in vivo и применимый в качестве противораковой вакцины в иммунотерапии рака.
Способ решения проблемы
Авторы провели серьезные различные исследования по модификации пептидов ракового антигена WT1235-243 и WT1235-243 (2M→Y), полученных из белка WT1, для того, чтобы получить пептид ракового антигена, обладающий улучшенными физико-химическими свойствами, устойчивостью и биоактивностью. В частности, авторы получили из таких пептидов модифицированные соединения и проверили иммуногенность с использованием трансгенных мышей HLA-A2402/Kb (см. WO 02/47474, далее в данном описании они также могут называться мышами HLA-A24).
В результате достигнут успех в получении пептида с улучшенными физико-химическими свойствами и устойчивостью посредством модификации цистеинового остатка (Cys) в N-концевом сайте WT1235-243 или WT1235-243 (2М→Y), в особенности, модификации тиольной группы цистеинового остатка в N-концевом сайте. Пептид по настоящему изобретению обладает улучшенной иммуногенностью и активностью по индукции ЦТЛ. Т-Клетки, специфически индуцированные пептидом по настоящему изобретению, применимы в качестве лечебного средства для иммунотерапии рака из-за их перекрестного взаимодействия с пептидом дикого типа WT1235-243, который изначально представлен раковыми клетками.
До сих пор было неизвестно, чтобы пептид, в котором модифицирован цистеиновый остаток WT1235-243 или WT1235-243 (2M→Y) как пептида антигена WT1, показывал иммуногенность, достаточную для того, чтобы действовать как раковый антиген. Авторы настоящего изобретения впервые обнаружили, что производное пептида, полученное конденсацией тиольной группы цистеинового остатка в N-концевом сайте с тиольной группой цистеина, глутатиона или тиогликолевой кислоты с образованием дисульфидной связи, можно использовать в качестве эффективного ракового антигена.
Настоящее изобретение осуществлено на основе открытия, описанного выше.
Настоящее изобретение относится к
[1] соединению формулы (1)
где X представляет собой тирозиновый остаток или метиониновый остаток; каждый из Y и Z выбирают, независимо, из числа простой связи и двухвалентной пептидной группы, состоящей из 1-10 аминокислотных остатков,
R1 представляет собой водород или алкил,
R2 представляет собой гидроксил, амино, алкиламино или диалкиламино,
R3 представляет собой водород, алкил, амино, алкиламино, диалкиламино или замещенный, или незамещенный алкилкарбониламино,
R4 представляет собой водород, алкил, карбокси, карбамоил, алкилкарбамоил, диалкилкарбамоил или группу формулы (2)
где W представляет собой аминокислотный остаток,
m равен 1 или 2, и
n равен целому числу 0-2, при условии, что когда n равен 0, R3 представляет собой водород или алкил,
или его фармацевтически приемлемой соли;
[2] соединению, описаному выше в [1], или его фармацевтически приемлемой соли, где указанный замещенный алкилкарбониламино, представленный R3, представляет собой алкилкарбониламино, замещенный одним или двумя заместителями, выбранными из группы, состоящей из карбокси, амино, алкиламино и диалкиламино;
[3] соединению, описаному выше в [1] или [2], или его фармацевтически приемлемой соли, где
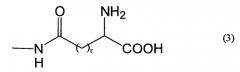
R3 представляет собой водород или группу формулы (3)
где r равен целому числу 1-3, и
R4 представляет собой карбокси или группу формулы (2')
где W' представляет собой глициновый остаток или β-аланиновый остаток;
[4] соединению, описаному выше в [3], или его фармацевтически приемлемой соли,
где R3 представляет собой группу формулы (3')
и R4 представляет собой карбоксиметилкарбамоил;
[5] соединению, описаному выше в [3], или его фармацевтически приемлемой соли,
где R3 представляет собой водород, и R4 представляет собой карбокси;
[6] соединению формулы (1')
где X' представляет собой тирозиновый остаток или метиониновый остаток,
R1' представляет собой водород или алкил,
R2' представляет собой гидроксил, амино, алкиламино или диалкиламино,
R3' представляет собой амино, алкиламино, диалкиламино или замещенный или незамещенный алкилкарбониламино, и
R4' представляет собой карбокси, карбамоил, алкилкарбамоил, диалкилкарбамоил,
или его фармацевтически приемлемой соли;
[7] антителу, которое специфически связывается с соединением, описанным выше в любом из [1]-[6], или его фармацевтически приемлемой солью;
[8] антигенпредставляющей клетке, которая представляет комплекс соединения, описанного выше в любом из [1]-[6], или его фармацевтически приемлемой соли и антигена HLA-A24;
[9] ЦТЛ, индуцированному соединением, описанным выше в любом из [1]-[6], или его фармацевтически приемлемой солью;
[10] ЦТЛ, описаному выше в [9], который узнает комплекс соединения, описанного выше в любом из [1]-[6], или его фармацевтически приемлемой соли, и антигена HLA-A24;
[11] ЦТЛ, описаному выше в [9], который узнает комплекс пептида SEQ ID NO:1 и антигена HLA-A24;
[12] фармацевтической композиции, содержащей соединение, описанное выше в любом из [1]-[6], или его фармацевтически приемлемую соль, антигенпредставляющие клетки, описанные выше в [8], или ЦТЛ, описанные выше в любом из [9]-[11], вместе с фармацевтически приемлемым носителем;
[13] фармацевтической композиции, описанной выше в [12], которую используют в качестве противораковой вакцины;
[14] применению соединения, описанного выше в любом из [1]-[6], или его фармацевтически приемлемой соли, антигенпредставляющих клеток, описанных выше в [8], или ЦТЛ, описанных выше в любом из [9]-[11], для получения противораковой вакцины;
[15] лекарственному средству для иммунотерапии рака, содержащему в качестве активного ингредиента соединение, описанное выше в любом из [1]-[6], или его фармацевтически приемлемую соль, антигенпредставляющие клетки, описанные выше в [8], или ЦТЛ, описанные выше в любом из [9]-[11]; или
[16] способу лечения или предупреждения рака, включающему введение пациенту, положительному на HLA-A24 и положительному на WT1, нуждающемуся в лечении или предупреждении рака, терапевтически или профилактически эффективного количества соединения, описанного выше в любом из [1]-[6], или его фармацевтически приемлемой соли, антигенпредставляющих клеток, описанных выше в [8], или ЦТЛ, описанных выше в любом из [9]-[11].
Эффект, производимый настоящим изобретением
Настоящее изобретение относится к новому пептиду, применимому в качестве лекарственного средства для иммунотерапии рака, например раковому антигену, полученному из WT1, который обладает активностью по индукции ЦТЛ in vivo и применим в качестве противораковой вакцины. Пептид по настоящему изобретению, который получают модификацией меркаптогруппы цистеинового остатка, расположенного в N-конце WT1235-243 или WT1235-243 (2М→Y), с сохранением активности как пептида ракового антигена, обладает улучшенными физико-химическими свойствами и устойчивостью, и, таким образом, его можно широко применять для лечения или исследований. В частности, новый пептид по настоящему изобретению обладает преимуществами, такими как удобство в обращении без опасности снижения активности из-за обработки in vitro, проявление устойчивого лечебного эффекта и так далее.
Краткое описание чертежей
Фигура 1 представляет собой диаграмму, показывающую цитотоксическую активность (специфический лизис), индуцированную пептидом примера 1, с использованием трех мышей по отдельности (черные столбики на фигуре). Белые столбики на фигуре показывают результаты, полученные с использованием клеток, не подвергавшихся обработке в импульсном режиме каким-либо пептидом (то же применимо для последующих фигур).
Фигура 2 представляет собой диаграмму, показывающую цитотоксическую активность (специфический лизис), индуцированную пептидом примера 2, с использованием трех мышей по отдельности.
Фигура 3 представляет собой диаграмму, показывающую цитотоксическую активность (специфический лизис), индуцированную пептидом примера 3, с использованием трех мышей по отдельности.
Фигура 4 представляет собой диаграмму, показывающую цитотоксическую активность (специфический лизис), индуцированную пептидом примера 4, с использованием трех мышей по отдельности.
Фигура 5 представляет собой диаграмму, показывающую цитотоксическую активность (специфический лизис), индуцированную пептидом примера 5, с использованием трех мышей по отдельности.
Фигура 6 представляет собой диаграмму, показывающую цитотоксическую активность (специфический лизис), индуцированную пептидом примера 6, с использованием трех мышей по отдельности.
Фигура 7 представляет собой график, показывающий цитотоксическую активность (специфический лизис), индуцированную пептидом примера 1 в зависимости от дозы. Ось Х показывает дозу на одну отдельную мышь (600 мкг, 200 мкг, 60 мкг и 20 мкг), и ось Y показывает цитотоксическую активность (специфический лизис). Каждую дозу вводят трем мышам, соответственно, и результаты приводят как среднее цитотоксических активностей и среднеквадратическое отклонение (S.D.).
Фигура 8 представляет собой диаграмму, показывающую реактивность пептидспецифических Т-клеток, полученных иммунизацией мышей пептидом примера 1, в отношении клеток, обработанных в импульсном режиме различными пептидами. На фигуре заштрихованные столбики показывают результаты, полученные с использованием клеток, обработанных в импульсном режиме пептидом дикого типа (WT1235-243), черные столбики показывают результаты, полученные с использованием клеток, обработанных в импульсном режиме пептидом соединением примера 1, и незаштрихованные столбики показывают результаты, полученные с использованием клеток, обработанных в импульсном режиме пептидом, полученным из вируса гриппа, соответственно. Кроме того, на фигуре вертикальная ось показывает точки.
Фигура 9 представляет собой диаграмму, показывающую реактивность пептидспецифических Т-клеток, полученных их человеческих РВМС стимуляцией пептидом примера 1, в отношении клеток, обработанных в импульсном режиме различными пептидами. На фигуре столбик "пептид дикого типа" показывает результаты, полученные с использованием клеток, обработанных в импульсном режиме пептидом дикого типа (WT1235-243), столбик "модифицированный пептид" показывает результаты, полученные с использованием клеток, обработанных в импульсном режиме модифицированным пептидом (WT1235-243 (2M→Y)), столбик "пептид примера 1" показывает результаты, полученные с использованием клеток, обработанных в импульсном режиме пептидом соединением примера 1, и столбик "без обработки пептидом в импульсном режиме " показывает результаты, полученные с использованием клеток, необработанных в импульсном режиме каким-либо пептидом, соответственно. Кроме того, на фигуре вертикальная ось показывает количество продуцированного интерферона-γ.
Наилучший способ осуществления изобретения
В описании и на чертежах настоящей заявки используются приведенные далее аббревиатуры аминокислотных остатков.
Ala - аланиновый остаток,
Arg - аргининовый остаток;
Asn - аспарагиновый остаток;
Cys - цистеиновый остаток;
Gln - глутаминовый остаток;
Glu -остаток глутаминовой кислоты;
Gly - глициновый остаток;
His - гистидиновый остаток;
Ile - изолейциновый остаток;
Leu - лейциновый остаток;
Lys - лизиновый остаток;
Met - метиониновый остаток;
Phe - фенилаланиновый остаток;
Pro - пролиновый остаток;
Ser - сериновый остаток;
Thr - треониновый остаток;
Trp - триптофановый остаток;
Tyr - тирозиновый остаток;
Val - валиновый остаток.
Используемый в данном описании термин "аминокислотный остаток" включает природные и неприродные остатки α-аминокислот, β-аминокислот, γ-аминокислот и δ-аминокислот. Например, "аминокислотный остаток" включает остаток природной α-аминокислоты (например, Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val), орнитиновый остаток, гомосериновый остаток, гомоцистеиновый остаток, β-аланин, γ-аминобутановую кислоту или δ-аминопентановую кислоту.
Описанные выше аминокислоты могут представлять собой или L-энантиомеры или D-энантиомеры, когда аминокислота является оптическим изомером, более предпочтителен L-энантиомер.
В описании аминокислотная последовательность пептида описывается согласно обычной форме, когда N-концевой аминокислотный остаток располагается с левой стороны, и С-концевой аминокислотный остаток располагается с правой стороны.
(1) Пептид
В первом аспекте настоящее изобретение относится к соединению описанной выше формулы (1) или его фармацевтически приемлемой соли.
В формуле (1), предпочтительно, Х представляет собой тирозиновый остаток (Tyr).
В формуле (1) "двухвалентные пептидные группы, состоящие из 1-10 аминокислотных остатков", представленные Y и Z, включают одинаковые или различные двухвалентные пептидные группы, состоящие из 1-10 аминокислотных остатков, без какого-либо ограничения аминокислотной последовательности. Например, указанная двухвалентная пептидная группа, состоящая из 1-10 аминокислотных остатков, включает аминокислотную последовательность, содержащуюся в аминокислотной последовательности человеческого WT1 (Cell, 60: 509, 1990, GenBank, Acc. No. A38080). Например, Y может представлять собой двухвалентную пептидную группу, состоящую из десяти аминокислотных остатков 225-234 человеческого WT1, которая описывается следующим образом: Asn-Leu-Tyr-Gln-Met-Thr-Ser-Gln-Leu-Glu (SEQ ID NO:3), или двухвалентную пептидную группу, имеющую фрагмент SEQ ID NO:3, в котором делегированы 1-9 аминокислотных остатков в N-конце. Кроме того, например, Z может представлять собой двухвалентную пептидную группу, состоящую из десяти аминокислотных остатков 244-253 человеческого WT1, которая описывается следующим образом: Gly-Ala-Thr-Leu-Lys-Gly-Val-Ala-Ala-Gly (SEQ ID NO:4), или двухвалентную пептидную группу, имеющую фрагмент SEQ ID NO:4, в котором делегированы 1-9 аминокислотных остатков в С-конце. Предпочтительно, каждый Y и Z может представлять собой простую связь.
В описании алкильная группа включает, например, линейную или разветвленную алкильную группу с 1-6 атомами углерода. Например, алкильная группа включает метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил и т.д.
В описании алкиламиногруппа включает, например, линейную или разветвленную алкиламиногруппу с 1-6 атомами углерода. Например, алкиламиногруппа включает метиламино, этиламино, пропиламино, 1-метилэтиламино, бутиламино, 1-метилпропиламиноамино, 2-метилпропиламино, 1,1-диметилэтиламино, пентиламино и т.д.
В описании диалкиламиногруппа включает, например, аминогруппу, замещенную двумя одинаковыми или различными и линейными или разветвленными алкильными группами с 1-6 атомами углерода. Например, диалкиламиногруппа включает диметиламино, диэтиламино, дипропиламино, метилпропиламино, бутилметиламино, метилпентиламино и т.д.
В описании "алкил" в алкилкарбониламиногруппе включает алкильную группу, описанную выше. "Алкил" в алкилкарбамоильной группе включает те же алкильные группы, что и описанная выше алкиламиногруппа. "Алкил" в диалкилкарбамоильной группе включает те же алкильные группы, что и описанная выше диалкиламиногруппа, когда два алкила могут быть одинаковыми или различными.
Каждый из R1 и R2, предпочтительно, представляет собой атом водорода.
Когда R3 представляет собой замещенную алкилкарбониламиногруппу, заместитель алкилкарбониламиногруппы включает, например, карбокси, гидрокси, амино, алкиламино и диалкиламино, где указанная алкилкарбониламиногруппа может быть замещена одинаковыми или различными 1-4, предпочтительно, 1-2, заместителями.
Аминокислотный остаток, представленный W в формуле (2), может включать, предпочтительно, глициновый остаток (Gly).
Пептид по настоящему изобретению включает, например, соединения приведенных далее формул (4)-(9).
Пептиды по настоящему изобретению можно получить согласно способу, описанному в описании в примерах, или способу, обычно используемому в синтезе пептидов. Примерами таких способов получения являются способы, описанные в литературе, в том числе, в "Peptide Synthesis", Interscience, New York, 1966; "The Proteins", Vol.2, Academic Press Inc., New York, 1976; "Pepuchido-Gosei", Maruzen Co. Ltd., 1975; "Pepuchido-Gosei-no-Kiso-to-Jikenn", Maruzen Co. Ltd., 1985; и "Iyakuhin-no-Kaihatu, Zoku, vol.14, Pepuchido-Gosei", Hirokawa Shoten, 1991. Пример способа получения пептида по настоящему изобретению включает способ получения пептида согласно методу с Fmoc или методу с Вос с помощью твердофазного синтезатора или способ получения пептида последовательной конденсацией Вос-аминокислоты или Z-аминокислоты согласно способу жидкофазного синтеза, где Fmoc представляет собой 9-флуоренилметилоксикарбонильную группу, Boc представляет собой трет-бутоксикарбонильную группу, и Z представляет собой бензилоксикарбонильную группу, соответственно.
Функциональную группу промежуточного соединения в синтезе соединения по настоящему изобретению, такую как амино, карбоксильная и меркаптогруппа, можно защитить подходящей защитной группой и из защищенного соединения защитную группу можно удалить с использованием обычного метода введения/удаления защитной группы, если требуется. Подходящие защитные группы и способы введения и удаления защитной группы подробно описаны, например, в Protective Groups in Organic Synthesis, 2nd Edition (John Wiley & Sons, Inc., 1990).
В частности, примером способа получения соединения по настоящему изобретению является способ, описанный следующей реакционной схемой
где в указанных формулах X, Y, Z, R1, R2, R3, R4, m и n имеют соответствующие значения, указанные выше. Каждый из R и R' представляет собой, независимо, атом водорода или защитную группу для меркаптогруппы.
Примеры указанной защитной группы для меркаптогруппы включают, например, ацетоамидометил или тритил.
Соединение формулы (1) можно получить окислением соединения формулы (1-1) и соединения формулы (1-2) в инретном растворителе.
Окисление можно осуществить традиционным способом, обычно применяемым в синтезе пептидов для образования дисульфидной связи. Например, дисульфидную связь можно образовать, смешивая два промежуточных соединения, содержащих меркаптогруппу, в подходящем растворителе и окисляя их. Можно использовать обычный способ окисления, такой как окисление на воздухе и окисление иодом. Растворителем может являться вода, уксусная кислота, метанол, хлороформ, ДМФА или ДМСО или их смесь. Реакция окисления иногда дает смесь симметричных и асимметричных дисульфидных соединений. Нужное асимметричное дисульфидное соединение можно получить очисткой смеси, такой как очистка с использованием различных видов хроматографии, очистка методом перекристаллизации и т.п.
С другой стороны, промежуточное соединение, содержащее активированную меркаптогруппу, смешивают с другим промежуточным соединением, содержащим меркаптогруппу, с образованием селективной дисульфидной связи. Примеры промежуточных соединений, содержащих активированную меркаптогруппу, включают, например, соединение, содержащее меркаптогруппу, связанную с группой Npys (3-нитро-2-пиридинсульфенильная группа).
С другой стороны, после смешивания одного из промежуточных соединений, содержащих активированную меркаптогруппу, с, например, 2,2'-дитиобис(5-нитропиридином) для активации меркаптогруппы к полученной смеси добавляют другое промежуточное соединение для образования селективной дисульфидной связи (Tetrahedron Letters, Vol.37, No.9, p.1347-1350).
Соединение формулы (1-1) можно получить согласно твердофазному или жидкофазному методу синтеза пептидов, которые хорошо известны специалистам в данной области техники.
Кроме того, в случае, когда соединение формулы (1-1) представляет собой соединение, алкилированное по N-концу, в качестве N-концевой аминокислоты можно использовать N-алкиламинокислоту или N,N-диалкиламинокислоту которые, при необходимости, могут быть защищены защитными группами. N-Алкиламинокислота или N,N-диалкиламинокислота может быть коммерчески доступна или получена согласно способу, хорошо известному специалистам в данной области техники, в котором, например, исходное вещество аминокислоту или защищенную аминокислоту вводят во взаимодействие с алкилгалогенидом в присутствии основания. Например, N-концевую аминогруппу можно соответствующим образом алкилировать взаимодействием аминокислоты, которая содержит защитную трет-бутоксикарбонильную группу, с алкилгалогенидом в присутствии основания, такого как гидрид натрия, как поясняется на приведенной далее реакционной схеме 2.
[Реакционная схема 2]
В указанных формулах каждый из X, Y, Z, R1, R2, R3, R4, m и R имеет значения, указанные выше, Hal представляет собой атом брома или атом иода, и Prot представляет собой защитную группу.
Далее, в случае, когда соединение представляет собой соединение, алкилированное или алкиламидированное по С-концу, в качестве С-концевого аминокислотного остатка исходного вещества можно использовать амидированную или алкиламидированную аминокислоту.
Соединение по настоящему изобретению или соединения, промежуточные при его синтезе, можно очистить согласно способу, хорошо известному специалистам в данной области техники. Например, очистку можно осуществить посредством различных видов хроматографии (например, колоночной хроматографией на силикагеле, ионообменной колоночной хроматографией, гель-фильтрацией или хроматографией с обращенной фазой) или перекристаллизации. Растворителями для перекристаллизации могут являться, например, спирты, такие как метанол, этанол и 2-пропанол, простые эфиры, такие как диэтиловый эфир, сложные эфиры, такие как этилацетат, ароматические углеводороды, такие как бензол и толуол, кетоны, такие как ацетон, углеводороды, такие как гексан, апротонные растворители, такие как диметилформамид и ацетонитрил, вода или смешанные растворители из их числа. Другим способом, используемым для очистки, может являться способ, описанный в томе 1 Jikkenkagakukoza (edited by Chemical Society of Japan, Maruzen).
В случае, когда соединение по настоящему изобретению имеет один или несколько асимметричных центров, для его получения согласно обычному способу можно использовать вещество (аминокислоту), имеющее асимметричный центр. Кроме того, можно осуществить расщепление на оптические изомеры на соответствующей стадии процесса получения для того, чтобы улучшить оптическую чистоту соединения по настоящему изобретению. Например, расщепление на оптические изомеры можно осуществить согласно способу диастереомеров, при котором соединение или промежуточное соединение по настоящему изобретению смешивают с оптически активной кислотой (например, монокарбоновой кислотой, такой как миндальная кислота, N-бензилоксианилин и молочная кислота, дикарбоновой кислотой, такой как винная кислота, о-диизопропилиденвинная кислота и яблочная кислота, или сульфоновой кислотой, такой как камфорсульфоновая кислота и бромкамфорсульфоновая кислота) в инертном растворителе (например, спиртовых растворителях, таких как метанол, этанол и 2-пропанол, простых эфирах, таких как диэтиловый эфир, сложных эфирах, таких как этилацетат, углеводородных растворителях, таких как толуол, апротонных растворителях, таких как ацетонитрил, или смешанных растворителях из их числа) для получения солевой формы. В случае, когда соединение или промежуточное соединение по настоящему изобретению содержит кислотную функциональную группу, такую как карбоксигруппа, расщепление на оптические изомеры можно осуществить, получая соль с оптически активным амином (например, органическим амином, таким как α-фенетиламин, хинин, хинидин, цинхонидин, цинхонин и стрихнин).
Реакцию образования соли можно проводить при температуре, колеблющейся от комнатной температуры до температуры кипения растворителя. В целях улучшения оптической чистоты предпочтительно, чтобы температура повышалась до примерно температуры кипения растворителя. Выход можно улучшить, если потребуется, охлаждением смеси, когда выпавшую в осадок соль извлекают фильтрацией.
Оптически активные кислоту или амин соответственно используют в количестве от примерно 0,5 до примерно 2,0 эквивалентов на субстрат, предпочтительно, в количестве примерно 1 эквивалента на субстрат. Если требуется, кристаллическое вещество можно перекристаллизовать из инертного растворителя (например, спиртов, таких как метанол, этанол и 2-пропанол, простых эфиров, таких как диэтиловый эфир, сложных эфиров, таких как этилацетат, углеводородов, таких как толуол, апротонных растворителей, таких как ацетонитрил, или смешанных растворителей из их числа) и получить высокочистую оптически активную соль. Кроме того, при необходимости, оптически расщепленную соль можно обработать кислотой или основанием согласно обычному способу для того, чтобы получить соединение в свободной форме.
Фармацевтически приемлемая соль включает соль присоединения кислоты и соль присоединения основания. Например, соль присоединения кислоты включает соль с неорганической кислотой, такую как гидрохлорид, гидробромид, сульфат, гидроиодид, нитрат и фосфат, и соль с органической кислотой, такую как цитрат, оксалат, ацетат, формиат, пропионат, бензоат, трифторацетат, малеат, тартрат, метансульфонат, бензолсульфонат и пара-толуолсульфонат. Соль присоединения основания включает соль с неорганическим основанием, такую как натриевая соль, калиевая соль, кальциевая соль, магниевая соль и аммониевая соль, соль с органическим основанием, такую как соль триэтиламмония, соль триэтаноламмония, соль пиридиния и соль диизопропиламмония, а также соль аминокислоты, такой как аминокислота щелочного или кислотного характера, включая аргинин, аспарагиновую кислоту и глутаминовую кислоту.
Кроме того, настоящее изобретение относится к сольвату пептида, представленного формулой (1), или его фармацевтически приемлемой соли, включая гидрат или сольват этанола. Кроме того, настоящее изобретение относится к любым возможным стереоизомерам, в том числе, любым диастереомерам и энантиомерам, соединения, представленного формулой (1), и любым его кристаллическим формам.
В ходе получения пептида, включающего стадии конденсации оптически активной α-аминокислоты, удаления различного рода защитных групп или высвобождения пептида из смолы, как правило, образуются побочные продукты, в том числе, пептид с делецией аминокислот, пептид, разрушенный гидролизом, окислением или подобным образом, и пептид с эпимеризованной аминокислотой. В лабораторном масштабе для удаления таких примесей можно использовать сочетание различных способов хроматографии (например, колоночной хроматографии на силикагеле, ионообменной колоночной хроматографии, гель-фильтрации или хроматографии с обращенной фазой) с тем, чтобы получить пептид высокой степени чистоты. Однако в промышленном масштабе трудно получить пептид высокой степени чистоты для целей предоставления его как лекарственного средства.
Пептид по настоящему изобретению имеет физико-химические свойства, которые дают возможность крупномасштабного получения фармацевтических средств в массе. В частности, пептид по настоящему изобретению имеет такие свойства, как высокая растворимость, высокая устойчивость в растворе или отсутствие склонности к превращению в гель при конденсации, так что пептид высокой чистоты можно легко получить как фармацевтическое средство в массе даже в крупном масштабе посредством очистки с использованием колоночной хроматогрфии, такой как хроматография с обращенной фазой.
Пептид по настоящему изобретению применим для активного ингредиента, входящего в индуктор ЦТЛ или противораковую вакцину для иммунотерапии рака. Пептид по настоящему изобретению обладает высокой иммуногенностью и высокой иктивностью индукции ЦТЛ, как видно из примеров, приведенных в данном описании. ЦТЛ, индуцированные пептидом по настоящему изобретению, могут неожиданно узнавать пептид дикого типа WT1, изначально содержащийся в раковых клетках. Таким образом, пептид по настоящему изобретению применим в лекарственном средстве для лечения или предупреждения (включая предупреждение рецидива) онкозаболевания, при котором экспрессируется ген WT1, такого как рак желудка, рак толстой кишки, рак легких, рак молочной железы, эмбриональный рак, рак кожи, рак мочевого пузыря, рак предстательной железы, рак матки, цервикальный рак и рак яичников.
(2) Антитела по настоящему изобретению
Во втором аспекте настоящее изобретение относится к антителам, которые специфически связываются с пептидом, представленным формулой (1), или его фармацевтически приемлемой солью (далее такие антитела могут называться "антителами по изобретению"). Антитела по изобретению не ограничиваются специфическим антителом и могут представлять собой поликлональные антитела или моноклональные антитела, полученные с использованием пептида по настоящему изобретению в качестве иммуногена.
Антитела по настоящему изобретению не ограничиваются каким-либо антителом до тех пор, пока они специфически связываются с пептидами по изобретению, и конкретные примеры включают антитела, которые специфически связываются с пептидами, представленными одной из формул (4)-(9), описанных выше.
Способы получения антител уже хорошо известны, и антитела по настоящему изобретению можно получить согласно обычным способам (Current protocols in Molecular Biology, edit. Ausubel et al. (1987), Publish. John Wiley and Sons, Section 11.12-11.13; Antibodies, A Laboratory Manual, Lane H.D. et al., ed., Cold Spring Harber Laboratory Press Publisher, New York, 1989).
Конкретно антитела можно получить с использованием пептидов по настоящему изобретению (например, соединения, представленного одной из формул (4)-(9)) в качестве иммуногена для иммунизации животного, не являющегося человеком, такого как кролик, с последующим получением антител из сыворотки иммунизированного животного обычным образом. С другой стороны, моноклональные антитела можно получить иммунизацией животного, не являющегося человеком, такого как мышь, соединением по настоящему изобретению, например, соединением, представленным одной из формул (4)-(9), и получая гибридомы из спленоцитов, полученных от животного, и клеток миеломы посредством слияния клеток, с последующим получением антител из гибридом (Current protocols in Molecular Biology, edit. Ausubel et al. (1987), Publish. John Wiley and Sons, Section 11.4-11.11).
Антитела, направленные против соединений по изобретению, можно получить способом, когда иммунологическую реакцию усиливают с использованием разнообразных адъювантов, подходящих для реципиента. Примеры адъювантов включают адъювант Фрейнда, неорганические гели, такие как гель гидроксида алюминия, поверхностно-активные вещества, такие как лизолецитин, полиол плюроник, полианионные соединения, пептиды, масляные эмульсии, гемоцианин моллюска морское блюдечко и динитрофенол, и адъюванты от человека, такие как БЦЖ (бацилла Кальметта-Герена) и Corynebacterium parvum.
Как