Стабильные фармацевтические композиции, включающие пиримидинсульфамид
Иллюстрации
Показать всеИзобретение относится к фармацевтической области и касается композиции, обладающей антагонистической активностью в отношении эндотелиновых рецепторов, включающей:
а) соединение формулы I или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму,
b) наполнитель, состоящий из моногидрата лактозы с монокристаллической целлюлозой;
с) вещество, обеспечивающее распадаемость, состоящее из натриевой соли гликолята крахмала или комбинации натриевой соли гликолята крахмала и поливинилпирролидона;
d) поверхностно-активное вещество, состоящее из полисорбата, в общем количестве от 0,1 до 3 мас.% в пересчете на полную массу фармацевтической композиции и
е) смазывающее вещество, состоящее из стеарата магния.
Изобретение обеспечивает стабильную фармацевтическую композицию, обладающую благоприятным фармакокинетическим профилем. 2 н. и 4 з.п. ф-лы, 1 ил., 25 табл.
Реферат
Настоящее изобретение относится к стабильным фармацевтическим композициям, включающим [5-(4-бромфенил)-6-[2-(5-бромпиримидин-2-илокси)-этокси]-пиримидин-4-ил]-амид пропилсульфаминовой кислоты или его фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы, указанное соединение ниже в настоящем изобретении называется соединением формулы I. Соединение формулы I обладает следующей формулой:
Соединение формулы I является ингибитором эндотелинового рецептора и применимо в качестве антагониста эндотелиновых рецепторов. Соединение формулы I и его получение раскрыто в WO 02/053557.
В контексте настоящего изобретения любая ссылка на соединение формулы I также означает ссылку на фармацевтически приемлемые соли или сольваты, включая гидраты соединения формулы I, а также на его морфологические формы, если не указано иное и если это является подходящим или целесообразным.
Соединение формулы I, предлагаемое в настоящем изобретении, в настоящее время проходит клинические исследования, поэтому было необходимо разработать стабильную композицию. Поэтому настоящее изобретение относится к стабильным фармацевтическим композициям, включающим соединение [5-(4-бромфенил)-6-[2-(5-бромпиримидин-2-илокси)-этокси]-пиримидин-4-ил]-амид пропилсульфаминовой кислоты или его фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы.
Стабильная фармацевтическая композиция, предлагаемая в настоящем изобретении, включает:
а) соединение формулы I, обладающее приведенной ниже формулой, или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму,
b) наполнитель,
c) вещество, обеспечивающее распадаемость,
d) поверхностно-активное вещество,
e) смазывающее вещество.
В предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция находится в форме таблетки.
В другом предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция находится в форме капсулы.
Стабильные фармацевтические композиции, предлагаемые в настоящем изобретении, предпочтительно таковы, что один или большее количество наполнителей выбраны из числа следующих: лактоза, кукурузный крахмал, предварительно желатинизированный крахмал, дигидрат гидрофосфата кальция (CaHPO4·2Н2О), микрокристаллическая целлюлоза, мальтодекстрин и маннит; одно или большее количество веществ, обеспечивающих распадаемость, выбрано из числа следующих: натриевая соль кроскармелозы, натриевая соль гликолята крахмала, кальциевая соль карбоксиметилцеллюлозы, натриевая соль карбоксиметилцеллюлозы, сшитый поливинилпирролидон, поливинилпирролидон, альгиновая кислота, альгинат натрия, предварительно желатинизированный крахмал, гуаровая камедь, глины и ионообменные смолы; поверхностно-активное вещество выбрано из числа следующих: лаурилсульфат натрия, полисорбаты, сополимеры этилена с оксипропиленом, полиоксиэтиленстеараты, диоктилсульфосукцинат натрия, полиоксиэтиленсорбитановые эфиры жирных кислот, полиоксиэтилен-С1-С4 алкиловые простые эфиры, сложные моноэфиры сахарозы и простые и сложные эфиры ланолина, и смазывающее вещество выбрано из числа следующих: стеарат магния, алюминия или кальция, стеариновая кислота, стеарилфумарат натрия, тальк, бензоат натрия, глицериловый моноэфир жирной кислоты, полиэтиленгликоль, гидрированное хлопковое масло, касторовое масло и сложные эфиры сахарозы.
Стабильная фармацевтическая композиция, предлагаемая в настоящем изобретении, предпочтительно может включать:
a) соединение формулы I по пункту 1 формулы изобретения или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму,
b) один или большее количество инертных наполнителей, выбранных из группы, включающей лактозу, кукурузный крахмал, предварительно желатинизированный крахмал, гидрофосфат кальция и микрокристаллическую целлюлозу,
c) поливинилпирролидон,
d) натриевую соль гликолята крахмала,
e) поверхностно-активное вещество и
f) смазывающее вещество.
Стабильная фармацевтическая композиция, предлагаемая в настоящем изобретении, более предпочтительно может включать:
a) соединение формулы I по пункту 1 формулы изобретения или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму в полном количестве, составляющем до 50 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 5 до 30% и более предпочтительно - от 10 до 20 мас.% в пересчете на полную массу фармацевтической композиции),
b) один или большее количество инертных наполнителей, выбранных из группы, включающей лактозу, кукурузный крахмал, предварительно желатинизированный крахмал, гидрофосфат кальция и микрокристаллическую целлюлозу в полном количестве, составляющем от 10 до 95 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 30 до 90%, предпочтительно - от 50 до 80% и более предпочтительно - от 60 до 75 мас.% в пересчете на полную массу фармацевтической композиции),
c) поливинилпирролидон в полном количестве, составляющем до 20 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,5 до 10%, предпочтительно - от 1 до 5% и более предпочтительно - от 2 до 4 мас.% в пересчете на полную массу фармацевтической композиции),
d) натриевую соль гликолята крахмала в полном количестве, составляющем до 30 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,5 до 20%, предпочтительно - от 1 до 10% и более предпочтительно - от 2 до 6 мас.% в пересчете на полную массу фармацевтической композиции),
e) поверхностно-активное вещество в полном количестве, составляющем до 7 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,01 до 5%, предпочтительно - от 0,05 до 1% и более предпочтительно - от 0,1 до 0,5 мас.% в пересчете на полную массу фармацевтической композиции), и
f) смазывающее вещество в полном количестве, составляющем до 10 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,05 до 5%, предпочтительно - от 0,1 до 2% и более предпочтительно - от 0,25 до 1,5 мас.% в пересчете на полную массу фармацевтической композиции).
Например, стабильная фармацевтическая композиция, предлагаемая в настоящем изобретении, может включать:
a) соединение формулы I по пункту 1 формулы изобретения или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму в полном количестве, составляющем до 50 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 1 до 50%, предпочтительно - от 5 до 30% и более предпочтительно - от 10 до 20 мас.% в пересчете на полную массу фармацевтической композиции),
b) лактозу или моногидрат лактозы в полном количестве, составляющем от 10 до 75 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 30 до 70%, предпочтительно - от 45 до 65% и более предпочтительно - от 52 до 60 мас.% в пересчете на полную массу фармацевтической композиции),
c) микрокристаллическую целлюлозу в полном количестве, составляющем от 0 до 20 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 1 до 10%, предпочтительно - от 2 до 8% и более предпочтительно - от 4 до 6 мас.% в пересчете на полную массу фармацевтической композиции),
d) поливинилпирролидон в полном количестве, составляющем до 20 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,5 до 10%, предпочтительно - от 1 до 5% и более предпочтительно - от 2 до 4 мас.% в пересчете на полную массу фармацевтической композиции),
e) натриевую соль гликолята крахмала в полном количестве, составляющем до 30 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,5 до 20%, предпочтительно - от 1 до 10% и более предпочтительно - от 2 до 6 мас.% в пересчете на полную массу фармацевтической композиции),
f) поверхностно-активное вещество в полном количестве, составляющем до 7 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,01 до 5%, предпочтительно - от 0,05 до 1% и более предпочтительно - от 0,1 до 0,5 мас.% в пересчете на полную массу фармацевтической композиции), и
g) смазывающее вещество в полном количестве, составляющем до 10 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,05 до 5%, предпочтительно - от 0,1 до 2% и более предпочтительно - от 0,25 до 1,5 мас.% в пересчете на полную массу фармацевтической композиции).
Фармацевтическая композиция, предлагаемая в настоящем изобретении, предпочтительно может содержать:
a) соединение формулы I по пункту 1 формулы изобретения или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму,
b) лактозу или моногидрат лактозы,
c) микрокристаллическую целлюлозу,
d) поливинилпирролидон,
e) натриевую соль гликолята крахмала,
f) поверхностно-активное вещество и
g) смазывающее вещество.
В предпочтительном варианте осуществления композиций, указанном выше, поверхностно-активным веществом является полисорбат.
В другом предпочтительном варианте осуществления композиций, указанном выше, смазывающим веществом является стеарат магния.
Стабильная фармацевтическая композиция, предлагаемая в настоящем изобретении, также необязательно может содержать вещество, придающее скользкость. Поэтому настоящее изобретение также относится к стабильным фармацевтическим композициям, включающим:
а) соединение формулы I или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму,
b) наполнитель,
c) вещество, обеспечивающее распадаемость,
d) поверхностно-активное вещество,
e) вещество, придающее скользкость, и
f) смазывающее вещество.
Наполнители, предлагаемые в настоящем изобретении, включают, но не ограничиваются только ими, один или большее количество из следующих: лактоза, кукурузный крахмал, предварительно желатинизированный крахмал, дигидрат гидрофосфата кальция (СаНРО4·2Н2О), микрокристаллическая целлюлоза, мальтодекстрин и маннит. Предпочтительно используют лактозу с микрокристаллической целлюлозой, лактозу с кукурузным крахмалом, предварительно желатинизированный крахмал с микрокристаллической целлюлозой или дигидрат гидрофосфата кальция с микрокристаллической целлюлозой. Также предпочтительным является моногидрат лактозы (например, Pharmatose® 200 Mesh) с микрокристаллической целлюлозой (например, Avicel РН101).
Вещества, обеспечивающие распадаемость, предлагаемые в настоящем изобретении, включают, но не ограничиваются только ими, одно или большее количество из следующих: натриевая соль кроскармелозы, натриевая соль гликолята крахмала, кальциевая соль карбоксиметилцеллюлозы (СМС-Са), натриевая соль карбоксиметилцеллюлозы CMC-Na, сшитый поливинилпирролидон (например, Crospovidone (PVP XL; Polyplasdone, продающийся фирмой ISP company, или Kollidon® XL, продающийся фирмой BASF)), поливинилпирролидон (ПВП), альгиновая кислота, альгинат натрия, предварительно желатинизированный крахмал, гуаровая камедь, глины и ионообменные смолы. В качестве вещества, обеспечивающего распадаемость, предпочтительно используют натриевую соль гликолята крахмала или комбинацию натриевой соли гликолята крахмала и ПВП.
Поверхностно-активное вещество, предлагаемое в настоящем изобретении, включает, но не ограничивается только ими, одно или большее количество из следующих: лаурилсульфат натрия, полисорбаты (имеющиеся в продаже под названием Tween®), сополимеры этилена с оксипропиленом (Pluronic F65), полиоксиэтиленстеараты (MYRJ), диоктилсульфосукцинат натрия, полиоксиэтиленсорбитановые эфиры жирных кислот (продающиеся фирмой Nikko Chemicals), полиоксиэтилен-С1-С4алкиловые простые эфиры, сложные моноэфиры сахарозы и простые и сложные эфиры ланолина. В качестве поверхностно-активного вещества предпочтительно используют лаурилсульфат натрия.
Полисорбат, включаемый в композицию, предлагаемую в настоящем изобретении, обладает средней степенью полимеризации, составляющей от 20 до 100 мономерных звеньев (предпочтительно - примерно 80), и может, например, представлять собой полисорбат 80. Также предпочтительно, если полисорбат получен из растений.
Вещества, придающие скользкость, предлагаемые в настоящем изобретении, включают, но не ограничиваются только ими, одно или большее количество из следующих: диоксид кремния; коллоидный диоксид кремния, например безводный коллоидный диоксид кремния (например, Aerosil® 200), трисиликат магния, порошкообразная целлюлоза, крахмал и тальк. Предпочтительно используют коллоидный диоксид кремния.
Смазывающие вещества, предлагаемые в настоящем изобретении, включают, но не ограничиваются только ими, одно или большее количество из следующих: Mg-, Al- или Са-стеарат, стеариновая кислота, стеарилфумарат натрия, тальк, бензоат натрия, глицериловый моноэфир жирной кислоты, например, обладающий молекулярной массой, равной от 200 до 800 Да (например, глицерилмоностеарат (например, продающийся фирмой Danisco, UK)), глицерилдибегенат (например, CompritolAT0888™, Gattefossé France), глицерилпальмитостеариловый эфир (например, Precirol™, Gattefossé France), полиэтиленгликоль (ПЭГ, BASF), гидрированное хлопковое масло (Lubitab, Edward Mendell Со Inc.), касторовое масло (Cutina HR, Henkel) и сложные эфиры сахарозы (Surfhope SE, Mitsubishi-Kagaku Foods Co.). Предпочтительно используют стеарат магния.
Следует понимать, что любой данный инертный наполнитель может выполнять более одной функции, например выступать в качестве наполнителя, вещества, обеспечивающего распадаемость, поверхностно-активного вещества, вещества, придающего скользкость, и/или смазывающего вещества.
Стабильная фармацевтическая композиция, предлагаемая в настоящем изобретении, также необязательно может содержать (независимо от наличия вещества, придающего скользкость) винную кислоту.
В настоящем изобретении используется имеющаяся в продаже лактоза, предпочтительно - моногидрат лактозы (такой, как Pharmatose® 200М, выпускающийся фирмой DMV International) в настоящем изобретении.
В настоящем изобретении используется имеющийся в продаже кукурузный крахмал, предпочтительно - кукурузный крахмал, выпускающийся фирмой Roquette.
В настоящем изобретении используется имеющийся в продаже предварительно желатинизированный крахмал, предпочтительно - крахмал 1500 (выпускающийся фирмой Colorcon).
В настоящем изобретении используется имеющийся в продаже дигидрат гидрофосфата кальция, предпочтительно - дигидрат гидрофосфата кальция в неразмолотой форме, такой как выпускающийся фирмой Calipharm А или A-Tab.
В настоящем изобретении используется имеющаяся в продаже микрокристаллическая целлюлоза, предпочтительно - Avicel PH101, выпускающийся фирмой FMC international.
В настоящем изобретении используется имеющийся в продаже поливинилпирролидон (ПВП), предпочтительно - поливинилпирролидон, выпускающийся фирмой BASF.
В настоящем изобретении используется имеющаяся в продаже натриевая соль гликолята крахмала, предпочтительно - натриевая соль гликолята крахмала, выпускающаяся фирмой Roquette.
В настоящем изобретении используется имеющийся в продаже лаурилсульфат натрия, предпочтительно - лаурилсульфат натрия, выпускающийся фирмой Ellis & Everard.
В настоящем изобретении используется имеющийся в продаже Коллоидный диоксид кремния, предпочтительно - Aerosil, выпускающийся фирмой Degussa AG.
В настоящем изобретении используется имеющийся в продаже стеарат магния, предпочтительно - стеарат магния, выпускающийся фирмой Peter Greven.
Термин “С1-С4-алкил” по отдельности или в комбинации с другими группами означает обладающую линейной или разветвленной цепью алкильную группу, содержащую от 1 до 4 атомов углерода. Примерами обладающих линейной или разветвленной цепью С1-С4алкильных групп являются метил, этил, пропил, изопропил, бутил, втор-бутил, изобутил, трет-бутил.
Термин “примерно”, находящийся перед числовым значением “X”, в настоящей заявке указывает диапазон от X минус 10% от X до X плюс 10% от X и предпочтительно - диапазон от X минус 5% от X до X плюс 5% от X.
Выражение “фармацевтически приемлемые соли” включает соли с неорганическими кислотами и с органическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, уксусная кислота, малеиновая кислота, винная кислота, бензойная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п., которые нетоксичны для живых организмов, или в случае, когда соединение формулы (I) является кислотным по характеру, - с неорганическим основанием, таким как основание щелочного или щелочноземельного металла, например гидроксид натрия, гидроксид калия, гидроксид кальция и т.п.
В предпочтительном варианте осуществления настоящего изобретения фармацевтические композиции включают:
наполнитель, причем один или большее количество наполнителей выбраны из числа следующих: лактоза, кукурузный крахмал, предварительно желатинизированный крахмал, дигидрат гидрофосфата кальция (CaHPO4·2H2O) и микрокристаллическая целлюлоза, мальтодекстрин и маннит; вещество, обеспечивающее распадаемость, причем одно или большее количество веществ, обеспечивающих распадаемость, выбрано из числа следующих: натриевая соль кроскармелозы, натриевая соль гликолята крахмала, СМС-Са, CMC-Na, сшитый ПВП, ПВП, альгиновая кислота, альгинат натрия, предварительно желатинизированный крахмал, гуаровая камедь, глины и ионообменные смолы; поверхностно-активное вещество, которое выбрано из числа следующих: лаурилсульфат натрия, полисорбаты, сополимеры этилена с оксипропиленом, полиоксиэтиленстеараты и диоктилсульфосукцинат натрия, полиоксиэтиленсорбитановые эфиры жирных кислот, полиоксиэтилен-С1-С4-алкиловые простые эфиры, сложные моноэфиры сахарозы и простые и сложные эфиры ланолина; вещество, придающее скользкость, которое выбрано из числа следующих: диоксид кремния, безводный коллоидный диоксид кремния, трисиликат магния, порошкообразная целлюлоза, крахмал и тальк; смазывающее вещество, которое выбрано из числа следующих: Mg-, Al- или Са-стеарат, стеариновая кислота, стеарилфумарат натрия, тальк, бензоат натрия, глицериловый моноэфир жирной кислоты, полиэтиленгликоль, гидрированное хлопковое масло, касторовое масло и сложные эфиры сахарозы.
В другом предпочтительном варианте осуществления настоящего изобретения фармацевтические композиции включают:
a) смесь по меньшей мере одного или большего количества инертных наполнителей, выбранных из следующей группы, включающей лактозу, кукурузный крахмал, предварительно желатинизированный крахмал, гидрофосфат кальция и микрокристаллическую целлюлозу,
b) поливинилпирролидон,
c) натриевую соль гликолята крахмала,
d) лаурилсульфат натрия,
e) коллоидный диоксид кремния и
f) стеарат магния.
В другом предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция включает:
a) смесь по меньшей мере одного или большего количества инертных наполнителей, выбранных из следующей группы, включающей лактозу, кукурузный крахмал, крахмал 1500, Calipharm А и Avicel РН101,
b) поливинилпирролидон,
c) натриевую соль гликолята крахмала,
d) лаурилсульфат натрия,
e) Aerosil и
f) стеарат магния.
В другом предпочтительном варианте осуществления настоящего изобретения фармацевтические композиции включают:
a) соединение формулы I или его фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы в полном количестве, составляющем до 50 мас.% в пересчете на полную массу фармацевтической композиции,
b) смесь по меньшей мере одного или большего количества наполнителей в полном количестве, составляющем 10-95 мас.% в пересчете на полную массу фармацевтической композиции,
c) поливинилпирролидон в полном количестве, составляющем до 20 мас.% в пересчете на полную массу фармацевтической композиции,
d) натриевую соль гликолята крахмала в полном количестве, составляющем до 30 мас.% в пересчете на полную массу фармацевтической композиции,
e) поверхностно-активное вещество в полном количестве, составляющем до 7 мас.% в пересчете на полную массу фармацевтической композиции,
f) вещество, придающее скользкость, в полном количестве, составляющем до 5 мас.% в пересчете на полную массу фармацевтической композиции, и
g) смазывающее вещество в полном количестве, составляющем до 10 мас.% в пересчете на полную массу фармацевтической композиции,
где полная масса фармацевтической композиции составляет 100%.
В другом предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция включает:
a) соединение формулы I или его фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы в полном количестве, составляющем до 50 мас.% в пересчете на полную массу фармацевтической композиции,
b) смесь по меньшей мере одного или большего количества наполнителей в полном количестве, составляющем 30-85 мас.% в пересчете на полную массу фармацевтической композиции,
c) поливинилпирролидон в полном количестве, составляющем от 2 до 10 мас.% в пересчете на полную массу фармацевтической композиции,
d) натриевую соль гликолята крахмала в полном количестве, составляющем до 10 мас.% в пересчете на полную массу фармацевтической композиции,
f) поверхностно-активное вещество в полном количестве, составляющем до 3 мас.% в пересчете на полную массу фармацевтической композиции,
e) вещество, придающее скользкость, в полном количестве, составляющем до 2,5 мас.% в пересчете на полную массу фармацевтической композиции, и
g) смазывающее вещество в полном количестве, составляющем до 7 мас.% в пересчете на полную массу фармацевтической композиции,
где полная масса фармацевтической композиции составляет 100%.
В другом предпочтительном варианте осуществления настоящего изобретения фармацевтические композиции включают:
a) соединение формулы I или его фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы в полном количестве, составляющем до 50 мас.% в пересчете на полную массу фармацевтической композиции,
b) смесь по меньшей мере одного или большего количества наполнителей в полном количестве, составляющем 30-85 мас.% в пересчете на полную массу фармацевтической композиции,
c) поливинилпирролидон в полном количестве, составляющем от 2 до 5 мас.% в пересчете на полную массу фармацевтической композиции,
d) натриевую соль гликолята крахмала в полном количестве, составляющем до 5 мас.% в пересчете на полную массу фармацевтической композиции,
e) поверхностно-активное вещество в полном количестве, составляющем до 3 мас.% в пересчете на полную массу фармацевтической композиции,
f) вещество, придающее скользкость, в полном количестве, составляющем до 1 мас.% в пересчете на полную массу фармацевтической композиции, и
g) смазывающее вещество в полном количестве, составляющем до 3 мас.% в пересчете на полную массу фармацевтической композиции,
где полная масса фармацевтической композиции составляет 100%.
Фармацевтические композиции или фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы, предлагаемые в настоящем изобретении, можно использовать в качестве лекарственного средства.
Фармацевтические композиции или фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы, предлагаемые в настоящем изобретении, можно использовать для приготовления лекарственного средства, предназначенного для лечения легочной артериальной гипертензии (ЛАГ).
Даются ссылки на обширную литературу по этим и другим фармацевтически приемлемым инертным наполнителям и методикам, указанным в настоящем изобретении, см., в частности, Handbook of Pharmaceutical Excipients, Third Edition, edited by Arthur H. Kibbe, American Pharmaceutical Association, Washington, USA and Pharmaceutical Press, London; и Lexikon der Hilfsstoffe für Pharmazie, Kosmetik und angrenzende Gebiete edited by H. P. Fiedler, 4th Edition, Edito Cantor, Aulendorf и более ранние издания.
В контексте настоящего изобретения количество соединения формулы I или его фармацевтически приемлемых солей, сольватов, гидратов или морфологических форм суммарно может составлять до 90 мас.% в пересчете на полную массу фармацевтической композиции. Предпочтительно, если количество соединения формулы I или его фармацевтически приемлемых солей, сольватов, гидратов или морфологических форм суммарно может составлять до 50 мас.% в пересчете на полную массу фармацевтической композиции. Более предпочтительно, если количество соединения формулы I или его фармацевтически приемлемых солей, сольватов, гидратов или морфологических форм составляет от 1 до 50%, предпочтительно - от 5 до 30% и более предпочтительно - от 10 до 20 мас.% в пересчете на полную массу фармацевтической композиции.
В контексте настоящего изобретения количество наполнителей может меняться в диапазоне от 10 до 95%, предпочтительно - от 30 до 85% и более предпочтительно - от 30 до 50 мас.% в пересчете на полную массу фармацевтической композиции.
Количество вещества, обеспечивающего распадаемость, может меняться от 1 до 20%, предпочтительно - от 2 до 10% (например, от 3 до 8%) и более предпочтительно - от 2 до 5 мас.% в пересчете на полную массу фармацевтической композиции. Например, композиция может содержать от 2 до 4 мас.% (например, 3%) вещества, обеспечивающего распадаемость, в пересчете на полную массу фармацевтической композиции.
Количество поверхностно-активного вещества может меняться от 0,01 до 7%, предпочтительно - от 0,1 до 3% и более предпочтительно - от 0,1 до 1 мас.% в пересчете на полную массу фармацевтической композиции.
Количество вещества, придающего скользкость, если оно содержится в композиции, может меняться в диапазоне от 0,1 до 5%, предпочтительно - от 0,1 до 2,5%, более предпочтительно - от 0,5 до 1,0 мас.% в пересчете на полную массу фармацевтической композиции.
Количество смазывающего вещества может меняться от 0,05 до 10%, предпочтительно - от 0,05 до 7%, наиболее предпочтительно - от 0,1 до 3,0% и еще более предпочтительно - от 0,1 до 1 мас.% в пересчете на полную массу фармацевтической композиции.
Количество винной кислоты, если она содержится в композиции, может меняться от 0,1 до 10%, предпочтительно - от 1 до 10% и наиболее предпочтительно - от 4 до 6 мас.% в пересчете на полную массу фармацевтической композиции.
Абсолютное количество каждого фармацевтически приемлемого инертного наполнителя и количество других фармацевтически приемлемых инертных наполнителей зависят от необходимых характеристик таблетки и могут быть выбраны с помощью стандартных экспериментов.
Полная масса фармацевтической композиции составляет 100%.
Фармацевтическая композиция, предлагаемая в настоящем изобретении, считается “стабильной”, если в течение некоторого периода времени сохраняется 70%, предпочтительно - 80% и наиболее предпочтительно - 95% от исходного содержания соединения формулы I или его фармацевтически приемлемой соли, сольвата, гидрата или морфологической формы.
Стабильность фармацевтической композиции можно исследовать обычным образом, например путем определения содержания соединения формулы I и продуктов его разложения, исследования растворения, хрупкости, времени распада, внешнего вида и/или микроскопического исследования, например, после хранения при 25°С и равной 60% относительной влажности и/или после хранения при 40°С и равной 75% относительной влажности в течение определенных периодов времени.
Пример методики исследования растворения приведен в экспериментальной части, расположенной после примеров.
Предпочтительно, чтобы твердые композиции, предлагаемые в настоящем изобретении, были стабильны в течение не менее 6 или 12 месяцев при хранении при температуре от 5 до 50°С. Более предпочтительно, чтобы они были стабильны в течение не менее 6 или 12 месяцев при хранении при температуре от 15 до 45°С. Наиболее предпочтительно, чтобы они были стабильны в течение не менее 6 или 12 месяцев при хранении при температуре от 25 до 40°С.
В более предпочтительном варианте осуществления фармацевтические композиции стабильны в течение периода времени, такого как 1 год, и предпочтительно - 2 года. Более предпочтительно, чтобы фармацевтические композиции были стабильны в течение 3 лет.
Содержание соединения формулы 1 и продуктов его разложения в капсулах и таблетках определяют с помощью ВЭЖХ (высокоэффективная жидкостная хроматография).
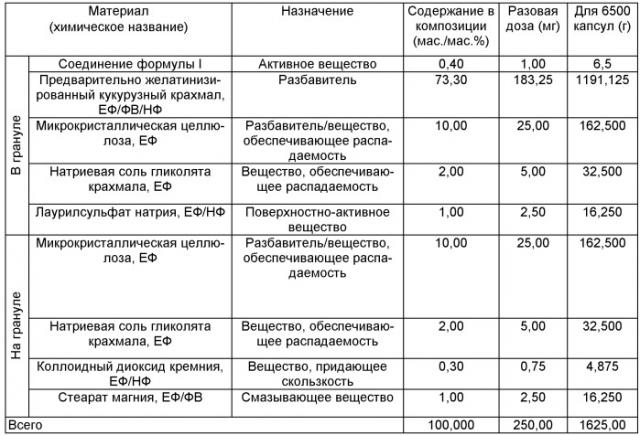
Фармацевтическую композицию можно приготовить в виде капсулы и таблетки. Например, партию массой 1625 г (6500 капсул) при дозе 1 мг можно приготовить следующим образом:
Материал гранул предварительно перемешивали в смесителе с большим сдвиговым усилием, например Diosna (резервуар объемом 6 л), в течение 5 мин. К материалу гранул при перемешивании прибавляли примерно 731-893 г воды со скоростью 65 г/мин и перемешивали до образования подходящих гранул. Материал гранул дополнительно перемешивали в течение 2 мин. Затем гранулы сушили в аппарате с псевдоожиженным слоем с подачей воздуха, обладающего температурой 60°С, пока потери при сушке гранул не достигали 6-9 мас./мас.%. После этого гранулы пропускали через мельницу, снабженную ситом с отверстиями размером 813 мкм. Все материалы, наносимые на гранулы, за исключением стеарата магния пропускали через сито с отверстиями размером 1000 мкм и перемешивали с гранулами в течение 25 мин при 25 оборотов/мин в смесителе с двухконусным корпусом Pharmatech объемом 10 л. Стеарат магния просеивали через сито с отверстиями размером 500 мкм и прибавляли к порошкообразной смеси, находящейся в смесителе, и перемешивали в течение еще 3 мин.
Затем порошок помещали в белые непрозрачные капсулы из твердого желатина размера 0.
В одном объекте настоящего изобретения перед прессованием на соприкасающиеся с материалом поверхности прессующего оборудования, например пуансоны и/или матрицы таблетирующей машины, можно распылить одно или большее количество смазывающих веществ.
Размер капсул может быть разным, например от размера 1 до размера 00.
В контексте настоящего изобретения также можно приготовить таблетки. Таблетки могут обладать разной формой и могут быть, например, круглыми, овальными, удлиненными, цилиндрическими, обладать формой клеверного листа или любой другой подходящей формой.
В одном варианте осуществления настоящего изобретения полученные таблетки обладают формой клеверного листа или круглой формой. Края таблеток могут быть скошенными или скругленными. В другом варианте осуществления таблетки обладают формой клеверного листа со скошенными краями. Таблетки, предлагаемые в настоящем изобретении, могут обладать насечкой или гравировкой.
Таблетка, предлагаемая в настоящем изобретении, также может обладать формой клеверного листа с крестообразной насечкой и скошенными краями. Она может обладать диаметром от 5 до 15 мм (например, диаметром от 5 до 8 мм, например, диаметром, равным 6 мм), предпочтительно - диаметром в диапазоне от 8 до 15 мм и более предпочтительно - диаметром в диапазоне от 9 до 11 мм. Ее толщина может находиться в диапазоне (до нанесения покрытия, если на таблетку наносят пленочное покрытие) от 2,5 до 4,5 мм, предпочтительно - от 2,9 до 3,9 мм.
Капсулы и таблетки, предлагаемые в настоящем изобретении, могут быть окрашены и/или маркированы, чтобы придать им индивидуальный внешний вид и сделать их быстро распознаваемыми. Использование красителей может служить для улучшения внешнего вида, а также для идентификации таблеток. Красители, пригодные для использования в фармацевтике, включают каротиноиды, оксиды железа и хлорофилл. Таблетки, предлагаемые в настоящем изобретении, можно маркировать с помощью штампованного кода.
Капсулы и таблетки, предлагаемые в настоящем изобретении, применимы для лечения ЛАГ и обладают хорошим фармакокинетическим профилем.
Методики, которые можно использовать, могут быть обычными или известными в данной области техники или основанными на таких методиках, например описанные в публикациях L. Lachman et al., The Theory and Practice of Industrial Pharmacy, 3rd Ed., 1986; H. Sucker et al., Pharmazeutische Technologie, Thieme, 1991; Hagers Handbuch der pharmazeutischen Praxis, 4th Ed. (Springer Verlag, 1971) и Remington's Pharmaceutical Sciences, 13th Ed., (Mack Publ., Co., 1970) или более поздних изданиях.
Способ приготовления фармацевтической композиции в форме капсул, предлагаемый в настоящем изобретении, можно осуществить в соответствии со следующей блок-схемой:
Стадию сушки предпочтительно проводить с помощью сушилки с псевдоожиженным слоем.
Если приготавливаемая фармацевтическая композиция представляет собой таблетки, то способ приготовления, предлагаемый в настоящем изобретении, можно осуществить в соответствии со следующей блок-схемой:
Можно осуществить два варианта этого способа, один включает мокрое гранулирование (т.е. способ, представленный на приведенной выше блок-схеме, в котором к материалу гранул прибавляют некоторое количество воды и указанную воду удаляют на стадии сушки), и второй включает прямое прессование (т.е. способ, представленный на приведенной выше блок-схеме, без стадии сушки, указанная стадия сушки является излишней, поскольку к материалу гранул не прибавляют воду).
В соответствии с предпочтительным вариантом способа на таблетки, приготовленные описанным выше способом, наносят защитное пленочное покрытие. Указанное защитное пленочное покрытие предотвращает непосредственное взаимодействие таблетки с влагой; оно также может облегчить нанесение маркировки на таблетку.
В контексте настоящего изобретения масса материала покрытия составляет от 2 до 8%, предпочтительно - от 3 до 7% и более предпочтительно - от 4 до 6 мас.% в пересчете на массу таблетки до нанесения покрытия.
Материал покрытия, образующий указанное защитное пленочное покрытие, включает полимер, обладающий низкой проницаемостью для паров воды (такой, как поливиниловый спирт (например, Opadry АМВ®) или диметиламиноэтилметакрилат (например, EUDRAGIT® Е РО)). Материал покрытия может дополнительно включать пластификатор (например, пропиленгликоль, триацетин, дибутилфталат или дибутилсебацинат), поверхностно-активное вещество (например, лаурилсульфат натрия или полисорбат, такой как Tween) и/или смазывающее вещество/вещество, придающее скользкость (например, стеариновая кислота, стеарат магния или кальция, или тальк). Кроме того, материал покрытия также может включать пигмент (например, оксид железа(II), оксид железа(III) или оксид титана) для придания таблетке окраски.
Приведенные ниже неограничивающие примеры иллюстрируют настоящее изобретение.
ПРИМЕРЫ
Фармацевтические композиции примеров 1-15 готовили способом, представленным на приведенной ниже блок-схеме:
Фармацевтические композиции примеров 16-33 готовили способом мокрого гранулирования, представленным на приведенной ниже блок-схеме:
Наконец, фармацевтические композиции примеров 34-35 готовили способом прямого прессования, представленным на приведенной ниже блок-схеме:
(Отметим, что на приведенных выше блок-схемах “оборотов/мин” означает количество оборотов в минуту.)
Для нанесения на таблетки покрытия из Opadry® АМВ использовали описанную ниже технологию (далее называющуюся “общая технология нанесения на таблетки покрытия из Opadry® АМВ”).
Раствор для нанесения на таблетки покрытия из Opadry® АМВ получали путем приготовления 20 мас./мас.% дисперсии Opadry® АМВ (мелкий белый порошок) в очищенной воде, проводимого в емкости из нер