Малеатные соли производного хиназолина, полезные в качестве антиангиогенного агента
Иллюстрации
Показать всеИзобретение относится к новой малеатной соли 4-((4-фтор-2-метил-1Н-индол-5-ил)окси)-6-метокси-7-(3-(пирролидин-1-ил)пропокси)хиназолина в виде кристаллической формы А или В, которые обладают улучшенными свойствами при их использовании, в частности обладают повышенной стабильностью. Соединения могут быть использованы для продуцирования антиангиогенного действия и/или снижения васкулярной проницаемости. Изобретение также относится к вариантам способов получения малеатной соли 4-((4-фтор-2-метил-1Н-индол-5-ил)окси)-6-метокси-7-(3-(пирролидин-1-ил)пропокси)хиназолина в виде кристаллической формы А или В, к фармацевтической композиции, их содержащей, и применению для производства медикамента, используемого для продуцирования противоракового эффекта. 8 н. и 6 з.п. ф-лы, 5 табл., 10 ил.
Реферат
Представленное изобретение касается малеатной соли AZD2171, в частности кристаллических форм малеатной соли AZD2171, способов их получения, фармацевтических композиций, которые их содержат как активный ингредиент, их применения при производстве медикаментов для продуцирования антиангиогенного действия и/или снижения васкулярной проницаемости у теплокровных животных, таких как люди, и их применения в способах лечения заболеваний, связанных с ангиогенезом и/или повышенной васкулярной проницаемостью.
Нормальный ангиогенез играет важную роль в разных процессах, включая развитие эмбриона, заживление ран и некоторых компонентов репродуктивных функций женщин. Нежелательный или патологический ангиогенез связывают с заболеваниями, к которым относятся диабетическая ретинопатия, псориаз, рак, ревматоидный артрит, атерома, саркома Капоси и гемангиома (Fan et al, 1995, Trends Pharmacol. Sci. 16: 57-66; Folkman, 1995, Nature Medicine 1: 27-31). Изменение васкулярной проницаемости играет важную роль и в нормальных, и в патологических физиологических процессах (Cullinan-Bove et al, 1993, Endocrinology 133: 829-837; Senger et al, 1993, Cancer and Metastasis Reviews, 12: 303-324). Были идентифицированы некоторые полипептиды, которые in vitro промотируют рост эндотелиальных клеток, включая кислотный и основный факторы роста фибробласта (aFGF & bFGF) и фактор роста васкулярного эндотелия (VEGF). В силу ограниченной экспрессии его рецепторов активность фактора роста VEGF, в отличие от FGF, является относительно специфичной по отношению к эндотелиальным клеткам. Недавние доказательства указывают на то, что VEGF является важным стимулятором и нормального, и патологического ангиогеназа (Jakeman et al, 1993, Endocrinology, 133: 848-859; Kolch et al, 1995, Breast Рак Research and Treatment, 36:139-155) и влияет на васкулярную проницаемость (Connolly et al, 1989, J. Biol. Chem. 264: 20017-20024). Антагонистическое действие по отношение к VEGF путем секвестрации VEGF, используя антитело, может приводить к ингибированию роста опухоли (Kim et al, 1993, Nature 362: 841-844).
Рецепторы тирозинкиназ (RTKs) являются важными в передаче биохимических сигналов через плазматическую мембрану клеток. Эти трансмембранные молекулы характеристично состоят из внеклеточного лиганд-связывающего домена, соединенного через сегмент в плазматической мембране с внутриклеточным доменом тирозинкиназы. Связывание лиганда с рецептором приводит к стимулированию связанной с рецептором активности тирозинкиназы, что в свою очередь приводит к фосфорилированию тирозиновых остатков и на рецепторе, и на других внутриклеточных молекулах. Изменения в фосфорилировании тирозина инициируют сигнальный каскад, который приводит к различным клеточным ответам. Получены данные по аминокислотной последовательности, по крайне мере, девятнадцати отдельных подсемейств RTK. Одно из этих подсемейств включает fms-подобный рецептор тирозинкиназы, Flt-1, киназа включает доменсодержащий рецептор, KDR (также относится к Flk-1), и другой fms-подобный рецептор тирозинкиназы, Flt-4. Два эти родственных RTK, Flt-1 и KDR, связывают VEGF с высоким степенью сродства (De Vries et al, 1992, Science 255: 989-991; Terman et al, 1992, Biochem. Biophys. Res. Comm. 1992, 187: 1579-1586). Связывание VEGF с этими рецепторами, которые экспрессируются в гетерологичных клетках, связывают с изменением в статусе фосфорилирования тирозина клеточных протеинов и притоком кальция.
VEGF является ключевым стимулятором для васкулогеназа и ангиогенеза. Этот цитокин стимулирует фенотип васкулярного разрастания путем индуцирования пролиферации эндотелиальных клеток, экспрессию протеазы и миграцию и последующую организацию клеток с образованием капиллярных трубок (Keck, P.J., Hauser, S.D., Krivi, G., Sanzo, K., Warren, Т., Feder, J., and Connolly, D.T., Science (Washington DC), 246: 1309-1312, 1989; Lamoreaux, W.J., Fitzgerald, M.E., Reiner, A., Hasty, K.A., and Charles, S.T., Microvasc. Res., 55: 29-42, 1998; Pepper, M.S., Montesano, R., Mandroita, S.J., Orci, L. and Vassalli, J.D., Enzyme Protein, 49: 138-162, 1996.). Кроме того, VEGF индуцирует значительную васкулярную проницаемость (Dvorak, H.F., Detmar, M., Claffey, К.Р., Nagy, J.A., van de Water, L., and Senger, D.R., (Int. Arch. Allergy Immunol., 107: 233-235, 1995; Bates, D.O., Heald, R.I., Curry, F.E. and Williams, B.J.Physiol. (Lond.), 533: 263-272, 2001), промотирует образование гипер-проницаемой, недоразвитой васкулярной сетки, которая является характеристикой патологического ангиогенеза.
Было показано, что активация только KDR является достаточной для промотирования всех основных фенотипичных ответов на VEGF, включая пролиферацию эндотелиальных клеток, миграцию и жизнеспособность, и индуцирует васкулярную проницаемость (Meyer, M., Clauss, M., Lepple-Wienhues, A., Waltenberger, J., Augustin, H.G., Ziche, M., Lanz, C., Biittner, M., Rziha, H-J. and Dehio, C., EMBO J., 18: 363-374, 1999; Zeng, H., Sanyal, S. and Mukhopadhyay, D., J. Biol. Chem., 276: 32714-32719, 2001; Gille, H., Kowalski, J., Li, В., LeCouter, J., Moffat, B, Zioncheck, T.F., Pelletier, N. and Ferrara, N., J. Biol. Chem., 276: 3222-3230, 2001).
Соединения, которые ингибируют действие VEGF, являются ценными при лечении заболеваний, связанных с ангиогенезом и/или повышением васкулярной проницаемости, таких как рак (включая лейкемию, множественную миелому и лимфому), диабет, псориаз, ревматоидный артрит, саркома Капоси, гемангиома, острый и хронический нефрит, атерома, артериальный рестеноз, аутоиммунные заболевания, острое воспаление, образование чрезмерных рубцов и спаек, эндометриоз, лимфоэдема, дисфункциональное маточное кровотечение и заболевания глаз с пролиферацией ретинальных сосудов, включая макулярную дегенерацию.
Производные хиназолина, которые являются ингибиторами VEGF рецептора тирозинкиназы, описываются в WO 00/47212. Соединение AZD2171 является иллюстративным из WO 00/47212, (смотрите Пример 240), и представляет собой 4-((4-фтор-2-метил-1H-индол-5-ил)окси)-6-метокси-7-(3-(пирролидин-1-ил)пропокси)хиназолин формулы I:
AZD2171 проявляет отменную активность в in vitro исследованиях (а) фермента и (б) HUVEC, которые описаны в WO 00/47212 и тут далее. IC50 значения AZD2171 по ингибированию активности изолированной KDR (VEGFR-2) и Flt-1 (VEGFR-1) тирозинкиназы в исследовании фермента были <2 нМ и 5±2 нМ, соответственно. AZD2171 сильно ингибирует VEGF-стимулированную пролиферацию эндотелиальных клеток (IС50 значение составляет 0,4±0,2 нМ в исследовании HUVEC), но в заметной мере не ингибирует пролиферацию базальных эндотелиальных клеток при >1250 кратном увеличении концентрации (IC50 значение составляет >500 нМ). Рост Calu-6 опухолевого ксенотрансплантата в in vivo (в) модели солидной опухоли, описанной тут далее, ингибировался на 49%**, 69%*** и 91%*** после 28-дневного перорального введения один раз в день 1,5, 3 и 6 мг/кг/день AZD2171, соответственно (Р**<0,01, Р***<0,0001; односторонний t тест).
Более стабильные формы фармацевтически активного соединения, например более стабильные кристаллические формы, являются предпочтительными с коммерческой точки зрения для рецептур и производства. Поскольку использование более стабильной формы снижает риск ее превращения в другую форму во время процедуры получения рецептуры, такой как прессование. Это в свою очередь обеспечивает большую предсказуемость свойств конечной рецептуры, таких как скорость растворения таблеток, биодоступность активного ингредиента. Использование более стабильной формы активного ингредиента позволяет увеличить контроль над физическими свойствами рецептуры.
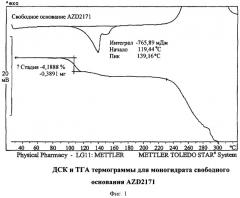
Свободное основание AZD2171 (4-((4-фтор-2-метил-1H-индол-5-ил)окси)-6-метокси-7-(3-(пирролидин-1-ил)пропокси)хиназолин) при условиях окружающей среды представляет собой кристаллический моногидрат. Дифференциальная сканирующая калориметрия (ДСК), проведенная в соответствии со способом, описанным тут далее, показала большую широкую эндотерму между 95° и 170°С вследствие потери воды и плавления (Фигура 1). Термогравиметрический (ТГА) анализ (детали приведены тут далее) показывает потерю массы в 4,02% между 80°С и 115°С (Фигура 1). Анализ содержания воды по Карлу Фишеру (детали приведены тут далее) дает цифру 3,9%, что указывает на то, что вся потеря массы является следствием потери воды.
Понятно, что значения начала/пика температуры ДСК может незначительно изменяться от одного прибора к другому или от одного образца к другому, и поэтому приведенные значения не должны истолковываться как абсолютные.
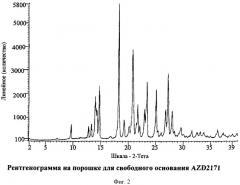
Свободное основание AZD2171 характеризуется присутствием, по крайней мере, одного из следующих 20 значений, измеренных используя излучение СuKa: 18,3 и 20,8. Свободное основание AZD2171 характеризуется рентгенограммой на порошке, как показано на Фигуре 2. Десять наиболее выступающих пиков показаны в Таблице 1.
| Таблица 1:Десять наиболее выступающих пиков рентгенограммы на порошке свободного основания AZD2171 | ||
| Угол 2-Тета (2θ) | Значение интенсивности | Относительная интенсивность |
| 18,287 | 100 | ос |
| 20,807 | 66,7 | ос |
| 27,277 | 48,9 | ос |
| 23,370 | 42,8 | ос |
| 14,684 | 39,8 | ос |
| 25,070 | 37,6 | ос |
| 13,966 | 32,2 | ос |
| 21,711 | 26,6 | ос |
| 22,898 | 23,1 | ос |
| 26,790 | 22,9 | ос |
ос = очень сильный
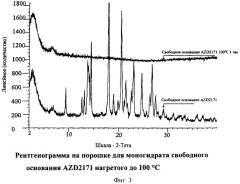
Было найдено, что когда образец свободного основания AZD2171 дегидратирует, например, при нагревании до 100°С, образец становится аморфным (Фигура 3) и потом не регидратирует, а остается после этого аморфным. Это может создавать проблемы, если свободное основание AZD2171 поддается манипуляциям по формированию фармацевтической композиции, поскольку свободное основание AZD2171 может дегидратировать во время некоторых процессов, например, уменьшения размера частичек (такого как измельчение), высушивание лекарственного средства в массе, формулирования, производства. Для того, чтобы сформулировать свободное основание AZD2171 в фармацевтическую композицию, бывает необходимо уменьшить размер частичек до некоторого предела, что может приводить к дегидратации и, поэтому, существует риск образования аморфного материала. Были приведены исследования по уменьшение размера частичек образца моногидрата свободного основания AZD2171 путем измельчения, и потом их исследовали на наличие аморфного материала. Фигура 4 показывает, что аморфный материал, на самом деле, образуется во время уменьшения размера частичек свободного основания AZD2171. Это подтверждается уширением пиков и образованием аморфного 'бугорка' - смотрите Фигуру 4. Аморфная или полуаморфная форма свободного основания AZD2171 может создавать проблемы во время производства и обуславливать нерепродуцируемую биодоступность.
Определение альтернативных форм AZD2171, форм, которые отличаются от свободного основания и которые имеют улучшенные свойства в твердом состоянии, является целью представленного изобретения.
Примером альтернативной формы является соль AZD2171. В WO 00/47212 говорится, что фармацевтически приемлемыми солями соединений изобретения могут быть кислотно-аддитивные соли соединений изобретения, которые являются достаточно основными для образования таких солей. Такими кислотно-аддитивными солями являются соли с неорганическими и органическими кислотами, которые образуют фармацевтически приемлемые анионы, такими как галогенводороды, особенно с хлорводородной или бромводородной кислотой, или серной, или фосфорной кислотой, или с трифторуксусной кислотой, лимонной или малеиновой кислотой. Кроме того, WO 00/47212 указывает на то, что когда соединения изобретения являются достаточно кислотными, могут образовываться фармацевтически приемлемые соли с неорганическими и органическими основаниями, которые образуют фармацевтически приемлемые катионы. Такими солями с неорганическими и органическими основаниями являются, как говорят, соль щелочного металла, такая как соль натрия или калия, соль щелочноземельного металла, такая как соль кальция или магния, соль аммония или, например, соль с метиламином, диметиламином, триметиламином, пиперидином, морфолином или трис(2-гидроксиэтил)амином.
Предпочтительными солями в WO 00/47212 являются гидрохлориды и гидробромиды, особенно гидрохлориды.
Нигде в WO 00/47212 не упоминается, что специфическая соль отдельного соединения проявляет неожиданно благоприятные свойства.
Непредвиденно и неожиданно мы установили, что малеатная соль AZD2171 является особенно стабильной формой AZD2171 с улучшенными свойствами в твердом состоянии, по сравнению со свободным основанием и по сравнению с другими солями, которые подвергались исследованию.
Малеат AZD2171 легко кристаллизуется, является высококристалличным, негигроскопичным и имеет репродуцируемое стехиометрическое соотношение лекарственное средство к противоиону 1:1.
Таким образом, малеат AZD2171 является легкокристаллизуемым, является высококристалличным, негигроскопичным и имеет репродуцируемое стехиометрическое соотношение лекарственное средство к противоиону приблизительно 1:1.
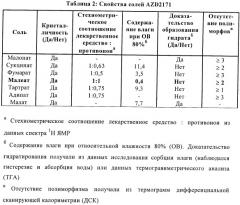
Было получено несколько солей AZD2171 и семь из которых были кристаллическими: малонат, сукцинат, фумарат, малеат, тартрат, адипат и малат. Исследовали твердотельные свойства этих 7 солей и результаты эти исследований приведены в Таблице 2:
Термин 'негигроскопичный' означает абсорбцию влаги <1% при ОВ 80%.
Малеатная соль AZD2171 была неожиданно лучше, чем другие, поскольку из 7 солей, которые было можно кристаллизовать, только она была негигроскопичной солью, была высококристалличной и имела репродуцируемое стехиометрическое соотношение лекарственное средство к противоиону 1:1.
Таким образом, было найдено, что малеат AZD2171 был не только негигроскопичной солью, был высококристалличным и имел репродуцируемое стехиометрическое соотношение лекарственное средство к противоиону приблизительно 1:1.
Малеатная соль AZD2171 является, по сути, свободной от аморфного материала и может, как ожидается, легче перерабатываться в рецептуры, нежели свободное основание AZD2171, и обеспечивает более репродуцируемые результаты дозирования. Выражение "по сути, свободная от аморфного материала" означает, что количество аморфного материала меньше нежели 10%, предпочтительно меньше нежели 5%, более предпочтительно меньше нежели 2%.
Малеатная соль AZD2171 является негигроскопичной, что должно предупреждать или уменьшать любые проблемы, связанные с изменением массы активного ингредиента во время процессов, таких как измельчение.
В соответствии с представленным изобретением, обеспечивается малеатная соль AZD2171.
Малеат AZD2171 имеет две кристаллические формы А и В.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде кристаллической формы, Форма А.
Форма А малеата AZD2171 характеризуется присутствием, по крайне мере, одного из следующих значений 2θ, измеренных используя излучение СuКа: 21,5 и 16,4. Форма А малеата AZD2171 характеризуется рентгенограммой на порошке, по сути, как показано на Фигуре 5. Десять наиболее выступающих пиков показаны в Таблице 3:
| Таблица 3Десять наиболее выступающих пиков рентгенограммы на порошке Формы А малеата AZD2171 | ||
| Угол 2-Тета (2θ) | Значение интенсивности | Относительная интенсивность |
| 21,522 | 100 | ос |
| 16,366 | 78,3 | ос |
| 24,381 | 73,7 | ос |
| 20,721 | 71,7 | ос |
| 25,025 | 71,5 | ос |
| 16,921 | 55,5 | ос |
| 12,085 | 44,1 | ос |
| 22,177 | 42,2 | ос |
| 17,444 | 40,7 | ос |
| 17,627 | 39,1 | ос |
| ос = очень сильный |
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы. Форма А, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, одним отдельным пиком приблизительно при 2-тета=21,5°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы. Форма А, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, одним отдельным пиком приблизительно при 2-тета=16,4°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы, Форма А, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, двумя отдельными пиками при 2-тета=21,5° и 16,4°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы. Форма А, где упомянутая соль имеет рентгенограмму на порошке с отдельными пиками приблизительно при 2-тета=21,5, 16,4, 24,4, 20,7, 25,0, 16,9, 12,1, 22,2, 17,4 и 17,6°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы, Форма А, где упомянутая соль имеет рентгенограмму на порошке, по сути такую же, как рентгенограмма на порошке, показанная на Фигуре 5.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы. Форма А, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, одним отдельным пиком при 2-тета=21,5° плюс или минус 0,5° 2-тета.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы. Форма А, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, одним отдельным пиком при 2-тета=16,4° плюс или минус 0,5° 2-тета.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы. Форма А, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, двумя отдельными пиками при 2-тета=21,5° и 16,4°, где упомянутые значения могут быть плюс или минус 0,5 2-тета.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы. Форма А, где упомянутая соль имеет рентгенограмму на порошке с отдельными пиками при 2-тета=21,5, 16,4, 24,4, 20,7, 25,0, 16,9, 12,1, 22,2, 17,4 и 17,6°, где упомянутые значения могут быть плюс или минус 0,5° 2-тета.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы. Форма А, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, одним отдельным пиком при 2-тета=21,5°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы. Форма А, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, одним отдельным пиком при 2-тета=16,4°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы. Форма А, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, двумя отдельными пиками при 2-тета=21,5° и 16,4°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы. Форма А, где упомянутая соль имеет рентгенограмму на порошке с отдельными пиками при 2-тета=21,5, 16,4, 24,4, 20,7, 25,0, 16,9, 12,1, 22,2, 17,4 и 17,6°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде первой кристаллической формы. Форма А, где упомянутая соль имеет рентгенограмму на порошке, как показано на Фигуре 5.
ДСК анализ показал, что Форма А малеата AZD2171 представляет собой твердое вещество с высокой температурой плавления и началом плавления при 198,3°С и пиком при 200,08°С (Фигура 6).
Таким образом, ДСК анализ показал, что Форма А малеата AZD2171 представляет собой твердое вещество с высокой температурой плавления и началом плавления приблизительно при 198,3°С и пиком приблизительно при 200,08°С.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы, Форма В.
Форма В малеата AZD2171, характеризуется присутствием, по крайне мере, одного из следующих значений 2θ, измеренных, используя излучение СuКа: 24,2 и 22,7. Форма В малеата AZD2171 характеризуется рентгенограммой на порошке, по сути, как показано на Фигуре 8. Десять наиболее выступающих пиков показаны в Таблице 4:
| Таблица 4Десять наиболее выступающих пиков рентгенограммы на порошке Формы В малеата AZD2171 | ||
| Угол 2-Тета (2θ) | Значение интенсивности | Относительная интенсивность |
| 24,156 | 100 | ос |
| 22,740 | 84,3 | ос |
| 15,705 | 64,0 | ос |
| 11,995 | 63,7 | ос |
| 27,087 | 60,9 | ос |
| 25,032 | 56,8 | ос |
| 17,724 | 37,7 | ос |
| 15,044 | 35,4 | ос |
| 23,102 | 34,5 | ос |
| 12,625 | 34,2 | ос |
| ос = очень сильный |
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы. Форма В, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, одним отдельным пиком приблизительно при 2-тета=24,2°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы. Форма В, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, одним отдельным пиком приблизительно при 2-тета=22,7°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы. Форма В, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, двумя отдельными пиками при 2-тета=24,2° и 22,7°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы. Форма В, где упомянутая соль имеет рентгенограмму на порошке с отдельными пиками приблизительно при 2-тета=24,2, 22,7, 15,7, 12,0, 27,1, 25,0, 17,7, 15,0, 23,1 и 12,6°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы, Форма В, где упомянутая соль имеет рентгенограмму на порошке, по сути, такую же как рентгенограмма на порошке показанная на Фигуре 8.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы. Форма В, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, одним отдельным пиком при 2-тета=24,2° плюс или минус 0,5° 2-тета.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы. Форма В, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, одним отдельным пиком при 2-тета=22,7° плюс или минус 0,5° 2-тета.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы. Форма В, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, двумя отдельными пиками при 2-тета=24,2° и 22,7°, где упомянутые значения могут быть плюс или минус 0,5° 2-тета.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы, Форма В, где упомянутая соль имеет рентгенограмму на порошке с отдельными пиками при 2-тета=24,2, 22,7, 15,7, 12,0, 27,1, 25,0, 17,7, 15,0, 23,1 и 12,6°, где упомянутые значения могут быть плюс или минус 0,5° 2-тета.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы, Форма В, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, одним отдельным пиком при 2-тета=24,2°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы. Форма В, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, одним отдельным пиком при 2-тета=22,7°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы, Форма В, где упомянутая соль имеет рентгенограмму на порошке с, по крайней мере, двумя отдельными пиками при 2-тета=24,2° и 22,7°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы, Форма В, где упомянутая соль имеет рентгенограмму на порошке с отдельными пиками при 2-тета=24,2, 22,7, 15,7, 12,0, 27,1, 25,0, 17,7, 15,0, 23,1 и 12,6°.
В соответствии с представленным изобретением обеспечивается малеатная соль AZD2171 в виде второй кристаллической формы. Форма В, где упомянутая соль имеет рентгенограмму на порошке, как показано на Фигуре 8.
ДСК анализ показал, что Форма В малеата AZD2171 представляет собой твердое вещество с высокой температурой плавления и началом плавления при 194,43°С и пиком при 195,97°С (Фигура 9).
Таким образом, ДСК анализ показал, что Форма В малеата AZD2171 представляет собой твердое вещество с высокой температурой плавления и началом плавления приблизительно при 194,43°С и пиком приблизительно при 195,97°С.
Форма В является метастабильной по сравнению с Формой А (точка плавления и нагревание плавления Формы В ниже чем у Формы А). Форма А является более термодинамически стабильной формой. Смесь Формы А и В превращается в Форму А при суспендировании в метаноле при 40°С на протяжении 4 дней (Фигура 10).
Форма А является более предпочтительной нежели Форма В.
Малеат AZD2171 является негигроскопичным абсорбирующим <1% влаги при относительной влажности 80% (Фигура 7).
Данные ЯМР анализа снятые после получения малеатной соли в Примере 1 указывают на стехиометрическое соотношение 1:1.
В соответствии с другим аспектом представленного изобретения обеспечивается дималеатная соль AZD2171. Дималеатную соль можно получить путем прибавления двух моль малеиновой кислоты к одному молю свободного основания AZD2171.
Когда указывается, что представленное изобретение касается кристаллической формы свободного основания AZD2171, или Формы А малеата AZD2171, или Формы В малеата AZD2171, степень кристалличности без труда составляет больше чем приблизительно 60%, более просто, больше чем приблизительно 80%, предпочтительно, больше чем приблизительно 90% и более предпочтительно больше чем приблизительно 95%. Наиболее предпочтительно степень кристалличности составляет больше чем приблизительно 98%.
Формы А и В малеатной соли AZD2171 имеют рентгенограммы на порошке, по сути, такие же, как рентгенограммы на порошке, показанные на Фигурах 5 и 8, соответственно, и имеют, по сути, десять наиболее выступающих пиков (значения угла 2-тета) показанные в Таблицах 3 и 4, соответственно. Понятно, что значения 2-тета рентгенограммы на порошке могут незначительно изменяться от одного прибора к другому или от одного образца к другому, и поэтому приведенные значения не должны истолковываться как абсолютные.
Известно, что рентгенограмму на порошке можно получить, когда имеется одна или несколько ошибок измерения зависящих от условий измерения (таких как оборудование или используемый прибор). В частности, общеизвестно, что интенсивность в рентгенограмме на порошке может меняться в зависимости от условий измерения. Поэтому должно быть понятно, что формы малеатной соли AZD2171 представленного изобретения не ограничиваются кристаллами, которые обеспечивают рентгенограммы на порошке, идентичные рентгенограммам на порошке, показанным на Фигурах 5 и 8, и любые кристаллы, обеспечивающие рентгенограммы на порошке, по сути, такие же самые, как показано на Фигурах 5 и 8, попадают в рамки представленного изобретения. Специалист в области рентгенографии на порошке способен оценить реальную идентичность рентгенограмм на порошке.
Специалистам в области рентгенографии на порошке будет понятно, что относительная интенсивность пиков может зависеть от, например, крупинок с размером больше 30 микрон и неоднородности соотношений, которые могут влиять на анализ образцов. Специалисту в данной области также должно быть понятно, что на расположение отражений может влиять точность расположения по высоте, на которой находится образец в дифрактометре и калибровка нуля дифрактометра. Незначительное влияние также может оказывать планарность поверхности образца. Поэтому приведенные данные дифракционной картины не должны рассматриваться как абсолютные значения (Jenkins, R & Snyder, R.L. 'Introduction to X-Ray Powder Diffractometry' John Wiley & Sons 1996; Bunn, C.W. (1948), Chemical Crystallography, Clarendon Press, London; Klug, H. P. & Alexander, L.E. (1974), X-Ray Diffraction Procedures).
Как правило, ошибка измерения угла дифракции в рентгеновской дифрактограмме на порошке составляет приблизительно 5% или меньше, в частности плюс или минус 0,5° 2-тета, и такая степень ошибки измерения должна браться во внимание, когда рассматривают рентгенограммы на порошке, приведенные на Фигурах 2, 3, 4, 5, 8 и 10, и когда анализируют Таблицы 1, 3 и 4. Кроме того, должно быть понятно, что интенсивности могут меняться в зависимости от условий эксперимента и полученного образца (предпочтительной ориентации).
Во избежание сомнений, термины, такие как 'малеатная соль AZD2171' и 'AZD2171 малеатная соль' касаются каждой и любой из форм малеатной соли AZD2171, где 'Форма А малеата AZD2171' относится от отдельной кристаллической форме, известной как Форма А и 'Форма В малеата AZD2171', относится от отдельной кристаллической форме известной как Форма В.
В соответствии со следующим аспектом изобретения обеспечивается фармацевтическая композиция, которая содержит малеатную соль AZD2171, как определено тут ранее, в комбинации с фармацевтически приемлемым наполнителем или носителем.
Композиция может быть в форме, пригодной для перорального введения, (например, как таблетки, лепешки, твердые или мягкие капсулы, водные или масляные суспензии, эмульсии, диспергируемые порошки или гранулы, сиропы или эликсиры), для введения в помощью ингаляции (например, как хорошо измельченный порошок или жидкий аэрозоль), для введения с помощью вдувания (например, как хорошо измельченный порошок), для парентеральной инъекции (например, как стерильный раствор, суспензия или эмульсия для внутривенного, подкожного, внутримышечного, внутрисосудистого введения или путем вливания), для местного введения (например, как кремы, мази, гели или водные или масляные растворы или суспензии), или для ректального введения (например, как суппозиторий). Предпочтительно малеатную соль AZD2171 вводят перорально. Вообще, упомянутые выше композиции можно получить обычным образом, используя обычные наполнители.
Композиции представленного изобретения преимущественно существуют в виде единичной дозированной формы. Малеат AZD2171 будут вводить теплокровным животным в виде единичной дозы в интервале 1-50 мг на квадратный метр поверхности тела животного, например, приблизительно 0,03-1,5 мг/кг человеку. Предусматривается единичная доза в интервале, например, 0,01-1,5 мг/кг, например 0,05-0,75 мг/кг, предпочтительно 0,03-0,5 мг/кг, и она представляет собой терапевтически эффективную дозу. Единичная доза в такой форме как таблетка или капсула будет обычно содержать, например, 1-50 мг активного ингредиента. Предпочтительно используется дневная доза в интервале 0,03-0,5 мг/кг. Размер дозы, необходимой для терапевтического или профилактического лечения отдельного заболевания, будет неминуемо изменяться в зависимости от субъекта подвергающегося лечению, пути введения и сложности заболевания подвергающегося лечению. Соответственно, оптимальную дозу может определить профессионал, который назначает лечение любому отдельному пациенту.
В соответствии со следующим аспектом представленного изобретения обеспечивается применение малеатной соли AZD2171, как тут определено выше, в способе лечения человека или животного с помощью терапии.
Следующей характерной чертой представленного изобретения является малеатная соль AZD2171, как определено тут ранее, для применения как медикамента, удобным является применение малеатной соли AZD2171, как определено тут ранее, для получения ангиогенного действия и/или снижения васкулярной проницаемости у теплокровного животного, такого как человек.
Таким образом, в соответствии со следующим аспектом изобретения обеспечивается применение малеатной соли AZD2171, как определено тут ранее, при производстве медикамента используемого продуцировании ангиогенного действия и/или снижения васкулярной проницаемости у теплокровного животного, такого как человек.
В соответствии со следующим аспектом представленного изобретения, обеспечивается способ продуцирования ангиогенного действия и/или снижения васкулярной проницаемости у теплокровного животного, такого как человек, нуждающегося в таком лечении, который включает введение упомянутому животному эффективного количества малеатной соли AZD2171, как определено тут ранее.
Малеатная соль AZD2171 представляет собой агент с ангиогенным действием и/или агент снижающий васкулярную проницаемость и может быть использован как единственный терапевтический агент или может включать, в дополнение к малеату AZD2171, один или большее количество веществ и/или методик лечения. Такое совместное лечение может быть осуществлено путем одновременного, последовательного или раздельного введения индивидуальных компонентов лечения. В области медицинской онкологии является нормальным применение комбинации разных форм терапии для лечения каждого отдельного пациента с раком. В медицинской онкологии другим компонентом(ами) такого комбинированного лечения в дополнение к малеатной соли AZD2171 может быть: хирургическое вмешательство, радиотерапия или химиотерапия. Такая химиотерапия может охватывать три основных категории терапевтических агентов:
(i) другие ангиогенные агенты, такие как агенты, которые ингибируют действие фактора роста васкулярного эндотелия, (например, бевацизумаб [Avastin™] - антитело фактора роста клеток васкулярного эндотелия, и агенты, механизм действия которых отличается от определенного тут ранее (например, линомид, ингибиторы функционирования интегрина αvβ3, ангиостатин, разоксин, талидомид), и включая васкулярно-нацеленные агенты (например, комбретастатинфосфат и соединения, описанные в международных заявках WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и WO 02/08213 и агенты, разрушающие васкулярную систему, описанные в международной заявке № WO 99/02166, полное описание которого включено сюда как ссылка (например, N-ацетилколхинол-O-фосфат));
(ii) цитостатические агенты, такие как антиэстрогены (например, томоксифен, торемифен, ралоксифен, дролоксифен, йодоксифен), даунрегуляторы рецептора эстрогена (например, фулвестрант), прогестогены (например, мегестролацетат), ингибиторы ароматазы (например, анастрозол, летразол, воразол, эксеместан), антипрогестогены, антиандрогены (например, флутамид, нилутамид, бикалутамид, ципротеронацетат), агонисты и антагонисты LHRH (гормон, высвобождающий лютеинизирующий гормон) (например, гозерелинацетат, лупролид, бузерелин), ингибиторы 5α-редуктазы (например, финастерид), антиинвазийные агенты (например, ингибиторы металлопротеиназы подобные маримастату и ингибиторы функционирования рецептора активатора плазминогена урокиназного типа) и ингибиторы функционирования фактора роста (такими факторами роста являются, например, тромбоцитарный фактор роста и гепатоцитный фактор роста), такими ингибиторами являются антитела фактора роста, антитела рецептора фактора роста (например, трацузумаб [Herceptin™] - антитело анти-еrbb2 и цетуксимаб [С225]) - антитело анти-erbb1, ингибиторы фарнезилтрансферазы, ингибиторы тирозинкиназы, например, ингибиторы семейства эпидермального фактора роста (например, ингибиторы тирозинкиназы семейства EGFR (рецептор эпидермального фактора роста), такие как] N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолинопропокси)хиназолин-4-амин (гефитиниб, AZD1839), N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амин (эрлотиниб, OSI-774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3-морфолинопропокси)хиназолин-4-амин (CI 1033)) и ингибиторы серин/треонинкиназы); и
(iii) антипролиферативные/антинеопластические лекарственные средства и их комбинации, используемые в медицинской онкологии, такие как антиметаболиты (например, антифолаты подобные метотрексату, фторпиримидины подобные 5-фторурацилу, тегафир, аналоги пурина и аденозина, цитозинарабинозид); противоопухолевые антибиотики (например, антрациклины подобные адриамицину, блеомицину, доксорубицину, даунорубицину, эпирубицину и идарубицину, митомицин-С, дактономицину, митрамицину); производные платины (например, цисплатин, карбоплатин); алкилирующие агенты (например, азотистый иприт, мелфалан, хлорамбуцил, бузулфан, циклофосфамид, ифосфамид, нитромочевины, тиотепа); антимитотические агенты (например, алкалоиды барвинка подобные винкристину, винбластину, виндесину, винорелбину, и таксоиды подобные токсолу, таксотеру); ингибиторы топоизомеразы (например, эпиподофиллотоксины подобные этопозиду и тенипозиду, амсакрин, топотекан, камптотецин, а также иринотекан); также ферменты (например, аспарагиназа); и ингибиторы тимидилатсинтазы (например, ралтитрексед);
и дополнительными типами химиотерапевтически