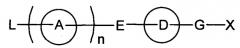Гетеросоединение
Иллюстрации
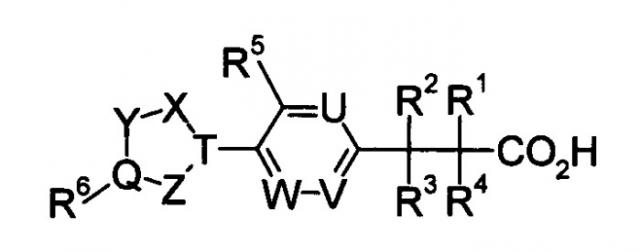
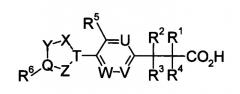
Показать всеИзобретение относится к соединению формулы (I)
или к его фармацевтически приемлемой соли, где символы имеют следующие значения: кольцо А представляет собой
или X представляет собой простую связь, -CH2-, -NR3-, -O-, -S-, R1 представляет собой галоген; фенил; пиридил; (С3-C8) циклоалкил, или (C1-С6) алкил, или (С2-С6) алкенил, каждый из которых может содержать галоген, -CONH2, фенил или (С3-С8)циклоалкил в качестве заместителя, R2 представляет собой -CN, -O-(С1-С6)алкил, -C(=O)H, галоген или (С1-С6)алкил, который может быть замещен с помощью галогена или -ОН, R3 может образовывать морфолино или 1-пирролидинил вместе с R1 и азотом, и, когда -Х- представляет собой простую связь, R1 и R2 могут в комбинации образовывать 5-членное кольцо и дополнительно содержать (C1-С6)алкил в качестве заместителя, R4 представляет собой следующее кольцо:
, , ,
, , , ,
, , или
где любая одна из связей от кольца связана с оксазольным кольцом, R5 представляет собой -Н; (С1-С6)алкил, который может быть замещен не менее одной группой, выбранной из ряда, содержащего: -C(=O)NRXRY -NHRX и -ORX-(С2-С6)алкенил-; -С(=O)H; -C(=O)NRXRY, RX и RY могут быть одинаковыми или отличатся друг от друга и представлять собой -H или (C1-С6) алкил. Изобретение также относится к фармацевтической композиции, обладающей активностью агониста SlP1, на основе указанных соединений. Соединения и композиции могут найти свое применение в медицине для профилактики и/или лечения отторжения при трансплантации органа, костного мозга или тканей, аутоиммунных заболеваний. 9 н. и 7 з.п. ф-лы, 84 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому гетеросоединению и лекарственному средству, содержащему его в качестве активного ингредиента, а именно как средство для лечения иммунологических заболеваний.
Уровень техники изобретения
Сфингозин-1-фосфат представляет собой метаболит сфинголипида, который является физиологически активным веществом, выделяющимся из активированного тромбоцита (Непатентный документ 1). Рецептор сфингозин-1-фосфата - это G протеинсвязывающего типа и принадлежит к Edg-семейству, который представляет собой ген эндотелиальной дифференциации. В настоящее время было найдено пять рецепторов S1P1(Edg1), S1P2(Edg5), S1P3(Edg3), S1P4(Edg6) и S1P5(Edg8). Все эти рецепторы широко представлены в клетках и тканях во всем теле, однако S1P1, S1P3 и S1P4 главным образом выражены в лимфоците и эндотелиальной клетке, S1P2 главным образом выражены в васкулярной гладкомышечной клетке и S1P5 главным образом выражены в мозге и селезенке, и их аминокислотные последовательности хорошо сохраняются у человека и грызунов (Непатентный документ 1). Многие рецепторы связаны с G протеинами путем стимуляции сфингозин-1-фосфата. S1P1 связан с Gi/0, S1P2 и S1P3 связан с Gi/0, Gq, G12/13 и Gs, S1P4 связан с Gi/0, G12/13 и Gs, S1P5 - это комбинация Gi/0 и G12/13 и вызывают рост клеток? обусловленный активацией МАПК, изменение цитоскелетной системы и инфильтрацию клеток, обусловленую активацией Rac (и/или Rho), и генерацию цитокина и медиатора, обусловленую активацией PLC и притоком кальция в клетку и т.п. (Непатентный документ 1). Было известно, что при стимулировании действия S1P1 сфингозин-1-фосфатом вызывается миграция лимфоцитов, ингибирование апоптоза, генерация цитокина, секвестирование лимфоцитов в тимусе и других вторичных лимфоидных тканях и ангиопластика в васкулярных эндотелиальных клетках (Непатентный документ 2). С другой стороны, S1P3 также найдены в кардиомиоците и обнаружено случайное снижение частоты сердцебиения (брадисфигмия) и кровяного давления при стимуляции сфингозин-1-фосфата (Непатентный документ 3), в то время как брадисфигмия не обнаружена при стимуляции сфингозин-1-фосфата у нокаутной мыши, у которой S1P3 генетически удален (Непатентный документ 4). Сообщалось что фосфатный эфир FTY720, который представляет собой активное вещество FTY720, в настоящее время проходит клинические испытания имеет неселективную агонистическую активность по отношению S1P1, S1P3, S1P4 и S1P5 (Непатентный документ 5), и, в особенности, брадисфигмия, вызванная эффектом стимуляции S1P3, зачастую выражается как нежелательный побочный эффект при клинических испытаниях (Непатентный документ 6). Таким образом, считается, что для секвестирования лимфоцита посредством рецептора сфингозин-1-фосфата необходима стимуляция S1P1 (Непатентный документ 7), в то время как стимуляция S1P3 не нужна, и она скорее рассматривается как причина нежелательного побочного эффекта. Следовательно, для разработки имуносупрессирующего средства с меньшими побочными эффектами желательно разработать агонист, обладающий слабым действием на S1P3 и селективно воздействующий на S1P1.
Например, в качестве соединения, обладающего активностью как агонист S1P1, было известно производное карбоновой кислоты, изображаемое следующей формулой (Патентный документ 1):
[Хим.1]
[по поводу символа в формуле обращайтесь к публикации]
В качестве соединения, обладающего активностью как агонист S1P1, известно производное индана, изображенное следующей формулой (Патентный документ 2):
[Хим.2]
[по поводу символа в формуле обращайтесь к публикации]
В качестве соединения, обладающего активностью как агонист S1P1, известно производное оксадиазола, изображаемое следующей формулой (последующие фигуры, Патентные документы 3, 4, 5, и 6):
[Хим.3]
[по поводу символа в формуле обращайтесь к публикации]
В качестве соединения, обладающего активностью как агонист S1P1, известно производное, изображенное следующей формулой (следующая фигура, Патентный документ 7):
[Хим.4]
[по поводу символа в формуле обращайтесь к публикации]
Однако соединение по настоящему изобретению не было описано ни в одном документе.
Непатентный документ 1: Annulan Review Biochemistry, 204, 73, 321-354
Непатентный документ 2: Nature Review Immunology, 2005, 5, 560-570
Непатентный документ 3: Japanese Journal of Pharmacology, 2000, 82, 328-342
Непатентный документ 4: Journal of Pharmacology и Experimental Therapeutics, 2004, 309, 758-768
Непатентный документ 5: Science, 2002, 296, 346-349
Непатентный документ 6: Journal of American Society of Nephrology, 2002, 13, 1073-1083
Непатентный документ 7: Nature, 2004, 427, 355-360
Патентный документ 1: Международная заявка на патент WO 2005/058848 брошюра
Патентный документ 2: Международная заявка на патент WO 2004/058149 брошюра
Патентный документ 3: Международная заявка на патент WO 2003/105771 брошюра
Патентный документ 4: Международная заявка на патент WO 2004/103279 брошюра
Патентный документ 5: Международная заявка на патент WO 2005/032465 брошюра
Патентный документ 6: Международная заявка на патент WO 2006/047195 брошюра
Патентный документ 7: Международная заявка на патент WO 2006/001463 брошюра
Описание изобретения
Проблема, которую изобретение призвано решить
Авторы настоящего изобретения провели исследование с целью обнаружения вещества, применимого для профилактики и/или лечения отторжения при трансплантации органа/костного мозга/ткани или аутоиммунных заболеваний, основываясь на агонистической активности по отношению к S1P1, и, в дальнейшем, предоставить лекарственный препарат, содержащий это вещество.
Средства решения задачи
Разработчики данного изобретения провели широкие исследования по отношению к веществу, имеющему S1P1 агностическую активность, и в результате они обнаружили, что новое гетеросоединение может быть использовано в качестве агониста S1P1, завершив, таким образом, настоящее изобретение. Иными словами, исходя из данного изобретения, можно предусмотреть новое гетеросоединение, представленное нижеследующей формулой (I), или его фармацевтически приемлемую соль.
Соединение, представленное формулой (I):
[Хим. 5]
или его фармацевтически приемлемая соль
[В формуле символы означают, как следует ниже.]
Кольцо представляет собой:
[Хим. 6]
Х представляет собой простую связь, -СН2-, -NR3-, -O-, -S-, -S(=O)- или -S(=O2)-,
R1 представляет собой -Н, галоген, арил, гетероарил, (С3-С8)циклоалкил, С3-С8)циклоалкенил, (С3-С8)гетероциклоалкил; или (С1-С6)алкил или (С2-С6)алкенил, каждый из которых может содержать галоген, -CONH2, арил, или (С3-С8)циклоалкил, как заместитель,
R2 представляет собой -CN, -O-(C1-C6)алкил, -С(=О)Н, галоген или (С1-С6)алкил, который может быть замещен с помощью галогена или -ОН,
R3 представляет собой -Н, где R3 может образовывать морфолино, 1-пирролидинил или 3,4-дегидропиперидин-1-ил вместе с R1 и азотом,
где когда -Х- представляет собой простую связь, R1 и R2 могут в комбинации образовывать 5-членное кольцо и, кроме того, содержать (С1-С6)алкил, как заместитель.
R4 представляет собой следующее ниже кольцо:
где любая одна из связей от кольца связана с оксадиазольным кольцом,
[Хим.7]
R5 представляет собой -Н; (С1-С6)алкил, который может быть замещен не менее одной группой, выбранной из ряда, содержащего: -CN, -C(=O)NRXRY, -NHRX, -SRX, -S(=O)2RX и -ORX (данный определен как R0-(C1-C6)алкил); R0-(C1-C6)алкил-О-; R0-(C1-C6)алкил-C(=O)-; R0-(C1-C6)алкил-S(=О)2-, R0-O-(C1-C6)алкил; R0-C(=O)(C1-C6)алкил-; R0-S(=O)2-(C1-C6)алкил-; (C2-C6)алкенил-; -С(=О)Н; -ORX; -S(=O)2RX; галоген; =О; NRXRY; -C(=O)NRXRY;
RX и RY могут быть одинаковыми или различными друг с другом и представлять собой -Н; или (С1-С6)алкил, который может быть замещен -ОН, NH2, которые могут быть защищены защитной группой, или гетероарил, в котором RX могут образовывать (С3-С8)гетероциклоалкил вместе с RY и азотом.
Что касается -Х-, он в формуле (I) предпочтительно представляет собой простую связь или -О- и, более предпочтительно, представляет собой -О-. Что касается R1, он предпочтительно представляет собой (С1-С4)алкил или (С2-С4)алкенил, каждый из которых может быть замещен галогеном или (С3-С8)циклоалкилом и, кроме того, более предпочтительно представляет собой (С1-С4)алкил, который может быть замещен с помощью F. Что касается кольца А, оно предпочтительно представляет собой:
[Хим.8]
Что касается R2, он предпочтительно представляет собой галоген, -CN, (C1-C4)алкил, который может быть замещен галогеном, и, более предпочтительно, он представляет собой Cl, CF3. Что касается R4, он предпочтительно представляет собой:
[Хим.9]
и более предпочтительно он представляет собой:
[Хим.10]
Что касается R5, он предпочтительно представляет собой -Н, (С1-С6)алкил, который может быть замещен с помощью -С(=О)NRXRY. Что касается RX, он предпочтительно представляет собой -Н, (С1-С6)алкил, который может быть замещен с помощью -ОН. Что касается RY, он предпочтительно представляет собой -Н; (С1-С6)алкил, который может быть замещен с помощью -ОН.
Соединение по настоящему изобретению, изображенное формулой (I), охарактеризовано химической структурой с точки зрения того, что бициклический азотсодержащий ненасыщенный гетероцикл или бициклический азотсодержащий частично ненасыщенный гетроцикл связан с 3-позицией оксазола и обладает фармакологическими характеристиками с точки зрения того, что соединение обладает S1P1 агонистической активностью.
Эффекты изобретения
Поскольку соединение по изобретению обладает S1P1 агонистической активностью, оно может быть использовано в качестве активного ингредиента средства для лечения или в качестве средства для профилактики заболеваний, вызванных неблагоприятной лимфоцитарной инфильтрацией, например отторжения трансплантата при пересадке органа, костного мозга или ткани, или реакции "трансплантат против хозяина", аутоиммунных заболеваний или воспалительных заболеваний, таких как ревматический артрит, рассеянный склероз, системная красная волчанка, нефротический синдром, энцефаломенингит, бульбоспинальный паралич, панкреатит, гепатит, нефрит, диабет, легочные расстройства, астма, атопический дерматит, воспалительные кишечные заболевания, атеросклероз или ишемическо-реперфузионное повреждение, и, кроме того, заболеваний, вызванных аномальным ростом или аккумуляцией клеток, таких как рак или лейкемия.
Лучший вариант осуществления изобретения
В дальнейшем в этом документе настоящее изобретение будет описано более детально.
В описании «алкил» означает линейную или разветвленную одновалентную группу. «С1-С6алкил» означает С1-С6 линейную или разветвленную группу, и ее специфические примеры включают: метил, этил, н-пропил, изопропил, н-бутил, изобутил, т-бутил, н-пропил и н-гексил, предпочтительны С1-С4алкил и особенно предпочтительны метил, этил, н-пропил и изопропил.
В описании «галоген» означает F, Cl, Br и I и предпочтительные примеры включают F и Сl.
В описании «С2-С6алкенил» означает С2-С6 линейную или разветвленную группу, которая имеет двойную связь в данном месте, и их специфические примеры включают: этинил (винил), 1-пропенил, 2-пропенил, 1-метилэтин-1-ил, 1-бутен-1-ил, 2-бутен-1-ил, 3-бутен-1-ил, 1-метил-1-пропен-1-ил, 2-метил-1-пропен-1-ил, 1-метил-2-пропен-1-ил и 2-метил-2-пропен-1-ил и предпочтительно, 1-метил-2-пропен-1-ил или 1-пентинил.
В описании «С3-С8циклоалкил» означает одновалентную группу неароматического углеродного цикла, имеющего степень восстановления 3-8, который частично может иметь ненасыщенные связи. Таким образом, специфические примеры включают циклопропил, циклобутил, циклопентил и циклогексил.
В описании «С3-С8 гетероциклоалкил» означает одновалентную неароматическую группу имеющую степень восстановления от 4 до 9, содержащую один или более гетероатомов, одинаковых или различных друг с другом, выбранные из ряда, содержащего азот, кислород и, по желанию, окисленную серу, которая может быть частично ненасыщенной. Их специфические примеры включают азиридинил, азетидинил, пирролидинил, пиперидинил, гомопиперидинил, морфолил, тиоморфолил, тетрагидропиранил и тетрагидротиопиранил.
В описании «арил» означает ароматическую углеводородную группу, но предпочтительными являются арильные группы, имеющие 6-14 атомов углерода. Их специфические примеры включают фенил, нафтил и антранил, и более предпочтительным является фенил.
В описании «гетероарил» означает 5- или 6-членный цикл ароматического гетероцикла, содержащий один или более гетероатомов, которые различны или отличаются друг от друга, выбранные из группы, содержащей азот, кислород и серу. Их специфические примеры включают пиридил, пиразил, пиримидинил, пирадизинил, пирролил, пиразолил, имидазолил, оксазолил, тиазолил, тиенил, фурил, аксадиазолил и тиадиазолил. Предпочтительным является 6-членный гетероарил и, в частности, предпочтительным является пиридил.
Соединение по настоящему изобретению в некоторых случаях может существовать в виде геометрического изомера или таутомера, в зависимости от типа заместителя. Более того, данное соединение может иметь асимметрический углерод. Настоящее изобретение включает все изолированные виды этих изомеров, а также их смесь. Кроме того, меченые соединения, т.е. соединения, в которых по меньшей мере один элемент в соединении по настоящему изобретению замещен радиоактивными или нерадиоактивными изотопами, также включаются в настоящее изобретение.
Более того, фармацевтически применимые, так называемые пролекарства, содержащие соединение по настоящему изобретению, также включены в настоящее изобретение. Фармацевтически допустимое пролекарство - это соединения, имеющие группу, которая может быть превращена в аминогруппу, гидроксильную группу, карбоксильную, или подобие соединения по настоящему изобретению, посредством сольволиза или в результате физиологического условия. Примеры группы, способной образовывать пролекарства, включают группы, описанные в "Prog. Med., vol. 5, 2157-2161 (1985) и "Iyakuhin no Kaihatsu (Development of Medicines) (Hirokawa Shoten, 1990), vol. 7, Bunshi Sekkei (Molecular Design)", 163-198.
Соединение, представленное формулой (I), может образовывать соли с кислотами или основаниями. Это могут быть любые фармацевтически приемлемые соли, и их специфические примеры включают соли присоединения кислоты неорганических кислот, такие как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, и органических кислот, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, аспаргиновая кислота и глутаминовая кислота; и соли с неорганическими основаниями, такими как натрий, калий, магний, кальций и алюминий, и с органическими основаниями, таким как метиламин, этиламин, этаноламин, лизин, орнитин и аммонийные соли.
Дополнительно настоящее изобретение также включает различные гидраты и сольваты и полиморфные соединения соединения, представленного формулой (I), и их соли.
В описании использовали следующие аббревиатуры.
Pr: метод получения, АсОН: уксусная кислота, n-BuLi: нормальный бутиллитий, t-BuOH: третичный бутанол, n-BuOH: нормальный бутанол, BrCN: бромистый цианид, CDI: 1,1'-карбонилбис-1Н-имидазол, DBU: диазобицикло[5.4.0]ундека-7-ен, DMAP: 4(N,N-диметиламино)пиридин, DIC: N,N'-диизопропилкарбодиимид, DMF: N,N-диметилформамид, DMSO: диметилсульфоксид, DPPA: дифенилфосфорилазид, Et: этил, EDCI/HCl: N[3-(диметиламино)пропил]-N'-этилкарбоксамида гидрохлорид, EtOH: этанол, Et3N: триэтиламин, EtOAc: этилацетат, HOBt: 1-гидрокси-1Н-бензотриазол, HPLC: высокоэффективная жидкостная хроматография, IPE: диизопропиловый эфир, i-PrOH: 2-пропанол, K2CO3: карбонат калия, КСN: цианид калия, KHCO3: гидрокарбонат калия, KOtBu: третичный бутоксид калия, LC-MS: жидкостная хроматография-масс-спектроскопия, LiH: гидрид лития, MeOH: метанол, NaH: гидрид натрия, NaOH: гидроксид натрия, NaBH4: боргидрид натрия, NaCN: цианид натрия, NaHCO3: гидрокарбонат натрия, Na2CO3: карбонат натрия, NaOMe: метоксид натрия, NaOEt: этоксид натрия, NCS: N-хлорсукцинимид, NH4Cl: хлорид аммония, NMP: N-метилпирролидон, POCl3: оксохлорид фосфора, Р2О5: пентаоксид фосфора, THF: тетрагидрофуран, TLC: тонкослойная хроматография, TMEDA: N,N,N',N'-тетраметилэтилендиамин, Zn(CN)2: цианид цинка.
(Метод Получения)
Соединение (I) по настоящему изобретению и его фармацевтически приемлемая соль могут быть получены путем применения различных известных синтетических методов, используя преимущества, даваемые их основным каркасом или типом заместителей. Здесь, в зависимости от типа функциональных групп, в некоторых случаях, с точки зрения методики приготовления, эффективно защитить функциональную группу подходящей защитной группой либо заменить ее группой, которая может быть легко превращена в функциональную группу, на протяжении стадий от исходных веществ до промежуточных соединений. Примеры таких функциональных групп включают аминогруппу, гидроксильную группу, карбоксильную группу, и примеры защитных групп для них включают защитные группы, которые описаны в «Protective Groups in Organic Synthesis» edited T.W. Green and P.G.M. Wuts, (USA) (3rd edition, 1999), которые могут быть выбраны по желанию, и их использование обуславливается условиями реакции. При помощи таких методов требуемое соединение можно получить путем введения защитной группы с целью проведения реакции, и затем, если требуется, удаления защитной группы или превращения в требуемую группу.
Дополнительно, пролекартво соединения (I) по настоящему изобретению может быть приготовлено путем введения специфических групп на протяжении стадий от исходных веществ до промежуточных соединений, сходной с вышеописанными защитными группами, или при проведении реакции, используя полученное соединение (I) по настоящему изобретению. Реакция может быть проведена при применении обычных методов этерефикации, аминирования, дегидратирования или методом, хорошо известным специалисту в данной области техники.
<Первый метод получения промежуточного вещества>
[Хим.11]
[где R или R' означает низший алкил, который может быть замещен не менее чем одним заместителем, выбранным из ряда, содержащего -CN, -C(=O)OH, -C(=O)ORX, -C(=O)NRXRY, -C(=O)NHSO2RX, -C(=O)-(С1-С8 гетероциклоалкил), -NHRX, -OH, SRX, -S(=O2)RX, галоген и -ORX (который определен как RZ-низший алкил); R0-(C1-C6)алкил-О-, R0-(C1-C6)алкил-С(=О)-; R0-(C1-C6)алкил-S(=O)2-; R0-O-(C1-C6)алкил-; R0-C(=O)-(C1-C6)алкил; R0-S(=O)2-(C1-C6)алкил-; (С2-С6)алкенил, -С(=О)Н, -ORX; -S(=O2)RX; галоген; =О; -NRXRY или -С(=О)NRXRY;
RX и RY одинаковы или отличаются друг от друга и каждый означает -Н; (С1-С6)алкил, который может быть замещен с помощью -ОН или пиридила. Также RX может быть связан с RY и атомом азота, образуя (C3-C8)гетероциклоалкил.
Этот метод получения представляет собой метод получения соединения безимидазола, изображенного формулой (1-с), при вступлении альдегидного соединения в реакцию с соединением 1,2-диаминобензола, изображенного формулой (1-b), которое может быть получено при восстановлении соединения, изображенного формулой (1-а).
Стадия, изображенная Стадией 1-1, представляет собой стадию восстановления нитрогруппы соединения, изображенного формулой (1-а), в аминогруппу, которая может быть проведена при нормальном давлении или при повышенном давлении в растворителе, инертном к реакции.
На стадии, изображенной Стадией 1-2, где R' представляет собой Н, можно создать имидазольное кольцо, например, при вступлении ортомуравьиного эфира, такого как этилортоформиат, в реакцию с соединением, изображенным формулой (1-b), в присутствии кислого катализатора.
Кроме того, на стадии, изображенной Стадией 1-2, где R' не является Н, например метод в котором аминогруппа соединения, изображенного формулой (1-а), предварительно проацилирована, используя карбоновую кислоту, хлорангидрид карбоновой кислоты, ангидрид карбоновой кислоты или подобные и циклизована при нагревании или в присутствии кислоты, метод, при котором тетраалакилортокарбонат, СDI и BrCN используют вместо ортомуравьиного эфира, или другие методы можно привести в качестве примера.
Кроме того, наряду с другими методами, можно привести в качестве примера и метод, в котором аминную часть соединения нитробензола (1-а) подвергают карбомилированию, приводящему к ациламинному соединению (1-е), подвергаемому восстановлению его нитрогруппы и циклизации при нагревании (Стадия 1-3, Стадия 1-4).
Все эти реакции могут быть проведены в растворителе, инертном к реакции, или без растворителя, от при комнатной температуре до при нагревании или при нагревании с кипячением.
<Второй метод получения промежуточного соединения>
[Хим.12]
[где R имеет те же самые значения, как определено выше]
Этот метод получения представляет собой метод получения имидазо[1,2-а]пиридина, замещенного нитрильной группой, изображенного при помощи формулы (2-b), при использовании соединения 2-аминопиридина, изображенного формулой (2-а), в качестве исходного соединения.
Стадия, изображенная Стадией 2-1, представляет собой реакцию сборки кольца имидазо[1,2-а]пиридина при вступлении в реакцию хлорацетальдегида или α-хлоркетона с соединением, изображенным формулой (2-а).
Ее предпочтительно проводить в присутствии основания, и специфические примеры оснований включают карбонаты щелочных металлов, таких как Na2CO3 и K2CO3; гидрокарбонаты щелочных металлов, таких как NaHCO3 и KHCO3; алкоксидов, таких как NaOMe, NaOEt и KOtBu; третичных аминов, таких как Et3N и DIPEA; и органических аминов, таких как DBU, пиридин и лутидин.
Все эти реакции могут быть проведены в растворителе, инертном к реакции, или без растворителя от при комнатной температуре до при нагревании или при нагревании с кипячением.
<Третий метод получения промежуточного соединения>
[Хим. 13]
[где R имеет те же самые значения, как определено выше]
Этот метод получения представляет собой метод получения соединения имидазола, изображенного при помощи формулы (3-с), при проведении реакции гидразингидрата с нитрильной группой соединения цианобензола, изображенного формулой (3-b), полученного путем замещения галогена соединения, изображенного формулой (3-а).
Стадия, изображенная Стадией 3-1, представляет собой реакцию галогена, связанного ароматическим кольцом с нитрильной группой. Примером этого могут служить реакция Zn(CN)2 в присутствии тетракисфенилфосфин палладия (0), реакция TMEDA и Pd катализатора в присутствии Na2CO3 в DMA, и реакции, в которых KCN, NaCN или им подобные вступают в реакцию вместо Zn(CN)2. Как правило, соединение, изображенное формулой (3-b), можно получить при реакции соединения, изображенного формулой (3-а), с трис(дибензилдиацетон)дипалладий (0),
1'-бис(дифенилфосфино)ферроценом и Zn(CN)2.
Здесь, примеры уходящей группы включают галоген, такие как Br и Сl; метансульфонилокси, этансульфонилокси, бензолсульфонилокси, п-толуилсульфонилокси и трифторметлисульфонилокси.
Стадия, изображенная Стадией 3-2, представляет собой реакцию создания имидазольного цикла из соединения цианобензальдегида, изображенного формулой (3-b). Как правило, в этой реакции используют гидразингидрат, эта реакция может быть проведена без растворителя или в растворителе, инертном к реакции, таком как МеОН и толуол, от при комнатной температуре до при нагревании или при нагревании при кипении. Дополнительно, также в качестве примера можно привести метод с использованием цианида меди и может быть добавлено основание, такое как пиридин. Также эту реакцию предпочтительно поводят в атмосфере азота.
<Четвертый метод получения промежуточного соединения>
[Хим.14]
[где R имеет те же самые значения, как определено выше. Z обозначает -СН= или -N=].
Этот метод получения представляет собой метод получения соединения бензотриазола или бензимидазола, изображенного формулой (4-с), путем дегидратации амидного соединения, изображенного формулой (4-b), полученного, используя в качестве исходного соединения карбоновую кислоту, изображенную формулой (4-а).
Стадия, изображенная стадией 4-1, представляет собой реакцию конденсации карбоновой кислоты, изображенной формулой (4-а), с аммиаком и создания функциональной группы амида карбоновой кислоты, изображенной формулой (4-b). Соединение, изображенное формулой (4-а), может быть использовано в виде свободной кислоты, но также могут быть использованы ее реакционноспособные производные. Примеры таких реакционноспособных производных, исходя из соединения, изображенного формулой (4-b), включают галогенангидриды карбоновых кислот, такие как хлорангидрид кислоты и бромангидридкислоты; обыкновенные сложные эфиры, такие как метиловый эфир, этиловый эфир и бензиловый эфир; азиды карбоновых кислот; активированные эфиры, такие как НОBt, п-нитрофениловый и N-гидроскисукцинимидный; симметричные ангидриды карбоновых кислот; смешанные ангидриды карбоновых кислот алкиловых эфиров галогенкарбоновых кислот, таких как хлорангидрид алкилугольной кислоты, пивалоилгалогенид и хлорангидрид п-толуолсульфоновой кислоты; смешанные ангидриды карбоновых кислот, такие как смешанные ангидриды фосфорной кислоты, такие как те, что получаются по реакции дифенилфсфорилхлорида с N-метилморфолином.
В случае, когда соединение, изображенное формулой (4-а), вступает в реакцию в виде свободной кислоты, или без выделения активированного эфира, или нечто подобное, предпочтительно используют конденсирующий агент, такой как DCC, CDI, DPPA, диэтилфосфорилцианид и EDCI/HCl.
Растворитель для реакции варьируется в зависимости от реакционной способности производного или конденсирующего агента, которые используют, но реакцию проводят в органическом растворителе, инертном к реакции, таких как галогенпроизводные углеводородов, ароматические углеводороды, простые эфиры, сложные эфиры, такие как EtOAc, ацетонитрил, DMF и DMSO или в их смесях. Также реакцию проводят при охлаждении, от при охлаждении до при комнатной температуре или от при комнатной температуре до при нагревании.
Кроме того, в реакции, для того чтобы реакция прошла хорошо, желательно проводить реакцию с избыточным количеством аммиака или в присутствии основания, такого как N-метилморфолин, триметиламин, Et3N, DIPEA, N,N-диметиланилин, пиридин, DMAP, пиколин и лутидин. Пиридин может быть использован в комбинации с растворителем.
Стадия, изображенная Стадией 4-2, представляет собой дегидратацию, для которой основание может или не может использоваться и могут быть использованы такие дегидратирующие агенты, как трифторуксуный ангидрид, POCl3 и Р2О5.
Кроме того, в случае синтеза конденсированных, промежуточного гетероциклического соединения, отличного от описанного, в вышеописанных методах получения промежуточных веществ, можно применять методы, описанные в Справочных Примерах или в Примерах в данном описании, или равноценные методы, или дополнительно, для получения следует использовать хорошо известные методы или методы, очевидные для специалистов в данной области техники.
<Первый метод получения>
[Хим.15]
[где А, Х, R1 и R4, как описаны выше. Lv обозначает уходящую группу. Карбоновая кислота, изображенная формулами (5-с), (5-d) и (5-g), можно приобрести как коммерчески доступный продукт, или приготовлен так же, как коммерчески доступный продукт].
Этот метод получения представляет собой метод получения соединения по настоящему изобретению, изображенного формулой (I), при помощи реакции гидроксиамида, изображенного формулой (5-b), полученного при вступлении в реакцию гидроксиламина с ароматическим нитрилом, изображенным формулой (5-а), с карбоновой кислотой, изображенной формулой (5-с).
На стадии, изображенной Стадией 5-1, гидроксиамидин, изображенный формулой (5-b), может быть получен при вступлении в реакцию свободного гидроксиламина или гидрохлорида гидроксиламина в присутствии основания.
Эту реакцию следует проводить в растворителе, инертном к реакции. Специфические примеры растворителей включают спирты, такие как МеОН, EtOH и i-PrOH; ароматические углеводороды, такие как толуол и ксилол; простые эфиры, такие как THF, диоксан и диэтоксиэтан; галогенуглеводороды, такие как дихлорметан, 1,2-дихлорэтан, хлороформ и четыреххлористый углерод; ацетонитрилы; апротонные полярные растворители, такие как DMF, 1,3-димитил-2-имидазолидинон и DMSO; воду или смеси таких растворителей. Как правило, в реакции используют спирты. Как описано выше, в случае, когда используют гидрохлорид гидроксиламина, реакцию проводят предпочтительно в присутствии основания, и специфические примеры оснований включают карбонаты щелочных металлов, такие как Na2CO3 и K2CO3; гидрокарбонаты щелочных металлов, такие как NaHCO3 и КНСО3; алкоксиды, такие как NaOMe, NaOEt и KOtBu; третичные амины, такие как Et3N и DIPEA; органические амины, такие как DBU, пиридин и лутидин. Температура реакции варьируется в зависимости от типа исходных веществ, условий реакции и т.п., но реакцию следует проводить, как правило, от при комнатной температуры до около температуры кипения растворителя. Как правило, в присутствии снования, такого как Na2CO3, реакцию следует проводить в органическом растворителе, инертном к реакции, таком как МеОН, от при комнатной температуры до при нагревании.
Стадия, изображенная Стадией 5-2, состоит из двух стадий, т.е. из стадии ацилирования гидроксиамидина и стадии реакции цикизации в соответствующем порядке. Стадию ацилирования можно провести следующим образом. Соединения, изображенное формулой (5-с), может быть использовано в реакции в виде свободной кислоты, но его реакционноспособное производное также может использоватся в реакции. Примеры таких реакционноспособных производных включают хлорангидрид кислоты и бромангидрид кислоты; обычные простые эфиры, такие как метиловый эфир, этиловый эфир и бензиловый эфир; азиды кислоты; активированные эфиры, такие как HOBt, п-нитрофениловый, N-гидроксисукцинимидный; симметричный ангидрид кислоты; смешанный ангидрид кислоты с алкиловыми эфирами галогенкарбоновых кислот, такими как алкиловый эфир галогенугольной кислоты, смешанный ангидрид смешанной фосфорной кислоты, такие как полученные по реакции дифенилфософорилхлорида с N-метилморфолином.
В случае, когда соединение, изображенное формулой (5-с), реагирует в виде свободной кислоты, или без выделения активированного эфира или нечто подобное, предпочтительно используют конденсирующий агент, такой как DCC, CDI, DPPA, диэтилфосфорилцианид и EDCI/HCl.
Растворитель для реакции варьируется в зависимости от реакционной способности производного и конденсирующего агента, который используют, но реакцию проводят в органическом растворителе, инертном к реакции, таких как галогенуглеводороды, ароматические углеводороды, простые эфиры, сложные эфиры, как, например, EtOAC, ацетонитрил, DMF и DMSO, или смеси таких растворителей, при охлаждении, от при охлаждении до при комнатной температуре или от при комнатой температуре до при нагревании.
Для того чтобы хорошо провести реакцию, в некоторых случаях предпочтительно ее проводить в присутствии таких оснований, как N-метилморфолин, триметиламин, Et3N, DIPEA, N,N-диметиланилин, пиридин, DMAP, пиколин и лутидин. Также пиридин может использоваться в комбинации с растворителем. Ацилированный продукт как промежуточное соединение может быть очищен путем выделения и нагрет в органическом растворителе, инертном к реакции, таком как EtOH, диоксан, толуол и вода. Как правило, эту двухстадийную реакцию следует проводить в одну стадию, при нагревании или микроволновом облучении продукта в том виде, в котором он есть, или в виде реакционной смеси после ацилирования.
Специфические примеры растворителей выключают ароматические, такие как толуол, ксилол и пиридин; простые эфиры, такие как диэтиловый эфир, THF, диоксан и диэтоксиэтан; галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан, хлороформ и четыреххлористый углерод; ацетонитрилы; апротонные полярные растворители, такие как DMF, DMA, 1,3-диметил-2-имидазолидинон, NMP и DMSO; воду или смеси этих растворителей. Температура реакции варьируется в зависимости от типа исходных веществ, условий реакции или нечто подобное, но реакцию следует проводить обычно от при комнатной температуры до при нагревании.
В случае, когда Х представляет собой -О- или -NH-, синтез может быть осуществлен нижеследующим методом приготовления.
Стадии, изображенные Стадией 5-3 и Стадией 5-5, могут быть проведены таким же образом, как и стадия, изображенная Стадией 5-2.
Стадии, изображенные Стадией 5-4 и Стадией 5-6, представляют собой стадии приготовления соединения по настоящему изобретению, изображенного формулой (I), осуществляемые при вступлении в реакцию фенола, анилина, спирта или амина, изображенных формулой (5-е) или формулой (5-i), с соединением, имеющим уходящую группу, изображенным формулой (5-f) или формулой (5-h). Здесь, примеры уходящих групп включают галогены, такие как хлор или бром; и сульфонилокси, такие как матансульфонилокси, этансульфонилокси, бензолсульфонилокси, п-толуолсульфонилокси, п-нитробензолсулфанилокси и трифотрметансульфонилокси.
Реакцию проводят при нормальном давлении или при повышенном давлении, без растворителя или в подходящем растворителе.
Специфические примеры растворителей включают ароматические углеводороды, такие как толуол или ксилол; кетоны, такие как ацетон и метилэтилкетон; простые эфиры, такие как эфир, THF, диоксан и диэтоксиэтан; спирты, такие как МеОН, EtOH, i-PrOH и n-BuOH; галогенированные углеводороды, такие как дихлорметан, 1,2-дихлоэтан, хлороформ и четыреххлористый углерод; ацетонитрилы; апротонные полярные растворители, такие как DMF, 1,3-диметил-2-имидазолидинон, NMP и DMSO; воду или смеси таковых растворителей. В этой реакции предпочтительно используют основание, и специфические примеры оснований включают NaH; карбонаты щелочных металлов, такие как Na2CO3 и K2CO3, гидрокарбонаты щелочных металлов, такие как NaНCO3 и KНCO3, алкоксиды, такие как NaOMe, NaOEt и KOtBu, третичные амины, такие как Et3N, трибутиламин и