Фармацевтическая композиция в виде микросфер для профилактики ампутации конечностей при диабете
Иллюстрации
Показать всеИзобретение относится к фармакологии, в частности к средству для лечения диабетических язв стопы или кожных хронических ишемических ран нижних конечностей больных диабетом и для предотвращения ампутации указанных конечностей. Применение фармацевтической композиции, содержащей микросферы эпидермального фактора роста, определенного диаметра, для лечения диабетических язв стопы или кожных хронических ишемических ран нижних конечностей больных диабетом и для предотвращения ампутации указанных конечностей. Вышеописанная композиция позволяет снизить частоту введения препаратов во время лечения и обеспечивает более быстрое заживление поражений. 7 з.п. ф-лы, 8 табл., 5 ил.
Реферат
Область техники
Настоящее изобретение относится к фармацевтической композиции, которая включает полимерные микросферы, содержащие эпидермальный фактор роста (EGF) для парентерального введения в нижние конечности больных диабетом с кожными хроническими ишемическими язвенными ранами для предотвращения ампутации конечностей вследствие сосудистых осложнений диабета.
Предшествующий уровень техники
Сахарный диабет представляет собой основной не травматический фактор риска ампутации нижних конечностей. Образование язв стопы представляет собой тяжелое осложнение диабета, имеющее ежегодную заболеваемость несколько выше 2% (Abbott C.A., et al. (2002) The North-West Diabetes Foot Care Study: incidence of, and risk factors for, new diabetic foot ulceration in a community-based patient cohort. Diabet. Med. 19(5):377-84). По меньшей мере, у 15% больных диабетом в течение их жизни развиваются хронические язвы стоп (Reiber G. E. (1996) The epidemiology of diabetic foot problems. Diabet. Med. 13 Suppl 1:S6-11), и, по оценкам, приблизительно 10-30% этих пациентов требуют ампутации нижних конечностей (Lipsky B.A. (2004) Medical treatment of diabetic foot infections. Clin. Infect. Dis. 39 Suppl 2:S104-14). 5-Летняя смертность пациентов, которые перенесли ампутацию нижних конечностей, составляет примерно 50-60% (Reiber G. E. (1996) The epidemiology of diabetic foot problems. Diabet. Med. 13 Suppl 1:S6-11). Использовалось несколько способов для лечения больных диабетом с кожными хроническими ишемическими язвенными ранами. Они включают жесткое регулирование метаболизма, профилактику модифицируемых факторов риска, хирургическую обработку ран, использование перевязочных материалов, противомикробное лечение инфекций, устранение сдавливания поврежденной области, использование кожных трансплантатов, факторов роста и, при наличии показания, использование способов реваскуляризации.
После регуляции метаболизма, хирургическая обработка ран представляет собой самый важный способ лечения для заживления диабетической язвы и должно проводиться перед любым другим местным терапевтическим лечением. Хирургическая обработка ран состоит в удалении всех нежизнеспособных и инфицированных тканей (включая кости) из пораженной области, а также окружающих гипертрофированных тканей.
Использование повязок по поводу диабетических язв стоп широко используется, и, хотя были изучены несколько видов повязок, преимущества каждого вида повязок перед другими не известны. Кроме того, поскольку исследования по использованию перевязочных материалов были немногочисленны и они были направлены главным образом на язвы низкой степени тяжести, то для демонстрации их эффективности требуется больше доказательств на основании клинических исследований. Новые виды перевязочных материалов, которые были исследованы в клинических испытаниях, включают материалы на основе полупроницаемой полимерной мембраны, промограма (коллагеновой матрицы), альгината, карбоксиметилцеллюлозы, гиалуронана, и материалы, в которых используется давление ниже атмосферного (Eldor R. et al. (2004) New and experimental approaches to treatment of diabetic foot ulcers: a comprehensive review of emerging treatment strategies. Diabet. Med. 21(11):1161-73).
Были разработаны несколько способов создания заместителей кожи, которые помещаются на область язвы. Например, Dermagraft получают высеванием фибробластов дермы человека на синтетический каркас из биологически поглощаемого материала. Было показано, что это устройство эффективно при язвах низкой степени тяжести, обеспечивая более высокую частоту заживления за более короткий интервал времени (Marston W.A., et al. (2003) Dermagraft Diabetic Foot Ulcer Study Group. The efficacy and safety of Dermagraft in improving the healing of chronic diabetic foot ulcers: results of a prospective randomized trial. Diabetes Care 26:1701-5). Apligraf состоит из слоев дермы, составленных из человеческих фибробластов в матрице из бычьего коллагена I типа и одного слоя эпидермиса, образованного кератиноцитами человека. Аналогичным образом было показано, что этот заместитель кожи обеспечивает значительно большее и более быстрое заживление повреждений при его наложении в случаях нейропатических язвах низкой степени тяжести и при не инфицированных язвах (Veves A., et al. (2001) Graftskin, a human skin equivalent, is effective in the management of non-infected neuropathic diabetic foot ulcers: a prospective randomized multicenter clinical trial. Diabetes Care 24:290-5).
В фазе III рандомизированного, двойного слепого клинического испытания с плацебо-контролем, гелевый состав полученного из тромбоцитов фактора роста (PDGF) показал эффективность и безопасность для лечения больных диабетом, у которых имеются нейропатические язвы с хорошим кровоснабжением (Wieman T.J., et al. (1998) Clinical efficacy of beclapermin (rh PDGF-BB) gel. Diabetes Care 21 (5):822-7). У большинства пациентов (95%), включенных в это исследование, были язвы с площадью ≤10 см2, в соответствии с оценкой планиметрией. Гель Becaplermin 100 мкг/г, по сравнению с плацебо, значительно увеличивает полное заживление повреждений у 43% (50, по сравнению с 35%, р=0,007) и уменьшает время, требуемое для достижения этого эффекта у 32% (86, по сравнению со 127 днями, р=0,013). Удовлетворительные результаты, полученные PDGF и becaplermin (Regranex), привели к их разрешению для лечения нейропатических локализующихся на нижних конечностях больных диабетом язв, которые простираются до подкожной ткани или глубже и имеют достаточное кровоснабжение (Brem H., Sheehan P., Boulton A.J. (2004) Protocol for treatment of diabetic foot ulcers. Am. J. Surg. 187(5A): 1S-10S).
Недавно были опубликованы результаты применения способа введения способствующего заживлению средства, подобного эпидермальному фактору роста (EGF), причем способ заключается в инфильтрации участка поражения раствором EGF посредством нескольких инъекций (WO 03/053458). Но он имеет явный недостаток: он очень травматичен для пациента, поскольку проведение инъекций в участок поражения очень болезнен. При каждом сеансе лечения необходимо выполнить несколько инъекций, и пациент должен получать лечение через день в течение нескольких недель. Учитывая недостатки этого способа, применение состава длительного высвобождения EGF могло бы уменьшить частоту введения препарата, что значительно увеличило бы удобство для пациента и соблюдение им назначенного лечения.
В патенте США № 6086863 описано, что регулирующие и факторы роста (т.е. эпидермальный фактор роста) могут быть включены в профилактические или лечебные композиции, содержащие микросферы полистирола или других неразлагаемых полимеров, для улучшения процесса репарации ран, таких как язвы при диабетической стопе, посредством местного нанесения суспензии этих микросфер в соответствующем носителе. Местное нанесение препаратов имеет ограничение, связанное с недостаточным контролем дозы, которая достигает участка действия, поскольку несколько факторов могут мешать всасыванию препарата, среди которых можно указать наличие некротической ткани и местных экссудатов, нарушение кровотока, присутствие ферментов, которые разрушают EGF.
Поэтому важной проблемой при лечении язв диабетической стопы является определение эффективной дозы препарата, которая вызывает регенерацию ишемизированной ткани и предотвращает ампутацию конечности вследствие диабетического поражения.
Многие другие патенты сосредоточились на других способах, предназначенных для ускорения скорости заживления. Тем не менее, ни один из этих способов не оказался эффективным в широком смысле.
Детальное описание изобретения
В целом, настоящее изобретение относится к фармацевтической композиции, которая содержит микросферы, нагруженные эпидермальным фактором роста, для введения парентеральным путем в нижние конечности больных диабетом, у которых имеются кожные хронические ишемические раны, с целью предотвращения ампутации этих конечностей. В настоящем изобретении термин «микросферы» включает микросферы и наносферы.
Инкапсуляция EGF в микросферы позволяет: (i) замедлить высвобождение препарата и (ii) защитить EGF против процессов разрушения, таких как переваривание белка протеазами, локализующимися в участке действия.
В настоящем изобретении микросферы можно описать как полимерные сферы с препаратом, равномерно диспергированном во всем их объеме, который высвобождается контролируемым образом.
В контексте настоящего изобретения термин «контролируемое высвобождение» включает высвобождение препарата непрерывным, прерывистым, линейным или нелинейным образом. Это достигается использованием различных композиций из полимерной матрицы, включением эксципиентов, которые модифицируют профили высвобождения, и/или добавлением агентов, усиливающих разрушение полимера, или других модификаций, которые по отдельности или в комбинации оказывают ожидаемый эффект на свойства композиции.
Микросферы получают способом двойного выпаривания эмульсии/растворителя, как описано Okada et al. (патент США № 4652441).
Полимеры, предпочтительные для создания этого изобретения, представляют собой те, которые, благодаря их свойствам, являются биологически совместимыми и биологически разрушаемыми. Последнее условие крайне важно, поскольку оно обеспечивает возможность парентерального применения состава инфильтрацией им участка поражения. Особенно предпочтительны гомополимеры гликолевой или молочной кислоты и сополимеры, полученные из них обеих [сополимеры (лактида и гликалида) (сокращенно PLGA)]. Эти полимеры имеют характеристики, которые сделали их превосходными материалами для изготовления шовных материалов, фиксирующих ортопедических устройств и полимерных матриц для систем доставки лекарственного средства (Ashammakhi N., et al (2001) Developments in Craniomaxillofacial Surgery: Use of Self-Reinforced Bioabsorbable Osteofixation Devices. Plast. Reconstr. Surg. Special Topic: 167-80; Eppley B. L. (2005) Use of resorbable plates and screws in pediatric facial fractures. J. Oral Maxillofac. Surg. 63(3):385-91). Благодаря приданию полимерам их свойств, они являются биологически совместимыми и биологически разрушаемыми, кроме обеспечения возможности варьирования профилей высвобождения препарата на основании композиции полимерной матрицы, молекулярной массы полимера и добавления в частицы других эксципиентов.
В дополнение к PLGA, можно использовать другие полимеры с аналогичными свойствами, подобными биологической совместимостью и биологической разрушаемостью. Они включают поликапролактон, сополимеры полигидроксибутирата-полигидроксивалерата, сополимеры полимолочной кислоты-поликапролактона, полиортоэфиры и полиангидриды.
В предпочтительном варианте осуществления микросферы фармацевтической композиции имеют диаметр в интервале от 1 до 100 мкм, и EGF составляет 1,6-2,4% от общей массы микросфер.
В другом предпочтительном варианте осуществления EGF, инкапсулированный в микросферы, высвобождается, после первого дня его инфильтрации, в количествах от 5 до 10 мкг/д, и он сохраняет свои физико-химические и биологические свойства в течение 14 дней.
Другой аспект настоящего изобретения относится к лечению ишемических повреждений у больного диабетом введением указанной выше фармацевтической композиции путем местной инфильтрации участка ткани, который включает края и дно повреждения.
Микроинкапсуляция белковых препаратов требует особого внимания в отношении активности этих биомолекул после процесса микроинкапсуляции. Это вызвано тем, что белки в большинстве случаев чувствительны к высоким температурам, которые часто создаются при процессах инкапсуляции, и к органическому растворителю, используемому для растворения полимеров. С другой стороны, каждый белок проявляет свое собственное поведение при процессе микроинкапсуляции. Учитывая эти аспекты, разработка методологии получения микросфер, нагруженных белками при их неизменной биологической активности, требует всеобъемлющего исследования для отбора целесообразного способа, полимера, растворителя, добавок и т.д.
В качестве активного агента фармацевтическая композиция может содержать EGF, полученный из естественных источников, посредством химического синтеза или технологией рекомбинантной ДНК.
Фармацевтическая композиция может также содержать, в качестве части носителя, некоторые дополнительные лекарственные средства из следующих групп: антимикробные средства (пенициллины, цефалоспорины, хинолон, метронидазол, клиндамицин, ванкомицин, макролиды, тетрациклины, азтреонам и имипенем), анестетики, анальгетики из группы нестероидных противовоспалительных средств, препараты с ангиогенным действием (сосудистый эндотелиальный фактор роста, фактор роста фибробластов), другие факторы роста (фактор, стимулирующий колонии гранулоцитов) или эритропоэтин.
Кожные хронические ишемические язвенные раны нижних конечностей больных диабетом представляют собой патологию, подвергаемую лечению фармацевтической композиции, которое является целью настоящего изобретения. В зависимости и от условий повреждения, и характеристик подлежащего лечению пациента, микросферы, включенные в фармацевтическую композицию, могут потребовать совместную инкапсуляцию другой молекулы. Эти дополнительные терапевтические средства относятся к группе антимикробных средств, анестетиков, анальгетиков из группы нестероидных противовоспалительных препаратов, препаратов с ангиогенным действием и других факторов роста.
Перед введением пациентам фармацевтическую композицию следует суспендировать в соответствующем носителе, который может представлять собой или солевой раствор, содержащий усилители вязкости, такие как карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, и детергенты, такие как полисорбаты, или термочувтствительный гидрогель типа PEG-PLGA-PEG, или производное из хитозана или декстрана.
Фармацевтическая композиция, являющаяся целью настоящего изобретения, позволила снизить частоту введения во время лечения и неожиданно увеличивает эффект лечения путем уменьшения общего времени лечения, поскольку заживление поражений происходило быстрее, чем поражений, леченых эквивалентными количествами неинкапсулированного EGF. Улучшенный лечебный эффект состава не ожидался, потому что достигнутый профиль медленного высвобождения вызывает низкие концентрации EGF. Также неожиданно, другой состав, в котором некоторые эксципиенты использовались для ускорения высвобождения EGF, и, таким образом, для получения более высоких концентраций препарата, не оказывали терапевтических эффектов состава по настоящему изобретению.
Краткое описание чертежей
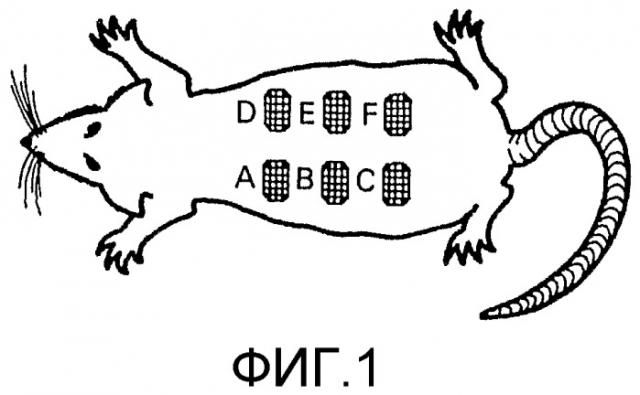
Фиг. 1. Схема, которая представляет локализацию язв, вызванных на экспериментальной модели.
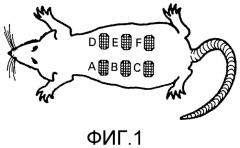
Фиг. 2. Диаграмма способа получения микросфер, нагруженных EGF, способом двойного выпаривания эмульсии-растворителя.
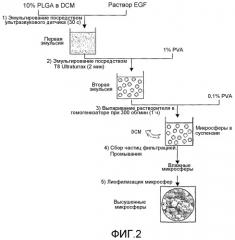
Фиг. 3. Сканирующая электронная микрофотография микросферы, нагруженной EGF.
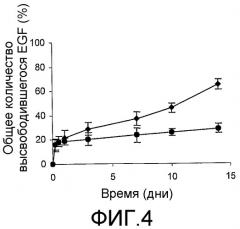
Фиг. 4. Профиль высвобождения EGF из микросфер PLGA. По оси Х показано время в днях, а по оси Y представлено количество высвобождаемого EGF, которое ожидается в виде процента общего количества EGF, содержащегося в микросферах, которые использовались в эксперименте, (♦) состав быстрого высвобождения и (●) состав медленного высвобождения.
Фиг. 5. Высокоэффективная жидкостная хроматография в обращенной фазе EGF, переваренного трипсином, в различных условиях. А: Контроль, В: Свободный EGF, С: инкапсулированный EGF в микросферах PLGA, D: EGF, смешанный с пустыми микросферами PLGA.
Примеры
Для более полного описания изобретения, представлены следующие примеры.
Пример 1. Получение фармацевтической композиции, содержащей микросферы PLGA с EGF
Получение микросфер, нагруженных EGF
Полимерный раствор (PLGA 50:50 (Sigma, St. Louis, Missouri, USA) 10% (мас./об.)) получали растворением 1 г полимера в дихлорметане (DCM). 1 мл раствора PLGA помещали в стеклянный контейнер и добавляли 200 мкл водного раствора EGF в концентрации 20 мг/мл. Эту смесь обрабатывали ультразвуком в течение 30 секунд посредством ультразвукового датчика (IKASONIC U 200 S control (IKA Labortechnik, Germany). Первую эмульсию добавляли к 40 мл 1% поливинилового спирта, а вторую эмульсию получали посредством энергичного перемешивания фаз при 14000 об/мин с использованием T8 Ultraturax (IKA Labortechnik, Germany). Двойную эмульсию добавляли к 140 мл 0,1% поливинилового спирта 30000-70000 (Sigma, St. Pouis, Missouri, USA) и перемешивали в гомогенизаторе (IKA Labortechnik, Germany). При 300 об/мин в течение 1 ч для выпаривания дихлорметана. Наконец, микросферы собирали фильтрацией, промывали 5 раз 50 мл дистиллированной воды и сушили лиофилизацией в лиофилизаторе (Edwards, UK). Высушенные микросферы хранили при 4°С до их использования (фиг. 2).
Микросферы EGF с эксципиентами получали в соответствии с той же процедурой, но с добавлением Pluronic F-127 (10 мг) и NaCl (0,5 мг) во внутренней водной фазе.
Характеристика микросфер, содержащих EGF
Рассчитывали эффективность способа микроинкапсуляции и белковой загрузки частиц посредством определения концентрации EGF микроанализом ВСА в полученном растворе после переваривания частиц 1N NaOH, которые нейтрализовали 1N HCl перед определением.
Микрочастицы сферической формы получали в результате процесса микроинкапсуляции. Они проявляли равномерную поверхность и поры (фиг. 3). Эти микросферы получали при выходе примерно 85%. В микросферы можно было включить от 40 до 60% общей массы белка, введенного в процесс микроинкапсуляции. Частицы проявляли белковую нагрузку от 1,6 до 2,4%. Размер микросфер был меньше, чем 25 мкм.
| Таблица 1Характеристика микросфер, содержащих EGF | ||
| Микросферы EGF | Микросферы EGF с F127 и NaCl | |
| Выход (%) | 83±2 | 83±3 |
| Эффективность инкапсуляции (%) | 54±3 | 48±4 |
| Белковая нагрузка (%) | 1,98±0,05 | 1,72±0,06 |
| Размер частиц (мкм) | 19±3 | 24±4 |
Включение эксципиентов значимо не изменяло характеристики микросфер, содержащих EGF.
Высвобождение in vitro инкапсулированного EGF
50 мг микросфер, нагруженных EGF, суспендировали в 1 мл приемной жидкости (0,001% Tween 80 и 0,1% азид натрия в PBS (солевом растворе с фосфатным буфером) при рН 7,2). Суспензию инкубировали при 37°С при осторожном перемешивании. Через определенные интервалы времени (0,25 (6 ч), 0,5 (12 ч), 1, 3, 7 и 14 дней), образцы центрифугировали в течение 5 мин при 5000 об/мин в настольной центрифуге Hettich (Tuttlingen, Germany), надосадочную жидкость собирали и добавляли равный объем свежей приемной жидкости. Концентрацию EGF в каждом взятом образце оценивали с помощью микроанализа ВСА.
Профиль высвобождения EGF, инкапсулированного в микросферы PGLA, проявлял «взрывное» высвобождение, которое происходило в течение первого дня, и другую стадию, на которой высвобождение EGF происходило непрерывно в течение следующих 14 дней. В течение первой стадии, приблизительно 20% всего инкапсулированного белка высвобождалось в обоих препаратах, в то время как в остальной период оценки профили высвобождения были другими: высвобождение EGF из микросфер с эксципиентами достигало почти 65% (при аппроксимированной скорости 28 мкг в день) и до 30% высвобождалось из частиц без эксципиентов (при аппроксимированной скорости 7 мкг в день) (фиг. 4).
Характеристики высвобождения EGF in vitro
Целью этого эксперимента была демонстрация того, что инкапсулированный EGF сохраняет свои физико-химические и биологические свойства. Оценивали свойства EGF, высвобождающегося в течение инкубационного периода (14 дней).
EGF, высвобождавшийся в течение первого дня, до 7 и 14 дней, характеризовали посредством нескольких аналитических методик: высокоэффективной хроматографии в обращенной фазе (RP-HPLC), электрофорезом в акриламидном геле с додецилсульфатом натрия (SDS-PAGE), ферментными иммуносорбентным анализом (ELISA) и биологической оценкой противовирусной активности in vitro. Результаты представлены в таблице 2.
| Таблица 2Физико-химические и биологические свойства EGF, высвобождающегося in vitro | ||||
| Анализ | Высвобождаемый EGF | Эталонd | ||
| 1 день | 7 дней | 14 дней | ||
| ELISA (%)а | 89 | 83 | 87 | 88 |
| SDS-PAGE (%)b | 98 | 100 | 99 | 100 |
| RP-HPLC (%)c | 95 | 94 | 94 | 95 |
| Удельная активность (МЕ/мг) | 7,0×105 | 7,1×105 | 6,8×105 | 7,2×105 |
| аПроцент EGF, который был иммунологически распознан, в отношении массы, которая была количественно определена микроанализом ВСА bПроцент, соответствующий основной полосе, выявленной при 6000 Да сПроцент, соответствующий основному виду dEGF, использованный для получения микросфер |
Эти результаты позволяют утверждать, что высвобождаемый EGF имеет физико-химические и биологические характеристики, аналогичные EGF, использованному для получения микросфер.
Влияние микроинкапсуляции на устойчивость EGF к действию протеаз
1 мг EGF получали независимо в трех различных условиях: (i) растворенный в 1 мл 4% гидрокарбоната натрия (NaHCO3), (ii) инкапсулированный в микросферах PLGA (2% массы) и суспендированный в 1 мл 4% NaHCO3 и (iii) смешанный с 50 мг пустых микросфер PLGA и суспендированный в 1 мл 4% NaHCO3. После этого к каждому препарату добавляли 100 мкл 200 мкг/мл трипсина в 4% NaHCO3, и их инкубировали при 37°С в течение 4 часов при осторожном перемешивании. 1 мл EGF, растворенного в 1,1 мл 4% NaHCO3, использовали в качестве контроля. Реакцию останавливали добавлением 10 мкл трифторуксусной кислоты. Образцы, содержащие микросферы, центрифугировали в течение 10 минут при 6000 g и супернатант отделяли от осадка после центрифугирования. EGF, микроинкапсулированный или адсорбированный на микросферах, отделяли от полимера экстракцией дихлорметаном/уксусной кислотой (Ruiz J. M., et al (1989) Microencapsulation peptide: a study of the phase separation of poly (D,L-lactic acid-co-glycolic acid) copolymers 50/50 by silicone oil. J. Pham. Sci. 49:69-77). Все образцы анализировали RP-HPLC в соответствии с процедурой, описанной Han et al. (Han K., et al. (1998) Site-specific degradation and transport of recombinant human epidermal growth factor (rhEGF) in the rat gastrointestinal mucosa. Int. J. Pharm. 168:189-197). Результаты (фиг. 5) показывают, что и не инкапсулированный EGF, и EGF, смешанный с пустыми микросферами, полностью разрушался. Однако инкапсулированный EGF был защищен от протеолиза, и его хроматографический профиль был аналогичен хроматографическому профилю контроля.
Пример 2. Эффект in vivo (на экспериментальной модели) инкапсулированного EGF в сравнении со свободным EGF
Экспериментальная модель регулируемых острых поражений
Описанный здесь эксперимент поставили с целью оценки заживляющего эффекта при острых поражениях с удовлетворительным прогнозом нового фармацевтического состава с микросферами EGF, подлежащими использованию для инфильтрации или парентерально, или посредством инъекций в края и дно ран.
Экспериментальная биологическая модель: Самцы крыс Wistar с массой тела 225-250 граммов. Животных содержали в регулируемых зонах вивария при CIGB при постоянной схеме освещения 12×12 часов, циклах смены воздуха и свободном доступе к рациону. Крыс отдельно помещали в ящики Т3 с заменой подстилки (предварительно стерилизованной) через каждые 48 часов.
Индукция язв: Животных наркотизировали внутрибрюшинной инъекцией кетамина/ксилазина. Проводили механическую и химическую депиляцию спины крыс, включающей область от позадилопаточного пространства до крестца. Эту область подвергали асептической обработке раствором повидона-йода и изопропилового спирта. Область по коже, выбранной для индукции язв, метили китайскими чернилами для создания круговых, поражений полной ширины с помощью биотомов диаметром 9 мм (AcuDrem, FI, USA).
Как указано на фиг. 1, у каждого животного индуцировали 6 симметричных, расположенных на одинаковом расстоянии, повреждений. Повреждения промывали стерильным солевым раствором и их внутреннюю границу очерчивали татуировочными чернилами для последующего расчета площади ран в нулевое время. Поражения у всех животных ежедневно подвергали гигиенической обработке 70% этанолом и стерильным солевым раствором перед применением какого-либо лечения.
Экспериментальные группы:
Язвы, созданные у животных, методом случайной выборки включали в следующие экспериментальные группы лечения, используя таблицу порядка включения/перекрестного подбора групп:
Группа I - без лечения. Это контроль для спонтанного развития процесса.
Группа II - плацебо (носитель, используемый для суспензии микросфер: 0,3% карбоксиметилцеллюлоза, 0,1% Tween 20 и 0,9% хлорид натрия, который инфильтрируется местно).
Группа III - инфильтрация микросфер (без эксципиентов), содержащих 675 мкг EGF, который был суспендирован в 1 мл носителя, предназначенного для этого состава. Инфильтрации выполняли в края и дно ран.
Группа IV - инфильтрация микросфер (с эксципиентами), содержащих 675 мкг EGF, который был суспендирован в 1 мл носителя, предназначенного для этого состава. Инфильтрации выполняли в края и дно ран.
Группа V - Свободный EGF (75 мг/мл) в 0,9% солевом растворе.
Каждая группа состояла из 10 крыс; поэтому исследовали 60 ран на группу. Лечение проводили ежедневно у животных, получавших лечение составами без микросфер, вводя иглу (271/-0 в края и дно поражений. Перед каждым лечением, седативный эффект у животных вызывали внутрибрюшинным введением диазепама. У животных, получавших лечение носителем или препаративными формами, содержащими микросферы, нагруженные EGF, проводили только одну инфильтрацию.
Определение уровня закрытия ран. Гистологическая обработка:
Повреждения прослеживали на прозрачных листах для расчета кинетики сокращения ран в течение следующих периодов времени: Время 0 - представляет 100% площади открытого поражения и 0% сокращения раны, Время 1 - 72 часа после индукции поражений. Время 2 - 5 дней после индукции повреждений, Время 3 - 7 дней после индукции повреждений, Время 4 - 9 дней после индукции повреждений. В соответствии с предшествующим опытом относительно кинетики спонтанного заживления этих поражений, девятый день был установлен как конец данного исследования, после чего животных умерщвляли. Изображения с границами поражений подвергали цифровой обработке. Площадь поражений и процент сокращения рассчитывали использованием программного обеспечения анализа изображений DIGIPAT. Статистический анализ каждого параметра выполняли пакетом SPSS использованием непараметрического критерия U Mann Whitney, принимали уровень значимости p<0,05.
Животных умерщвляли внутрибрюшинной инъекцией избыточной дозы пентобарбитала натрия (250 мг/кг). Поражения осушали от panniculus carnosus и фиксировали в 10% нейтральном формалине для последующей заливки в парафин. Использовали трихромные красители гематоксилин/эозин, van Giesson и Masson. Для каждой группы определяли количество животных со 100% эпителизацией поражения и со стратифицированным и дифференцированным эпидермисом.
Величины кинетики сокращения ран показаны в таблице 3 (величины сокращения в мм выражены в виде изменения в процентах размера ран относительно размера ран во время 0).
| Таблица 3Величины сокращения язв | |||||
| Кинетика сокращения регулируемых острых язв (%) | |||||
| Группа | Время 0 | Время 1 | Время 2 | Время 3 | Время 4 |
| Группа I | 0 | 6,1±2,1 | 9,3±2,2 | 37,6±3,3 | 56,7±3,8 |
| Группа II | 0 | 8,3±2,2 | 11,4±2,4 | 41,5±2,7 | 67,4±4,5 |
| Группа III | 0 | 11,4±3,3* | 22,5±3,8* | 69,8±4,8* | 86,8±3,5* |
| Группа IV | 0 | 9,9±1,1 | 12,8±1,4 | 52,4±3,1 | 69,6±4,9 |
| Группа V | 0 | 9,6±1,2 | 11,6±1,5 | 51,5±2,7 | 67,4±4,5 |
| (*) Обозначает статистически значимое отличие p<0,05 относительно других групп. Критерий U Mann Whitney. |
Неожиданно, препаративная форма, которая содержит микросферы EGF с более медленным профилем высвобождения (без совместно инкапсулированных эксципиентов), оказывала самый мощный эффект сокращения краев раны, что, другими словами, означает, что она оказывает самый благоприятный эффект при ускорении общего заживления. Сокращение представляет схождение несколько консолидированных явлений, которые приближают рану к фазе реконструкции.
В таблице 4 представлен процент площади, занятой зрелой и организованной грануляционной тканью язв в каждой экспериментальной группе. Расчеты проводили по взятым образцам во Время 4, количественно определяя число положительных микроскопических полей, одновременно трихромными реакциями van Giesson и Masson в каждом образце. Два патологоанатома проводили оценки независимо и слепым методом.
| Таблица 4Процент гранулированной площади во Время 4 для каждой экспериментальной группы. Посредством положительных реакций на коллагеновые волокна было исследовано 60 ран на экспериментальную группу | |
| Площадь, покрытая зрелой грануляционной тканью (%) | |
| Группа I | 48,7±5,7 |
| Группа II | 62,4±3,9 |
| Группа III | 84,5±4,3 |
| Группа IV | 64,7±2,7 |
| Группа V | 61,3±2,6 |
Неожиданно, препаративная форма, которая содержит микросферы EGF с более медленным профилем высвобождения (без совместно инкапсулированных эксципиентов), оказывала самый мощный эффект на процесс генерирования и созревания грануляционной ткани, что соответствует указанному выше описанию для процесса сокращения ран.
Эффект различных видов лечения также был изучен в отношении процесса эпителизации поражений. Микроскопический аспект эпителия оценивали, учитывая повторную эпителизацию язв, присутствие стратифицированного эпителия и существование общего кератинового слоя. Для микроскопического исследования производили центральное продольное рассечение пополам участков поражения, и полученные кусочки заливали в такой же парафиновый блок. Всего по экспериментальной группе исследовали 120 гистологических срезов, которые представляли 60 поражений. Результаты представлены в таблице 5.
| Таблица 5Эффект различных видов лечения на эпителизацию ран | ||
| Количество ран со 100% эпителизацией | Количество ран со зрелым эпителием | |
| Группа I | 32 | 28 |
| Группа II | 56 | 45 |
| Группа III | 81* | 73* |
| Группа IV | 64 | 56 |
| Группа V | 60 | 51 |
| (*) Обозначает статистически значимое отличие p<0,05 относительно других групп. Критерий U Mann Whitney. |
К удивлению, в группе III, получавшей лечение составом на основе микросфер EGF с профилем медленного высвобождения (без инкапсулированных эксципиентов), проявились наилучшие показатели эпителиальной реакции, подтвержденные общей повторной эпителизацией и зрелостью эпителия.
Экспериментальная модель хронических кожных язв
Целью следующего эксперимента была оценка заживляющего эффекта новой фармацевтической препаративной формы, которая основана на микросферах, содержащих EGF, предназначенной для инфильтрационного использования, при хронических поражениях с неблагоприятным прогнозом, которые имитируют поражения у больных диабетом.
Экспериментальная биологическая модель: Самцы крыс Wistar с массой тела 225-250 граммов. Животных содержали в регулируемых зонах вивария при CIGB при постоянной схеме освещения 12×12 часов, циклах смены воздуха и свободном доступе к рациону. Крыс отдельно помещали в ящики Т3 с заменой подстилки (предварительно стерилизованной) через каждые 48 часов. Животных предварительно лечили в течение двух месяцев 0,01% раствором метилглиоксала для создания среды гликозилирования, аналогичной среде, встречающейся у больного с длительно развивающимся диабетом. Среди других органических поражений это ведет к замедлению грануляции и реконструкции ран (Berlanga J., Cibrian D., et al. (2005) Methylglyoxal administration induces diabetes-like microvascular changes and perturbs the healing process of cutaneous wounds. Clin. Sci. (Lond) 109(1):83-95).
Индукция язв: Животных наркотизировали внутрибрюшинной инъекцией кетамина/ксилазина. Проводили механическую и химическую депиляцию спины крыс, включающей область от позадилопаточного пространства до крестца. Эту область подвергали асептической обработке раствором повидона-йода и изопропилового спирта. Область по коже, выбранной для индукции язв, метили китайскими чернилами для создания круговых поражений полной ширины с помощью биотомов диаметром 9 мм (AcuDrem, FI, USA). У каждого животного индуцировали 6 симметричных, расположенных на одинаковом расстоянии, повреждений. Повреждения промывали стерильным солевым раствором и их внутреннюю границу очерчивали татуировочными чернилами для последующего расчета площади ран в нулевое время. Поражения у всех животных ежедневно подвергали гигиенической обработке 70% этанолом и стерильным солевым раствором перед применением какого-либо лечения.
Экспериментальные группы:
Язвы, созданные у животных, методом случайной выборки включали в следующие экспериментальные группы лечения, используя таблицу порядка включения/перекрестного подбора групп:
Группа I - без лечения. Это контроль для спонтанного развития процесса.
Группа II - плацебо (носитель, используемый для суспендирования микросфер: 0,3% карбоксиметилцеллюлоза, 0,1% Tween 20 и 0,9% хлорид натрия, который инфильтрируется местно).
Группа III - инфильтрация микросфер (без эксципиентов), содержащих 1 мг EGF, который был суспендирован в 1 мл носителя, предназначенного для этого состава. Инфильтрации выполняли в края и дно ран.
Группа IV - инфильтрация микросфер (с эксципиентами), содержащих 1 мг EGF, который был суспендирован в 1 мл носителя, предназначенного для этого состава. Инфильтрации выполняли в края и дно ран.
Группа V - Свободный EGF (75 мг/мл) в 0,9% солевом растворе.
Каждая группа состояла из 10 крыс; поэтому исследовали 60 ран на группу. Лечение проводили ежедневно у животных, получавших лечение составами без микросфер. Перед каждым лечением седативный эффект у животных вызывали внутрибрюшинным введением диазепама. У животных, получавших лечение носителем или препаративными формами, содержащими микросферы, нагруженные EGF, проводили только одну инфильтрацию.
Определение уровня закрытия ран. Гистологическая обработка:
Повреждения прослеживали на прозрачных листах для расчета кинетики сокращения ран в течение следующих периодов времени: Время 0 - представляет 100% площади открытого поражения и 0% сокращения раны, Время 1 - 72 часа после индукции поражений. Время 2 - 5 дней после индукции повреждений, Время 3 - 7 дней после индукции повреждений, Время 4 - 9 дней после индукции повреждений и Время 5 - 14 дней после индукции поражений. Четырнадцатый день был установлен как конец данного исследования, после чего животных умерщвляли, в соответствии с предыдущими исследованиями кинетики спонтанного заживления этих поражений. Изображения с границами поражений подвергали цифровой обработке. Площадь поражений и процент сокращения рассчитывали использованием программного обеспечения анализа изображений DIGIPAT. Статистический анализ каждого параметра выполняли пакетом SPSS использованием непараметрического критерия U Mann Whitney, принимали уровень значимости p<0,05.
Животных умерщвляли внутрибрюшинной инъекцией избыточной дозы пентобарбитала натрия (250 мг/кг). Поражения осушали от panniculus carnosus и фиксировали в 10% нейтральном формалине для последующей заливки в парафин. Использовали трихромные красители гематоксилин/эозин, van Giesson и Masson. Для каждой группы определяли количество животных со 100% эпителизацией поражения и со стратифицированным и дифференцированным эпидермисом.
Величины кинетики сокращения ран показаны в таблице 6.
| Таблица 6Величины кинетики сокращения язв в течение периода оценки | |||||
| Кинетика сокращения хронических язв (%) | |||||
| Группа | Время 1 | Время 2 | Время 3 | Время 4 | Время 5 |
| Группа I | 3,18±1,1 | 5,31±1,15 | 15,8±1,37 | 21,8±1,54 | 40,82±4,41 |
| Группа II | 4,14±2,2 | 7,63±1,12 | 17,3±1,81 | 23,81±1,53 | 39,75±3,63 |
| Группа III | 6,55±1,14* | 25,33±4,1** | 35±3,51** | 43,15±3,66** | 67,2±3,44** |
| Группа IV | 6,25±1,5 | 17,3±1,51 | 19,7±2,1 | 29,9±2,85 | 48,16±3,14 |
| Группа V | 6,67±1,8 | 15,4±1,63 | 16,8±3,8 | 28,1±3,31 | 45,72±3,55 |
| (*) Обозначает статистически значимое отличие p<0,05 относительно других групп. (**) Обозначает статистически значимое отличие p<0,01 относительно других групп. Критерий U Mann Whitney. |
Величины сокращения в мм выражены в виде изменения в процентах размера ран относительно размера ран во Время 0.
Неожиданно, препаративная форма, которая содержит микросферы EGF с более медленным профилем высвобождения (без совместно инкапсулированных эксципиентов), оказывала самый мощный эффект сокращения краев раны, что, другими словами, означает, что она ок