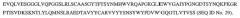Композиции антител
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Предложен состав буфера фармацевтической композиции, содержащей пертузумаб. Буфер на основе гистидин-ацетата, имеющий уровень рН от 5,5 до 6,5, обеспечивает снижение дезаминирования и агрегации пертузумаба в процессе длительного хранения. 4 н. и 40 з.п. ф-лы, 9 табл, 33 ил.
Реферат
В настоящей, не являющейся предварительной, заявке, поданной согласно подпункту 1.53(b) пункта 37 Свода федеральных правил, испрашивается приоритет по предварительной заявке 60/620413, поданной 20 октября, 2004, содержание которых включены в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композициям антител, в том числе к моноклональным антителам, составленным в гистидин-ацетатном буфере, а также к композиции, которая содержит антитело, связывающееся с доменом II HER2 (например, пертузумаб), и к композиции, которая содержит антитело, связывающееся с DR5 (например, апомаб).
УРОВЕНЬ ТЕХНИКИ
В последние десять лет успехи в биотехнологии позволили с использованием способов рекомбинантной ДНК получать множество белков для фармацевтического применения. Поскольку белки являются более крупными и более сложными, чем обычные органические и неорганические лекарственные средства (т.е. обладают многочисленными функциональными группами, в дополнение к сложным трехмерным структурам), то композиция из таких белков создает определенные проблемы. Для того чтобы белок оставался биологически активным, композиция должна сохранять неповрежденной конформационную целостность по меньшей мере каркасной последовательности аминокислот белка, в то же время защищая от разрушения многочисленные функциональные группы белка. Пути разрушения белков могут включать в себя нарушение химической стабильности (т.е. любой процесс, включающий в себя модификацию белка посредством образования связи или расщепления, который приводит к новой химической структуре) или нарушение физической стабильности (т.е. изменения белковой структуры более высокого порядка). Нарушение химической стабильности может происходить в результате дезамидирования, рацемизации, гидролиза, окисления, бета-элиминирования или дисульфидного обмена. Нарушение физической стабильности может происходить, например, в результате денатурации, агрегации, осаждения или поглощения. Три наиболее распространенных пути разрушения белков представляют собой агрегацию, дезамидирование и окисление белков. Cleland et al. Critical Reviews in Therapeutic Drug Carrier Systems 10(4): 307-377 (1993).
КОМПОЗИЦИИ АНТИТЕЛ
В используемые для фармацевтического применения белки включены антитела. Примером эффективного для лечения антитела является антитело, которое связывается с антигеном HER2, такое как пертузумаб.
В патенте США №6339142 описана композиция антитела против HER2, содержащая смесь антитела против HER2 и одного или нескольких его кислых вариантов, где количество кислого варианта(ов) составляет приблизительно менее чем 25%. Примером антитела против HER2 является трастузумаб.
В патентах США №№6267958 и 6685940 (Andya et al.) описаны лиофилизированные композиции антител, в том числе композиции антител против HER2 и IgE. В WO 97/04807 и патенте США 2004/0197326A1 (Fick et al.) описаны способы лечения аллергической астмы с использованием антитела против IgE. WO 99/01556 (Lowman et al.) относится к антителу против IgE с подверженными изомеризации аспартиловыми остатками и к его улучшенным вариантам. В патенте США 2002/0045571 (Liu et al.) представлены концентрированные композиции белка со сниженной вязкостью, примерами которых являются композиции гуманизированного антитела против IgE, rhuMAb E25 и E26. В WO 02/096457 и патенте США 2004/0170623 (Arvinte et al.) описаны стабильные жидкие композиции, содержащие антитело E25 против IgE. См. также патент США 2004/0197324 A1 (Liu и Shire), относящийся к высококонцентрированной композиции антитела против IgE.
В патенте США №6171586 (Lam et al.) описаны стабильные водные композиции антител. F(ab')2 антитела rhuMAb против CD18 составляли в буферах из ацетата натрия и гистидин-HCl. Предпочтительная композиция для rhuMAb против CD18 представляла собой 10 мМ ацетат натрия, 8% трегалозу, 0,01% TWEEN 20TM, pH 5,0. Ацетатные (pH 5,0) композиции rhuMAb против CD20, сохраняемые в течение одного месяца при 40°C, проявляли более высокую стабильность, чем те образцы, которые составляли в гистидине (pH 5,0 или 6,0).
Патент США 2003/0190316 (Kakuta et al.) относится к композиции антитела hPM-1, гуманизированного антитела против рецептора для IL-6. Потеря мономера была наибольшей в цитрате натрия (pH 6,7), за которым в нисходящем порядке следовали фосфат натрия (рН 6,8), Tris-HCl (pH 7,2), гистидин-HCl (pH 7,2) и глицин (pH 7,6). Оценивали эффект фосфата Na (pH 6,5), фосфат-гистидина (pH 6,0 или 6,5), гистидин-HCl (pH 6,5) и фосфата Na (pH 6,0) на стабильность hPM-1.
В WO 2004/071439 (Burke et al.) указано, что в композиции натализумаба (гуманизированного моноклонального антитела против альфа4-интегрина) возникали примеси вследствие разрушения полисорбата-80, вероятно, в результате реакции окисления, включающей ионы металлов и гистидин. Таким образом, был выбран фосфатный буфер.
WO 2000/066160 (эквивалент на английском языке EP 1 174 148 A1) (Okada et al.) относится к композиции гуманизированного антитела C4G1, которое связывается с рецептором для фибриногена, являющимся мембранным гликопротеином тромбоцитов человека GPIIb/IIIa, в буфере из фосфата натрия или цитрата натрия.
WO 2004/019861 (Johnson et al.) относится к CDP870, пегилированному фрагменту Fab против TNFα, составляемому в виде 200 мг/мл в 50 мМ ацетате натрия (pH 5,5) и 125 мМ хлориде натрия.
WO 2004/004639 (Nesta, P.) относится к композиции для huC242-DM1, активируемого опухолью иммунотоксина, в буфере из 50 мМ янтарной кислоты (pH 6,0) и сахарозе (5% масс./об.).
В WO 03/039485 (Kaisheva et al.) открыто, что даклизумаб (гуманизированное антитело против рецептора для IL-2) обладает наибольшей стабильностью в буфере из сукцината натрия при pH 6,0 и быстро теряет эффективность в гистидине по мере окисления буфера.
WO 2004/001007 относится к моноклональному антителу против CD80 в буфере из гистидин-HCl, ацетата натрия или цитрата натрия.
Патент США №6252055 (Relton, J.) относится к антителам против CD4 и против CD23, составляемым в буферах из малеата, сукцината, ацетата натрия или фосфата, где в качестве предпочтительного буфера указан фосфат.
Патент США №5608038 (Eibl et al.) относится к высококонцентрированным поликлональным композициям иммуноглобулина, содержащим иммуноглобулин, глюкозу или сахарозу и хлорид натрия.
WO 03/015894 (Oliver et al.) относится к водной композиции 100 мг/мл SYNAGIS®, 25 мМ гистидин-HCl, 1,6 мМ глицина, pH 6,0, и к лиофилизированному SYNAGIS®, который при получении композиции (перед лиофилизацией) содержит 25 мМ гистидин, 1,6 мМ глицин и 3% масс./об. маннит при pH 6,0.
В патенте США 2004/0191243 A1 (Chen et al.) указана композиция ABX-IL8, антитела IgG2 человека.
Патент США 2003/0113316 A1 (Kaisheva et al.) относится к лиофилизированной композиции антитела против рецептора для IL2.
АНТИТЕЛА ПРОТИВ HER2
Тирозинкиназы рецепторов семейства HER являются важными медиаторами роста, дифференцировки и выживания клеток. Семейство рецепторов включает в себя четыре различных члена, в том числе рецептор эпидермального фактора роста (EGFR, ErbB1 или HER1), HER2 (ErbB2 или p185neu), HER3 (ErbB3) и HER4 (ErbB4 или tyro2).
EGFR, кодируемый геном erbB1, обусловливает развитие злокачественных опухолей человека. В частности, повышенную экспрессию EGFR наблюдали при раке молочной железы, мочевого пузыря, легких, головного мозга, шеи и желудка, а также при глиобластомах. Повышенная экспрессия рецептора для EGFR часто связана с повышенной продукцией теми же опухолевыми клетками лиганда EGFR, трансформирующего фактора роста альфа (TGF-α), что приводит к активации рецептора посредством каскада реакций аутокринной стимуляции. Baselga и Mendelsohn Pharmac. Ther. 64:127-154 (1994). В качестве терапевтических средств в лечении таких злокачественных опухолей оценивали моноклональные антитела против EGFR или его лигандов, TGF-α и EGF. См., например, Baselga и Mendelsohn., выше; Masui et al. Cancer Research 44:1002-1007 (1984); и Wu et al. J. Clin. Invest. 95:1897-1905 (1995).
Второй член семейства HER, p185neu, исходно был выявлен как продукт трансформирующего гена из нейробластом химически обрабатываемых крыс. Активированная форма протоонкогена neu возникает в результате точковой мутации (валин на глутаминовую кислоту) в трансмембранной области кодируемого белка. Амплификацию гомолога neu у человека наблюдают при раке молочной железы и яичника, и она связана с неблагоприятным прогнозом (Slamon et al., Science, 235:177-182 (1987); Slamon et al., Science, 244:707-712 (1989); и патент США №4968603). К настоящему времени для опухолей человека не указана точковая мутация, аналогичная мутации в протоонкогене neu. Также сверхэкспрессию HER2 (часто, но не всегда, обусловленную амплификацией гена) наблюдали и при других карциномах, в том числе карциномах желудка, эндометрия, слюнных желез, легких, почек, толстой кишки, щитовидной железы, поджелудочной железы и мочевого пузыря. См., в числе прочих, King et al., Science, 229:974 (1985); Yokota et al., Lancet: 1:765-767 (1986); Fukushige et al., Mol Cell Biol, 6:955-958 (1986); Guerin et al., Oncogene Res., 3:21-31 (1988); Cohen et al., Oncogene, 4:81-88 (1989); Yonemura et al., Cancer Res., 51:1034 (1991); Borst et al., Gynecol. Oncol, 38:364 (1990); Weiner et al., Cancer Res., 50:421-425 (1990); Kern et al., Cancer Res., 50:5184 (1990); Park et al., Cancer Res., 49:6605 (1989); Zhau et al., Mol Carcinog., 3:254-257 (1990); Aasland et al. Br. J. Cancer 57:358-363 (1988); Williams et al. Pathobiology 59:46-52 (1991); и McCann et al., Cancer, 65:88-92 (1990). HER2 может сверхэкспрессироваться при раке предстательной железы (Gu et al. Cancer Lett. 99:185-9 (1996); Ross et al. Hum. Pathol. 28:827-33 (1997); Ross et al. Cancer 79:2162-70 (1997); и Sadasivan et al. J. Urol. 150:126-31 (1993)).
Описаны антитела против белковых продуктов p185neu крысы и HER2 человека. Drebin и коллеги получили антитела против продукта гена neu крысы, p185neu. См., например, Drebin et al., Cell 41:695-706 (1985); Myers et al., Meth. Enzym. 198:277-290 (1991); и WO 94/22478. В Drebin et al. Oncogene 2:273-277 (1988) описано, что смеси антител, взаимодействующих с двумя различными областями p185neu, приводят к синергичным противоопухолевым эффектам в отношении трансформированных neu клеток NIH-3T3, которые имплантировали голым мышам. См. также патент США №5824311, опубликованный 20 октября, 1998.
В Hudziak et al., Mol Cell. Biol. 9(3): 1165-1172 (1989) описано получение набора антител против HER2, которые характеризовали с использованием линии клеток рака молочной железы человека SK-BR-3. Относительную клеточную пролиферацию клеток SK-BR-3 после воздействия антител определяли посредством окрашивания монослоев кристаллическим фиолетовым через 72 часа. При использовании этого анализа максимального ингибирования достигали с помощью антитела, обозначаемого 4D5, которое ингибировало клеточную пролиферацию на 56%. Другие антитела из набора снижали клеточную пролиферацию в этом анализе в меньшей степени. Кроме того, было открыто, что антитело 4D5 повышает чувствительность линий клеток рака молочной железы, сверхэкспрессирующих HER2, в отношении цитотоксических эффектов TNF-α. См. также патент США №5677171, опубликованный 14 октября 1997. Описанные в Hudziak et al. антитела против HER2 дополнительно охарактеризованы в Fendly et al. Cancer Research 50:1550-1558 (1990); Kotts et al. In Vitro 26(3):59A (1990); Sarup et al. Growth Regulation 1:72-82 (1991); Shepard et al. J. Clin. Immunol. 11(3):117-127 (1991); Kumar et al. Mol. Cell. Biol 11(2):979-986 (1991); Lewis et al. Cancer Immunol Immunother. 37:255-263 (1993); Pietras et al. Oncogene 9:1829-1838 (1994); Vitetta et al. Cancer Research 54:5301-5309 (1994); Sliwkowski et al. J. Biol. Chem. 269(20): 14661-14665 (1994); Scott et al. J. Biol. Chem. 266:14300-5 (1991); D'souza et al. Proc. Natl. Acad. Sci91:7202-7206 (1994); Lewis et al. Cancer Research 56:1457-1465 (1996); и Schaefer et al. Oncogene 15:1385-1394 (1997).
Рекомбинантный гуманизированный вариант мышиного антитела 4D5 против HER2 (huMAb4D5-8, rhuMAb против HER2, трастузумаб или HERCEPTIN®; патент США №5821337) клинически активен у пациентов с вариантами метастазирующего рака молочной железы со сверхэкспрессией HER2, где пациентам перед этим проводили обширное противоопухолевое лечение (Baselga et al., J. Clin. Oncol. 14:737-744 (1996)). Управление по контролю за пищевыми продуктами и лекарственными средствами 25 сентября, 1998 выдало разрешение на продажу трастузумаба для лечения пациентов с метастазирующим раком молочной железы, у которых опухоли сверхэкспрессируют белок HER2.
Другие антитела против HER2 с различными свойствами были описаны в Tagliabue et al. Int. J. Cancer 47:933-937 (1991); McKenzie et al. Oncogene 4:543-548 (1989); Maier et al. Cancer Res. 51:5361-5369 (1991); Bacus et al. Molecular Carcinogenesis 3:350-362 (1990); Stancovski et al. PNAS (USA) 88:8691-8695 (1991); Bacus et al. Cancer Research 52:2580-2589 (1992); Xu et al. Int. J. Cancer 53:401-408 (1993); WO94/00136; Kasprzyk et al. Cancer Research 52:2771-2776 (1992); Hancock et al. Cancer Res. 51:4575-4580 (1991); Shawver et al. Cancer Res. 54:1367-1373 (1994); Arteaga et al. Cancer Res. 54:3758-3765 (1994); Harwerth et al. J. Biol. Chem. 267:15160-15167 (1992); патент США №5783186; и Klapper et al. Oncogene 14:2099-2109 (1997).
В результате скрининга на предмет гомологии были выявлены два других члена семейства рецептора HER; HER3 (патенты США №№5183884 и 5480968, а также Kraus et al. PNAS (USA) 86:9193-9197 (1989)), и HER4 (патентная заявка EP №599274; Plowman et al., Proc. Natl. Acad. Sci. USA, 90:1746-1750 (1993); и Plowman et al., Nature, 366:473-475 (1993)). Для обоих этих рецепторов наблюдают повышенную экспрессию по меньшей мере в некоторых линиях клеток рака молочной железы.
Как правило, в клетках рецепторы HER выявляют в различных сочетаниях, а гетеродимеризация, как предполагают, повышает разнообразие клеточных реакций на различные лиганды HER (Earp et al. Breast Cancer Research and Treatment 35:115-132 (1995)). EGFR связывается шестью различными лигандами; эпидермальным фактором роста (EGF), трансформирующим фактором роста альфа (TGF-α), амфирегулином, связывающим гепарин эпидермальным фактором роста (HB-EGF), бетацеллюлином и эпирегулином (Groenen et al. Growth Factors 11:235-257 (1994)). Семейство белков херегулинов, возникающих в результате альтернативного сплайсинга одного гена, представляет собой лиганды для HER3 и HER4. Семейство херегулинов включает альфа-, бета- и гамма-херегулины (Holmes et al., Science, 256:1205-1210 (1992); патент США №5641869; и Schaefer et al. Oncogene 15:1385-1394 (1997)); факторы дифференцировки neu (NDF), глиальные факторы роста (GGF); вещество, индуцирующее активность ацетилхолинового рецептора (ARIA); а также фактор, происходящий из чувствительных и двигательных нейронов (SMDF). В качестве обзора см. Groenen et al. Growth Factors 11:235-257 (1994); Lemke, G. Molec. & Cell. Neurosci. 7:247-262 (1996) и Lee et al. Pharm. Rev. 47:51-85 (1995). В последнее время были выявлены три дополнительных лиганда HER; нейрегулин-2 (NRG-2), для которого описано связывание с HER3 или HER4 (Chang et al. Nature 387 509-512 (1997); и Carraway et al. Nature 387:512-516 (1997)); нейрегулин-3, связывающий HER4 (Zhang et al. PNAS (USA) 94(18):9562-7 (1997)); и нейрегулин-4, связывающий HER4 (Harari et al. Oncogene 18:2681-89 (1999)). Также с HER4 связываются HB-EGF, бетацеллюлин и эпирегулин.
Хотя EGF и TGFα не связывают HER2, EGF стимулирует EGFR и HER2 к образованию гетеродимера, активирующего EGFR и приводящего к трансфосфорилированию HER2 в гетеродимере. Вероятно, димеризация и/или трансфосфорилирование активирует тирозинкиназу HER2. См. Earp et al., выше. Сходным образом, когда HER3 совместно экспрессируется с HER2, формируется активный сигнальный комплекс, а антитела против HER2 способны разрушать этот комплекс (Sliwkowski et al., J. Biol. Chem., 269(20):14661-14665 (1994)). Кроме того, при совместной экспрессии с HER2 сродство HER3 к херегулину (HRG) повышается. В отношении белкового комплекса HER2-HER3 см. также Levi et al., Journal of Neuroscience 15:1329-1340 (1995); Morrissey et al., Proc. Natl. Acad. Sci USA 92:1431-1435 (1995); и Lewis et al., Cancer Res., 56:1457-1465 (1996). HER4, сходно с HER3, формирует активный сигнальный комплекс с HER2 (Carraway and Cantley, Cell 78:5-8 (1994)).
Для того чтобы направить воздействие на путь передачи сигнала HER, было получено rhuMAb 2C4 (пертузумаб, OMNITARGTM) в качестве гуманизированного антитела, которое ингибирует димеризацию HER2 с другими рецепторами HER, ингибируя тем самым управляемые лигандом фосфорилирование и активацию, а также активацию путей RAS и AKT в нисходящем направлении. На стадии I исследования пертузумаба как отдельного средства для лечения солидных опухолей 3 индивидуумам с прогрессирующим раком яичника проводили лечение пертузумабом. У одного индивидуума наблюдали продолжительную частичную реакцию, а еще у одного индивидуума наблюдали стабильное состояние заболевания в течение 15 недель Agus et al. Proc Am Soc Clin Oncol 22:192, Abstract 771 (2003).
АНТИТЕЛА ПРОТИВ DR5
В данной области были выявлены различные лиганды и рецепторы, относящиеся к суперсемейству фактора некроза опухоли (TNF). В число таких лигандов входят фактор некроза опухоли альфа, ("TNF-альфа"), фактор некроза опухоли бета ("TNF-бета" или "лимфотоксин-альфа"), лимфотоксин-бета ("LT-бета"), лиганд CD30, лиганд CD27, лиганд CD40, лиганд OX-40, лиганд 4-1BB, LIGHT, лиганд Apo-1 (также обозначаемый как лиганд Fas или лиганд CD95), лиганд Apo-2 (также обозначаемый как Apo2L или TRAIL), лиганд Apo-3 (также обозначаемый как TWEAK), APRIL, лиганд OPG (также обозначаемый как лиганд RANK, ODF или TRANCE) и TALL-1 (также обозначаемый как BlyS, BAFF или THANK). (См., например, Ashkenazi, Nature Review, 2:420-430 (2002); Ashkenazi and Dixit, Science, 281:1305-1308 (1998); Ashkenazi and Dixit, Curr. Opin. Cell Biol, 11:255-260 (2000); Golstein, Curr. Biol, 7:750-753 (1997) Wallach, Cytokine Reference, Academic Press, 2000, стр. 377-411; Locksley et al., Cell, 104:487-501 (2001); Gruss and Dower, Blood, 85:3378-3404 (1995); Schmid et al., Proc. Natl. Acad. Sci., 83:1881 (1986); Dealtry et al., Eur. J. Immunol, 17:689 (1987); Pitti et al., J. Biol. Chem., 271:12687-12690 (1996); Wiley et al., Immunity, 3:673-682 (1995); Browning et al., Cell, 72:847-856 (1993); Armitage et al. Nature, 357:80-82 (1992), WO 97/01633, опубликованный 16 января, 1997; WO 97/25428, опубликованный 17 июля, 1997; Marsters et al., Curr. Biol., 8:525-528 (1998); Chicheportiche et al., Biol Chem., 272:32401-32410 (1997); Hahne et al., J. Exp. Med., 188:1185-1190 (1998); WO 98/28426, опубликованный 2 июля, 1998; WO 98/46751, опубликованный 22 октября, 1998; WO/98/18921, опубликованный 7 мая, 1998; Moore et al., Science, 285:260-263 (1999); Shu et al., J. Leukocyte Biol., 65:680 (1999); Schneider et al., J. Exp. Med., 189:1747-1756 (1999); Mukhopadhyay et al., J. Biol. Chem., 274:15978-15981 (1999)).
Как правило, индукция различных клеточных реакций, опосредуемая такими лигандами семейства TNF, вызывается их связыванием со специфическими клеточными рецепторами. Некоторые, но не все, лиганды семейства TNF связываются с и индуцируют различную биологическую активность посредством "рецепторов смерти" на поверхности клетки, активируя каспазы или ферменты, приводящие к гибели клетки или осуществляющие каскад реакций апоптоза (Salvesen et al., Cell, 91:443-446 (1997)). В число выявленных к настоящему времени членов суперсемейства рецепторов TNF входят TNFR1, TNFR2, TACI, GITR, CD27, OX-40, CD30, CD40, HVEM, Fas (также обозначаемый как Apo-1 или CD95), DR4 (также обозначаемый как TRAIL-R1), DR5 (также обозначаемый как Apo-2 или TRAIL-R2), DcR1, DcR2, остеопротегерин (OPG), RANK и Apo-3 (также обозначаемый как DR3 или TRAMP).
Большинство этих членов семейства рецепторов TNF обладает обычной структурой рецепторов клеточной поверхности, включая внеклеточную, трансмембранную и внутриклеточную области, тогда как у других рецепторов, встречающихся в природе в виде растворимых белков, отсутствуют трансмембранный и внутриклеточный домены. Внеклеточный участок обычных TNFR содержит набор повторяющихся аминокислотных последовательностей из множества богатых цистеином доменов (CRD), начиная с NH2-конца.
Несколько лет назад в качестве члена семейства цитокинов TNF был выявлен лиганд, обозначаемый как Apo-2L или TRAIL (см., например, Wiley et al., Immunity, 3:673-682 (1995); Pitti et al., J. Biol. Chem., 271:12697-12690 (1996); WO 97/01633; WO 97/25428; патент США №5763223, опубликованный 9 июня 1998; патент США №6284236, опубликованный 4 сентября 2001). Полноразмерная природная последовательность полипептида Apo2L/TRAIL человека представляет собой трансмембранный белок II типа, длиной 281 аминокислота. Некоторые клетки способны продуцировать природную растворимую форму полипептида посредством ферментного расщепления внеклеточной области полипептида (Mariani et al., J. Cell. Biol., 137:221-229 (1997)). В результате кристаллографических исследований растворимых форм Apo2L/TRAIL выявлена гомотримерная структура, сходная со структурами TNF и других родственных белков (Hymowitz et al., Molec. Cell, 4:563-571 (1999); Cha et al., Immunity, 11:253-261 (1999); Mongkolsapaya et al., Nature Structural Biology, 6:1048 (1999); Hymowitz et al., Biochemistry, 39:633-644 (2000)). Однако было открыто, что в отличие от других членов семейства TNF, Apo2L/TRAIL обладает уникальным структурным свойством в том отношении, что три остатка цистеина (в положении 230 каждой субъединицы в гомотримере) вместе координируют атом цинка, и что связывание цинка важно для устойчивости и биологической активности тримера. (Hymowitz et al., выше; Bodmer et al., J. Biol. Chem., 275:20632-20637 (2000)).
В литературе было описано, что Apo2L/TRAIL может играть роль в регуляции иммунной системы, в том числе при аутоиммунных заболеваниях, таких как ревматоидный артрит (см., например, Thomas et al., J. Immunol, 161:2195-2200 (1998); Johnsen et al., Cytokine, 11:664-672 (1999); Griffith et al., J. Exp. Med., 189:1343-1353 (1999); Song et al., J. Exp. Med., 191:1095-1103 (2000)).
Также было описано, что растворимые формы Apo2L/TRAIL индуцируют апоптоз у множества раковых клеток, включая опухоли толстой кишки, легких, молочной железы, предстательной железы, мочевого пузыря, почек, яичников и головного мозга, а также меланому, лейкоз и множественную миелому (см., например, Wiley et al., выше; Pitti et al, выше; патент США №6030945, опубликованный 29 февраля 2000; патент США №6746668, опубликованный 8 июня 2004; Rieger et al., FEBS Letters, 427:124-128 (1998); Ashkenazi et al., J. Clin. Invest., 104:155-162 (1999); Walczak et al., Nature Med., 5:157-163 (1999); Keane et al., Cancer Research, 59:734-741 (1999); Mizutani et al., Clin. Cancer Res., 5:2605-2612 (1999); Gazitt, Leukemia, 13:1817-1824 (1999); Yu et al., Cancer Res., 60:2384-2389 (2000); Chinnaiyan et al., Proc. Natl. Acad. Sci., 97:1754-1759 (2000)). Исследования на моделях опухолей на мышах in vivo позволили предположить, что Apo2L/TRAIL, отдельно или в сочетании с химиотерапией или лучевой терапией, может оказывать значительные противоопухолевые эффекты (см., например, Ashkenazi et al., выше; Walzcak et al., выше; Gliniak et al., Cancer Res., 59:6153-6158 (1999); Chinnaiyan et al., выше; Roth et al., Biochem. Biophys. Res. Comm., 265:1999 (1999); заявка PCT США/00/15512; заявка PCT США/01/23691). В отличие от многих типов раковых клеток, у большинства обычных типов клеток человека наблюдают устойчивость к индукции апоптоза определенными рекомбинантными формами Apo2L/TRAIL (Ashkenazi et al., выше; Walzcak et al, выше). Jo et al. описывали, что меченная полигистидином растворимая форма Apo2L/TRAIL индуцировала апоптоз in vitro в обычных выделенных гепатоцитах человека, в отличие от не-человеческих гепатоцитов (Jo et al., Nature Med., 6:564-567 (2000); см. также Nagata, Nature Med., 6:502-503 (2000)). Полагают, что определенные композиции рекомбинантного Apo2L/TRAIL могут различаться в аспекте биохимических свойств и биологической активности в отношении патологических клеток в сравнении с нормальными, что зависит, например, от наличия или отсутствия молекулы-метки, содержания цинка и % содержания тримера (см., Lawrence et al., Nature Med., Letter to the Editor, 7:383-385 (2001); Qin et al., Nature Med., Letter to the Editor, 7:385-386 (2001)).
Было открыто, что Apo2L/TRAIL связывает по меньшей мере пять различных рецепторов. По меньшей мере два из рецепторов, связывающихся с Apo2L/TRAIL, содержат функциональный цитоплазматический домен смерти. Один такой рецептор был обозначен как "DR4" (и альтернативно как TR4 или TRAIL-R1) (Pan et al., Science, 276:111-113 (1997); см. также WO 98/32856, опубликованный 30 июля, 1998; WO 99/37684, опубликованный 29 июля, 1999; WO 00/73349, опубликованный 7 декабря, 2000; патент США №6433147, опубликованный 13 августа, 2002; патент США №6461823, опубликованный 8 октября, 2002 и патент США №6342383, опубликованный 29 января, 2002).
Другой такой рецептор для Apo2L/TRAIL был обозначен как DR5 (также он был альтернативно обозначен как Apo-2; TRAIL-R или TRAIL-R2, TR6, Tango-63, hAPO8, TRICK2 или KILLER) (см., например, Sheridan et al., Science, 277:818-821 (1997), Pan et al., Science, 277:815-818 (1997), WO 98/51793, опубликованный 19 ноября, 1998; WO 98/41629, опубликованный 24 сентября, 1998; Screaton et al., Curr. Biol., 7:693-696 (1997); Walczak et al., EMBO J., 16:5386-5387 (1997); Wu et al., Nature Genetics, 17:141-143 (1997); WO 98/35986, опубликованный 20 августа, 1998; EP 870827, опубликованный 14 октября, 1998; WO 98/46643, опубликованный 22 октября, 1998; WO 99/02653, опубликованный 21 января, 1999; WO 99/09165, опубликованный 25 февраля, 1999; WO 99/11791, опубликованный 11 марта, 1999; патент США №2002/0072091, опубликованный 13 августа, 2002; патент США №2002/0098550, опубликованный 7 декабря, 2001; патент США №6313269, опубликованный 6 декабря, 2001; патент США №2001/0010924, опубликованный 2 августа, 2001; патент США №2003/01255540, опубликованный 3 июля, 2003; патент США №2002/0160446, опубликованный 31 октября, 2002; патент США №2002/0048785, опубликованный 25 апреля, 2002; патент США №6342369, опубликованный в феврале, 2002; патент США №6569642, опубликованный 27 мая, 2003; патент США №6072047, опубликованный 6 июня, 2000; патент США №6642358, опубликованный 4 ноября, 2003; патент IS 6743625, опубликованный 1 июня, 2004). Сходно с DR4, описано, что DR5 содержит цитоплазматический домен смерти и способен передавать сигнал апоптоза при связывании лиганда (или при связывании такой молекулы, как антитело-агонист, воспроизводящее активность лиганда). Кристаллическая структура комплекса, формируемого Apo-2L/TRAIL и DR5, описана в Hymowitz et al., Molecular Cell, 4:563-571 (1999).
При связывании лиганда DR4 и DR5 способны запускать апоптоз независимо от вовлечения и активации инициатора апоптоза, каспазы-8, посредством содержащей домен смерти вспомогательной молекулы, которую обозначают как FADD/Mort1 (Kischkel et al., Immunity, 12:611-620 (2000); Sprick et al., Immunity, 12:599-609 (2000); Bodmer et al., Nature Cell Biol., 2:241-243 (2000)).
Было описано, что Apo2L/TRAIL также связывает те рецепторы, которые обозначены как DcR1, DcR2 и OPG, функционирующие, как предполагают, в качестве ингибиторов, а не передатчиков сигнала (см., например, DcR1 (также обозначаемый как TRID, LIT или TRAIL-R3) (Pan et al., Science, 276:111-113 (1997); Sheridan et al., Science, 277:818-821 (1997); McFarlane et al., J. Biol. Chem., 272:25417-25420 (1997); Schneider et al., FEBS Letters, 416:329-334 (1997); Degli-Esposti et al., J. Exp. Med., 186:1165-1170 (1997); и Mongkolsapaya et al., J. Immunol, 160:3-6 (1998)); DcR2 (также называемый TRUNDD или TRAIL-R4) (Marsters et al., Curr. Biol., 7: 1003-1006 (1997); Pan et al., FEBS Letters, 424:41-45 (1998); Degli-Esposti et al., Immunity, 7:813-820 (1997)), а также OPG. В отличие от DR4 и DR5, рецепторы DcR1 и DcR2 не передают сигнал апоптоза.
В литературе были описаны определенные антитела, связывающиеся с рецепторами DR4 и/или DR5. Например, антитела против DR4, направленные к рецептору DR4 и обладающие агонистической или апоптотической активностью, описаны, например, в WO 99/37684, опубликованном 29 июля, 1999; WO 00/73349, опубликованном 12 июля, 2000; WO 03/066661, опубликованном 14 августа, 2003. См. также, например, Griffith et al., J. Immunol., 162:2597-2605 (1999); Chuntharapai et al., J. Immunol., 166:4891-4898 (2001); WO 02/097033, опубликованный 2 декабря, 2002; WO 03/042367, опубликованный 22 мая, 2003; WO 03/038043, опубликованный 8 мая, 2003; WO 03/037913, опубликованный 8 мая, 2003. Аналогично были описаны некоторые антитела против DR5, см., например, WO 98/51793, опубликованный 8 ноября, 1998; Griffith et al., J. Immunol, 162:2597-2605 (1999); Ichikawa et al., Nature Med., 7:954-960 (2001); Hylander et al., "An Antibody to DR5 (TRAIL-Receptor 2) Suppresses the Growth of Patient Derived Gastrointestinal Tumors Grown in SCID mice", Abstract, 2d International Congress on Monoclonal Antibodies in Cancers, Aug. 29-Sept. 1, 2002, Banff, Alberta, Canada; WO 03/038043, опубликованный 8 мая, 2003; WO 03/037913, опубликованный 8 мая, 2003. Кроме того, были описаны некоторые антитела, обладающие перекрестной реактивностью в отношении обоих рецепторов DR4 и DR5 (см., например, патент США №6252050, опубликованный 26 июня, 2001).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, по меньшей мере частично, относится к выявлению гистидин-ацетата, pH от 5,5 до 6,5, как особенно эффективного буфера для составления моноклональных антител, особенно полноразмерных антител IgG1, которые чувствительны к дезамидированию и/или агрегации. Композиция замедляет разрушение содержащегося в ней продукта в виде антитела.
Таким образом, в первом аспекте изобретение относится к стабильной фармацевтической композиции, содержащей моноклональное антитело в буфере гистидин-ацетат, pH от 5,5 до 6,5. Предпочтительно моноклональное антитело связывает антиген, выбранный из группы, которая состоит из HER2, CD20, DR5, BR3, IgE и VEGF.
Кроме того, изобретение относится к способу лечения заболевания или нарушения у индивидуума, где способ включает введение индивидууму композиции в количестве, эффективном для лечения заболевания или нарушения.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей: (a) полноразмерное антитело IgG1, чувствительное к дезамидированию или агрегации, в количестве приблизительно от 10 мг/мл до приблизительно 250 мг/мл; (b) буфер гистидин-ацетат, pH от 5,5 до 6,5; (c) сахарид, выбранный из группы, которая состоит из трегалозы и сахарозы, в количестве приблизительно от 60 мМ до приблизительно 250 мМ; и (d) полисорбат-20 в количестве приблизительно от 0,01% до приблизительно 0,1%.
Также изобретение относится к способу снижения дезамидирования или агрегации терапевтического моноклонального антитела, где способ включает составление антитела в буфере гистидин-ацетат, pH от 5,5 до 6,5.
В еще одном аспекте изобретение относится к фармацевтической композици, которая содержит связывающееся с доменом II HER2 антитело в гистидиновом буфере с pH приблизительно от 5,5 до приблизительно 6,5, сахарид и поверхностно-активное вещество.
Также изобретение относится к фармацевтической композиции, содержащей пертузумаб в количестве приблизительно от 20 мг/мл до приблизительно 40 мг/мл, буфер гистидин-ацетат, сахарозу и полисорбат-20, где pH композиции составляет приблизительно от 5,5 до приблизительно 6,5.
Также изобретение относится к фармацевтической композиции, содержащей антитело против DR5 в гистидиновом буфере с pH приблизительно от 5,5 до приблизительно 6,5, сахарид и поверхностно-активное вещество.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей апомаб в количестве приблизительно от 10 мг/мл до приблизительно 30 мг/мл, буфер гистидин-ацетат, трегалозу и полисорбат-20, где pH композиции составляет приблизительно от 5,5 до приблизительно 6,5.
В еще одном аспекте изобретение относится к способу лечения рака у индивидуума, включающему введение индивидууму фармацевтической композиции в количестве, эффективном для лечения рака.
Также изобретение относится к флакону с пробкой, проницаемой для шприца, или к емкости из нержавеющей стали, содержащим внутри флакона или емкости композицию, необязательно, в замороженном виде.
Кроме того, изобретение относится к способу получения фармацевтической композиции, где способ включает: (a) получение композиции моноклонального антитела; и (b) оценку физической стабильности, химической стабильности или биологической активности моноклонального антитела в композиции.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фигуре 1 представлены домены I-IV (SEQ ID No. 19-22 соответственно) внеклеточного домена HER2.
На фигурах 2A и 2B представлены выравнивания аминокислотных последовательностей вариабельного домена легкой цепи (VL) (фигура 2A) и вариабельного домена тяжелой цепи (VH) (фигура 2B) мышиного моноклонального антитела 2C4 (SEQ ID No. 1 и 2 соответственно); VH и VL домены варианта 574 гуманизированного 2C4 (SEQ ID No. 3 и 4 соответственно), а также консенсусные каркасные области VH и VL человека (hum κ1, подгруппа легкой каппа-цепи; humIII, подгруппа III тяжелой цепи) (SEQ ID No. 5 и 6 соответственно). Звездочками обозначены различия между вариантом 574 гуманизированного 2C4 и мышиным моноклональным антителом 2C4 или между вариантом 574 гуманизированного 2C4 и каркасной областью человека. Гипервариабельные участки (CDR) представлены в квадратных скобках.
На фигурах 3A и 3B представлены аминокислотные последовательности легкой цепи и тяжелой цепи пертузумаба (SEQ ID No. 15 и 16 соответственно). CDR выделены жирным шрифтом. Рассчитанные молекулярные массы легкой цепи и тяжелой цепи составляют 23526,22 Да и 49216,56 Да (цистеины в восстановленной форме). К аспарагину 299 тяжелой цепи присоединена углеводная группа.
На фигурах 4A и 4B представлены аминокислотные последовательности легкой и тяжелой цепей пертузумаба, где каждая содержит целую N-концевую последовательность сигнального пептида (SEQ ID No. 17 и 18 соответственно).
На фигуре 5 схематично представлено связывание 2C4 в участке связывания гетеродимеров HER2, которое тем самым предотвращает гетеродимеризацию с активированным EGFR или HER3.
На фигуре 6 представлена связь HER2/HER3 с каскадами реакций MAPK и Akt.
На фигуре 7 представлено сравнение активности трастузумаба и пертузумаба.
На фигуре 8 представлена стабильность композиции пертузумаба при ионообменных (IEX) анализах.
На фигуре 9 представлена стабильность композиции пертузумаба при анализе посредством гель-фильтрации (SEC).
На фигуре 10 представлена физическая стабильность пертузумаба в различных композициях.
Фигура 11 представлена из исследования перемешивания жидких композиций пертузумаба.
Фигура 12 представлена из другого исследования перемешивания жидких композиций пертузумаба.
Фигура 13 представлена из исследования замораживания-размораживания композиции пертузумаба.
На фигурах 14A и 14B представлены аминокислотные последовательности легкой цепи (SEQ ID No. 13) и тяжелой цепи (SEQ ID No. 14) трастузумаба.
На фигурах 15A и 15B представлен вариант последовательности легкой цепи пертузумаба (SEQ ID No. 23) и вариант последовательности тяжелой цепи пертузумаба (SEQ ID No. 24).
На фигурах 16A и 16B представлены структуры олигосахаридов, обычно наблюдаемых в антителах IgG.
На фигурах 17A и 17B представлены последовательности легкой и тяжелой цепей (SEQ ID No. 37-44) специфических антител E25, E26, HAE1 и Hu-901 против IgE. На фигуре 17A вариабельный домен легкой цепи заканчивается остатками VEIK, остатком 111. На фигуре 17B вариабельный домен тяжелой цепи заканчивается остатками VTVSS, приблизительно остатком 120.
На фигуре 18A представлено выравнивание последовательностей для сравнения аминокислотных последовательностей вариабельного домена легкой цепи (VL) для каждого из мышиного 2H7 (SEQ ID No. 25), варианта гуманизированного 2H7v16 (SEQ ID No. 26) и легкой каппа-цепи человека подгруппы I (SEQ ID No. 27). CDR в VL из 2H7 и hu2H7v16 представляют собой следующие: CDR1 (SEQ ID No. 57), CDR2 (SEQ ID No. 58) и CDR3 (SEQ ID No. 59).
На фигуре 18B представлено выравнивание последовательностей для сравнения аминокислотных последовательностей вариабельного домена тяжелой цепи (VH) для каждого из 2H7 мыши (SEQ ID No. 28), варианта гуманизированного 2H7v16 (SEQ ID No. 29), и консенсусной последовательности тяжелой цепи человека подгруппы III (SEQ ID No. 30). CDR в VH из 2H7 и hu2H7v16 представляют собой следующие: CDR1 (SEQ ID No. 60), CDR2 (SEQ ID No. 61) и CDR3 (SEQ ID No. 62).
На фиг. 18A и фиг. 18B CDR1, CDR2 и CDR3 в каждой цепи заключены в скобки, которые фланкируются каркасными областями, FR1-FR4, как указано. 2H7 относится к антителу 2H7 мыши. Звездочками между двумя рядами последовательностей указаны положения, которые являются различными между двумя последовательностями. Нумерация остатков соответствует Kabat et al. Sequence of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), со вставками, указанными как a, b, c, d и e.
На фигуре 19 представлены последовательности вариабельных доменов трех различных антител против VEGF с SEQ ID No. 31-36.
На фигуре 20 представлен профиль элюирования при гель-фильтрации (SEC) следующих образцов апомаба: (a) контроль и композиции, полученные при (b) pH 4,0, (c) pH 5,0, (d) pH 6,0 и (e) pH 7,0. Перед анализом составленные образцы хранили при 40°C в течение 2 месяцев.
На фигуре 21 представлен профиль значений pH для потери мономера антитела апомаб в процессе хранения. В процессе хранения при 30°C и 40°C проводили мониторинг кинетики мономера посредством SEC и вычисляли константу скорости реакции первого порядка.
На фигуре 22 представлен профиль элюирования при ионообменной хроматографии (IEC) образцов апомаба следующим образом: (a) контроль и композиции, полученные при (b) pH 4,0, (c) pH 5,0, (d) pH 6,0 и (e) pH 7,0. Перед анализом составленные образцы хранили при 40°C в течение 2 месяцев.
На фигуре 23 представлен профиль значений pH для снижения в процессе хранения главного пика при IEC. В процессе хранения при 30°C и 40°C проводили мониторинг кинетики мономера посредством IEC и вычисляли константу скорости реакции первого порядка.
На фигуре 24 представлена нуклеотидная последовательность кДНК лиганда Apo-2 человека (SEQ ID No. 45) и получаемой на ее основе аминокислотной последовательности (SEQ ID No. 46). "N" в положении нуклеотида 447 (в SEQ ID No. 45) используют для указания того, что нуклеотид может представлять собой "T" или "G".
На фигурах 25A и 25B представлена аминокислотная последовательность из 411 аминокислот для рецептора DR5 человека (SEQ ID No. 47), как опубликовано в WO 98/51793 19 ноября, 1998, и кодирующая нуклеотидная последовательность (SEQ ID No. 48).
На фигурах 26A и 26B представлена аминокислотная последовательность из 440 аминокислот для рецептора DR5 человека (SEQ ID No. 49) и кодирующая нуклеотидная последовательность (SEQ ID No. 50), как также опубликовано в WO 98/35986 20 августа, 1998.
На фигуре 27 представлена аминокислотная последовательность тяжелой цепи апомаба 7.3 (SEQ ID No. 51).
На фигуре 28 представлена аминокислотная последовательность легкой цепи апомаба 7.3 (SEQ ID No. 52).
На фигурах 29 представлено выравнивание аминокислотных последовательностей тяжелой цепи 16E2 (SEQ ID No. 53) и тяжелой цепи апомаба 7.3 (SEQ ID No. 51).
На фигуре 30 представлено выравнивание аминокислотных последовательностей легкой цепи 16E2 (SEQ ID No. 54) и легкой цепи апомаба 7.3 (SEQ ID No. 52).
На фигурах 31A и 31B представлены аминокислотная последовательность вариабельного домена тяжелой цепи (фиг. 31A; SEQ ID No. 55) и аминокислотная последовательность вариабельного домена легкой цепи (фиг. 31B; SEQ ID No. 56) апомаба 7.3. Остатки CDR указаны жирным шрифтом.
На фигуре 32 представлено выравнивание легких цепей зрелых 2H7v16 и 2H7v511 (SEQ ID No. 63 и 64 соответственно). Последовательности представлены с помощью нумерации остатков вариабельного домена Kabat и нумерации остат