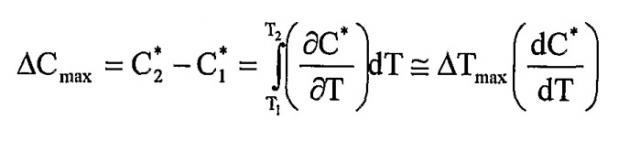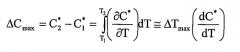Способы изготовления, применение и композиции небольших сферических частиц, приготовленных регулируемым фазовым разделением
Иллюстрации
Показать всеИзобретение относится к способу приготовления небольших сферических частиц активного агента при обеспечении раствора в единственной жидкой фазе. Единственная жидкая фаза содержит активный агент, усиливающий фазовое разделение агент и первый растворитель. Фазовое изменение индуцируется при контролируемой скорости в растворе, чтобы вызвать фазовое разделение жидкость-твердое активного агента и образовать жидкую фазу и твердую фазу, причем указанное индуцирование включает в себя охлаждение раствора. Твердая фаза содержит небольшие сферические частицы активного агента. Жидкая фаза содержит усиливающий фазовое разделение агент и растворитель. Небольшие сферические частицы являются, по существу, сферическими и имеют размер от, примерно, 0,01 мкм до, примерно, 200 мкм. 3 н. и 74 з.п. ф-лы, 49 ил., 6 табл.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ:
По данной заявке испрашивается приоритет на основании предварительной заявки U.S. 60/488712, зарегистрированной 18 июля 2003 г., которая включена во всей полноте посредством ссылки и является частью данной заявки.
ФЕДЕРАЛЬНОЕ СПОНСИРОВАНИЕ ИССЛЕДОВАНИЯ ИЛИ РАЗРАБОТКИ
Не проводилось
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Техническая область
Изобретение относится к способам изготовления, способам применения и композициям небольших сферических частиц активного агента. В соответствии со способом производства активный агент растворяют в водном или смешивающемся с водой растворителе, содержащем растворенный усиливающий фазовое разделение агент (УФРА), чтобы образовать раствор в единственной жидкой фазе. Раствор затем подвергают фазовому разделению жидкость-твердое, причем имеющийся активный агент содержится в твердой фазе, а УФРА и растворитель содержатся в жидкой фазе. Фазовое разделение жидкость-твердое может быть вызвано рядом способов, например, изменением температуры раствора ниже температуры фазового перехода системы. Способ является наиболее подходящим для образования небольших сферических частиц терапевтических агентов, которые могут быть потом доставлены к объекту, который нуждается в терапевтическом агенте. Способ также является наиболее подходящим для образования твердых небольших сферических частиц макромолекул, в частности, макромолекул, которые термически неустойчивы, например, протеины.
Предшествующий уровень техники
Несколько технологий были использованы в прошлом для изготовления биополимерных нано- и микрочастиц. Обычные технологии для образования частиц включают в себя распылительную сушку и измельчение и могут быть использованы для производства частиц размером 5 мкм или меньше.
В патентах U.S. 5654010 и U.S. 5667808 описано производство твердых форм рекомбинантного гормона роста человека, ГРЧ, через комплексообразование с цинком, для того чтобы создать аморфный комплекс, который затем мелко измельчают, пропуская через ультразвуковое сопло, и распыляют в жидком азоте, чтобы заморозить капли. Жидкому азоту затем дают возможность испариться при температуре -80°С, и полученный материал сушат сублимацией.
Микрочастицы, микросферы и микрокапсулы представляют собой твердые или полутвердые частицы с диаметром меньшим, чем один миллиметр, более предпочтительно, меньшим, чем 100 мкм, и наиболее предпочтительно, меньшим, чем 10 мкм, которые могут быть образованы из различных материалов, включая в себя протеины, синтетические полимеры, полисахариды и их комбинации. Микросферы были использованы по многим различным назначениям, главным образом, при разделении, диагностике и доставке лекарства.
Наиболее хорошо известные примеры микросфер, используемых в технологиях разделения, представляют собой микросферы, образованные полимерами синтетического или природного происхождения, такими как полиакриламид, гидроксиапатит или агароза. В области лекарств с контролируемой доставкой молекулы часто объединены или инкапсулированы в небольшие сферические частицы или объединены в монолитную матрицу для последующего освобождения. Ряд различных технологий регулярно используется для получения указанных микросфер из синтетических полимеров, натуральных полимеров, протеинов и полисахаридов, включая в себя фазовое разделение, испарение растворителя, коацервацию, эмульгирование и распылительную сушку. Обычно полимеры образуют структуру носителя для данных микросфер, и нужный лекарственный препарат заключается в полимерную структуру.
В настоящее время доступны частицы, приготовленные с использованием липидов, чтобы инкапсулировать целевые лекарственные препараты. Липосомы представляют собой сферические частицы, состоящие из одного или множества фосфолипидных и/или холестериновых бислоев. Липосомы имеют размер, равный 100 нанометрам или больше, и могут нести множество водорастворимых или липидорастворимых лекарственных препаратов. Например, липиды, организованные в двухслойные мембраны, окружающие множество водных отделений, чтобы образовать частицы, могут быть использованы для инкапсулирования водорастворимых лекарственных препаратов для последующей доставки, как описано в патенте U.S. 5422120, Sinil Kim.
Сферические бусины коммерчески доступны как инструмент для биохимиков в течение многих лет. Например, антитела, соединенные с бусинами, создают относительно большие частицы, которые специфически связываются с конкретными лигандами. Антитела, регулярно используемые для связывания с рецепторами на поверхности клетки для клеточной активации, привязывают к твердой фазе, чтобы образовать частицы, покрытые антителами, для иммуноаффинной очистки, и могут быть использованы для доставки терапевтических агентов, которые медленно выделяются с течением времени, используя ткань или опухолеспецифические антитела, присоединенные к частицам, чтобы доставить агент к желаемому участку.
В настоящее время имеется острая необходимость развития новых способов получения частиц, особенно тех, которые могут быть приспособлены для использования в областях доставки лекарственного препарата, разделения и диагностики. Наиболее желательными частицами с точки зрения использования, являлись бы небольшие сферические частицы со следующими характеристиками: ограниченный гранулометрический состав, по существу, сферические, по существу, состоящие только из активного агента, сохранение биохимической целостности и биологической активности активного агента. Частицы должны обеспечивать подходящую твердость, что дает дополнительную стабилизацию частиц при нанесении покрытия или при микроинкапсулировании. Кроме того, способ изготовления небольших сферических частиц должен обладать следующими желательными характеристиками: простота изготовления, по существу, водный способ, высокий выход и не требующий последующего просеивания.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам производства и способам применения небольших сферических частиц активного агента. В соответствии со способом активный агент растворяют в растворителе, содержащем усиливающий фазовое разделение агент, чтобы образовать раствор, который представляет собой единственную жидкую фазу. Растворитель представляет собой, предпочтительно, водный или смешивающийся с водой растворитель. Раствор затем подвергают фазовому разделению жидкость-твердое, причем имеющийся активный агент содержится в твердой фазе, а УФРА и растворитель содержатся в жидкой фазе. Фазовое разделение жидкость-твердое может быть вызвано рядом способов, например, изменением температуры раствора ниже температуры фазового перехода раствора.
В предпочтительном варианте осуществления настоящего изобретения используется способ фазового разделения раствора жидкость-твердое охлаждением раствора ниже температуры фазового перехода активного агента в растворе. Температура может быть выше или ниже температуры замерзания раствора. Для растворов, в которых температура замерзания выше температуры фазового перехода, раствор может включать в себя агент, понижающий температуру замерзания, например, полиэтиленгликоль или полипропиленгликоль, чтобы понизить температуру замерзания раствора и позволить произойти фазовому разделению в растворе без замерзания раствора.
Усиливающий фазовое разделение агент по настоящему изобретению усиливает или вызывает фазовое разделение жидкость-твердое активного агента в растворе, когда раствор подвергается этапу фазового изменения, в котором активный агент затвердевает, образуя суспензию небольших сферических частиц как дискретную фазу, в то время как усиливающий фазовое разделение агент остается растворенным в непрерывной фазе. То есть, усиливающий фазовое разделение агент не изменяет фазы, в то время как активный агент изменяет фазу.
Способ производства частиц по настоящему изобретению может также включать в себя дополнительный этап управления фазовым разделением частиц жидкость-твердое, чтобы регулировать размер и форму образованных частиц. Способы управления фазовым разделением включают в себя регулирование ионной силы, pH, концентрации усиливающего фазовое разделение агента, концентрации активного агента в растворе или регулирование скорости изменения температуры раствора, причем регулирование указанных параметров проводят или перед фазовым разделением или изменяют один или несколько из них для того, чтобы вызвать фазовое разделение.
В предпочтительном варианте осуществления настоящего изобретения небольшие сферические частицы отделяют от УФРА в непрерывной фазе после образования частиц. В другом предпочтительном варианте осуществления способ разделения представляет собой промывание раствора, содержащего частицы, жидкостью, в которой активный агент не растворим, в то время как усиливающий фазовое разделение агент растворим в жидкости. Промывная жидкость может содержать агент, который уменьшает растворимость активного агента в жидкости. Промывная жидкость может также содержать один или более наполнитель. Наполнитель может действовать как стабилизатор для небольших сферических частиц или для активного агента, или для несущего агента. Наполнитель может также придавать активному агенту или частице дополнительные характеристики, такие как контролируемое выделение активного агента из частиц, или модифицированное проникновение активного агента через биологические ткани.
В другом предпочтительном варианте осуществления, несмотря на то, что небольшие частицы не включают в себя УФРА, они могут быть образованы в присутствии фазы УФРА для последующих этапов обработки до отделения от фазы УФРА.
В другом предпочтительном варианте осуществления раствор представляет собой водный раствор, содержащий водный или смешивающийся с водой растворитель.
Активный агент настоящего изобретения представляет собой, предпочтительно, фармацевтически активный агент, который может быть терапевтическим агентом, диагностическим агентом, косметическим веществом, пищевой добавкой или пестицидом. В предпочтительном варианте осуществления настоящего изобретения активный агент представляет собой макромолекулу, такую как протеин, полипептид, углевод, полинуклеотид или нуклеиновая кислота. В еще одном предпочтительном варианте осуществления частицы, содержащие активный агент, являются подходящими для доставки in vivo агента к необходимому объекту соответствующим путем, таким как парентеральная инъекция, топически, орально, ректально, через легкие, вагинально, через щеку, под язык, подкожно, через слизистые оболочки, через глаза, внутри глаз или через уши.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
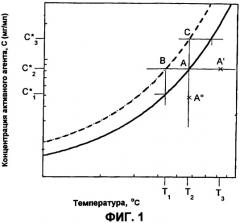
Фиг.1 представляет собой двумерную фазовую диаграмму зависимости концентрации активного компонента от температуры.
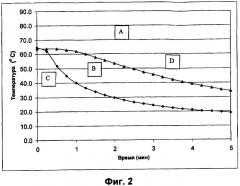
Фиг.2 представляет собой профиль уменьшения температуры, иллюстрирующий влияние температуры раствора и скорости охлаждения на фазовое изменение инсулина в буферном растворе полимера. При температуре выше 60°С инсулин остается в растворе (область А). Область В представляет собой площадь оптимального образования небольших сферических частиц, ограниченную наиболее высокой и наиболее низкой скоростью изменения температуры, наблюдаемой в теплообменнике. Большие скорости охлаждения (область С) приводят к образованию очень мелких несферических частиц, в то время как низкие скорости охлаждения (область D) приводят к смеси небольших сферических частиц различных размеров, наряду с частицами неправильной формы и рыхлого осадка.
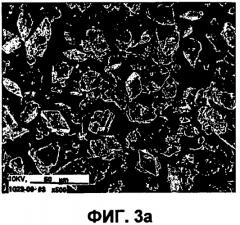
Фиг.3а представляет собой изображение исходного материала инсулина, полученное сканирующим электронным микрографом (СЭМ).
Фиг.3b представляет собой изображение (СЭМ) небольших сферических частиц инсулина (пример 4).
Фиг.4 представляет собой ВЭЖХ анализ, показывающий сохранение химической стабильности инсулина при приготовлении небольших сферических частиц, иллюстрирующий химическую стабильность во время способа изготовления микросфер инсулина.
ВЭЖХ анализ показал отсутствие увеличения высокомолекулярных соединений, связанного со способом, и увеличение (относительно исходного сырья инсулина) % димера, % А21 дезамидоинсулина, % поздно элюируемых пиков и % других соединений в пределах USP.
Фиг.5 представляет собой схематическую демонстрацию воспроизводимости от порции к порции. Фигура показывает распределение небольших сферических частиц инсулина (время-пролетные данные Aerosizer). Для всех шести полученных партий больше чем 96% частиц попали между 0,86 и 2,9 мкм, с более 60% попавшими между 1,6 и 2,5 мкм. Меньше чем 1,1% небольших сферических частиц попали за пределы размеров, охватываемых диаграммой.
Фиг.6 представляет собой схематическую демонстрацию воспроизводимости от порции к порции. Фигура показывает распределение небольших сферических частиц инсулина с использованием каскадного импактора Андерсена. Данные являются средними (означает+/-КО (квадратичное отклонение)) результатами для шести партий небольших сферических частиц инсулина, полученных на устройстве Cyclohaler при 60 ЛВМ. ЭПД для ступеней 1, 2, 3 и 4 составляло 4,4; 3,3; 2,0 и 1,1 мкм соответственно.
Фиг.7 представляет собой схематическую диаграмму непрерывного проточного способа получения небольших сферических частиц инсулина в примере 3.
Фиг.8 представляет собой изображение (сканирующий электронный микрограф (при 10 Кв и 6260Х увеличении)) небольших сферических частиц инсулина, полученных в непрерывном проточном способе примера 3.
Фиг.9 представляет собой ВЭЖХ хроматограмму растворенных небольших сферических частиц инсулина, полученных в способе с непрерывным потоком примера 3.
Фиг.10а демонстрирует влияние хлорида натрия (при 2,5 мг/мл) на растворимость инсулина в объеме пробирки (NaCl против температуры). На фигуре представлены следующие данные (подъем от 60°С):
| % NaCl | 0,1 | 0,3 | 0,5 | 0,7 | 0,9 | 1,1 | 1,3 | 1,5 | 1,7 |
| Растворение, °С | 77 | 73 | 69 | 67 | 66 | 65 | 63 | 63 | 62 |
| Реосаждение, °С | 58 | 55 | 50 | 42 | 37 | 34 | 29 | 22 | 22 |
Фиг.10b демонстрирует влияние хлорида натрия (при 5 мг/мл) на растворимость инсулина в объеме пробирки (NaCl против температуры). На фигуре представлены следующие данные (подъем от 60°С):
| % NaCl | 0,8 | 1,2 | 1,6 | 2,0 | 2,4 | 2,8 | 3,2 | 3,6 | 4,0 |
| Растворение, °С | 77 | 74 | 72 | 65 | 64 | 64 | 63 | 62 | 62 |
| Реосаждение, °С | 48 | 43 | 36 | 30 | 26 | 22 | <22 | <20 | <20 |
Фиг.10с демонстрирует влияние хлорида натрия (при 10 мг/мл) на растворимость инсулина в объеме пробирки (NaCl против температуры). На фигуре представлены следующие данные (подъем от 40°С):
| % NaCl | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 | 2,2 | 2,4 | 2,6 | 2,8 |
| Растворение, °С | 85 | 83 | 74 | 70 | 68 | 74 | 74 | 74 | 73 |
| Реосаждение, °С | 67 | 46 | 33 | 23 | 20 | 39 | 37 | 37 | 35 |
| % NaCl | 3,0 | 3,2 | 3,4 | 3,6 | 3,8 | 4,0 |
| Растворение, °С | 71 | 70 | 70 | 70 | 70 | 69 |
| Реосаждение, °С | 31 | 30 | 27 | 26 | 24 | 22 |
Фиг.10d демонстрирует влияние хлорида натрия (при 20 мг/мл) на растворимость инсулина в объеме пробирки (NaCl против температуры). На фигуре представлены следующие данные (подъем от 40°С):
| % NaCl | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 |
| Растворение, °С | 88 | 83 | 80 | 77 | 74 |
| Реосаждение, °С | 67 | 60 | 49 | 40 | 27 |
Фиг.10е-10h демонстрируют влияние солей на растворимость инсулина.
Фиг.10i представляет собой спектр КР сырого материала инсулина, инсулина, выделенного из небольших сферических частиц, и инсулина в небольших сферических частицах. Приведен КР спектр в области амидной полосы I для необработанного порошка инсулина и порошка из небольших сферических частиц, а также из соответствующих растворов.
Фиг.11 представляет собой результаты, полученные на каскадном импакторе Андерсена для радиомеченого инсулина примера 10. Результаты с каскадного импактора Андерсена для 99mТc радиомеченого порошка инсулина показывают устойчивую связь 99тТc с инсулином перед тем, как первой собаке ввели дозу, и после того, как последнему животному была доставлена доза.
Фиг.12 представляет собой гистограмму отношения P/I для примера 8, показывающую среднее значение соотношения P/I, равное 0,93, для пяти проверенных собак.
Фиг.13 представляет собой сцинтиграфический вид легкого из примера 8, где 99mТc радиомеченый инсулин был гомогенизированно распределен на периферии легких. Нет визуального подтверждения осаждения в центре легких. Это поддерживает унимодальное распределение по размеру небольших сферических частиц инсулина после введения собакам.
Фиг.14а представляет собой график кругового дихроизма (КД) для альфа-1-антитрипсина (ААТ).
Фиг.14b представляет собой график зависимости активности от времени хранения при комнатной температуре в примере 17.
Фиг.14 с представляет собой график зависимости активности от времени хранения при 4°С в примере 17.
Фиг.15 представляет собой график ДСК, показывающий первую термограмму нагрева 50 мг/мл рААТ образца в BDS растворе против BDS как эталона.
Фиг.16 представляет собой график ДСК, показывающий первую термограмму охлаждения 50 мг/мл рААТ образца в BDS растворе против BDS как эталона.
Фиг.17 представляет собой график ДСК, показывающий вторую термограмму нагрева 50 мг/мл рААТ образца в BDS растворе против BDS как эталона.
Фиг.18 представляет собой график ДСК, показывающий вторую термограмму охлаждения 50 мг/мл рААТ образца в BDS растворе против BDS как эталона.
Фиг.19 представляет собой график ДСК, показывающий вторую термограмму нагрева 45 мг/мл рААТ образца в растворе ацетата против ацетатного буфера как эталона.
Фиг.20 представляет собой график ДСК, показывающий вторую термограмму охлаждения 45 мг/мл рААТ образца в растворе ацетата против ацетатного буфера как эталона.
Фиг.21 представляет собой график ДСК, показывающий вторую термограмму нагрева 1 мг/мл рААТ образца в BDS растворе против BDS буфера как эталона. рААТ образец получен при растворении 3 небольших сферических частиц рААТ в BDS.
Фиг.22 представляет собой график ДСК, показывающий вторую термаграмму охлаждения 1 мг/мл рААТ образца в BDS растворе против BDS буфера как эталона, рААТ образец получен при растворении 3 небольших сферических частиц рААТ в BDS.
Фиг.23 представляет собой график ДСК, показывающий первую термограмму охлаждения небольших сферических частиц изготовленной партии.
Фиг.24 представляет собой график ДСК, показывающий первую термограмму нагрева небольших сферических частиц изготовленной партии.
Фиг.25a представляет собой график ДСК, показывающий вторую термограмму охлаждения небольших сферических частиц полученной партии.
Фиг.25b представляет собой график ДСК, показывающий вторую термограмму нагрева небольших сферических частиц изготовленной партии.
Фиг.26 представляет собой график данных по размеру частиц (TSI Corporation Aerosizer).
Фиг.27 представляет собой СЭМ небольших сферических частиц гормона роста человека (ГРЧ).
Фиг.28 представляет собой график, показывающий, что инсулин в форме микросферы сохраняет стабильность после хранения в газе-вытеснителе HFA 134а.
Фиг.29 представляет собой график сравнения аэродинамического качества инсулина с использованием трех устройств для ингаляции, где аэродинамические качества небольших сферических частиц инсулина сравнивали с использованием трех различных приборов для ингаляции: ИИД, Cyclohaler ИСП, Disphaler ИСП.
Фиг.30 представляет собой график данных по стабильности небольших сферических частиц инсулина в сравнении с исходным инсулином, хранящимся при 25°С, показывающий, что при хранении при температуре 25°С процент образования А21-дезамидоинсулина из исходного материала значительно больше по сравнению с образованием из небольших сферических частиц инсулина. Данный результат показывает, что небольшие сферические частицы инсулина значительно более устойчивы к химическому разрушению, чем исходный материал, без добавления стабилизирующих наполнителей.
Фиг.31 представляет собой график данных по стабильности небольших сферических частиц инсулина в сравнении с исходным инсулином, хранящимся при 37°С, показывающий, что при хранении при температуре 37°С процент образования А21-дезамидоинсулина из исходного материала значительно больше по сравнению с образованием из небольших сферических частиц инсулина. Данный результат показывает, что небольшие сферические частицы инсулина значительно более устойчивы к химическому разрушению, чем исходный материал, без добавления стабилизирующих наполнителей.
Фиг.32 представляет собой график данных по стабильности небольших сферических частиц инсулина в сравнении с исходным инсулином, хранящимся при 25°С, показывающий, что при хранении при температуре 25°С процент образования димера и олигомера инсулина из исходного материала значительно больше по сравнению с образованием из небольших сферических частиц инсулина. Данный результат показывает, что небольшие сферические частицы инсулина значительно более устойчивы к химическому разрушению, чем исходный материал, без добавления стабилизирующих наполнителей.
Фиг.33 представляет собой график данных по стабильности небольших сферических частиц инсулина в сравнении с исходным инсулином, хранящимся при 37°С, показывающий, что при хранении при температуре 37°С процент образования димера и олигомера инсулина из исходного материала значительно больше по сравнению с образованием из небольших сферических частиц инсулина. Данный результат показывает, что небольшие сферические частицы инсулина значительно более устойчивы к химическому разрушению, чем исходный материал, без добавления стабилизирующих наполнителей.
Фиг.34 представляет собой график данных по стабильности небольших сферических частиц инсулина в сравнении с исходным инсулином, хранящимся при 25°С, показывающий, что при хранении при температуре 25°С процент образования суммарных соединений, родственных инсулину, из исходного материала значительно больше по сравнению с образованием из небольших сферических частиц инсулина. Данный результат показывает, что небольшие сферические частицы инсулина значительно более устойчивы к химическому разрушению, чем исходный материал, без добавления стабилизирующих наполнителей.
Фиг.35 представляет собой график данных по стабильности небольших сферических частиц инсулина в сравнении с исходным инсулином, хранящимся при 37°С, показывающий, что при хранении при температуре 37°С процент образования суммарных соединений, родственных инсулину, из исходного материала значительно больше по сравнению с образованием из небольших сферических частиц инсулина. Данный результат показывает, что небольшие сферические частицы инсулина значительно более устойчивы к химическому разрушению, чем исходный материал, без добавления стабилизирующих наполнителей.
Фиг.36 представляет собой гистограмму аэродинамической стабильности небольших сферических частиц инсулина с использованием ингалятора сухого порошка (ИСП) Cyclohaler в каскадном импакторе Андерсена.
Фиг.37 представляет собой световую микрофотографию небольших сферических частиц ДНКазы (световой микроскоп Nikon, 100x масляная иммерсионная линза).
Фиг.38 представляет собой график ферментативной активности ДНКазы.
Фиг.39 представляет собой световую микрофотографию небольших сферических частиц SOD (световой микроскоп Nikon, 100x масляная иммерсионная линза, образец сухого порошка).
Фиг.40 представляет собой график ферментативных данных для небольших сферических частиц SOD (методика определения активности описана в Worthington Biochemical Catalogue).
Фиг.41А-В представляют собой схематические иллюстрации реактора непрерывного эмульгирования, где фиг.41А представляет собой схематическую иллюстрацию реактора непрерывного эмульгирования, когда поверхностно-активное соединение добавлено в непрерывную фазу или в дисперсную фазу перед эмульгированием, и фиг.41В представляет собой схематическую иллюстрацию реактора непрерывного эмульгирования, когда поверхностно-активное соединение добавлено после эмульгирования.
Фиг.42 иллюстрирует влияние PEG на IVR профиль PLLA-инкапсулированных частиц HSA (пример 32).
Фиг.43 иллюстрирует IVR профиль PLGA-инкапсулированных небольших сферических частиц LDS (пример 33).
Фиг.44 иллюстрирует влияние рН непрерывной фазы на IVR профиль PLGA-инкапсулированных небольших сферических частиц инсулина (пример 31).
Фиг.45 иллюстрирует IVR профиль PLGA-инкапсулированных небольших сферических частиц ГРЧ (пример 34).
Фиг.46 иллюстрирует влияние переменных микроинкапсулирования (рН непрерывной фазы и материал матрицы) на образование димеров ИНС в инкапсулированном ИНСмс (пример 35).
Фиг.47 иллюстрирует влияние переменных микроинкапсулирования (рН непрерывной фазы и материал матрицы) на образование ВМ частиц в инкапсулированном ИНСмс (пример 35).
Фиг.48 иллюстрирует in vivo выделение рекомбинантного инсулина человека из не инкапсулированных и инкапсулированных предварительно изготовленных небольших сферических частиц инсулина у крыс (пример 36).
Фиг.49 представляет собой СЭМ при 10 кВ частиц примера 27.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение включает варианты осуществления во многих различных формах. Предпочтительные варианты осуществления изобретения излагаются с пониманием того, что настоящее изложение должно рассматриваться как ряд примеров принципа изобретения без намерения ограничить широкие аспекты изобретения проиллюстрированными вариантами осуществления.
Настоящее изобретение относится к способам производства, способам применения и композиции небольших сферических частиц активного агента. В соответствии со способом производства активный агент растворяют в растворителе, содержащем растворенный агент, усиливающий фазовое разделение, чтобы образовать раствор, который представляет собой единственную непрерывную жидкую фазу. Растворитель, предпочтительно, представляет собой водный или смешивающийся с водой растворитель. Раствор далее подвергается фазовому изменению, например, понижением температуры раствора ниже температуры фазового перехода активного агента, таким образом, активный агент проходит через фазовое разделение жидкость-твердое с образованием суспензии небольших сферических частиц, составляющих дискретную фазу, в то время как усиливающий фазовое разделение агент остается в непрерывной фазе.
Фазы
Непрерывная фаза
Способ приготовления небольших сферических частиц активного агента по настоящему изобретению начинается с получения раствора, имеющего активный агент и усиливающий фазовое разделение агент, растворенный в первом растворителе в единственной жидкой фазе. Раствор может быть органической системой, содержащей органический растворитель или смесь смешивающихся органических растворителей. Раствор может также быть раствором, основанным на воде, содержащим водную среду или смешивающийся с водой органический растворитель, или смесь смешивающихся с водой органических растворителей, или их комбинации. Водная среда может быть водой, раствором соли или буферным раствором, буферным раствором соли и тому подобное. Подходящие смешивающиеся с водой органические растворители включают в себя, но не ограничиваются ими, N-метил-2-пирролидинон (N-метил-2-пирролидон), 2-пирролидинон (2-пирролидон), 1,3-диметил-2-имидазолидинон (ДМИ), диметилсульфоксид, диметилацетамид, уксусную кислоту, молочную кислоту, ацетон, метилэтилкетон, ацетонитрил, метанол, этанол, изопропанол, 3-пентанол, н-пропанол, бензиловый спирт, глицерин, тетрагидрофуран (ТГФ), полиэтиленгликоль (ПЭГ), ПЭГ-4, ПЭГ-8, ПЭГ-9, ПЭГ-12, ПЭГ-14, ПЭГ-16, ПЭГ-120, ПЭГ-75, ПЭГ-150, сложные эфиры полиэтиленгликоля, ПЭГ-4 дилаурат, ПЭГ-20 дилаурат, ПЭГ-6 изостеарат, ПЭГ-8 пальмитостеарат, ПЭГ-150 пальмитостеарат, полиэтиленгликольсорбитаны, ПЭГ-20 сорбитанизостеарат, моноалкиловые эфиры полиэтиленгликоля, ПЭГ-3 диметиловый эфир, ПЭГ-4 диметиловый эфир, полипропиленгликоль (ППГ), полипропиленальгинат, ППГ-10 бутандиол, ППГ-10 метиловый эфир глюкозы, ППГ-20 метиловый эфир глюкозы, ППГ-15 стеариловый эфир, пропиленгликоль дикаприлат/дикапрат, пропиленгликольлаурат и гликофурол (тетрагидрофурфуриловый спирт эфир пропиленгликоля), алканы, включающие в себя пропан, бутан, пентан, гексан, гептан, октан, нонан, декан или их комбинации.
Единственная непрерывная фаза может быть получена при первом приготовлении раствора усиливающего фазовое разделение агента, который или растворим, или смешивается с первым растворителем. За этим следует добавление в раствор активного агента. Активный агент может быть добавлен непосредственно в раствор или активный агент может быть сначала растворен во втором растворителе и затем прибавлен к раствору. Второй растворитель может быть тем же самым растворителем, что и первый растворитель, или это может быть другой растворитель, выбранный из перечисленных выше, и который смешивается с раствором. Предпочтительно, чтобы агент добавляли к раствору при температуре окружающей среды или ниже, что особенно важно для термолабильных молекул, таких как некоторые протеины. Температура «окружающей среды» означает температуру около комнатной температуры, от примерно 20°С до примерно 40°С. Однако система также может быть нагрета для увеличения растворимости активного агента в системе настолько, пока нагревание не вызывает значительного уменьшения активности агента.
Усиливающий фазовое разделение агент
Усиливающий фазовое разделение агент (УФРА) по настоящему изобретению усиливает или вызывает фазовое разделение жидкость-твердое активного агента из раствора, когда раствор проходит этап фазового разделения, в котором активный агент становится твердым или почти твердым с образованием суспензии небольших сферических частиц в качестве дискретной фазы, в то время как усиливающий фазовое разделение агент остается растворенным в непрерывной фазе. Усиливающий разделение фаз агент уменьшает растворимость активного агента, когда раствор находится в условиях фазового разделения. Подходящие усиливающие фазовое разделение агенты включают в себя, но не ограничиваются ими, полимеры или смеси полимеров, которые растворимы или смешиваются с раствором. Примеры подходящих полимеров включают в себя линейные или разветвленные полимеры. Указанные полимеры могут быть водорастворимыми, частично растворимыми в воде, смешивающимися с водой или нерастворимыми.
В предпочтительной форме изобретения усиливающий фазовое разделение агент является водорастворимым или смешивается с водой. Типы полимеров, которые могут быть использованы, включают в себя полимеры на основе углеводов, полиалифатические спирты, поли(винил)полимеры, полиакриловые кислоты, полиорганические кислоты, полиаминокислоты, сополимеры и блок сополимеры (например, полоксамеры, такие как Pluronics F127 или F68) трет-полимеры, полиэфиры, полимеры, встречающиеся в природе, полиимиды, поверхностно-активные вещества, сложные полиэфиры, разветвленные и циклические полимеры и полиальдегиды.
Предпочтительные полимеры представляют собой полимеры, которые допустимы как фармацевтические добавки для намеченного пути введения частиц активного агента. Предпочтительные полимеры представляют собой фармацевтически допустимые добавки, такие как полиэтиленгликоль (ПЭГ) с различным молекулярным весом, такой как ПЭГ 200, ПЭГ 300, ПЭГ 3350, ПЭГ 8000, ПЭГ 10000, ПЭГ 20000 и т.д., и полоксамеры, такие как Pluronics F127 или Pluronics F68. Другой предпочтительный полимер представляет собой поливинилпирролидон (ПВП). Еще один предпочтительный полимер представляет собой гидроксиэтилкрахмал. Другие амфифильные полимеры также могут использоваться по отдельности или в комбинациях. Усиливающий фазовое разделение агент может также не быть полимером, например, смесь пропиленгликоля и этанола.
Фазовое разделение жидкость-твердое
Фазовое разделение жидкость-твердое активного агента в растворе может быть вызвано любым способом, известным в данной области, например, изменение температуры, изменение давления, изменение pH, изменение ионной силы раствора, изменение концентрации активного агента, изменение концентрации усиливающего фазовое разделение агента, изменение осмотического давления раствора, комбинация указанных факторов и тому подобное.
В предпочтительном варианте осуществления настоящего изобретения фазовое изменение представляет собой температурно индуцированное фазовое изменение понижением температуры ниже температуры фазового перехода активного агента в растворе.
Фиг.1 представляет собой двумерную фазовую диаграмму 10 для раствора, содержащего растворитель, УФРА и активный агент. Диаграмма изображает зависимость концентрации активного агента от температуры раствора. Концентрацию УФРА поддерживают постоянной.
Диаграмма содержит кривую насыщения 12, кривую перенасыщения 14; метастабильную площадь 16 между ними; первую площадь 18 ниже кривой насыщения, где система представляет собой гомогенную единую жидкую фазу, где все компоненты находятся в жидкой фазе; и вторую площадь 20 выше кривой перенасыщения, где система представляет собой двухфазную систему, имеющую твердую фазу активного агента и жидкую фазу УФРА и растворителя. Фазовая диаграмма является полезной для определения температуры системы и относительной концентрации компонентов в чистой жидкой фазе, в фазе жидкость-твердое и условий перехода между двумя данными фазами.
Как здесь изложено, приготовление небольших сферических частиц активного агента принципиально включает в себя вымораживание из ненасыщенного раствора (точка А') с достижением насыщения в точке А, где раствор находится в равновесии с любой твердой фазой, которая может присутствовать. При дополнительном охлаждении достигается состояние, когда раствор содержит больше активного агента, чем это соответствует равновесной растворимости при данной температуре; раствор, таким образом, становится перенасыщенным. Самопроизвольного образования твердой фазы не происходит, пока не будет достигнута точка В. Данная точка В представляет собой границу метастабильной зоны. Ширина метастабильной зоны может быть выражена или по максимуму достижимого переохлаждения ∆Тмакс=T2-T1 или перенасыщению ∆Смакс=С*2-C*1. Данные два выражения термодинамически эквивалентны:
Путь А'-А-В представляет собой политермический способ получения метастабильного раствора. В изотермическом способе исходной точкой была бы А''. Увеличением концентрации при постоянной температуре насыщение будет снова достигнуто в точке А. Изотермическое увеличение концентрации (например, испарением растворителя или введением затравки/прибавлением активного агента) до точки С вызовет сдвиг раствора в метастабильное состояние, пока метастабильный предел не будет снова достигнут. Когда метастабильный предел превышен, раствор становится неустойчивым, и немедленно происходит самопроизвольное образование твердой фазы.
Значение (∆Смакс)Т=С*3-C*2, полученное изотермически, может быть отличным от соответствующего значения ∆Тмакс=T3-T2, полученного политермически. Когда приближается граница метастабильной зоны, уменьшается время, необходимое для образования твердой частицы, пока метастабильный предел не будет достигнут.
В политермическом способе охлаждение проводят при контролируемой скорости, чтобы регулировать размер и форму частиц. Под контролируемой скоростью понимают скорость примерно от 0,2°С/минуту до примерно 50°С/минуту, и, более предпочтительно, от 0,2°С