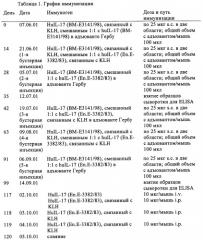
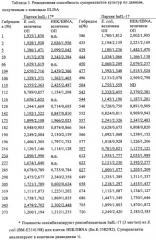
Антагонистические антитела к il-17
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой IL-17-связывающее антитело или его активный фрагмент. Также представлены конструкция ДНК, кодирующая антитело, способ получения антитела, применение антитела, фармацевтическая композиция, вектор экспрессии. Изобретение может эффективно использоваться для получения лекарственного средства для лечения опосредуемого IL-17 заболевания или нарушения. 13 н. и 1 з.п. ф-лы, 2 ил., 15 табл.
Реферат
Настоящее изобретение относится к IL-17-связывающей молекуле, прежде всего к антителу к человеческому IL-17, более предпочтительно к человеческому антителу к человеческому IL-17 (который обозначают также IL-17A), и к применению таких антител при лечении опосредуемых IL-17 заболеваний и нарушений.
IL-17, продуцируемый Т-клетками цитокин, присутствующий, например, при ревматоидном артрите (РА), действует в качестве провоспалительного цитокина, прежде всего в сочетании с IL-1 и TNF-α (Chabaud M. и Miossec P., Arthritis Rheum 42, 1999 сс.963-970; Awane M. и др., J. Immunol 162, 1999, сс.5337-5344). IL-17 индуцирует производство ММР и осуществляет понижающую регуляцию TIMP (Jovanovic D.V. и др., J. Rheumatol. 28, 2001, сс.712-718), и блокада IL-1 и IL-17 оказывает синергетическое действие на воспаление и разрушение кости in vivo (Chabaud M. и Miossec, Arthritis Rheum 44, 2001, сс.1293-1303). Нарушение производства или избыточное производство IL-17 связано с патологией, характерной для различных заболеваний и нарушений, таких как ревматоидный артрит (Witowski и др., Cell Mol Life Sci 61, 2004, сс.567-579), остеоартрит, расшатывание костных имплантатов, острое отторжение трансплантатов (Antonysamy и др., J Immunol 162, 1999, сс.577-584; van Kooten и др., J Am Soc Nephrol 9, 1998, сс.1526-1534), септицемия, септический или эндотоксический шок, различные типы аллергий, астма (Molet и др., J Allergy Clin Immunol 108, 2001, сс.430-438), потеря костной ткани, псориаз (Teunissen и др., J Invest Dermatol 111, 1998, сс.645-649), ишемия, системный склероз (Kurasawa и др., Arthritis Rheum 43, 2000, сс.2455-2463), «удар» и другие воспалительные нарушения. Для лечения опосредуемых IL-17 заболеваний и нарушений были предложено применять антитела к IL-17; см., например, WO 95/18826 и обсуждение, приведенное во введении.
При создании настоящего изобретения были созданы обладающие улучшенными характеристиками антитела к человеческому IL-17, которые можно применять для лечения опосредуемых IL-17 заболеваний и нарушений.
Таким образом, изобретение относится к IL-17-связывающей молекуле, которая содержит антигенсвязывающий центр, включающий по меньшей мере одну вариабельную область тяжелой цепи (VH) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1, CDR2 и CDR3, где CDR1 имеет аминокислотную последовательность SEQ ID NO:I (N-Y-W-M-N), CDR2 имеет аминокислотную последовательность SEQ ID NO:2 (A-I-N-Q-D-G-S-E-K-Y-Y-V-G-S-V-K-G) и CDR3 имеет аминокислотную последовательность SEQ ID NO:3 (D-Y-Y-D-I-L-T-D-Y-Y-I-H-Y-W-Y-F-D-L);
или ее непосредственным эквивалентам, содержащим модифицированные CDR (CDR-эквиваленты).
Изобретение относится также к IL-17-связывающей молекуле, содержащей по меньшей мере одну вариабельную область легкой цепи (VL) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1', CDR2' и CDR3', где CDR1' имеет аминокислотную последовательность SEQ ID NO:4 (R-A-S-Q-S-V-S-S-S-Y-L-A), CDR2' имеет аминокислотную последовательность SEQ ID NO:5 (G-A-S-S-R-A-Т) и CDR3' имеет аминокислотную последовательность SEQ ID NO:6 (Q-Q-Y-G-S-S-P-C-T); или непосредственным CDR'-эквивалентам.
Другой вариант осуществления изобретения относится к IL-17-связывающей молекуле, которая содержит антигенсвязывающий центр, включающий по меньшей мере одну вариабельную область тяжелой цепи (VH) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1-x, CDR2-x и CDR3-x, где CDR1-x имеет аминокислотную последовательность SEQ ID NO:11 (G-F-T-F-S-N-Y-W-M-N), CDR2-x имеет аминокислотную последовательность SEQ ID NO:12 (A-I-N-Q-D-G-S-E-K-Y-Y) и CDR3-x имеет аминокислотную последовательность SEQ ID NO:
13 (C-V-R-D-Y-Y-D-I-L-T-D-Y-Y-I-H-Y-W-Y-F-D-L-W-G); или непосредственным CDR-x-эквивалентам.
Кроме того, изобретение относится также к IL-17-связывающей молекуле, которая содержит вариабельные области и тяжелой (VH) и легкой цепи (VL); при этом указанная IL-17-связывающая молекула содержит по меньшей мере один антигенсвязывающий центр, включающий:
а) вариабельную область тяжелой цепи (VH) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1, CDR2 и CDR3, где CDR1 имеет аминокислотную последовательность SEQ ID NO:1, CDR2 имеет аминокислотную последовательность SEQ ID NO:2 и CDR3 имеет аминокислотную последовательность SEQ ID NO:3, или непосредственные CDR-эквиваленты; и
б) вариабельную область легкой цепи (VL) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1', CDR2' и CDR3', где CDR1' имеет аминокислотную последовательность SEQ ID NO:4, CDR2' имеет аминокислотную последовательность SEQ ID NO:5 и CDR3' имеет аминокислотную последовательность SEQ ID NO:6, или непосредственные CDR'-эквиваленты.
Кроме того, изобретение относится также к IL-17-связывающей молекуле, которая содержит вариабельные области и тяжелой (VH) и легкой цепи (VL); при этом указанная IL-17-связывающая молекула содержит по меньшей мере один антигенсвязывающий центр, включающий:
а) вариабельную область тяжелой цепи (VH) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1-x, CDR2-x и CDR3-x, где CDR1-x имеет аминокислотную последовательность SEQ ID NO:11, CDR2-x имеет аминокислотную последовательность SEQ ID NO:12 и CDR3-x имеет аминокислотную последовательность SEQ ID NO:13, или непосредственные CDR-x-эквиваленты; и
б) вариабельную область легкой цепи (VL) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1', CDR2' и CDR3', где CDR1' имеет аминокислотную последовательность SEQ ID NO:4, CDR2' имеет аминокислотную последовательность SEQ ID NO:5 и CDR3' имеет аминокислотную последовательность SEQ ID NO:6, или непосредственные CDR'-эквиваленты.
Если не указано иное, любая представленная в описании полипептидная цепь имеет аминокислотную последовательность, которая начинается на N-конце и заканчивается на С-конце. Если антигенсвязывающий центр содержит и VH-, и VL-области, то они могут быть расположены на одной и той же полипептидной молекуле или предпочтительно каждая область может располагаться на разных цепях, VH-область может быть частью тяжелой цепи иммуноглобулина или ее фрагмента, а VL-область - частью легкой цепи иммуноглобулина или ее фрагмента.
Понятие «IL-17-связывающая молекула» обозначает любую молекулу, которая обладает способностью связываться с антигеном IL-17 либо индивидуально, либо в сочетании с другими молекулами. Реакцию связывания можно идентифицировать с помощью стандартных методов (качественные анализы), которые включают, например, анализ связывания, конкурентный анализ или биологический анализ, предназначенный для оценки ингибирования связывания IL-17 с его рецептором, или анализы связывания любого типа, в сравнении с отрицательным контролем, в котором используют антитело неродственной специфичности, но относящееся к тому же изотипу, например антитело к CD25 (см. пример 1).
Примеры антигенсвязывающих молекул включают антитела, продуцируемые В-клетками или гибридомами, и химерные антитела, антитела со встроенными путем трансплантации CDR или человеческие антитела или любые их фрагменты, например F(ab')2- и Fab-фрагменты, а также одноцепочечные или содержащие один домен антитела.
Одноцепочечное антитело состоит из вариабельных областей тяжелых и легких цепей антитела, ковалентно связанных пептидным линкером, который, как правило, состоит из 10-30 аминокислот, предпочтительно из 15-25 аминокислот. Таким образом, эта структура не включает константную область тяжелых и легких цепей, и можно предположить, что небольшой пептидный спейсер должен обладать менее выраженными антигенными свойствами, чем вся константная область. Понятие «химерное антитело» относится к антителу, в котором константные области тяжелых или легких цепей или и тех и других цепей получают из организма человека, а вариабельные области как тяжелых, так и легких цепей получают из организма кроме человека (например, мыши) или из организма человека, но которое представляет собой другое человеческое антитело. Понятие «антитело со встроенным путем трансплантации CDR» обозначает антитело, в котором гипервариабельные участки (CDR) получают из антитела-донора, такого как антитело из организма кроме человека (например, мыши) или другое человеческое антитело, в то время как все или практически все другие части иммуноглобулина, например константные области и высококонсервативные участки вариабельных областей, т.е. каркасные участки, получают из антитела-акцептора, например антитела из организма человека. Однако антитело с встроенным путем трансплантации CDR может включать небольшое количество аминокислот последовательности-донора в каркасных участках, например в частях каркасных участков, примыкающих к гипервариабельным участкам. Понятие «человеческое антитело» обозначает антитело, в котором все константные и вариабельные области как тяжелых, так и легких цепей получают из организма человека или они практически идентичны последовательностям антитела человека, но необязательно получены из этого же антитела, и включают полученные в организме мыши антитела, в которых мышиные гены вариабельных и константных областей иммуноглобулина заменены их человеческими копиями, например, как описано в ЕР 0546073 В1, US 5545806, 5569825, 5625126, 5633425, 5661016, 5770429. ЕР 0438474 В1 и ЕР 0463151 В1.
Особенно предпочтительные IL-17-связывающие молекулы, предлагаемые в изобретении, представляют собой человеческие антитела, прежде всего антитело AIN457, описанное ниже в примерах 1 и 2.
Так, в предпочтительных химерных антителах вариабельные области как тяжелой, так и легкой цепей получают из организма человека, например из антитела AIN457, последовательности которых представлены в SEQ ID NO:10 (вариабельная область легкой цепи, т.е. аминокислоты 1-109 SEQ ID NO:10) и SEQ ID NO:8 (вариабельная область тяжелой цепи, т.е. аминокислоты 1-127 SEQ ID NO:8). Домены константных областей предпочтительно также содержат приемлемые домены человеческих константных областей, например, как это описано в «Sequences of Proteins of Immunological Interest», Kabat E.A. и др., US Department of Health and Human Services, Public Health Service, National Institute of Health.
Гипервариабельные участки могут быть связаны с каркасными участками любого типа, хотя предпочтительно их получают из организма человека. Приемлемые каркасные участки описаны у Kabat E.A. и др., там же. Предпочтительный каркасный участок тяжелой цепи представляет собой каркасный участок человеческой тяжелой цепи, например антитела AIN457. Он состоит из последовательно расположенных участков FR1 (аминокислоты 1-30 SEQ ID NO:8), FR2 (аминокислоты 36-49 SEQ ID NO:8), FR3 (аминокислоты 67-98 SEQ ID NO:8) и FR4 (аминокислоты 117-127 SEQ ID NO:8). С учетом данных рентгеноструктурного анализа, с помощью которого определяли гипервариабельные участки AIN457, другой предпочтительный каркасный участок состоит из последовательно расположенных участков FR1-x (аминокислоты 1-25 SEQ ID NO:8), FR2-x (аминокислоты 36-49 SEQ ID NO:8), FR3-x (аминокислоты 61-95 SEQ ID NO:8) и FR4-x (аминокислоты 119-127 SEQ ID NO:8). Аналогично этому каркасный участок легкой цепи состоит из последовательно расположенных участков FR1' (аминокислоты 1-23 SEQ ID NO:10), FR2' (аминокислоты 36-50 SEQ ID NO:10), FR3' (аминокислоты 58-89 SEQ ID NO:10) и FR4' (аминокислоты 99-109 SEQ ID NO:10).
Таким образом, изобретение относится также к IL-17-связывающей молекуле, которая содержит по меньшей мере один антигенсвязывающий центр, включающий либо первый домен, аминокислотная последовательность которого практически идентична последовательности, представленной в SEQ ID NO:8, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 127, либо описанный выше первый домен и второй домен, аминокислотная последовательность которого практически идентична последовательности, представленной в SEQ ID NO:10, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 109.
Моноклональные антитела, которые вырабатываются против белка, встречающегося в естественных условиях у всех людей, как правило, получают в организме кроме человека, например в организме мыши, и поэтому они, как правило, представляют собой белки, не встречающиеся в организме человека. Непосредственным результатом этого является то, что полученное с помощью гибридомы ксеногенное антитело при введении людям вызывает нежелательный иммунный ответ, который главным образом опосредуется константной областью ксеногенного иммуноглобулина. Это существенно ограничивает применение таких антител, поскольку их нельзя вводить в течение длительных периодов времени. Вследствие этого особенно предпочтительно применять одноцепочечные, несущие один домен, химерные антитела, антитела со встроенным путем трансплантации CDR или, прежде всего, человеческие антитела, которые при введении людям, по-видимому, не должны вызывать выраженную аллогенную реакцию.
В свете вышеизложенного более предпочтительная IL-17-связывающаяя молекула, предлагаемая в изобретении, представляет собой человеческое антитело к IL-17, которое содержит по меньшей мере
а) тяжелую цепь иммуноглобулина или ее фрагмент, который включает (I) вариабельную область, содержащую последовательно расположенные гипервариабельные участки CDR1, CDR2 и CDR3, или непосредственные CDR-эквиваленты, и (II) константную область человеческой тяжелой цепи или ее фрагмент; где CDR1 имеет аминокислотную последовательность SEQ ID NO:I, CDR2 имеет аминокислотную последовательность SEQ ID NO:2 и CDR3 имеет аминокислотную последовательность SEQ ID NO:3; и
б) легкую цепь иммуноглобулина или ее фрагмент, который включает (I) вариабельную область, содержащую последовательно расположенные гипервариабельные участки и необязательно также гипервариабельные участки CDR1', CDR2' и CDR3' или непосредственные CDR'-эквиваленты, и (II) константную область человеческой легкой цепи или ее фрагмент, где CDR1' имеет аминокислотную последовательность SEQ ID NO:4, CDR2' имеет аминокислотную последовательность SEQ ID NO:5 и CDR3' имеет аминокислотную последовательность SEQ ID NO:6.
В другом варианте IL-17-связывающая молекула, предлагаемая в изобретении, может представлять собой одноцепочечную связывающую молекулу, которая содержит антигенсвязывающий центр антитела, включающий
а) первый домен, который содержит последовательно расположенные гипервариабельные участки CDR1, CDR2 и CDR3, или непосредственные CDR-эквиваленты, где CDR1 имеет аминокислотную последовательность SEQ ID NO:1, CDR2 имеет аминокислотную последовательность SEQ ID NO:2 и CDR3 имеет аминокислотную последовательность SEQ ID NO:3; и
б) второй домен, который содержит гипервариабельные участки CDR1', CDR2' и CDR3', или непосредственные CDR-эквиваленты, где CDR1' имеет аминокислотную последовательность SEQ ID NO:4, CDR2' имеет аминокислотную последовательность SEQ ID NO:5 и CDR3' имеет аминокислотную последовательность SEQ ID NO:6; и
в) пептидный линкер, который связан либо с N-концом первого домена и с С-концом второго домена, либо с С-концом первого домена и с N-концом второго домена.
Как хорошо известно, минорные изменения аминокислотной последовательности, такие как делеция, добавление или замена одной, небольшого количества или даже нескольких аминокислот, могут приводить к получению аллельной формы исходного белка, которая обладает практически идентичными свойствами.
Таким образом, понятие «их непосредственные CDR-эквиваленты» относится к IL-17-связывающим молекулам, содержащим последовательно расположенные гипервариабельные участки CDR1i, CDR2i и CDR3i, (вместо CDR1, CDR2, и CDR3), в которых
(I) гипервариабельный участок CDR1i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR1, последовательность которого представлена в SEQ ID NO:1; и
(II) гипервариабельный участок CDR2i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR2, последовательность которого представлена в SEQ ID NO:2; и
(III) гипервариабельный участок CDR3i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR3, последовательность которого представлена в SEQ ID NO:3; и
(IV) где такая молекула, содержащая последовательно расположенные гипервариабельные участки CDR1i, CDR2i и CDR3i, обладает способностью ингибировать на 50% активность 1 нМ (30 нг/мл) человеческого IL-17, которую измеряют по индуцируемому huIL-17 производству IL-6 в человеческих кожных фибробластах, при концентрации указанной молекулы, составляющей 50нМ, предпочтительно 20 нМ, более предпочтительно 10 нМ, еще более предпочтительно 5 нМ.
Аналогично этому понятие «их непосредственные CDR-x-эквиваленты» относится к IL-17-связывающим молекулам, содержащим последовательно расположенные гипервариабельные участки CDR1i-x, CDR2i-x и CDR3i-x (вместо CDR1-x, CDR2-x, и CDR3-x), в которых
(V) гипервариабельный участок CDR1i-x отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR1-x, последовательность которого представлена в SEQ ID NO:11; и
(VI) гипервариабельный участок CDR2i-x отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR2-x, последовательность которого представлена в SEQ ID NO:12; и
(VII) гипервариабельный участок CDR3i-x отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR3-x, последовательность которого представлена в SEQ ID NO:13; и
(VIII) где такая молекула, содержащая последовательно расположенные гипервариабельные участки CDR1i-x, CDR2i-x и CDR3i-x, обладает способностью ингибировать на 50% активность 1 нМ (30 нг/мл) человеческого IL-17, которую измеряют по индуцируемому huIL-17 производству IL-6 в человеческих кожных фибробластах, при концентрации указанной молекулы, составляющей 50 нМ, предпочтительно 20 нМ, более предпочтительно 10 нМ, еще более предпочтительно 5 нМ.
Аналогично этому понятие «его непосредственные CDR'-эквиваленты» относится к домену, содержащему последовательно расположенные гипервариабельные участки CDR1'i, CDR2'i и CDR3'i, в которых
(I) гипервариабельный участок CDR1'i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR1', последовательность которого представлена в SEQ ID NO:4; и
(II) гипервариабельный участок CDR2'i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR2', последовательность которого представлена в SEQ ID NO:5; и
(III) гипервариабельный участок CDR3'i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR3', последовательность которого представлена в SEQ ID NO:6; и
(IV) где такая молекула, содержащая последовательно расположенные гипервариабельные участки CDR1'i CDR2'i и CDR3'i, обладает способностью ингибировать на 50% активность 1 нМ (30 нг/мл) человеческого IL-17, которую измеряют по индуцируемому huIL-17 производству IL-6 в человеческих кожных фибробластах, при концентрации указанной молекулы, составляющей 50 нМ, предпочтительно 20нМ, более предпочтительно 10 нМ, еще более предпочтительно 5 нМ.
В альтернативном варианте IL-17-связывающая молекула, предлагаемая в изобретении, может представлять собой IL-17-связывающую молекулу, которая содержит по меньшей мере один антигенсвязывающий центр, включающий по меньшей мере одну вариабельную область тяжелой цепи (VH) иммуноглобулина, которая содержит последовательно расположенные
а) гипервариабельные участки CDR1 (SEQ ID NO:1), CDR2 (SEQ ID NO:2) и CDR3 (SEQ ID NO:3); или
б) гипервариабельные участки CDR1i, CDR2i, CDR3i, где гипервариабельный участок CDR1i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR1, последовательность которого представлена в SEQ ID NO:1; гипервариабельный участок CDR2i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR2, последовательность которого представлена в SEQ ID NO:2; и гипервариабельный участок CDR3i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR3, последовательность которого представлена в SEQ ID NO:3; и
указанная IL-17-связывающая молекула, содержащая последовательно расположенные гипервариабельные участки CDR1x, CDR2x и CDR3x, обладает способностью ингибировать на 50% активность 1 нМ (30 нг/мл) человеческого IL-17, которую измеряют по индуцируемому huIL-17 производству IL-6 в человеческих кожных фибробластах, при концентрации указанной молекулы, составляющей 50 нМ, предпочтительно 20 нМ, более предпочтительно 10 нМ, еще более предпочтительно 5 нМ.
Аналогично этому IL-17-связывающая молекула, предлагаемая в изобретении, может представлять собой IL-17-связывающую молекулу, которая содержит по меньшей мере один антигенсвязывающий центр, включающий по меньшей мере одну вариабельную область тяжелой цепи (VH) иммуноглобулина, которая содержит последовательно расположенные
а) гипервариабельные участки CDR1-x (SEQ ID NO:11), CDR2-x (SEQ ID NO:12) и CDR3-x (SEQ ID NO:13); или
б) гипервариабельные участки CDR1i-x, CDR2i-x, CDR3i-x, где гипервариабельный участок CDR1i-x отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR1-x, последовательность которого представлена в SEQ ID NO:11; гипервариабельный участок CDR2i-x отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR2-x, последовательность которого представлена в SEQ ID NO:12; и гипервариабельный участок CDR3i-x отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR3-x, последовательность которого представлена в SEQ ID NO:13; и
указанная IL-17-связывающая молекула, содержащая последовательно расположенные гипервариабельные участки CDR1i-x, CDR2i-x и CDR3i-x, обладает способностью ингибировать на 50% активность 1 нМ (30 нг/мл) человеческого IL-17, которую измеряют по индуцируемому huIL-17 производству IL-6 в человеческих кожных фибробластах, при концентрации указанной молекулы, составляющей 50 нМ, предпочтительно 20 нМ, более предпочтительно 10 нМ, еще более предпочтительно 5 нМ.
Аналогично этому IL-17-связывающая молекула, предлагаемая в изобретении, может представлять собой IL-17-связывающую молекулу, которая содержит по меньшей мере один антигенсвязывающий центр, включающий по меньшей мере одну вариабельную область легкой цепи (VL) иммуноглобулина, которая содержит последовательно расположенные
а) гипервариабельные участки CDR1' (SEQ ID NO:4), CDR2' (SEQ ID NO:5) и CDR3' (SEQ ID NO:6); или
б) гипервариабельные участки CDR1'i, CDR2'i, CDR3'i, где гипервариабельный участок CDR1'i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR1', последовательность которого представлена в SEQ ID NO:4; гипервариабельный участок CDR2'i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR2', последовательность которого представлена в SEQ ID NO:5; и гипервариабельный участок CDR3'i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR3', последовательность которого представлена в SEQ ID NO:6; и
указанная IL-17-связывающая молекула, содержащая последовательно расположенные гипервариабельные участки CDR1'i, CDR2'i и CDR3'i, обладает способностью ингибировать на 50% активность 1 нМ (30 нг/мл) человеческого IL-17, которую измеряют по индуцируемому huIL-17 производству IL-6 в человеческих кожных фибробластах, при концентрации указанной молекулы, составляющей 50 нМ, предпочтительно 20 нМ, более предпочтительно 10 нМ, еще более предпочтительно 5 нМ.
В альтернативном варианте IL-17-связывающая молекула, предлагаемая в изобретении, может представлять собой IL-17-связывающую молекулу, которая содержит вариабельные области как тяжелой цепи (VH), так и легкой цепи (VL), и IL-17-связывающая молекула содержит по меньшей мере один антигенсвязывающий центр, включающий:
а) вариабельную область тяжелой цепи (VH) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1 (SEQ ID NO:1), CDR2 (SEQ ID NO:2) и CDR3 (SEQ ID NO:3); и
вариабельную область легкой цепи (VL) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1' (SEQ ID NO:4), CDR2' (SEQ ID NO:5) и CDR3' (SEQ ID NO:6); или
б) вариабельную область тяжелой цепи (VH) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1i, CDR2i, CDR3i, где гипервариабельные участки CDR1i, CDR2i, CDR3i характеризуются тем, что гипервариабельный участок CDR1i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR1, последовательность которого представлена в SEQ ID NO:1; гипервариабельный участок CDR2i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR2, последовательность которого представлена в SEQ ID NO:2; и гипервариабельный участок CDR3i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR3, последовательность которого представлена в SEQ ID NO:3; и
вариабельную область легкой цепи (VL) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1'i, CDR2'i, CDR3'i, где гипервариабельный участок CDR1'i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR1', последовательность которого представлена в SEQ ID NO:4; гипервариабельный участок CDR2'i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR2', последовательность которого представлена в SEQ ID NO:5; и гипервариабельный участок CDR3'i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR3', последовательность которого представлена в SEQ ID NO:6; и
IL-17-связывающая молекула, указанная в подпункте б), которая содержит последовательно расположенные гипервариабельные участки CDR1i, CDR2i, CDR3i, CDR1i, CDR2'i и CDR3'i, обладает способностью ингибировать на 50% активность 1нМ (30 нг/мл) человеческого IL-17, которую измеряют по индуцируемому huIL-17 производству IL-6 в человеческих кожных фибробластах, при концентрации указанной молекулы, составляющей 50 нМ, предпочтительно 20 нМ, более предпочтительно 10 нМ, еще более предпочтительно 5 нМ.
В альтернативном варианте IL-17-связывающая молекула, предлагаемая в изобретении, может представлять собой IL-17-связывающую молекулу, которая содержит вариабельные области как тяжелой цепи (VH), так и легкой цепи (VL) иммуноглобулина, и IL-17-связывающая молекула содержит по меньшей мере один антигенсвязывающий центр, включающий:
а) вариабельную область тяжелой цепи (VH) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1-x (SEQ ID NO:11), CDR2-x (SEQ ID NO:12) и CDR3-x (SEQ ID NO:13); и
вариабельную область легкой цепи (VL) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1' (SEQ ID NO:4), CDR2' (SEQ ID NO:5) и CDR3' (SEQ ID NO:6); или
б) вариабельную область тяжелой цепи (VH) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1i-x, CDR2i-x и CDR3i-x, где гипервариабельные участки CDR1i, CDR2i, CDR3i характеризуются тем, что гипервариабельный участок CDR1i-x отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR1-x, последовательность которого представлена в SEQ ID NO:11; гипервариабельный участок CDR2i-x отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR2, последовательность которого представлена в SEQ ID NO:12; и гипервариабельный участок CDR3i-x отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR3-x, последовательность которого представлена в SEQ ID NO:13; и
вариабельную область легкой цепи (VL) иммуноглобулина, которая содержит последовательно расположенные гипервариабельные участки CDR1'i, CDR2'i, CDR3'i, где гипервариабельный участок CDR1'i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR1', последовательность которого представлена в SEQ ID NO:4; гипервариабельный участок CDR2'i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR2', последовательность которого представлена в SEQ ID NO:5; и гипервариабельный участок CDR3'i отличается тремя, предпочтительно двумя, более предпочтительно одной аминокислотой от гипервариабельного участка CDR3', последовательность которого представлена в SEQ ID NO:6; и
IL-17-связывающая молекула, указанная в подпункте б), которая содержит последовательно расположенные гипервариабельные участки CDR1i, CDR2i, CDR3i, CDR1'i, CDR2'i и CDR3'i, обладает способностью ингибировать на 50% активность 1 нМ (30 нг/мл) человеческого IL-17, которую измеряют по индуцируемому huIL-17 производству IL-6 в человеческих кожных фибробластах, при концентрации указанной молекулы, составляющей 50 нМ, предпочтительно 20 нМ, более предпочтительно 10 нМ, еще более предпочтительно 5 нМ.
Ингибирование связывания IL-17 с его рецептором удобно тестировать путем проведения различных анализов, включая анализы, которые описаны ниже. Понятие «в такой же степени» обозначает, что молекула, с которой проводится сравнение, и эквивалентная молекула обладают практически одинаковой с точки зрения статистики активностью в отношении ингибирования IL-17 при исследовании с помощью одного из указанных в настоящем описании методов (см. пример 1). Например, IL-17-связывающие молекулы, предлагаемые в изобретении, как правило, имеют значения IC50, характеризующие ингибирование человеческого IL-17, которое оценивают по индуцируемому человеческим IL-17 производству IL-6 в человеческих кожных фибробластах, находящиеся в пределах +/- ×5, т.е. ниже 10 нМ, более предпочтительно 9, 8, 7, 6, 5, 4, 3 или 2 нМ (предпочтительно являются практически одинаковыми) относительно IC50 соответствующей молекулы, с которой проводится сравнение, при анализе с помощью методов, описанных в примере 1.
В альтернативном варианте применяемый анализ может представлять собой анализ конкурентного ингибирования связывания IL-17 с растворимыми IL-17-рецепторами (например, конструкциями человеческий IL-17 R/Fc, описанными в примере 1) и IL-17-связывающими молекулами, предлагаемыми в изобретении.
Наиболее предпочтительно человеческое антитело к IL-17 содержит по меньшей мере
а) одну тяжелую цепь, которая несет вариабельную область, аминокислотная последовательность которой практически идентична последовательности, представленной в SEQ ID NO:8, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 127, и константную область человеческой тяжелой цепи; и
б) одну легкую цепь, которая несет вариабельную область, аминокислотная последовательность которой практически идентична последовательности, представленной в SEQ ID NO:10, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 109, и константную область человеческой легкой цепи.
Константная область человеческой тяжелой цепи может быть γ1-, γ2-, γ3-, γ4-, µ-, α1-, α2-, δ- или ε-типа, предпочтительно γ-типа, более предпочтительно γ-типа, а константная область человеческой легкой цепи может быть κ- или λ-типа (включая λ1-, λ2- и λ3-подтипы), но предпочтительно κ-типа. Аминокислотные последовательности всех указанных константных областей приведены у Кэбота и др., выше.
Под объем изобретения подпадают также конъюгаты связывающих молекул, предлагаемых в изобретении, например конъюгаты с ферментом или токсином, или с радиоизотопом.
Понятие «полипептид», если в описании не указано иное, относится к любому пептиду или белку, который содержит аминокислоты, соединенные друг с другом пептидными связями, аминокислотная последовательность которого начинается на N-конце и заканчивается на С-конце. Предпочтительно полипептид, предлагаемый в настоящем изобретении, представляет собой моноклональное антитело, более предпочтительно химерное (также называемое антителом со встроенными путем трансплантации V-областями) или гуманизированное (также называемое антителом со встроенными путем трансплантации CDR) моноклональное антитело, наиболее предпочтительно полностью человеческое антитело, которое можно получать с помощью технологии, описанной в примере. Гуманизированное (со встроенными путем трансплантации гипервариабельными участками (CDR)) или полностью человеческое моноклональное антитело может содержать дополнительные мутации, введенные в последовательности каркасного участка (FR) акцепторного антитела, но может и не содержать их.
В контексте настоящего описания понятие «функциональное производное полипептида» относится к молекуле, обладающей качественной биологической активностью, присущей полипептиду, предлагаемому в настоящем изобретении, т.е. обладающей способностью связываться с человеческим IL-17. Понятие «функциональное производное» включает фрагменты и пептидные аналоги полипептида, предлагаемого в настоящем изобретении. Фрагменты представляют собой участки последовательности полипептида, предлагаемого в настоящем изобретении, например, конкретной последовательности. Понятие «производное» применяют для обозначения вариантов аминокислотной последовательности и ковалентных модификаций полипептида, предлагаемого в настоящем изобретении, например конкретной последовательности. Функциональные производные полипептида, предлагаемого в настоящем изобретении, например, конкретной последовательности, например гипервариабельного участка легкой и тяжелой цепи, предпочтительно имеют последовательности, которые гомологичны по меньшей мере примерно на 65%, более предпочтительно по меньшей мере примерно на 75%, еще более предпочтительно по меньшей мере примерно на 85%, наиболее предпочтительно по меньшей мере примерно на 95, 96, 97, 98, 99% полной аминокислотной последовательности полипептида, предлагаемого в настоящем изобретении, например конкретной последовательности, и сохраняют практически такую же способность связываться с человеческим IL-17 или, например, нейтрализовать индуцируемое IL-17 производство IL-6 в человеческих кожных фибробластах.
Понятие «ковалентная модификация» включает модификации полипептида, предлагаемого в настоящем изобретении, например, конкретной последовательности; или его фрагмента с использованием органического белкового или небелкового дериватизирующего агента, слияния с гетерологичными полипептидными последовательностями и посттрансляционные модификации. Ковалентно модифицированные полипептиды, например, имеющие конкретную последовательность, все еще сохраняют способность связываться с человеческим IL-17 или, например, нейтрализовать индуцируемое IL-17 производство IL-6 в человеческих кожных фибробластах. Как правило, ковалентные модификации интродуцируют путем взаимодействия аминокислотных остатков-мишеней с органическим дериватизирующим агентом, который обладает способностью взаимодействовать с выбранными боковыми или концевыми остатками, или путем использования механизмов посттрансляционных модификаций, функционирующих в выбранных рекомбинантных клетках-хозяевах. Определенные пост-трансляционные модификации являются результатом воздействия рекомбинантных клеток-хозяев на экспрессируемый полипептид. Глутаминильные и аспарагинильные остатки часто деамидируют после трансляции с получением соответствующих глутамильных и аспартильных остатков. В другом варианте эти остатки деаминируют в мягких кислотных условиях. Другие пост-трансляционные модификации включают гидроксилирование пролина и лизина, фосфо