Составы и способы лечения заболеваний и нарушений, связанных с передачей сигналов цитокинами
Иллюстрации
Показать всеНастоящее изобретение относится к иммунологии и биотехнологии. Предложены варианты антител, специфичных к IL22 человека. Антитела отличаются тем, что их получают из разных гибридом РТА-7312, РТА-7315, РТА-7319. Антитело из РТА-7312 характеризуется тем, что ингибирует активацию STAT3, достигая IC50 при концентрации 0,14 мкг/мл, тогда как антитела из РТА-7315, РТА-7319 характеризуются Kd менее 1 нМ. Использование изобретения может найти дальнейшее применение в терапии иммунных расстройств, опосредованных IL22. 3 н. и 21 з.п. ф-лы, 1 табл., 41 ил.
Реферат
Эта заявка основана на предварительной заявке США № 60/741640, зарегистрированной 2 декабря 2005 г., и предварительной заявке США № 60/822597, зарегистрированной 16 августа 2006 г., раскрытие которых приведено полностью в данном документе посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к составам и способам, полезным для диагностики и лечения заболеваний и нарушений, связанных с передачей сигналов цитокинами.
УРОВЕНЬ ТЕХНИКИ
Различные заболевания и нарушения связаны с воспалением. Воспаление представляет собой процесс, связанный с рекрутированием воспалительных клеток (например, лейкоцитов) в область повреждения или инфицирования. Однако чрезмерное или неадекватное воспаление может обладать отрицательным действием. Аутоиммунные нарушения, например, часто вызывают воспаление, приводя к разрушению нормальных тканей тела. Воспаление, кроме того, связано с раком. См., например, Coussens et al. (2002) Nature 420:860-867. Например, связанное с воспалительной болезнью кишечника (IBD) хроническое воспаление строго коррелирует с кишечным канцерогенезом. Во время воспалительной реакции определенные воспалительные клетки синтезируют вещества, которые стимулируют ангиогенез, снижают антиопухолевую активность цитоксичных T-клеток и уменьшают мутации ДНК, таким образом, создавая окружение ускоренной опухолевой прогрессии Id.
IL-23 представляет собой гетеродимерный цитокин, который играет доминантную роль при аутоиммунных/воспалительных нарушениях, и в частности при хроническом воспалении. Например, в исследованиях на мышах показано, что IL-23 чрезвычайно важен для развития экспериментального аллергического энцефаломиелита (аутоиммунное воспаление мозга), который является моделью рассеянного склероза; коллаген-индуцированного артрита, который является моделью ревматоидного артрита; и гиперчувствительности замедленного типа. IL-23 также функционирует для поддержания стабилизированного колита (форма IBD). Трансгенная экспрессия IL-23 приводит к системной воспалительной реакции, а нарушение регуляции IL-23 приводит к экзематозной болезни кожи (воспалительное состояние кожи). IL-23 активирует специфичную популяцию Т-клеток (ThIL-17 клетки), которые в свою очередь вызывают продукцию ThIL-17 и провоспалительных цитокинов. Для обзора роли IL-23 при воспалении и аутоиммунной реакции см., например, Hunter (2005) Nat. Rev. Immunol. 5:521-531; и Holscher (2005) Curr. Opin. Invest. Drugs 6:489-495. Было показано, что IL-23 также ускоряет опухолевый рост путем увеличения ангиогенеза и уменьшения опухолевой инфильтрации цитотоксическими Т-клетками. Langowski et al. (2006), Nature 442:461-465.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Представлены составы и способы, полезные для диагностирования и лечения воспалительных нарушений и аутоиммунных нарушений (например, псориаз). Далее представлены составы и способы, полезные для изменения передачи сигнала IL-23 или IL-22. Эти и другие варианты осуществления изобретения представлены в данном документе. Настоящее изобретение частично основано на идентификации (определении) пути передачи сигнала, в котором IL-23 действует через IL-22, стимулируя экспрессию IL-22 в недавно открытой подгруппе Т-клеток-хелперов (Th клетки), то есть ThIL-17 линии. В одном аспекте, представлено антитело, которое специфически связывается с IL-22, в котором антитело представляет собой (a) антитело, производимое гибридомой, выбранной из 3F11.3 (ATCC каталог № PTA-7312), гибридомой 11H4.4 (ATCC каталог № PTA-7315), и гибридомой 8E11.9 (ATCC каталог № PTA-7319); (b) аффинной созревшей формой антитела (a); (c) антигенсвязывающим фрагментом антитела (a) или (b); или (d) гуманизированной формой антитела (a), (b) или (c).
В другом аспекте, представлено антитело, которое специфически связывается с IL-22R, в котором антитело представляет собой (a) антитело, производимое гибридомой, выбранной из 7E9 (ATCC каталог № PTA-7313), гибридомой 8A12 (ATCC каталог № PTA-7318), и гибридомой 8H11 (ATCC каталог № PTA-7317); (b) аффинной созревшей формой антитела (a); (c) антигенсвязывающим фрагментом антитела (a) или (b); или (d) гуманизированной формой антитела (a), (b) или (c).
В другом аспекте, представлен способ лечения аутоиммунного нарушения, в котором аутоиммунное нарушение не является артритом, способ, включающий введение млекопитающим эффективного количества фармацевтического состава, содержащего антагонист IL-22. В одном варианте осуществления, антагонист IL-22 представляет собой антитело, которое специфически связывается с IL-22. В одном таком варианте осуществления, антитело, которое специфически связывается с IL-22, представляет собой (a) антитело, производимое гибридомой, выбранной из 3F11.3 (ATCC каталог № PTA-7312), гибридомой 11H4.4 (ATCC каталог № PTA-7315) и гибридомой 8E11.9 (ATCC каталог № PTA-7319); (b) аффинной созревшей формой антитела (a); (c) антигенсвязывающим фрагментом антитела (a) или (b); или (d) гуманизированной формой антитела (a), (b) или (c). В другом варианте осуществления, антагонист IL-22 представляет антитело, которое специфически связывается с IL-22R. В одном таком варианте осуществления, антитело, которое специфически связывается с IL-22R, представляет собой (a) антитело, производимое гибридомой, выбранной из (ATCC каталог № PTA-7313), гибридомой 8A12 (ATCC каталог № PTA-7318) и гибридомой 8H11 (ATCC каталог № PTA-7317); (b) аффинной созревшей формой антитела (a); (c) антигенсвязывающим фрагментом антитела (a) или (b); или (d) гуманизированной формой антитела (a), (b) или (c). В одном варианте осуществления, антагонист IL-22 представляет собой IL-22BP. В одном варианте осуществления, аутоиммунное заболевание представляет собой воспалительное заболевание кишечника. В одном варианте осуществления, аутоиммунное заболевание представляет собой псориаз. В одном варианте осуществления, способ в дальнейшем включает в себя введение как минимум одного вида антител, выбранного из антитела, которое специфически связывается с IL20Ra, антитела, которое специфически связывается с IL20Rb, и антитела, которое специфически связывает IL-22R. В одном варианте осуществления, способ в дальнейшем включает в себя введение как минимум одного вида антител, выбранного из антитела, которое специфически связывает IL-22, антитела, которое специфически связывает IL20Ra, и антитела, которое специфически связывает IL20Rb.
В другом аспекте, представлен способ лечения воспаления, в котором воспаление не является воспалением при артрите, способ, включающий введение млекопитающему эффективного количества фармацевтического состава, включающего антагонист IL-22. В одном варианте осуществления, антагонист IL-22 представляет собой антитело, которое специфически связывает IL-22. В одном таком варианте осуществления, антитело, которое специфически связывает IL-22, представляет собой (a) антитело, производимое гибридомой, выбранной из 3F11.3 (ATCC каталог № PTA-7312), гибридомой 11H4.4 (ATCC каталог № PTA-7315) и гибридомой 8E11.9 (ATCC каталог № PTA-7319); (b) аффинной созревшей формой антитела (a); (c) антигенсвязывающим фрагментом антитела (a) или (b); или (d) гуманизированной формой антитела (a), (b) или (c). В одном варианте осуществления, антагонист IL-22 представляет собой антитело, которое специфически связывает IL-22R. В одном таком варианте осуществления, антитело, которое специфически связывает IL-22R, представляет собой (a) антитело, производимое гибридомой, выбранной из 7E9 (ATCC каталог № PTA-7313), гибридомой 8A12 (ATCC каталог № PTA-7318) и гибридомой 8H11 (ATCC каталог № PTA-7317); (b) аффинной созревшей формой антитела (a); (c) антигенсвязывающим фрагментом антитела (a) или (b); или (d) гуманизированной формой антитела (a), (b) или (c). В одном варианте осуществления, антагонист IL-22 представляет собой IL-22BP. В одном варианте осуществления, воспаление представляет собой аутоиммунное воспаление. В одном варианте осуществления, воспаление представляет собой воспаление кожи. В одном варианте осуществления, воспаление представляет собой хроническое воспаление.
В другом аспекте, представлен способ подавления опухолевой прогрессии, способ, включающий введение млекопитающему эффективного количества фармацевтического состава, содержащего антагонист IL-22. В одном варианте осуществления, антагонист IL-22 представляет собой антитело, которое специфически связывает IL-22. В другом таком варианте осуществления, антитело, которое специфически связывает IL-22, представляет собой (a) антитело, производимое гибридомой, выбранной из 3F11.3 (ATCC каталог № PTA-7312), гибридомой 11H4.4 (ATCC каталог № PTA-7315) и гибридомой 8E11.9 (ATCC каталог № PTA-7319); (b) аффинной созревшей формой антитела (a); (c) антигенсвязывающим фрагментом антитела (a) или (b); или (d) гуманизированной формой антитела (a), (b) или (c). В одном варианте осуществления, антагонист IL-22 представляет собой антитело, которое специфически связывает IL-22R. В одном таком варианте осуществления, антитело, которое специфически связывает IL-22R, представляет собой (a) антитело, производимое гибридомой, выбранной из 7E9 (ATCC каталог № PTA-7313), гибридомой 8A12 (ATCC каталог № PTA-7318) и гибридомой 8H11 (ATCC каталог № PTA-7317); (b) аффинной созревшей формой антитела (a); (c) антигенсвязывающим фрагментом антитела (a) или (b); или (d) гуманизированной формой антитела (a), (b) или (c). В одном варианте осуществления, антагонист IL-22 представляет собой IL-22BP.
В другом аспекте, представлен способ стимуляции IL-23-опосредованного пути передачи сигнала в биологической системе, способ, включающий обеспечение биологической системы агонистом IL-22. В одном варианте осуществления, агонист IL-22 представляет собой IL-22. В другом аспекте, представлен способ подавления IL-23-опосредованного пути передачи сигнала в биологической системе, способ, включающий подавление биологической системы агонистом IL-22. В одном варианте осуществления, агонист IL-22 представляет собой антитело, которое специфически связывает IL-22. В одном варианте осуществления, агонист IL-22 представляет собой антитело, которое специфически связывает IL-22R.
В другом аспекте, представлен способ стимуляции функции ThIL-17 клетки, способ, включающий воздействие IL-22 агониста на ThIL-17 клетку. В одном варианте осуществления, агонист IL-22 представляет собой IL-22. В другом аспекте, представлен способ подавления функции ThIL-17 клетки, способ, включающий воздействие IL-22 антагониста на ThIL-17 клетки. В одном варианте осуществления, антагонист IL-22 представляет собой антитело, которое специфически связывает IL-22. В одном варианте осуществления, антагонист IL-22 представляет собой антитело, которое специфически связывает IL-22R.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показана нуклеотидная последовательность (SEQ ID NO: 1) кДНК, кодирующая нативный IL-22 человека.
На фиг.2 показана аминокислотная последовательность (SEQ ID NO:2), полученная из кодирующей последовательности SEQ ID NO: 1, показанной на фиг. 1.
На фиг.3 показана аминокислотная последовательность (SEQ ID NO:3) нативного IL-22R человека.
На фиг.4 показана аминокислотная последовательность (SEQ ID NO:4) нативного IL-22BP человека.
На фиг.5 представлен список всех полученных антител к IL-22 и их соответствующих свойств, как описано в примере 1. Внутриклеточное окрашивание сокращено как IC.
На фиг.6 показано, что анти-IL-22 антитела способны блокировать активацию STAT3, как описано в примере 2.
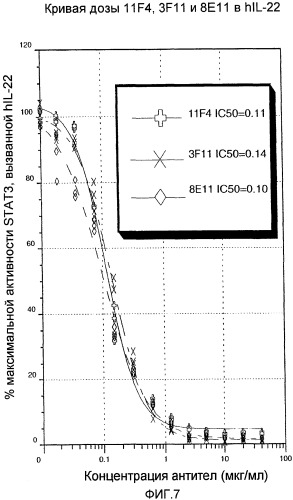
На фиг.7 показано, что три специфических вида анти-IL-22 антител блокируют IL-22 человека зависимым от дозы образом, как описано в примере 3.
На фиг.8 показано, что три специфических вида анти-IL-22 антител IL-22 способны блокировать мышиный IL-22 зависимым от дозы образом, как описано в примере 4.
На фиг.9 представлен расчет аффинности анти-IL-22 антител к IL-22 человека, как описано в примере 5.
На фиг.10 показано, что анти-IL-22 антитела обнаруживают внутриклеточную экспрессию IL-22, как описано в примере 6.
На фиг.11 показано внутриклеточное FACS окрашивание на IL-22 с использованием меченных анти-IL-22 антител, как описано в примере 6.
На фиг.12 показана экспрессия IL-22 в мышиных Th1 клетках, как определено 5' нуклеазным анализом, как описано в примере 7.
На фиг.13 показана экспрессия IL-22 в мышиных γδ Т-клетках, как определено 5' нуклеазным анализом, как описано в примере 8.
На фиг.14 показана экспрессия IL-22 в активированных Т-клетках человека, как определено микрочиповым анализом, как описано в примере 9.
На фиг.15 показан уровень экспрессии IL-22 в Т-клетках путем FACS, как описано в примере 10.
На фиг. 16 показано исследование анти-IL-22R антител на 293 клетках, экспрессирующих IL-22R, как описано в примере 11.
На фиг. 17 показано, что анти-IL-22R антитела могут блокировать вызванную IL-22 экспрессию STAT3 репортерного конструкта, как описано в примере 12.
На фиг. 18 показана экспрессия IL-22R и IL-10R2 на поверхности первичных кератиноцитов, как описано в примере 13.
На фиг. 19 показано, что IL-22 вызывает истончение эпидермиса человека, как описано в примере 14.
На фиг. 20 показано, что IL-22 вызывает экспрессию цитокератина 16, маркера кератиноцитарного метаболизма, как описано в примере 14.
На фиг. 21 показано, что лечение эпидермиса человека IL-22 вызывает индукцию экспрессии псориазина, высокоэкспрессируемого при псориазе гена, как описано в примере 14.
На фиг. 22 показано, что лечение кератиноцитов IL-22 увеличивает экспрессию нескольких генов, включая псориазин, как описано в примере 15.
На фиг. 23 показано, что экспрессия псориазина уменьшается при лечении анти-IL-22 и анти-IL-22R антителами, как описано в примере 14.
На фиг. 24 показано, что эпидермальное истончение уменьшается при лечении анти-IL-22 и анти-IL-22R антителами, как описано в примере 14.
На фиг. 25 показано, что эпидермальное истончение уменьшается при лечении анти-IL-22 и анти-IL-22R антителами, как описано в примере 14.
На фиг. 26 показано, что IL-23 и IL-12 вызывают эпидермальное истончение с отчетливо выраженными гистологическими признаками, как описано в примере 16.
На фиг. 27 показано, что IL-23 вызывает экспрессию IL-22, а IL-22 вызывает кожное воспаление и эпидермальное истончение in vivo, как описано в примере 17 и 18.
На фиг. 28 показано, что IL-12 и IL-23 вызывают экспрессию отдельных групп цитокинов, как описано в примере 17.
На фиг. 29 показано, что лечение анти-IL-22 моноклональными антителами значительно уменьшает IL-23-вызванный эпидермальный акантоз in vivo, как описано в примере 20.
На фиг. 30 представлена стратегия, использованная для разрушения гена IL-22 у мышей, и доказательство, подтверждающее что экспрессия IL-22 отсутствует у IL-22-/- мышей, как описано в примере 20.
На фиг. 31 показано, что IL-23-вызванный акантоз значительно уменьшается у IL-22 дефицитных мышей, как описано в примере 20.
На фиг. 32 показано, что дефицит IL-22 не имеет никакого эффекта на IL-12-вызванный акантоз, как описано в примере 20.
На фиг. 33 показано, что IL-23 вызывает продукцию IL-22 из разных IL-23-активированных лимфоцитов, как описано в примере 21.
На фиг. 34 показано, что IL-22 представляет собой новый эффекторный цитокин из ThIL-17 линии, как описано в примере 22.
На фиг. 35 показано, что IL-22 и IL-17 продуцируются той же самой Th линией (ThIL-17), как описано в примере 22.
На фиг. 36 показано, что IL-23 стимулирует продукцию IL-22 исходя из активации Т-клеток, как описано в примере 22.
На фиг. 37 показано, что IL-19, IL-20, IL-22 и IL24 вызывает эпидермальное истончение, как описано в примере 23.
На фиг. 38 показана количественная оценка эпидермального акантоза, вызванного IL-19, IL-20, IL-22 и IL24, как описано в примере 23.
На фиг.39 показано, что компоненты рецепторов для IL-19, IL-20 и IL-22 экспрессируются в кератиноцитах человека, как описано в примере 24.
На фиг. 40 показано, что блокирующие антитела к компонентам рецептора для IL-19, IL-20 и IL-22 уменьшают экспрессию псориазина, как описано в примере 24.
На фиг. 41 показано, что антитела к IL-20Ra и IL-22R, при использовании в сочетании, эффективно блокируют IL-20-вызванную экспрессию псориазина.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
I. ОПРЕДЕЛЕНИЯ
Термин "IL-22 полипептид" или "IL-22" относятся к разным интерлейкин-22 полипептидам (также обозначенный как "интерлейкин-22 лиганд" или "IL-22L" в данной области). Термин включает нативную последовательность IL-22 полипептидов и их варианты (которые определяются в дальнейшем в данном документе). IL-22 полипептиды, описанные в данном документе, могут быть выделены из различных источников, таких как ткани человека, или другого источника, или полученных рекомбинантными или синтетическими способами. Нативный IL-22 может быть любых видов, например мышиный ("mIL-22") или человеческий ("hIL-22").
Термины "IL-22R полипептид" или "IL-22R" относятся к полипептидному компоненту гетеродимера рецептора интерлейкина-22 или гетеродимера рецептора интерлейкина-20. Термин включает нативную последовательность IL-22R полипептидов и их вариантов (которые определяются в дальнейшем в данном документе). IL-22R полипептиды, описанные в данном документе, могут быть выделены из разных источников, таких как человеческая ткань, или другого источника, или получены рекомбинантными или синтетическими способами. Нативный IL-22R может быть любых видов, например мышиный ("mIL-22R") или человеческий ("hIL-22R"). Нативная последовательность IL-22R полипептидов, также называемая в данной области как "IL-22R1" и "IL22RA." "Нативная последовательность IL-22 полипептида" или "нативная последовательность IL-22R полипептида" относится к полипептиду, включающему ту же самую аминокислотную последовательность, как соответствующие IL-22 или IL-22R полипептиды, полученные в природе. Такая нативная последовательность IL-22 или IL-22R полипептидов может быть выделена природно или может быть получена рекомбинантными или синтетическими способами. Термины, в частности, включают встречающиеся в природе усеченные или секретируемые формы специфического IL-22 или IL-22R полипептида (например, IL-22, не имеющий своего связанного сигнального пептида), встречающиеся в природе различные формы (например, формы альтернативного спласинга), и встречающиеся в природе аллельные варианты полипептида. В различных вариантах осуществления изобретения, нативная последовательность IL-22 или IL-22R полипептидов, раскрытых в данном документе, представляет собой зрелые или полной длины нативные последовательности полипептидов. На фиг.2 и 3 показаны типичные человеческие полной длины IL-22 и IL-22R, соответственно. Нуклеиновая кислота, кодирующая полипептид, показанная на фиг.2, показана на фиг.1. Стартовый и стоп-кодоны показаны на этом чертеже жирным шрифтом и подчеркнуты. Хотя показано, что IL-22 и IL-22R полипептидные последовательности, раскрытые в сопроводительных чертежах, начинаются с остатков метионина, обозначенных в данном документе как аминокислотное положение 1, возможно и вероятно, что другие остатки метионина, расположенные либо в обратном направлении, либо в прямом направлении от аминокислотного положения 1 на чертежах, могут использоваться как стартовый аминокислотный остаток для IL-22 или IL-22R полипептидов.
"IL-22 вариант", "IL-22R вариант", "полипептид IL-22 варианта" или "полипептид IL-22R варианта" означает активный IL-22 или IL-22R полипептид как определено выше, имеющий как минимум примерно 80% идентичности аминокислотной последовательности с нативной последовательностью IL-22 полной длины или IL-22R полипептидной последовательностью. Обычно вариант IL-22 или IL-22R полипептида будет иметь, как минимум, примерно 80% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 81% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 82% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 83% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 84% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 85% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 86% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 87% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 88% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 89% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 90% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 91% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 92% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 93% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 94% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 95% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 96% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 97% идентичности аминокислотной последовательности, альтернативно, как минимум, примерно 98% идентичности аминокислотной последовательности и альтернативно, как минимум, примерно 99% идентичности аминокислотной последовательности к полной длины или зрелой нативной последовательности IL-22 или IL-22R полипептидной последовательности.
"Процент (%) идентичности аминокислотной последовательности" по отношению к IL-22 или IL-22R полипептидным последовательностям, идентифицированным в данном документе, определяется как процент аминокислотных остатков в подходящей последовательности, которые идентичны аминокислотным остаткам в специфической IL-22 или IL-22R полипептидной последовательности, после ориентирования последовательностей и внесения брешей, если необходимо, для получения максимального процента идентичности последовательностей, и не учитывая никаких консервативных замен в рамках идентичности последовательностей. Ориентирование для целей определения процента идентичности аминокислотной последовательности можно получить различными путями, которые известны специалисту в данной области, например с использованием общедоступного компьютерного программного обеспечения, такого как BLAST, BLAST-2, ALIGN или Megalign (DNASTAR) программное обеспечение. Специалисты в данной области могут определять подходящие параметры измерения ориентирования, включая любые алгоритмы, необходимые для получения максимального ориентирования над полной длиной последовательностей, при сравнении. Для сравнений аминокислотных последовательностей, % идентичности аминокислотных последовательностей, данной аминокислотной последовательности A к, с, или против данной аминокислотной последовательности B (которая может альтернативно называться как данная аминокислотная последовательность A, которая имеет или включает некоторый % идентичности аминокислотной последовательности к, с или против данной аминокислотной последовательности B) рассчитывается, как указано ниже:
100 умножить на дробь X/Y,
где X представляет собой количество аминокислотных остатков, отмеченных как идентичные пары программой ориентирования последовательностей в этом программном ориентировании A и B, и где Y представляет собой общее количество аминокислотных остатков в B. Принимая во внимание, что длина аминокислотной последовательности A не эквивалентна длине аминокислотной последовательности B, % идентичности аминокислотной последовательности A к B не будет эквивалентным % идентичности аминокислотной последовательности B к A. В качестве примеров вычислений % идентичности аминокислотной последовательности с использованием этого способа, в таблицах 2 и 3 показано как вычислить % идентичности аминокислотной последовательности, обозначенной "белком сравнения" аминокислотной последовательности, к аминокислотной последовательности, обозначенной "IL-22 или IL-22R", где "IL-22 или IL-22R" представляет аминокислотную последовательность интересующего полипептида IL-22 или IL-22R, "белок сравнения" представляет аминокислотную последовательность полипептида, против которого сравнивается интересующий полипептид "IL-22 или IL-22R", и каждый "X, "Y" и "Z" представляет различные аминокислотные остатки.
| Таблица 2 | ||
| IL-22 или IL-22R | XXXXXXXXXXXXXXX | (длина = 15 аминокислот) |
| белок сравнения | XXXXXYYYYYYY | (длина = 12 аминокислот) |
% идентичности аминокислотной последовательности = (число идентичных парных аминокислотных остатков между двумя полипептидными последовательностями) деленное на (общее количество аминокислотных остатков IL-22 или IL-22R полипептида) = 5 деленное на 15=33,3%
| Таблица 3 | ||
| IL-22 или IL-22R | XXXXXXXXXX | (длина = 10 аминокислот) |
| белок сравнения | XXXXXYYYYYYZZYZ | (длина = 15 аминокислот) |
% идентичности аминокислотной последовательности = (число идентичных парных аминокислотных остатков между двумя полипептидными последовательностями) деленное на (общее количество аминокислотных остатков IL-22 или IL-22R полипептида) = 5 деленное на 10=50%
Термин "IL-19" относится к любому нативному IL-19 из любого позвоночного животного, включая млекопитающих, таких как приматы (например, люди и обезьяны) и грызуны (например, мыши и крысы), если не указано особо. Термин охватывает "полной длины", непроцессируемый IL-19, а также и любую форму IL-19, которая получается в результате процессинга в клетке. Термин также включает встречающиеся в природе варианты IL-19, например сплайс-варианты, аллельные варианты и другие изоформы. Термин также включает фрагменты или варианты нативного IL-19, который поддерживает, как минимум, одну биологическую активность IL-19.
Термин "IL-20" относится к любому нативному IL-20 из любого позвоночного животного, включая млекопитающих, таких как приматы (например, люди и обезьяны) и грызуны (например, мыши и крысы), если не указано особо. Термин включает "полной длины", непроцессируемый IL-20, а также и любую форму IL-20, которая получается в результате процессинга в клетке. Термин также включает встречающиеся в природе варианты IL-20, например сплайс-варианты, аллельные варианты и другие изоформы. Термин также включает фрагменты или варианты нативного IL-20, который поддерживает, как минимум, одну биологическую активность IL-20.
Термин "IL-24" относится к любому нативному IL-24 из любого позвоночного животного, включая млекопитающих, таких как приматы (например, люди и обезьяны) и грызуны (например, мыши и крысы), если нет особого указания. Термин включает "полной длины", непроцессируемый IL-24, а также и любую форму IL-24, которая получается в результате процессинга в клетке. Термин также включает встречающиеся в природе варианты IL-24, например сплайс-варианты, аллельные варианты и другие изоформы. Термин также включает фрагменты или варианты нативного IL-24, который поддерживает, как минимум, одну биологическую активность IL-24.
Термин "IL-22BP" или "IL-22 связывающий белок", как использовано в данном документе, относится к любому нативному IL-22BP из любого позвоночного животного, включая млекопитающих, таких как приматы (например, люди и обезьяны) и грызуны (например, мыши и крысы), если не указано особо. Термин охватывает "полной длины", непроцессируемый IL-22BP, а также и любую форму IL-22BP, которая получается в результате процессинга в клетке. Термин также включает встречающиеся в природе варианты IL-22BP, например сплайс-варианты, аллельные варианты и другие изоформы. Термин также включает фрагменты или варианты нативного IL-22BP, который поддерживает, как минимум, одну биологическую активность IL-22BP. Нативный IL-22BP также называется как "IL-22RA2" в данной области.
Термин IL-20Ra относится к полипептидному компоненту гетеродимера рецептора IL-19 или гетеродимера рецептора IL-20. Термин включает любой нативный IL-20Ra из любого позвоночного животного, включая млекопитающих, таких как приматы (например, люди и обезьяны) и грызуны (например, мыши и крысы), если не указано особо. Термин включает "полной длины", непроцессируемый IL-20Ra, а также и любую форму IL-20Ra, которая получается в результате процессинга в клетке. Термин также включает встречающиеся в природе варианты IL-20Ra, например сплайс-варианты, аллельные варианты и другие изоформы. Термин также включает фрагменты или варианты нативного IL-20Ra, который поддерживает, как минимум, одну биологическую активность IL-20Ra. Нативный IL-20Ra также называется как "IL-20R1" в данной области.
Термин IL-20Rb относится к полипептидному компоненту гетеродимера рецептора IL-19 или гетеродимера рецептора IL-20. Термин включает любой нативный IL-20Rb из любого позвоночного животного, включая млекопитающих, таких как приматы (например, люди и обезьяны) и грызуны (например, мыши и крысы), если не указано особо. Термин включает "полной длины", непроцессируемый IL-20Rb, а также и любую форму IL-20Rb, которая получается в результате процессинга в клетке. Термин также включает встречающиеся в природе варианты IL-20Rb, например сплайс-варианты, аллельные варианты и другие изоформы. Термин также включает фрагменты или варианты нативного IL-20Rb, который поддерживает, как минимум, одну биологическую активность IL-20Rb. Нативный IL-20Rb также называется как "IL-20R2" в данной области.
Термин "IL-10R2" относится к полипептидному компоненту гетеродимера рецептора IL-22 или гетеродимера рецептора IL-20. Термин включает любой нативный IL-10R2 из любого позвоночного животного, включая млекопитающих, таких как приматы (например, люди и обезьяны) и грызуны (например, мыши и крысы), если не указано особо. Термин включает "полной длины", непроцессируемый IL-10R2, а также и любую форму IL-10R2, которая получается в результате процессинга в клетке. Термин также включает встречающиеся в природе варианты IL-10R2, например сплайс-варианты, аллельные варианты и другие изоформы. Термин также включает фрагменты или варианты нативного IL-10R2, который поддерживает, как минимум, одну биологическую активность IL-10R2. Нативный IL-10R2 также называется как "IL-10Rb" в данной области.
"Выделенная" биологическая молекула, такая как различные полипептиды, полинуклеотиды и описанные в данном документе антитела, относится к биологической молекуле, которая была идентифицирована и разделена и/или извлечена из, как минимум, одного компонента из естественных условий.
"Активный" или "активность", по отношению к IL-22 или IL-22R, относятся к биологической и/или иммунологической активности нативного IL-22 или IL-22R, где "биологическая" активность относится к биологической функции нативного IL-22 или IL-22R, исключая способность вызывать продукцию антител против антигенного эпитопа, обладающего нативным IL-22 или IL-22R. "Иммунологическая" активность относится к способности вызывать продукцию антител против антигенного эпитопа, обладающего нативным IL-22 или IL-22R.
Термин "антагонист" используется в широком смысле понимания и включает в себя любую молекулу, которая частично или полностью блокирует, подавляет или нейтрализует биологическую активность полипептида, такого как нативный IL-22 или IL-22R полипептид. Также включенные "антагонисты" представляют собой молекулы, которые полностью или частично подавляют транскрипцию или трансляцию мРНК, кодирующую полипептид. Подходящие молекулы-антагонисты включают в себя, например, антагонисты-антитела или фрагменты антител; фрагменты или варианты аминокислотных последовательностей нативного полипептида; пептиды; антисмысловые олигонуклеотиды; малые органические молекулы; и нуклеиновые кислоты, которые кодируют полипептидные антагонисты или антагонисты-антитела. Ссылка на "an" антагонист включает простой антагонист или комбинацию двух или более различных антагонистов. Термин "агонист" используется в широком смысле понимания и включает в себя любую молекулу, которая частично или полностью воспроизводит биологическую активность полипептида, такого как нативный IL-22 или IL-22R полипептид. Также включенный "агонист" представляет собой молекулы, которые стимулируют транскрипцию или трансляцию мРНК, кодирующую полипептид. Подходящие молекулы-агонисты включают в себя, например, агонисты-антитела или фрагменты антител; нативный полипептид; фрагменты или варианты аминокислотных последовательностей нативного полипептида; пептиды; антисмысловые олигонуклеотиды; малые органические молекулы; и нуклеиновые кислоты, которые кодируют полипептидные агонисты или антитела. Ссылка на "an" агонист включает простой агонист или комбинацию двух или более различных агонистов.
"Облегчение" относится и к терапевтическому лечению, и к профилактическим или предупредительным мерам, при которых у индивида предотвращается или снижается темп (уменьшается) нацеленного патологического состояния или нарушения. Таковые при необходимости лечения включают в себя индивидов уже с нарушением, а также индивидов, склонных к нарушению, или индивидов, у которых предупреждают нарушение.
"Хроническое" введение относится к введению веществ(а) в непрерывном режиме в отличие от острого режима, с тем чтобы поддержать начальный терапевтический эффект в течение длительного периода времени. "Прерывистое" введение представляет собой лечение, которое не обходится без последовательного прерывания, но предпочтительно является циклическим по характеру.
Термин "млекопитающие" для целей лечения относится к любому животному, классифицированному как млекопитающее, включая людей, грызунов (например, мышей и крыс) и обезьян; домашних и сельскохозяйственных животных; и животных из зоопарка, спорта, лаборатории или питомцев, таких как собаки, кошки, крупный рогатый скот, лошади, овцы, свиньи, козы, кролики и др. В некоторых вариантах осуществления, млекопитающих выбирают из человека, грызуна или обезьяны.
Введение "в комбинации с" одним или более в дальнейшем терапевтическими веществами включает в себя одновременное (параллельное) и последующее введение в любом порядке. "Носители", как использовано в данном документе, включают в себя фармацевтически приемлемые носители, наполнители или стабилизаторы, которые являются нетоксичными для клетки или млекопитающего, если подвергаются этому воздействию в дозах и концентрациях. Часто физиологически приемлемый носитель представляет собой водный pH буферный раствор. Примеры физиологически приемлемых носителей включают в себя буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; полипептиды низкого молекулярного веса (менее чем примерно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводороды, включая глюкозу, маннозу или декстрины; хелатирующие вещества, такие как EDTA; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как TWEENTM, полиэтиленгликоль (PEG) и PLURONICSTM. "Антитела" (Abs) и "иммуноглобулины" (Igs) представляют собой гликопротеины, имеющие сходные структурные характеристики.
Хотя антитела подавляют специфичность связывания специфичного антигена, иммуноглобулины включают в себя и антитела, и другие подобные антителам молекулы, которые, как правило, лишены антигенной специфичности. Полипептиды последнего типа представляют собой, например, производимые лимфатической системой в низких уровнях и миеломой в высоких уровнях.
Термины "антитело" и "иммуноглобулин" используются равнозначно в широком смысле понимания и включают в себя моноклональные антитела (например, полной длины или интактные моноклональные антитела), поликлональные антитела, моновалентные антитела, мультивалентные антитела, мультиспецифичные антитела (например, биспецифические антитела, поскольку они проявляют требуемую биологическую активность) и могут также включать в себя некоторые фрагменты антител (как подробно описано в данном документе). Антитело может быть химерным, человеческим, гуманизированным и/или аффинно зрелым.
Антитело, которое специфически связывается со специфическим антигеном, относится к антителу, которое способно связывать антиген с достаточной аффиностью, так что антитело является полезным в качестве диагностического и/или терапевтического вещества в мишени-антигене. Предпочтительно, степень связывания такого антитела с ненацеленным полипептидом представляет собой менее чем примерно 10% связывания антитела с мишенью антигеном, как измерено, например, радиоиммунологическим анализом (RIA). В некоторых вариантах осуществления, антитело, которое связывает мишень антиген, имеет константу диссоциации (Kd)≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ или ≤0,1 нМ.
"Вариабельная область" или "вариабельный домен" антитела относится к амино-терминальным до