Способ получения 11бета-гидрокси-9бета,10альфа-стероидов с использованием клеток amycolatopsis mediterranei
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Заявлено применение бактериальных штаммов вида Amycolatopsis mediterranei для микробиологического превращения 9β,10α-стероидов общей формулы (I) в их соответствующие 11β-гидроксил аналоги. Также предложен новый бактериальный штаммам Amycolatopsis mediterranei DSM 17416 для микробиологического превращения 9β,10α-стероидов общей формулы (I) в их соответствующие 11β-гидроксил аналоги. Предложен способ превращения 9β,10α-стероидов в их соответствующие 11β-гидроксил производные. Способ включает контактирование соединений формулы (I) в ферментирующей среде с бактерией вида Amycolatopsis mediterranei. Также заявлены 11β-гидрокси-9β,10α-стероидные соединения формулы (V). 4 н. и 16 з.п. ф-лы, 3 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к использованию бактериальных штаммов вида Amycolatopsis mediterranei для микробиологической трансформации 9β,10α-стероидов (ретростероидов) в их соответствующие 11β-гидроксил аналоги, а также к специфичным штаммам этого вида. Настоящее изобретение относится также к способу превращения 9β,10α-стероидов в их соответствующие 11β-гидроксил производные при использовании бактериальных штаммов вида Amycolatopsis mediterranei, и последующему отделению 11β-гидроксил производных от среды, содержащей бактериальную культуру. Образующиеся 11β-гидроксилированные продукты представляют собой полезные промежуточные соединения (интермедиаты) для получения новых стероидных веществ с 9β,10α-строением, несущих различные заместители в 11β-положении.
Уровень техники.
Публикации и другие сведения, использованные здесь для освещения предпосылок создания изобретения, и, в частности, представление дополнительной информации, относящейся к технологии, включены сюда в качестве ссылочного материала и не относятся к предшествующему уровню техники.
Ретростероиды
Ретростероиды, то есть стероиды с 9β,10α-конформацией, хорошо известны из уровня техники. Коммерчески доступное соединение Дидрогестерон ((9β,10α)-прегна-4,6-диен-3,20-дион) следующей формулы (I-1)
представляет собой активный при приеме внутрь прогестативный гормон и в основном используется для восполнения нехватки прогестерона в организме. Синтез Дидрогестерона облучением и фотохимической реакцией описаны в Европейских патентах ЕР 0152138 В1 (US 4601855) и ЕР 0558119 В1 (US 5304291).
Широко известными ретростероидами являются также, к примеру, 1,2-метилен-3-кето-Δ4,6-бисдегидро-6-гало-9β,10α-стероиды, как это раскрыто US 3937700 и 3-кето-Δ4,6-бисдегидро-6-гало-9β,10α-стероиды, как это раскрыто BE 652597 и US 3304314. Далее патент US 3555053 описывает получение 6-гало- или 6-алкил-9β,10α-стероидов. Некоторые 6,7-дегидро-9β,10α-стероиды описаны Westerhof и Hartog [1965]. Дальнейший синтез ретростероидов раскрыт Hartog и др. [1972] для некоторых 16-метилен-17α-ацетокси-9β,10α-прегна-4,6-диен-3,20-дион производных и Halkes и др. [1972] для 1,2β-метилен-17α-ацетокси-9β,10α-прегнанов. Производные 18-алкил-9β,10α-прегнанов раскрыты Van Moorselaar и Halkes [1969]. Однако все до сих пор известные ретростероидные вещества обладали прогестативной активностью, то есть являлись агонистами прогестеронового рецептора.
Новые ретростероиды, обладающие гормональной активностью, несущие гидроксильную или этерифицированную гидроксильную группу в C11 положении, были описаны в GB 1111320. Специально описанные соединения или промежуточные соединения представляют собой:
11β-гидрокси-9β,10α-прегна-4,6-диен-3,20-дион (CAS No. 22413-62-3),
11β-гидрокси-9β,10α-прегна-4-ен-3,20-дион (CAS No. 10007-43-9), и
11β-17α-дигидрокси-9β,10α-прегна-4-ен-3,20-дион (CAS No. 4076-89-5),
которые так же, как и их 11β-ацетокси производные, были получены из соответствующих 11β-гидрокси соединений химической модификацией.
Так как вещества, являющиеся агонистами, частичными агонистами (т.е. частичными активаторами и/или тканеспецифичными активаторами) и/или антагонистами прогестероновых рецепторов, преимущественно демонстрирующими сбалансированный агонистический/антагонистический профиль, являются исключительно ценными продуктами для улучшения женского здоровья, то существует необходимость разработки новых соединений, которые терапевтически модулируют прогестероновый рецептор, оказывая агонистическое и/или антагонистическое действие, которое проявляется с более высокой рецепторной специфичностью для прогестерона (по сравнению с другими рецепторами стероидных гормонов), чем для уже известных веществ, и которые обладают высокой тканеспецифичностью (например, избирательность в отношении ткани матки перед тканью молочной железы). Ретростероидные соединения, несущие разные заместители в 11β-положении, могут выполнить эту задачу. Однако, несмотря на соединения, раскрытые в GB 1111320, никакие другие производные ретростероидов, несущие заместители в C11β-положении, до сих пор не были раскрыты.
Главный аспект настоящего изобретения заключается в том, чтобы раскрыть ключевые соединения-интермидиаты, которые полезны для получения новых стероидных соединений с 9β,10α-конформацией, несущих различные заместители в C11β-положении, так же как и способ получения этих интермедиатов с высоким выходом и качеством. Эти ключевые интермедиаты несут гидроксильную группу в C11β-положении стероидного ядра и включают в себя 11β-гидрокси-дидрогестерон, 11β-гидрокси-9β,10α-прогестерон их производные.
Микробиологическое превращение - гидроксилирование стероидного ядра по C11 положению.
Микробиологическое превращение стероидных соединений, включающее гидроксилирование стероидного ядра по C11 положению, является хорошо известным из уровня техники процессом. Обычно, штаммы грибов видов Aspergillus или Rhizopus используются для 11α-гидроксилирования стероидов с 9β,10α-конформацией (как раскрыто, например, в Европейском патенте ЕР 0028309, и патенте США No. 6046023). 11β-Гидроксилирование стероидов с 9β,10α-конформацией достигается использованием грибов рода Curvularia (патент США No. 4353985), или в особенности Curvularia lunata (патент США No. 4588683) или Cochliobolus lunatus [Zakelj-Mavric и др., 1990].
Гидроксилирование ретростероидов.
Публикации van der Sijde и др. [1966] посвящены С11-гидроксилированию ретростероидов, например 9β,10α-прогестерона, с помощью грибного штамма Aspergillus ochraceus NRRL405. Однако гидроксилирование ретростероидного ядра затрагивает 11α-положение.
Другая публикация Saucy и др. [1966] также описывает микробиологическое гидроксилирование ретростероидов по C11 положению с помощью грибного штамма Aspergillus ochraceus для 11α-гидроксилирования, но не было описано микроорганизма для 11β-гидроксилирования.
Описание изобретения GB 1111320 раскрывает микробиологическое гидроксилирование некоторых специфических ретростероидов по C11 положению. В частности, изобретение относится к способу производства некоторых 11β-гидрокси-ретростероидов, включающему переработку соответствующего незамещенного по 11 положению ретростероида микроорганизмом из таксономических подгрупп несовершенных грибов, аскомицетов, фитомицетов, базидиомицетов или актиномицетов. Специфические штаммы вышеупомянутых таксономических подгрупп, наиболее пригодные для процесса гидроксилирования, включают: Gliocladium catenulatum, Gliocladium roseum, Helicostylum piriforme, Penicillium canescens, Mucor griseocyanus, Mucor corymbifer, Choanephora circinans, Nocardia lurida (=Amycolatopsis orientalis subsp. lurida), Streptomyces rimosus и Streptomyces fradiae. Приведенные примеры демонстрируют гидроксилирование 9β,10α-прегна-4,6-диен-3,20-диона (дидрогестерона), 9β,10α-прегна-4-ен-3,20-диона (9β,10α-прогестерона) или 17α-гидрокси-9β,10α-прегна-4-ен-3,20-диона, т.е. ретростероидов, относящихся к дидрогестерону или наиболее близких к нему, при использовании следующих штаммов: Nocardia lurida, Penicillium canescens, Gliocladium catenulatum, Helicostylum piriforme, Choanephora circinans, Streptomyces fradiae, Mucor griseocyanus, и Streptomyces rimosus. Главным недостатком описанного процесса ферментации являлся сравнительно малый выход целевого продукта ферментации, который обычно лежит между 2 и 10%, в одном примере выше 30%.
Amycolatopsis mediterranei
Бактериальный вид Amycolatopsis mediterranei также известен, как Streptomyces mediterranei и Nocardia mediterranei [Margalith и Beretta, 1960, и Lechevalier и др. 1986]. Amycolatopsis mediterranei принадлежит к классу актинобактерий, к таксономической подгруппе актиномицетов, к роду Amycolatopsis. Несколько штаммов этого вида доступны из коллекций культур "Deutsche Sammlung von Mikroorganismen und Zellkulturen", DSMZ (адрес: Mascheroder Weg 1 b, D-38124 Braunschweig, Germany), известные как DSM 43304 (также депонируются в других коллекциях культур как АТСС 13685, CBS 121.63, CBS 716.72, DSM 40501, IFO 13415, IMET 7651, ISP 5501, JCM 4789, KCC S-0789, LBG A 3136, NBRC 13142, NBRC 13415, NCIB 9613, NRRL B-3240, RIA 1376, или VKM Ac-798), DSM 40773 и DSM 46096 (также депонируются в других коллекциях под названиями АТСС 21411, IMET 7669).
Штаммы Amycolatopsis mediterranei широко применимы для микробиологического производства рифамицина В, вещества, активного как антибиотик; однако эти виды до сих пор не были описаны для гидроксилирования стероидных соединений и, в частности, для C11β-гидроксилирования ретростероидов.
Способ очистки стероидов от микробиологических культур
Продукт ферментативного процесса обычно отделяется от среды, содержащей культуру, с помощью многостадийного процесса фильтрации (устранение мицелия), экстракции, необязательно, хроматографической очистки, кристаллизации и последующей перекристаллизации с целью получения чистого соединения. Например, продукты микробиологического гидроксилирования по патенту GB 1111320 выделяются из порции ферментатирующей среды путем тщательно разработанной процедуры, включающей несколько жидкость-жидкостных экстракций и последующую колоночную хроматографию или перекристаллизацию для более глубокой очистки с использованием токсичных и/или вредных для здоровья органических растворителей, таких как бензол или четыреххлористый углерод.
Следовательно, существует необходимость оптимизации способа микробиологического 11β-гидроксилирования ретростероидных соединений, и, в частности, идентификации бактериального вида и соответствующих штаммов, которые способны производить процесс гидроксилирования с высокой производительностью и эффективностью.
Раскрытие изобретения.
Цель данного изобретения состояла в том, чтобы разработать новый микробиологический способ простого и количественного получения ретростероидных соединений, несущих C11β-гидроксильную группу, которые являются ключевыми интермедиатами для синтеза новых соединений, модуляторов прогестеронового рецептора, на основе ретростероидного ядра известного агониста прогестерона Дидрогестерона. Поэтому одним из объектов настоящего изобретения является идентификация микробиологического вида, который способен к C11β-гидроксилированию идентичных и сходных с Дидрогестероном ретростероидов с высокой производительностью и выходом.
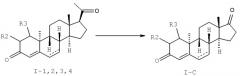
Неожиданно было обнаружено, что при использовании бактериального микроорганизма вида Amycolatopsis mediterranei 9β,10α-стероидное (ретростероидное) соединение общей формулы (I)
где
R1 и R4 вместе представляют собой кислород, или
R4 представляет собой β-ацетильную группу и R1 выбрана из группы, состоящей из водорода, -OH, -O-(C1-C4)алкил, и -O-CO-(C1-C4)алкил, и
R2 и R3 оба представляют собой водород или вместе формируют метиленовую группу, может быть превращено в его соответствующий 11β-гидроксил аналог.
В одном из вариантов, 9β,10α-стероидное (ретростероидное) соединение, используемое в вышеупомянутом превращении, представлено соединением с формулой (II)
где
R1 выбран из группы, состоящей из водорода, -OH, -O-(C1-C4)алкил, и -O-CO-(C1-C4)алкил, и
R2 и R3 оба представляют собой водород или вместе формируют метиленовую группу.
Другой вариант относится к использованию для вышеупомянутой трансформации бактериальных микроорганизмов вида Amycolatopsis mediterranei, штаммы которого выбраны из группы, содержащей Amycolatopsis mediterranei LS30, DSM 43304 (соответствующих АТСС 13685, CBS 121.63, CBS 716.72, DSM 40501, IFO 13415, IMET 7651, ISP 5501, JCM 4789, KCC S-0789, LBG A 3136, NBRC 13142, NBRC 13415, NCIB 9613, NRRL B-3240, RIA 1376 или VKM Ac-798), DSM 40773 и DSM 46096 (соответствующих АТСС 21411, IMET 7669). Предпочтительно использовать бактериальный штамм Amycolatopsis mediterranei LS30, депонированный как DSM 17416 в "Deutsche Sammlung von Mikroorganismen und Zellkulturen", DSMZ (адрес: Mascheroder Weg 1 b, D-38124 Braunschweig, Germany).
Микроорганизм, использованный для указанного микробиологического превращения, является бактериальным штаммом Amycolatopsis mediterranei LS30, который был впервые идентифицирован и не был ранее описан в литературе. Бактериальный штамм Amycolatopsis mediterranei LS30 был охарактеризован как принадлежащий к виду Amycolatopsis mediterranei, основываясь на макроскопических и микроскопических признаках (морфология колоний), на хемотаксономической классификации (строение жирных кислот) и на сравнении последовательности 16S рРНК. Следовательно, настоящее изобретение также относится к бактериальному штамму Amycolatopsis mediterranei LS30, депонированному как DSM 17416 в "Deutsche Sammlung von Mikroorganismen und Zellkulturen", DSMZ (адрес: Mascheroder Weg 1 b, D-38124 Braunschweig, Germany).
При превращении ретростероидного соединения с общей формулой (I), его 11β-гидроксильный аналог будет получен в качестве продукта превращения, представленного следующей общей формулой (IV)
где
R1 и R4 вместе представляют собой кислород, или R4 представляет собой β-ацетильную группу и R1 выбран из группы, состоящей из водорода, -OH, -O-(C1-C4)алкил, и -O-CO-(C1-C4)алкил, и
R2 и R3 оба представляют собой водород или вместе формируют метиленовую группу.
Если превращению подвергается ретростероидное соединение общей формулы (II), то его 11β-гидроксильный аналог будет получен в качестве продукта превращения, представленного следующей общей формулой (V)
где
R1 выбран из группы, состоящей из водорода, -OH, -O-(C1-C4)алкил, и -O-CO-(C1-C4)алкил, и
R2 и R3 оба представляют собой водород или вместе формируют метиленовую группу.
Указанные соединения с общими формулами (IV) и (V) представляют собой требуемые ключевые интермедиаты, удобные для получения новых стероидных соединений с 9β,10α-конформацией, несущих различные виды заместителей в C11β положении.
Некоторые конкретные соединения, подпадающие под общую формулу (V), уже известны, например 11β-гидрокси-9β,10α-прегна-4,6-диен-3,20-дион (CAS No. 22413-62-3), 11β-гидрокси-9β,10α-прегна-4-ен-3,20-дион (CAS No. 10007-43-9), и 11β-17α-дигидрокси-9β,10α-прегна-4-ен-3,20-дион (CAS No. 4076-89-5); однако остальные соединения с общей формулой (V) являются новыми и представляют собой часть настоящего изобретения.
Следовательно, еще одним объектом настоящего изобретения является получение 11β-гидрокси-ретростероидных соединений общей формулы (V)
где
а) R1 выбран из группы, состоящей из водорода, -OH, -O-(C1-C4)алкил, и -O-CO-(C1-C4)алкил, и R2 и R3 вместе формируют метиленовую группу, или
б) R1 выбран из группы, состоящей из -O-(C1-C4)алкил и -O-CO-(C1-C4)алкил, и R2 и R3 оба представляют собой водород, или
в) R1 представляет собой -ОН, R2 и R3 оба представляют собой водород, и соединение представляет собой 4,6-диен.
В одном из вариантов, 11β-гидрокси-ретростероидное соединение-интермедиат выбрано из группы, состоящей из
11β-гидрокси-1,2-метилен-9β,10α-прегна-4,6-диен-3,20-диона,
17α-этокси-11β-гидрокси-9β,10α-прегна-4,6-диен-3,20-диона,
17α-этокси-11β-гидрокси-1,2-метилен-9β,10α-прегна-4,6-диен-3,20-диона,
11β-17α-дигидрокси-9β,10α-прегна-4,6-диен-3,20-диона,
11β-17α-дигидрокси-1,2-метилен-9β,10α-прегна-4,6-диен-3,20-диона,
11β-гидрокси-1,2-метилен-9β,10α-прегна-4-ен-3,20-диона,
17α-этокси-11β-гидрокси-9β,10α-прегна-4-ен-3,20-диона,
17α-этокси-11β-гидрокси-1,2-метилен-9β,10α-прегна-4-ен-3,20-диона, и
11β-17α-дигидрокси-1,2-метилен-9β,10α-прегна-4-ен-3,20-диона.
Так как целью настоящего изобретения является разработка нового и улучшенного способа выработки указанных соединений-интермедиатов, еще одним аспектом настоящего изобретения является способ микробиологического превращения in vitro ретростероидного соединения общей формулы (I)
где
R1 и R4 вместе представляют собой кислород, или
R4 представляет собой β-ацетильную группу и R1 выбран из группы, состоящей из водорода, -OH, -O-(C1-C4)алкил, и -O-CO-(C1-C4)алкил, и
R2 и R3 оба представляют собой водород или вместе формируют метиленовую группу;
в его соответствующий 11β-гидроксильный аналог, в процессе которого осуществляется взаимодействие в среде, в которой происходит культивирование, соединения формулы (I) с бактерией вида Amycolatopsis mediterranei, способной к осуществлению превращения соединения формулы (I) в соответствующий 11β-гидроксильный аналог.
В одном из вариантов настоящее изобретение относится к способу микробиологического превращения in vitro ретростероидного соединения общей формулы (II)
где
R1 выбран из группы, состоящей из водорода, -OH, -O-(C1-C4)алкил, и -O-CO-(C1-C4)алкил, и
R2 и R3 оба представляют собой водород или вместе формируют метиленовую группу,
в соответствующий 11β-гидроксильный аналог, в процессе которого осуществляется взаимодействие соединения формулы (II) в (подходящей) среде, в которой происходит культивирование, с бактерией вида Amycolatopsis mediterranei, способной к осуществлению превращения соединения формулы (II) в соответствующий 11β-гидроксильный аналог.
В одном из вариантов настоящее изобретение относится к способу микробиологического превращения in vitro ретростероидного соединения общей формулы (III)
где
R1 выбран из группы, состоящей из -O-(C1-C4)алкил; и
R2 и R3 оба представляют собой водород или вместе формируют метиленовую группу,
в соответствующий 11β-гидроксильный аналог, в процессе которого осуществляется взаимодействие соединения формулы (III) в (подходящей) среде, в которой происходит культивирование, с бактерией вида Amycolatopsis mediterranei, способной к осуществлению превращения соединения формулы (III) в соответствующий 11β-гидроксильный аналог.
Кроме того, настоящее изобретение позволяет оптимизировать метод отделения целевых 11β-гидрокси-ретростероидных соединений с общими формулами (IV) и/или (V), как указано выше, от жидкой среды, содержащей культуру. Следовательно, настоящее изобретение также относится к способу отделения указанного 11β-гидроксильного аналога от ферментирующей смеси (среды, содержащей культуру) после превращения ретростероидных соединений с общими формулами (I), (II) или (III), как указано выше, с участием бактерий вида Amycolatopsis mediterranei, в соответствии с чем 11β-гидроксильный аналог отделяют от ферментирующей смеси в несколько этапов, состоящих из
а) получения надосадочной жидкости из ферментирующей среды, свободной от бактериальных клеток, фрагментов бактериальных клеток, слизистых субстанций и твердых остатков,
б) контактирования надосадочной жидкости, выбранной из группы, состоящей из надосадочной жидкости, полученной на стадии (а), концентрированной посредством уменьшения объема указанной надосадочной жидкости, и концентрата (ретентата), полученного мембранной фильтрацией указанной надосадочной жидкости, с достаточным количеством неионной семиполярной полимерной адсорбирующей смолы для адсорбции 11β-гидроксильного аналога, содержащегося в надосадочном материале, так что неионная семиполярная полимерная адсорбирующая смола нагружается полученным 11β-гидроксильным аналогом и затем отделяется от остатков надосадочной жидкости;
в) промывания нагруженной адсорбирующей смолы водным раствором с pH по меньшей мере 12, предпочтительно от 12,5 до 14;
г) необязательного промежуточного этапа промывания смолы, при котором нагруженная адсорбирующая смола промывается водой; и
д) контактирования промытой адсорбирующей смолы с достаточным количеством элюента для десорбции адсорбированного на ней 11β-гидроксильного аналога, указанный элюент включает в себя по меньшей мере один смешивающийся с водой органический сольвент, выбранный из группы, состоящей из смешивающихся с водой эфиров, низших алканолов, низших алифатических кетонов или смесей с водой, которые имеют щелочную реакцию и содержат по меньшей мере один смешивающийся с водой органический сольвент, выбранный из группы, состоящей из смешивающихся с водой эфиров, низших алканолов, низших алифатических кетонов, и
е) отделения элюата, содержащего 11β-гидроксильный аналог, от адсорбирующей смолы и концентрации элюата путем уменьшения объема.
Осуществление изобретения
Определения.
Следующие термины, употребляемые здесь, обладают следующими значениями, если иное не оговорено.
Употребляемые здесь термины "включающий" и "содержащий" используются в их открытом, неограниченном смысле.
Слово "соединение" должно пониматься как любые и все изомеры (например, энантиомеры, стериоизомеры, диастереомеры, ротомеры, таутомеры) или любые смеси изомеров, предшественники лекарств, и любые фармакологически приемлемые соли названных соединений, если не оговорено иное.
Если для соединений, солей и подобного употреблено множественное число, это также означает единичное соединение, соль и подобное.
Соединения, описанные в настоящем изобретении, могут содержать по меньшей мере один асимметричный центр в молекуле, например хиральный атом углерода, в зависимости от природы различных заместителей. В случае такого асимметричного центра соединение может быть представлено в виде двух оптически активных стереоизомерных форм или в виде рацемата. Настоящее изобретение включает и рацемические смеси, и изомерно чистые вещества, за исключением случаев, специально оговоренных, или при специальном указании структурной формулы, например для 9β,10α-конформации или для C11β конформации или для C17β-ацетильной группы. Соединения, описанные в настоящем изобретении, могут содержать больше асимметрических центров в молекуле в зависимости от природы различных заместителей. В некоторых случаях асимметрия также может быть обусловлена ограниченным вращением относительно связи, примыкающей к двум ароматическим кольцам специфических соединений. Подразумевается, что все изомеры (включая энантиомеры и диастереомеры), как имеющие асимметричный центр, так и обладающие ограниченным вращением, как описано выше, как отделенные, очищенные или частично очищенные, так и их рацемические смеси, включены в объем настоящего изобретения.
Любые асимметрические атомы углерода могут быть представлены в (R)-, (S)- или (R,S)-конфигурации, предпочтительно в (R)- или (S)-конфигурации, которая является наиболее активной. Заместители при двойной связи или кольце могут находится в цис- (=Z-) или транс- (=E-) положении.
Термин "ретростероид" относится к стероидному соединению с 9β,10-конформацией.
Термин "замещенный" означает, что специфическая группа или остаток несет один или более заместителей. Если какая-либо группа может нести несколько заместителей и предусмотрено множество возможных заместителей, заместители независимо выбираются и не должны быть одинаковыми. Термин "незамещенный" означает, что специфическая группа не несет заместителей. Термин "необязательно замещенный" означает, что специфическая группа незамещена или замещена одним или более заместителями.
Термин "гидроксил" или "гидрокси"относится к OH-группе.
Термин "алкил" относится к углеводородному радикалу, который может быть линейным, циклическим или разветвленным, с единственным или множественным разветвлением, который может содержать от 1 до 12 атомов углерода. В одном варианте термин "алкил" относится к линейным или разветвленным (с единственным или множественным разветвлением) алкильным цепочкам из 1-4 углеродных атомов и обозначается термином (C1-C4)алкил. Термин (C1-C4)алкил относится к таким группам как метил; этил; н-пропил; изопропил; н-бутил; втор-бутил; изобутил и трет-бутил. Алкильная или (C1-C4)алкильная группа может быть ненасыщенной, образуя такие группы, как, например, винильная, 1-пропенильная, 2-пропенильная (аллильная) и бутенильная. Термин "алкил" относится также циклоалкильным группам, преимущественно цикло(C3-C4)алкильным, которые относятся к циклопропильным или циклобутильным, и их изомерным формам, таким как метилциклопропильная группа. Циклоалкильная группа также может быть ненасыщенной. Более того, термин (C1-C4)алкил также включает цикропилметильную группу.
Термин "метилен" относится к -CH2- руппе.
Термин "ацетил" относится к -CO-CH3 группе.
Нумерация в соединении (номенклатура).
Кроме того, для сохранения единообразия обозначения соединения одинаковой структуры, но с разными заместителями, описанные здесь вещества называются согласно следующим главным принципам. Предусмотрена система нумерации для расположения заместителей в подобных соединениях.
Атомы углерода стероидного ядра производных прегнана нумеруются согласно следующей схеме:
Дидрогестерон - 9β,10α-прегна-4,6-диен-3,20-дион - обладает следующей формулой (I-1):
Ретропрогестерон - 9β,10α-прегна-4-ен-3,20-дион - обладает следующей формулой (I-3):
Общие структурные формулы обозначены римскими цифрами I, II, III и так далее. Интермедиаты обозначены той же римской цифрой, как их соответствующие общие структуры, и дополнительно буквой или цифрой, например I-2 представляет собой производное, находящееся в рамках общей формулы I. Соединения по настоящему изобретению обозначены №1, №2 и т.д.
Аббревиатуры и акронимы
BV - объем слоя
D - дни(ей)
DCM - дихлорметан
DDQ - 2,3-дихлор-5,6-дицианохинон
DM - сухой материал
DMSO - диметилсульфоксид
DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen (Немецкая коллекция микроорганизмов и клеточных культур)
h - ч (час(ы))
HPLC - ВЭЖХ (высокопроизводительная жидкостная хроматография)
LAH - алюмогидрид лития
Min - мин (минуты)
NMMO - N-метилморфолин-N-оксид
rpm - оборотов в минуту
Реагент с общей формулой (I)
9β,10α-стероидное (ретростероидное) соединение с общей формулой
где
R1 и R4 вместе представляют собой кислород, или
R4 представляет собой β-ацетильную группу, и R1 выбран из группы, состоящей из водорода, -OH, -O-(C1-C4)алкил, и -O-CO-(C1-C4)алкил, и
R2 и R3 оба представляют собой водород или вместе формируют метиленовую группу,
и используемое в качестве исходного материала в способе, описанном в настоящем изобретении, может быть получено из известных ретростероидов при помощи известных химических реакций и процедур. Тем не менее, следующие основные препаративные методы, используемые в настоящем изобретении, представлены с целью облегчения синтеза вещества. Все возможные сочетания этих методов идентичны описанным, если обратное специально не отмечено ниже.
Очевидно, что некоторые из указанных в изобретении веществ, с их заявленными возможными функциональными группами не могут быть получены каждым из указанных ниже методов. В рамках каждого метода возможные заместители могут появиться в реагентах или интермедиатах, которые могут играть роль защитных или принимающих другое участие в синтезе групп. Используемые методы хорошо известны из уровня техники, эти группы вводятся и/или удаляются в схемах синтеза, по которым получают соединения настоящего изобретения.
Последовательность стадий главной схемы синтеза соединений настоящего изобретения показана ниже. В каждой из схем R группы (например, R1, R2 и так далее) относятся к специфическим заместителям, структура которых указана в описании и примерах.
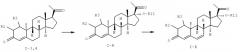
Схема I
Схема I демонстрирует удобную реакцию замещения коммерчески доступного дидрогестерона (9β,10α-прегна-4,6-диен-3,20-диона) формулы (I-1) по положению 1,2 метиленовой группой. Введение 1,2-метиленовой группы осуществлено с помощью хорошо известной процедуры, как описано Halkes и др. [1972] и в патенте США No. 3937700 для 17α-гидрокси-9β,10α-прегна-4,6-диен-3,20-диона, с помощью дегидрирования и последующей реакции с метилидом диметилсульфония.
Схема II
По Схеме II, 1,2 метилен замещенный 9β,10α-прегна-4,6-диен-3,20-дион общей формулы 1-1,2; превращают в соответствующий 9β,10α-прегна-4-ен-3,20-дион (9β,10α-прогестерон) общей формулы 1-3,4; в восстанавливающих условиях, как это раскрыто в патенте США No. 3555053.
Схема III
Введение дополнительной боковой цепи в С17 положение - как показано на Схеме III - с целью получения соединений общей формулы (I-А), где R11 представляет собой -H, -(C1-C4)алкил, или -CO-(C1-C4)алкил, может быть осуществлено по методам и процедурам, описанным Halkes и van Moorselaar [1969] и в патентах США №№ 3555053 и 3937700 путем введения 17α-гидроксигруппы и последующего образования простого или сложного эфира с гидроксильной группе при 17 атоме углерода. С целью получения соединений общей формулы (I-B), двойная связь в C6-C7 положении может быть повторно образована дегидрированием.
Функционализация C17 положения начинается с введения -OH группы в C17-альфа положение: например, (9β,10α)-прегна-4-ен-3,20-дион формулы I-3 или I-4 может быть восстановлен с использованием подходящих восстановительных агентов, таких как алюмогидрид лития (LAH), для получения соответствующего 3,20-диола. Позже 3-гидроксильная группа может быть окислена с использованием селективного окислительного агента, такого как 2,3-дихлор-5,6-дицианохинон (DDQ) в ароматическом растворителе или диоксидом марганца. Образующийся 20-гидрокси-(9β,10α)-прегна-4-ен-3-он далее дегидратируется путем тозилирования тозилхлоридом в пиридине. Последующая обработка полученного тозильного производного кипячением в пиридине приводит к смеси цис- и транс-изомеров 17,20 ненасыщенных производных. Последнее соединение далее окисляется под действием аминоксида, такого как N-метилморфолин-N-оксид (NMMO), в качестве стехиометричного окислительного агента с добавлением перекиси водорода и в присутствии тетраоксида осмия, взятого в каталитическом количестве, для получения соответствующего 17α-гидрокси-9β,10α-прегна-4-ен-3,20-диона.
Дальнейшая модификация данного соединения подчинена реакциям образования простого или сложного эфира по гидроксильной группе при C17, в соответствии с описанием в патенте Бельгии BE 577615 или в патенте США No. 3937700. Удобными ацилирующими агентами являются карбоновые кислоты, ангидриды карбоновых кислот, галогенангидриды карбоновых кислот в присутствии таких катализаторов, как п-толуолсульфоновая кислота, ангидрид трифторуксусной кислоты, гидрохлорид пиридина или в присутствии связывающего вещества, такого как органическое основание, например коллодий. Реакция ацилирования проводится в присутствии углеводородных растворителей, таких как бензол или толуол. Температура, при которой происходит реакция, может варьировать от комнатной до температуры кипения используемого растворителя. Если исходное соединение содержит, кроме 17-OH группы, одну или более OH-групп, то они тоже будут этерифицированы, поэтому эти OH-группы должны быть предварительно защищены. Альтернативно реакция алкилирования может проводиться при использовании алкилгалогенов в присутствии Ag2O или при использовании дигидропирана или дигидрофурана в слабо кислой, слабо щелочной или нейтральной среде.
Наконец, полученные соединения могут быть снова дегидрированы с получением 4,6 ненасыщенных производных общей формулы I-B.
Схема IV
По Схеме IV 1,2 метилен замещенный 9β,10α-прегна-4-(6-ди)-ен-3,20-дион общей формулы I-1,2,3,4 может быть далее превращен в соответствующий 18-метил-9β,10α-андро-4-(6-ди)-ен-3,17-дион общей формулы I-C последовательным восстановлением, окислением и элиминированием, следующим за озонолизом 18-метил-9β,10α-прегна-4,6,17(20)-триен-3-он интермедиата, как описано Halkes и van Moorselaar [1969].
Процесс микробиологического 11β-гидроксилирования
Главная характеристика
Процесс протекает по обычному пути. С этой целью готовится стерилизованная питательная смесь (=среда) для данного бактериального штамма, и на данную смесь высевается бактериальный штамм, обычно путем отделения некоторого количества колоний от агара и получения их суспензии, и последующей культивации. Обычно вторичная прекультура может быть приготовлена заражением (инокуляцией) новой питательной смеси аликвотой суспензии, содержащей культуру. Прекультуру, приготовленную таким способом, затем добавляют в ферментер, который также содержит подходящую питательную смесь. Предпочтительно добавить исходное вещество - соединение общей формулы I - в ферментер по окончании фазы роста культуры штамма так, чтобы могла происходить реакция - согласно изобретению - превращения соединения общей формулы I в соответствующее 11-гидроксилированное соединение общей формулы IV. После окончания реакции, смесь веществ очищается обычным способом или способом согласно данному изобретению с целью отделения искомого 11β-гидроксилированного ретростероида.
Штаммы Amycolatopsis mediterranei
Способ по настоящему изобретению основан на открытии способности микроорганизмов вида Amycolatopsis mediterranei к введению 11β-гидроксильной группы в 11-незамещенные 9β,10α-прегна-4,6-диен-3,20-дион и 9β,10α-прегна-4-ен-3,20-дион производные. Эти бактериальные штаммы, получаемые из природных материалов, таких как почва, также доступны из открытых коллекций культур, способны использовать ретростероиды в качестве источника углерода или игнорировать эти стероиды в присутствии других ассимилируемых источников углерода.
Следовательно, способ производства ретростероидов формул IV или V по настоящему изобретению, как описано выше, включает ферментацию соответствующего 11-незамещенного ретростероида бактериями вида Amycolatopsis mediterranei. Примерами специфических штаммов Amycolatopsis mediterranei, которые удобны для осуществления способа, описанного в данном изобретении, могут служить, как новый открытый штамм LS30, так и доступные из открытых коллекций культур штаммы, такие как DSM 43304 (соответствующий АТСС 13685, CBS 121.63, CBS 716.72, DSM 40501, IFO 13415, IMET 7651, ISP 5501, JCM 4789, КСС S-0789, LBG А 3136, NBRC 13142, NBRC 13415, NCIB 9613, NRRL В-3240, RIA 1376, VKM Ас-798), DSM 40773, и DSM 46096 (соответствующий АТСС 21411, IMET 7669). В одном из вариантов штамм Amycolatopsis mediterranei LS30 представляет собой штамм Amycolatopsis mediterranei, депонированный в DSMZ ("Deutsche Sammlung von Mikroorganismen und Zellkulturen") под обозначением DSM 17416.
Мутанты штаммов Amycolatopsis mediterranei, полученные методами молекулярной биологии, химическими методами (например, с помощью обработки нитритами) или физическими методами (например, облучением) также могут быть использованы в способе по данному изобретению. В другом случае фермент или ферменты, которые осуществляют ферментацию 11-незамещенных ретростероидов, также могут быть взяты из бактериальной культуры или из питательной среды и приведены в контакт со стероидным субстратом в отсутствие живых клеток. Предпочтительно использование бактериальных штаммов как таковых во избежание дополнительных производственных стадий. Бактериальные штаммы или изолированные от них ферменты при желании могут быть иммобилизованы на подходящем субстрате.
Способ по настоящему изобретению осуществляется в условиях, подходящих для 11β-гидроксилирования с помощью актиномицетов; например, как это описано в патенте GB 1111320.
Питательный раствор (питательная среда)
Штаммы Amycolatopsis mediterranei, используемые в способе по настоящему изобретению, могут культивироваться на твердых и жидких питательных растворах (средах), которые содержат источник ассимилируемого азота, источник ассимилируемого углерода и неорганические соли.
Удобными источниками ассимилируемого азота являются соединения животного, растительного, микробного происхождения, а также неорганические вещества; такие как мясные экстракты, пептоны, зерновые настои, экстракты дрожжей, глицин и нитрат натрия или их смеси. Удобными источниками ассимилируемого углерода являются все сахара и их полимеры (например, крахмал, декстран, сахароза, мальтоза и глюкоза) и аминокислоты, протеины, пептоны, жирные кислоты, жиры и стероиды (особенно ретростероиды) также как и их смеси. Предпочтительно, чтобы питательная смесь содержала экстракт дрожжей в количестве до 2,5% (по массе), предпочтительно от 0,2-2% источника азота и глюкозу в количестве до 20% (по массе), предпочтительно от 5-10% источника углерода.
Смесь может содержать элементы в следовых количествах (присутствующих естественно или добавленных), которые доступны из минеральных или органических ингредиентов. Особенно желательно присутствие железа. Предпочтительно, чтобы питательная смесь содержала железо в форме ионов Fe3+ в концентрации от 0 до 200 мг/мл (FeCl3), предпочтительно около 50 мг/мл FeCl3. Сера может быть представлена в форме органиче