Способ совместного получения линейных и циклических гомо- и содимеров стирола и альфа-метилстирола
Иллюстрации
Показать всеИзобретение относится к способу совместного получения циклических и линейных гомо- и содимеров стирола и α-метилстирола путем содимеризации мономеров в присутствии кислотного катализатора, характеризующемуся тем, что в качестве катализатора используют цеолит NiHY в количестве 5-30 мас.% и реакцию проводят в хлорбензоле при температуре 80-130°С. Применение настоящего способа позволяет упростить совместную олигомеризацию стирола и α-метилстирола. 2 з.п. ф-лы, 2 табл., 1 ил.
Реферат
Изобретение относится к области нефтехимического синтеза, а именно к способу получения линейных и циклических гомо- и содимеров стирола и α-метилстирола.
Циклические и линейные гомо-димеры стирола и α-метилстирола применяются в качестве пластификаторов полимеров и каучуков, регуляторов молекулярной массы полимеров, сырья для получения топлив, компонентов синтетических масел и смазочных материалов, растворителей для лакокрасочных материалов, высокотемпературных теплоносителей, мономеров для получения полимерных газоразделительных мембран [Патенты США №3161692, 3792096, 3994816, 4302618, 4442027, 20040242441; А.с. СССР №1036727; Патенты РФ №2071460, 2129043, 2149862; Maier G. Angew. Chem. Im. Ed. 1998, 37, p.2960-2974].
Синтез гомо-димеров α-метилстирола проводят с использованием различных кислотных катализаторов: минеральных или органических кислот [Патент Великобритании №1507600; патент РФ №2088561], катионообменных смол [B.Chaudhuri, M.M. Sharma. Ind. Eng. Chem. Res. 1989, v.28, N12, p.1757-1763; M.Fujiwara, K.Kuraoka, T.Yazawa. Chem. Commun. 2000, p.1523-1524], обработанных кислотой глин [Патент США №3161692, 1964]. В зависимости от условий реакции и природы катализатора основными продуктами реакции являются линейные (ЛДМС, 1а, б) или циклический димер α-метилстирола (ЦДМС, 1в):
Эффективными катализаторами для получения линейных димеров α-метилстирола являются цеолиты и цеолитоподобные материалы.
В работе [Я.И.Исаков, Х.М.Миначев, В.З.Шарф и др. Нефтехимия, 1999, т.39, №4, с.278-283] описан способ получения линейных димеров α-метилстирола в присутствии кристаллических алюмофосфатов. На катализаторе, полученном из немодифицированного кристаллита AlPO4-8, при атмосферном давлении, 75-100°С и объемной скорости 1,5 ч-1 конверсия α-метилстирола составляет 80-83%, селективность образования линейных димеров 93,6-96,3%.
Авторы [В.П.Талзи, В.П.Доронин, Т.П.Сорокина. ЖПХ, 2000, т.13, №5, с.787] осуществили димеризацию α-метилстирола на цеолите Y в среде метиленхлорида при 25-40°С. Конверсия α-метилстирола составляет 98,4-99,9 мас.%, селективность образования линейных димеров достигает 76,1-87,0 мас.%.
В патентах приведены способы получения линейных димеров α-метилстирола без растворителя в присутствии цеолитов HNaY [Патенты РФ №2189963, 2189964, 2313511], Beta [Патент РФ №2322429], ZSM-12 [Патент РФ №2312095].
Для синтеза циклического димера α-метилстирола 1,1,3-триметил-3-фенилиндана (ЦДМС) использовали цеолиты типа морденит и СаХ в среде растворителей - нитробензола или нитрометана [А.с. СССР №829606, 1979, БИ, 1981,№18]. Содержание растворителя составляет 41-45 об.%, содержание катализатора 18-19 мас.% на шихту (или 35-40% катализатора на α-метилстирол); температура реакции 80°С, время - 2-2,5 ч. Выход ЦДМС оставляет 99,0 мас.%. Конверсия α-метилстирола не указана, но поскольку в описании говорится о том, что при выделении ЦДМС отгоняют непрореагировавший α-метилстирол, то можно сделать вывод о неполном превращении мономера.
Известен способ получения ЦДМС, осуществляемый путем димеризации α-метилстирола в присутствии цеолитсодержащего катализатора крекинга Ц-10 в количестве 5-50 мас.% при температуре 60-150°С. Конверсия α-метилстирола достигает 100 мас.%, выход ТМФИ составляет 92-98,8% [Патент РФ №2223937]. Столь же успешно ЦДМС может быть получен в присутствии цеолита Beta [Патент РФ №2327969].
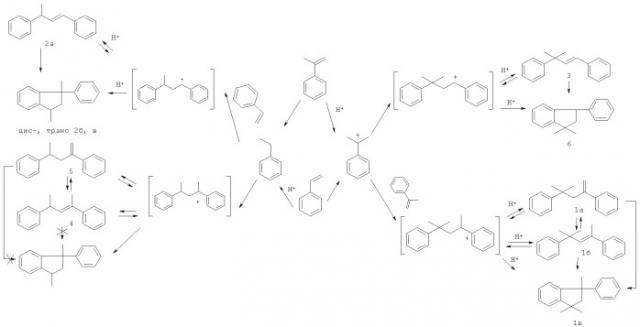
Гомодимеризация стирола проходит с образованием линейного (ЛДС 2а) и циклических димеров (ЦДС 2б, в):
Линейный димер стирола (транс-1,3-дифенилбутен-1) предложено получать путем димеризации стирола в присутствии цеолита HY со степенью ионного обмена 10%, прошедшего термическую обработку при 400°С в течение 2 ч под вакуумом. Реакцию проводили в атмосфере аргона в растворителе при соотношении растворитель: стирол = 50:1 (об.), количество катализатора составляет 55,5 мас.%. Выход линейного димера составляет 81% [K.B. Joon, J.L. Lim, J.K. Kochi. J. Mol. Catal, 1989, 52, p.375-386].
Использование цеолита H-ZSM-12 позволяет получать линейные димеры стирола с селективностью 68-75% в присутствии нонана при отношении стирол: растворитель = 1:2-4 (об.) [Патент РФ №2349567] или с близкой селективностью в отсутствие растворителя [Патент РФ №2349568].
Для синтеза циклических димеров стирола цис- и транс-1-метил-3-фенилинданов предложено проводить димеризацию стирола в присутствии фосфорной кислоты [Патент Великобритании №1343445], фосфорной кислоты на угле [B.B. Corson, Ju. Dorsky, J.E. Nickels. J. Org. Chem, 1954, v.19, p.17-26], катионообменной смолы H-Nafion [Hasegawa П., Higashimura H. Polim. J., 1979, 11, p.737].
Известен способ получения циклических димеров стирола в присутствии цеолита Beta. Реакцию проводят в растворителе CCl4, количество которого составляет от 227 до 454 объемных частей на 1 об. часть стирола. Катализатор используют в количестве 500-1000 мас.% в расчете на стирол. Температура реакции 72°С, время - 3 ч. Селективность образования циклического димера составляет 84-90% при конверсии стирола 95 мас.% [Benito A., Corma A., Garcia H. Appl. Catal. A: General. 1994, 116, p.127-135].
В отличие от широко изученной гомодимеризации стирола и α-метилстирола их совместная димеризация исследована мало.
Описана совместная олигомеризация стирола с α-метилстиролом под действием фосфорной кислоты с получением смеси циклических гомо- и содимеров [Р.Н. Волков, Ю.С. Цыбин, В.В. Кузенков. Нефтехимия, 1970, т.Х, №4, с.541-545]. Реакцию проводили, добавляя 150 г смеси мономеров к 150 мл упаренной фосфорной кислоты, постепенно поднимая температуру от 130 до 155°С, в течение 3 ч. Выход димеров составляет 80% при мольном соотношении стирол: α-метилстирол = 1:1. В составе димеров присутствуют циклический димер α-метилстирола (ЦДМС); циклические димеры стирола (ЦДС); два циклических содимера (ЦСД) - 1,1-диметил-3-фенилиндан и 1,3-диметил-3-фенилиндан.
К недостаткам данного способа относится использование большого количества агрессивного, коррозионно-активного реагента - фосфорной кислоты, сложность ее отделения от продуктов реакции (необходимость в нейтрализации, отмывке, осушке органической части перед перегонкой), появление большого количества стоков. Кроме того, продуктами реакции являются только циклические гомо- и содимеры.
Задачей настоящего изобретения является разработка малостадийного, экологически безопасного способа совместной олигомеризации стирола и α-метилстирола.
Решение поставленной задачи достигается тем, что способ получения смеси гомо- и содимеров стирола и α-метилстирола осуществляют взаимодействием стирола и α-метилстирола в присутствии цеолита NiHY. Реакцию проводят в хлорбензоле при мольном соотношении стирол: α-метилстирол = 1:1, температуре 80-130°С и количестве катализатора 5-30 мас.% (в расчете на смесь мономеров). Начальная концентрация мономеров в хлорбензоле составляет 2-8 моль/л.
Конверсия стирола и α-метилстирола составляет 97,5-100 мас.%. Выход димеров в присутствии цеолита NiHY достигает 80 мас.%. В составе димеров образуются циклические и линейные димеры стирола (ЦДС и ЛДС), α-метилстирола (ЦДМС и ЛДМС), а также циклический содимер (ЦСД) - 1,1-диметил-3-фенилиндан (6) и линейные содимеры (ЛСД) - транс-3-метил-1,3-дифенилбут-1-ен (3), 2,4-дифенилпент-2-ен (4), 2,4-дифенилпент-1-ен (5). Содержание содимеров в димерной фракции достигает 54,2 мас.%. Соотношение циклический содимер: линейные содимеры составляет 1-2:1. Кроме димеров образуются более высокомолекулярные олигомеры с числом мономерных звеньев n=3-5.
Схема содимеризации стирола и α-метилстирола:
Сравнительный анализ заявляемого решения с прототипом показывает, что заявляемый способ отличается от прототипа тем, что в процессе содимеризации стирола и α-метилстирола в качестве катализатора используют цеолит NiHY. Процесс содимеризации осуществляют в присутствии 5-30 мас.% катализатора при температуре 80-130°С. Конверсия стирола и α-метилстирола достигает 100 мас.%, а выход димеров, в состав которых входят гомо- и содимеры указанных виниларенов - 80%.
Катализатор цеолит NiHY легко отделяется фильтрованием. Может использоваться многократно без потери активности.
Предлагаемый способ осуществляют следующим образом. Катализатор цеолит NiHY получали из цеолита NaY с мольным соотношением SiO2/Al2O3=6,0, синтезированного по методике, описанной в [Патент РФ №2090502]. Декатионированием из раствора NH4NO3 и последующим прокаливанием при 540°С цеолит NaY переводили в Н-форму со степенью декатионирования ионов Na+ на Н+ 90-96% (соответствующие образцы цеолитов обозначены как 0,90HY или 0,96HY). Ионным обменом высокодекатионированных образцов цеолитов HY из раствора NiNO3 получали цеолит NiHY (степень обмена = 96%).
Соолигомеризацию проводили в периодическом термостатированном реакторе, в присутствии 5-30 мас.% катализатора, при 80-130°С в среде хлорбензола. Реакционную массу перемешивают при температуре реакции в течение определенного времени. После окончания реакции реакционную массу отделяли от катализатора фильтрованием. Степень превращения исходных виниларенов и состав димерной фракции анализировали методом газожидкостной хроматрграфии. Состав образующихся олигомеров анализировали методом высокоэффективной жидкостной хроматографии. Для калибровки выделяли вакуумной перегонкой димеры и тримеры.
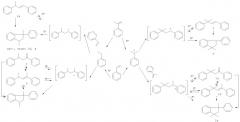
Чертеж. Хроматограмма фракции димеров, полученных при содимеризации стирола и метилстирола в присутствии цеолита NiHY.
Порядок выхода компонентов: (2б, ЦДС)-цис-1-метил-3-фенилиндан; (6, ЦСД)-1,1-диметил-3-фенилиндан; (2в, ЦДС)-транс-1-метил-3-фенилиндан; (1в, ЦДМС)-1,1,3-триметил-3-фенилиндан; (5, ЛСД)-2,4-дифенил-пент-1-ен; (2а, ЛДС)-транс-1,3-дифенилбут-1-ен; (1а, ЛДМС)-4-метил-2,4-дифенилпент-1-ен; (3, ЛСД)-транс-3-метил-1,3-дифенилбут-1-ен; (4, ЛСД)-2,4-дифенилпент-2-ен; (1б, ЛДМС)- 4-метил-2,4-дифенилпен-2-ен.
Из представленной на чертеже хроматограммы смеси димеров видно, что соединения (1-6) близки по температурам кипения. Время выхода циклических димеров меньше, чем линейных (ЛДС, ЛДМС, 4-6). В группу циклических димеров попадает линейный содимер 2,4-дифенилпент-1-ен (6), но его количество в смеси невелико (<1%). При необходимости смесь димеров может быть разделена на две фракции - линейные и циклические соединения.
ГЖХ - анализ выполняли на хроматографе HRGS 5300 Mega Series ("Carlo Erba") с пламенно-ионизационным детектором (капиллярная колонка 25 м, фаза SE-30, программирование нагревания от 50 до 280°С со скоростью подъема 8°С/мин, температура детектора 250°С, температура испарителя 300°С, газ-носитель - гелий, 30 мл/мин). ВЭЖХ - анализ выполняли на хроматографе HP-1090 с рефрактометрическим детектором и полистирольной колонкой Pigel 100 Ǻ, элюент-толуол, скорость подачи толуола 0,8 мл/мин, скорость ленты 1,5 см-1.
Предлагаемый способ иллюстрируется следующими примерами (таблица 1 и 2).
ПРИМЕР 1. В стеклянный обогреваемый реактор с мешалкой, обратным холодильником и термометром помещали смесь 5,2 г (0,05 моля) стирола и 5,9 г (0,05 моля) α-метилстирола в 25 мл хлорбензола. При 100°С прибавляли 1,1 г цеолита NiHY и перемешивали при этой температуре 5 ч. После охлаждения от реакционной смеси отфильтровывали катализатор, затем при пониженном давлении удаляли растворитель и непрореагировавшие виниларены. Получали 10,5 г олигомеров состава, мас.%: димеры - 70,9, олигомеры n≥3 - 29,1. В составе димеров содержится, мас.%: содимеры циклический (ЦСД-22,2) и линейные (ЛСД-26,4); димеры стирола (ЦДС-3,0 и ЛДС-5,2), димеры α-метилстирола (ЦДМС-12,1 и ЛДМС-31,1).
Транс-3-метил-1,3-дифенилбут-1-ен (3). Спектр ЯМР 1Н (δ, м.д.): 1,70 (с. СН3; 6Н); 6,60-6,65 (м. СН=СН; 2Н); Спектр ЯМР 13С (δ, м.д): 28,89 (СН3;); 40,94 (СН); 126,09 (=СН); 140,30 (=СН). Масс-спектр, m/z: 222; индекс Ковача 1820.
2.4-Дифенилпент-2-ен (4). Спектр ЯМР 1Н (δ, м.д.): 1,60 (д. СН3; 3Н); 2,26 (с; СН3; 3Н); 4,03 (м, СН; 1Н); 6,11 (д, =СН; 1Н. Спектр ЯМР 13С (δ, м.д): 16,26 (СН3;); 22,61 (СН3;); 38,47 (СН); 133,59 (НС=); 143,83 (=С). Масс-спектр, m/z: 222; индекс Ковача 1830.
2,4-Дифенилпент-1-ен (5). Масс-спектр, m/z: 222; индекс Ковача 1746.
1,1-Диметил-3-фенилиндан (6). Спектр ЯМР 1H (δ, м.д.): 1,36 (с, 3Н, СН3), 1,40 (с, 3Н, СН3), 1,79 (м, 1H, СН3); 2,06 (м, 1Н, СН3); 4,43 (т, 1Н, СН). Спектр ЯМР 13С (δ, м.д.): 29,70 (-СН3); 29,10 (-СН3); 46,64 (-С(СН3)2); 49,04 (CPh); 52,79 (-СН2-). Масс-спектр, m/z: 222; индекс Ковача 1713.
Примеры 2-7 приведены в таблицах 1 и 2 аналогично примеру 1.
В таблице 1: [М]0 - начальная концентрация мономеров в хлорбензоле;
αNa+ - степень обмена Na+ на H+ в исходном цеолите Na
| Таблица 1 | ||||||||||
| Состав олигомеров, образующихся при содимеризации стирола и α-метилстирола в присутствии цеолита NiY | ||||||||||
| № п/п | αNa+, мас.% | [М]0, моль/л | [kt], мас.% | Т, °С | τ, ч | Конверсия, % | Олигомеры | |||
| Стирол | α-метилстирол | димеры | тримеры | n>4 | ||||||
| 1 | 90 | 4 | 10 | 100 | 5 | 98,8 | 99,5 | 70,9 | 16,8 | 12,3 |
| 2 | 90 | 4 | 20 | 120 | 5 | 99,0 | 99,9 | 75,8 | 14,3 | 9,9 |
| 3 | 96 | 4 | 5 | 130 | 5 | 99,8 | 100,0 | 74,4 | 15,1 | 10,5 |
| 4 | 96 | 2 | 10 | 120 | 3 | 97,8 | 98,8 | 80,0 | 12,2 | 7,8 |
| 5 | 96 | 4 | 10 | 110 | 3 | 98,2 | 99,3 | 72,5 | 15,4 | 12,1 |
| 6 | 96 | 8 | 20 | 120 | 3 | 100,0 | 100,0 | 79,1 | 13,5 | 7,4 |
| 7 | 96 | 2 | 30 | 80 | 5 | 97,5 | 98,1 | 69,1 | 17,2 | 13,7 |
1. Способ совместного получения циклических и линейных гомо- и содимеров стирола и α-метилстирола путем содимеризации мономеров в присутствии кислотного катализатора, отличающийся тем, что в качестве катализатора используют цеолит NiHY в количестве 5-30 мас.% и реакцию проводят в хлорбензоле при температуре 80-130°С.
2. Способ по п.1, отличающийся тем, что концентрация смеси стирола и α-метилстирола в хлорбензоле составляет 2-8 моль/л.
3. Способ по п.1, отличающийся тем, что цеолит NiHY получают ионным обменом высокодекатионированных образцов цеолитов HY со степенью обмена ионов Na+ на H+, равной 90-96%.