Противоопухолевые соединения
Иллюстрации
Показать всеИзобретение касается новых противоопухолевых соединений общей формулы I
где R1-16 являются группами, независимо выбранными из водорода, защищенного или незащищенного гидроксила, C1-C24 алкила, C2-C24 алкенила, =O и ORa, OCORa; X и Y являются C5-C12 алкильными группами, которые замещены одной или несколькими C1-С6 алкильными группами, гидроксильными группами и/или тетрагидропираном, который необязательно может быть замещен алкилом и/или группой ORa; Ra независимо выбирают из водорода и C1-С12 алкила; и пунктирная линия показывает присутствие двойной связи. А также способа их получения, фармацевтической композиции, на основе данных соединений, обладающей противоопухолевой активностью, и применения соединений формулы I для получения лекарственного средства, направленного на лечение рака. Технический результат: получены и описаны новые соединения, которые обладают цитотоксической активностью и могут быть использованы для лечения рака. 4 н. и 11 з.п. ф-лы, 2 табл.
Реферат
Уровень техники, к которой относится изобретение
Изобретение относится к новым противоопухолевым соединениям, содержащим их фармацевтическим композициям и их применению в качестве противоопухолевых агентов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
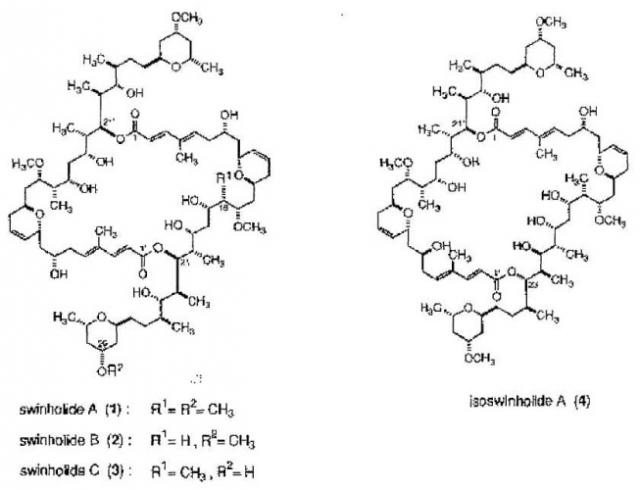
Было показано, что некоторые асимметричные димерные макролиды обладают противоопухолевыми, противовирусными и/или противогрибковыми свойствами. В частности, Kitagawa и др. (Chem. Pharm. Bull., 1994, 42(1), 19-26) выделили несколько асимметричных димерных макролидов из окинавской морской губки Theonella swinhoei:
Показано, что Swinholide А (1), В (2) и С (3) проявляют цитотоксическую активность против L1210 и КВ клеток со значением IC50 0,03, 0,30 и 0,14 мкг/мл (для L1210) и 0,04, 0,04 и 0,05 мкг/мл (для КВ), соответственно. Однако наблюдалось, что isoswinhokide A (4) показывал меньшую цитотоксичность [IC50 1,35 мкг/мл (L1210) и 1,1 мкг/мл (КВ)] по сравнению с другими, ранее указанными аналогами.
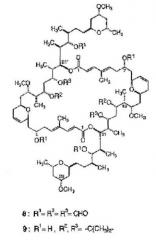
Kitagawa и др. также проверили цитотоксичность некоторых димеров, полученных из Swinholide А (1):
наблюдая, что оба димера (8 и 9) показывают слабую способность ингибирования роста КВ клеток (51,1% ингибирования при 50 мкг/мл и 19,3% ингибирования при 10 мкг/мл, соответственно).
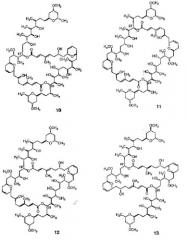
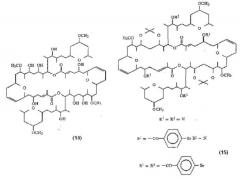
Другие димерные макролиды, которые были получены из Swinholide А (1), были следующими:
Цитотоксичность данных соединений (10-13) против L1210 и КВ клеток является меньшей, чем цитотоксичность, показанная Swinholide A (1).
Помимо этого, Kitagawa и др. проверили противоопухолевый эффект Swinholide A (1) и его изомеров против Р388 лейкемии у CDF1 мыши. Неожиданно было обнаружено, что Swinholide А (1), isoswinholide А (4) и изомер 11 были токсичны и не показали многообещающей противоопухолевой активности.
Кроме этого, заявка на патент WO 88/00195 описывает следующие соединения (Misakinolide А (15) и производные (15)), которые были выделены из морской губки рода Theonella:
В указанной заявке на патент описывается противоопухолевая активность Misakinolide А (14) in vitro против Р388, НСТ-8, А549 и MDA-MB-231 раковых клеток. Также было описано, что кроме ярко выраженной цитотоксичности [IC50 0,035 мкг/мл (L1210)], Misakinolide А также обладает противоопухолевой активностью [T/C 140% при дозе 0,1 мг/кг (мыши), против Р388 лейкемии] (Chem. Pharm. Bull., 1994, 42(1), 19-26).
Рак продолжает быть одной из главных причин смерти среди видов животных и человека. Были предприняты и продолжают предприниматься огромные усилия, направленные на поиск средств предохранения и новых эффективных противоопухолевых агентов, которые внесут вклад в увеличение терапевтического арсенала, необходимого для эффективного лечения пациентов с этим заболеванием. В этом смысле настоящее изобретение направлено на решение данной проблемы, предоставляя новые соединения, эффективные при лечении рака.
Сущность изобретения
Настоящее изобретение направлено на асимметрические димерные макролиды с общей формулой I, а также на их соответствующие фармацевтически приемлемые соли, производные, пролекарства и стереоизомеры,
где R1-16 являются группами, независимо выбранными из водорода, защищенного или незащищенного гидроксила, замещенного или незамещенного С1-С24 алкила, замещенного или незамещенного С2-С24 алкенила, замещенного или незамещенного С2-С24 алкинила, =О, ORa, OCORa, NRaRb, NRaCORb, CONRaRb, CORa, COORa и галогена.
X и Y являются группами, независимо выбранными из замещенного или незамещенного С1-С24 алкила, замещенного или незамещенного С2-С24 алкенила, замещенного или незамещенного С2-С24 алкинила, =О, ORa, OCORa, NRaRb, NRaCORb, CONRaRb, CORa, COORa и галогена;
Ra и Rb являются группами, независимо выбранными из водорода, галогена, замещенного или незамещенного С1-С12 алкила, замещенного или незамещенного С2-С12 алкенила, замещенного или незамещенного С2-С12 алкинила, замещенного или незамещенного арила и замещенного или незамещенного гетероцикла; и пунктирная линия показывает необязательное присутствие двойной связи.
Изобретение также относится к выделению соединений формулы I из губок семейства Theonellidae, рода Theonella и вида swinhoei, и к образованию производных выделенных соединений.
Кроме этого, настоящее изобретение также относится к соединению общей формулы I или его фармацевтически приемлемой соли, производному, пролекарству или стереоизомеру, для его применения в качестве лекарственного средства.
Изобретение также направлено на применение соединения формулы I или его фармацевтически приемлемой соли, производного, пролекарства или стереоизомера для получения лекарственного средства для лечения рака.
Также настоящее изобретение относится к фармацевтическим композициям, содержащим соединение формулы I или его соответствующие фармацевтически приемлемые соли, производные, пролекарства или стереоизомеры в смеси с фармацевтически приемлемым эксципиентом или разбавителем.
Подробное описание изобретения
Соединения, являющиеся целью изобретения, относятся к асимметрическим димерным макролидам общей формулы I
где R1-16 являются группами, независимо выбранными из водорода, защищенного или незащищенного гидроксила, замещенного или незамещенного С1-С24 алкила, замещенного или незамещенного С2-С24 алкенила, замещенного или незамещенного С2-С24 алкинила, =О, ORa, OCORa, NRaRb, NRaCORb, CONRaRb, CORa, COORa и галогена.
X и Y являются группами, независимо выбранными из замещенного или незамещенного С1-С24 алкила, замещенного или незамещенного С2-С24 алкенила, замещенного или незамещенного С2-С24 алкинила, =О, ORa, OCORa, NRaRb, NRaCORb, CONRaRb, CORa, COORa и галогена;
Ra и Rb являются группами, независимо выбранными из водорода, галогена, замещенного или незамещенного С1-С24 алкила, замещенного или незамещенного С2-С24 алкенила, замещенного или незамещенного С2-С24 алкинила, замещенного или незамещенного арила и замещенного или незамещенного гетероцикла; и пунктирная линия показывает необязательное присутствие двойной связи.
Группы или заместители в данных соединениях могут быть выбраны согласно следующим условиям.
Термин алкил обозначает линейную или разветвленную углеродную цепь, имеющую от 1 до 24 атомов углерода. Предпочтительными являются алкильные группы от 1 до 6 атомов углерода, и особенно предпочтительны те, которые состоят из 1, 2, 3 и 4 атомов углерода. В соединениях настоящего изобретения особенно предпочтительными алкильными группами являются метильная, этильная, пропильная, изопропильная, бутильная, втор-бутильная и трет-бутильная группы. Также термин алкил, используемый в настоящем изобретении, относится как к циклической, так и нециклической группе, принимая во внимание, что циклические группы будут содержать, по крайней мере, три атома углерода в кольце. Другими предпочтительными алкильными группами являются такие, которые имеют от 5 до 12 атомов углерода, причем особенно предпочтительны такие, которые состоят из 6, 7, 8, 9 и 10 атомов углерода. В соединениях настоящего изобретения особенно предпочтительными алкильными группами являются гексильная, гептильная, 1,3-диметилпентильная, октильная, 1,3-диметилгексильная и нонильная группы.
Термины алкенил и алкинил обозначают линейную или разветвленную ненасыщенную алкильную цепь, содержащую от 2 до 24 атомов углерода, и включающую одно или несколько ненасыщенных положений. Предпочтительными являются алкенильные, алкинильные группы, имеющие от 2 до 6 атомов углерода, и особенно предпочтительны те, которые состоят из 2, 3 и 4 атомов углерода. Также термины алкенил и алкинил, используемые в настоящем изобретении, относятся как к циклическим, так и нециклическим группам, принимая во внимание, что циклические группы будут содержать, по крайней мере, три атома углерода в кольце. Другими предпочтительными алкенильными и алкинильными группами являются такие, которые имеют от 5 до 12 атомов углерода. В число арильных групп, которые могут присутствовать в соединениях изобретения, включены такие, которые содержат одно или несколько колец, включая множественные кольца с разделенными или конденсированными арильными или гетероарильными группами. Обычно арильные группы содержат от 1 до 3 колец и от 4 до 18 атом углерода в кольце(ах). Предпочтительными арильными группами являются фенил, нафтил, бифенил, фенантрил и антрацил, причем все они замещены или незамещены.
В число гетероциклических групп, которые могут присутствовать в соединениях изобретения, включены как гетероароматические, так и гетероалициклические группы. Гетероароматические группы содержат один, два или три гетероатома, выбранных из N, O и S, например, включая группы, такие как кумаринил, предпочтительно 8-кумаринил, хинолинил, предпочтительно 8-хинолинил, пиридил, пиразинил, пиримидил, фурил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, индолил, бензофуранил и бензотиазолил. Гетероалициклические группы содержат один, два или три гетероатома, выбранных из N, O и, S, и, например, включая группы, такие как тетрагидрофуранил, тетрагидропиранил, пиперидинил, морфолин и пирролидинил. Гетероциклические группы могут быть как замещенными, так и незамещенными.
Ранее упомянутые группы, возможно, могут быть замещены по их одному или нескольким доступным положениям, независимо одним или несколькими подходящими заместителями, такими как OR`, =О, SR`, SOR`, SO2R`, NO2, NHR`, N(R`)2, =N-R`, NHCOR`, N(COR`)2, NHSO2R`, NR`C(=NR`)NHR`, CN, галоген, С(=O)R`, COOR`, OC(=O)R`, CONHR`, CON(R`)2, замещенный или незамещенный С1-С24 алкил, замещенный или незамещенный С2-С24 алкенил, замещенный или незамещенный С2-С24 алкинил, замещенный или незамещенный арил и замещенный или незамещенный гетероцикл, где каждая группа R` независимо выбрана из Н, ОН, NO2, NH2, SH, CN, галогена, =О, С(=O)Н, С(=O)алкила, СООН, замещенного или незамещенного С1-С12 алкила, замещенного или незамещенного С2-С12 алкенила, замещенного или незамещенного С2-С12 алкинила, замещенного или незамещенного арила и замещенного или незамещенного гетероцикла. В число галогеновых заместителей, которые могут присутствовать в соединениях настоящего изобретения, включены F, Cl, Br и I. В случае таких групп, которые в свою очередь замещены, соответствующие заместители могут быть выбраны из указанного здесь списка заместителей.
Гидроксильная группа, возможно, может быть защищена. Существует огромное число гидроксильных защитных групп, и они хорошо известны специалисту в данной области техники. Для справки см. Protecting groups, Kocienski, 2004, 3-е изд.
Термин «фармацевтически приемлемые соли, производные, пролекарства» относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату, гидрату или какому-либо другому соединению, которое после его введения пациенту способно (напрямую или опосредованно) дать соединение формулы I. Однако следует принимать во внимание, что не фармацевтически приемлемые соли также находятся в рамках изобретения, так как они могут быть пригодными при получении фармацевтически приемлемых солей. Получение солей, пролекарств и производных может быть осуществлено с помощью способов, известных в области техники.
Например, фармацевтически приемлемые соли соединений настоящего изобретения получаются из соответствующих соединений, имеющих кислотные или основные части, с помощью традиционных химических методов. В основном указанные соли образуются, например, посредством реакции соответствующей основной или свободнокислотной формы указанного соединения со стехиометрическим количеством подходящего основания или кислоты в воде, органическом растворителе или в их смеси. Обычно предпочтительными неводными средами являются эфир, этилацетат, этанол, изопропанол или ацетонитрил. В число солей, полученных добавлением кислоты, входят соли, полученные добавлением минеральных кислот, такие как гидрохлорид, гидробромид, гидроиодид, сульфат, нитрат и фосфат, и соли, полученные добавлением органических кислот, такие как ацетат, трифторацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, соль яблочной кислоты, соль миндальной кислоты, метансульфанат и паратолуолсульфанат. В число солей, полученных добавлением основания, входят неорганические соли, такие как натриевые, калиевые, кальциевые и аммонийные соли, и органические соли, такие как соли этилендиамина, этаноламина, N,N-диалкиленэтаноламина, триэтаноламина и основные соли аминокислот.
Соединения настоящего изобретения могут быть в кристаллической форме как в виде свободных соединений, так и сольватов (например, гидратов), причем обе формы включены в объем настоящего изобретения. Способы сольватации в основном хорошо известны в области техники.
Любое соединение, которое является пролекарством соединения общей формулы I, включено в объем настоящего изобретения. Термин «пролекарство» используется в широком смысле и включает все производные, которые могут быть превращены in vivo в любые соединения изобретения. Специалист в области техники знает, какие это производные могут быть, и они включают, например, соединения, в которых свободная гидроксильная группа превращена в сложноэфирное производное, или сложный эфир модифицирован посредством переэтерификации или образования подходящего амида.
Соединения настоящего изобретения, представленные общей формулой I, имеют более чем один стереогенный центр, так что изобретение в равной степени относится к каждому и любому из возможных энантиомеров и диастериомеров, которые могут быть получены, а также к возможным Z и Е стереоизомерам, которые могут быть образованы при наличии в молекуле двойной связи. В рамках настоящего изобретения находятся как чистые изомеры, так и смеси изомеров указанных соединений.
Предпочтительными соединениями настоящего изобретения являются такие, у которых R1-16 являются группами, независимо выбранными из водорода, защищенного или незащищенного гидроксила, ORa, OCORa, =О, NRaRb, NRaCORb, галогена и замещенного или незамещенного С1-С24 алкила, где Rа определен выше. Особенно предпочтительными являются такие соединения, в которых R1-7 и R9-15 являются группами, независимо выбранными из водорода, гидроксила, С1-С6 алкила и ORа; и среди них предпочтительными являются водород, гидроксил, метил и метокси. Также особенно предпочтительно, чтобы R8 и R16 группы были =О.
Предпочтительно Х и Y являются группами, независимо выбранными из замещенного или незамещенного С5-С12 алкила и замещенного или незамещенного С5-С12 алкенила. Особенно предпочтительно, чтобы они были независимо замещены одним или несколькими подходящими заместителями, и, в частности, замещены одним или несколькими следующими заместителями: ОН, OR`, NHCOR` и замещенным или незамещенным гетероциклом, где R` определен ранее. Более предпочтительно, чтобы X и Y были С5-С12 алкильными группами, замещенными одной или несколькими гидроксильными группами и/или замещенными гетероциклами. Особенно предпочтительно, когда X и Y являются
В данных участках структуры предпочтительно наличие двойных связей, показанных пунктирной линией в общей формуле I.
Следующие соединения являются особенно предпочтительными соединениями настоящего изобретения:
Соединение А
Соединение А является природным продуктом, выделенным из морской губки, а именно из губки вида Theonella swinhoei (Класс: Demosponhiae, Подкласс: Tetractinomorpha, Отряд: Lithistida, Подотряд: Triaenosina, Семейство: Theonellidae). Указанный организм был собран на Островах Глорьез (северо-запад Мадагаскара).
Данные виды губок обычны для запада Тихого Оокеана, в Индийском Океане и в Красном Море, причем располагаются по побережью на глубине до 48 метров. Образцы были найдены:
- Кения, Момбаса, Shelly Beach, на внешнем откосе рифа, на глубине 12-16 метров.
- North Kenya Banks (02° 25,`ю.ш. - 40° 42,5` в.д., на глубине 48 метров)
- Tulear, область Ifaty (Мадагаскар)
- Острова Albadra (северо-запад Мадагаскара)
- Ternate, Celebes, Ambon, Manila, Formosa (Филиппины), Тайвань.
Кроме этого, аналоги указанных соединений могут быть синтезированы специалистом в данной области техники с помощью, например, кислотного или основного гидролиза, окисления, этерификации, альдолльной конденсации, озонолиза, реакции Виттига, реакции Хорнера-Эммонса, эпоксидирования по Шарплессу или реакции Пиктеда-Спенглера. Соединение А и его аналоги могут быть синтезированы, например, посредством описанных синтезов подходящим образом защищенных мономерных единиц Swinholide A и Misakinolide A, последующего проведения реакций макролактонизации, которые позволяют получить Соединение А и его аналоги (см. K-S. Yeung и I. Paterson. Angew. Chem. Int. Ed. 2002, 41, 4632-4653).
Важным аспектом соединений настоящего изобретения является их биологическая активность и, в частности, их цитотоксическая активность. Следовательно, настоящее изобретение обеспечивает новые фармацевтические композиции соединений общей формулы I, имеющих цитотоксический эффект, а также их применение в качестве противоопухолевых агентов. Кроме этого, настоящее изобретение также обеспечивает фармацевтические композиции, содержащие соединение настоящего изобретения или фармацевтически приемлемую соль, производное, пролекарство или стереоизомер в смеси с фармацевтически приемлемым наполнителем или разбавителем.
Фармацевтические композиции, включенные в качестве примеров, являются любыми твердыми (таблетки, пилюли, капсулы, гранулы и т.п.) или жидкими (растворы, суспензии или эмульсии) композициями для орального, топического или парентерального введения. Фармацевтические композиции, содержащие соединения настоящего изобретения, также могут быть получены в форме липосом или наносфер, составов замедленного высвобождения или любых других традиционных систем высвобождения.
Введение соединений или композиций настоящего изобретения может быть осуществлено с помощью любых обычных способов, таких как внутривенное вливание, составы для орального введения и/или внутрибрюшинного и внутривенного введения. Предпочтительно, чтобы используемые времена вливания не превышали 24 часа, предпочтительно были от 1 до 12 часов и еще более предпочтительно от 1 до 6 часов. Короткие времена вливания особенно желаемы, так как это позволяет проводить лечение без необходимости проводить ночь в госпитале. Однако времена вливания от 12 до 24 часов и включая большие, при необходимости могут быть использованы. Вливание может быть проведено с подходящими интервалами, такими как от 1 до 4 недель.
Правильная доза соединений меняется в зависимости от типа используемого состава, формы применения и местоположения, хозяина и опухоли, которую необходимо лечить. Также должны приниматься во внимание другие факторы, такие как возраст, вес тела, пол, режим питания, время введения, скорость выведения, состояние здоровья хозяина, комбинация активных ингредиентов, чувствительность с точки зрения реакций и серьезности заболевания. Введение может быть проведено непрерывно или периодически с максимально переносимой дозой.
Соединения и композиции настоящего изобретения могут быть использованы вместе с другими активными ингредиентами в комбинированной терапии. Другие активные ингредиенты могут быть частью той же композиции или могут быть введены посредством другой композиции, причем одновременно или в различное время.
ПРИМЕРЫ
ПРИМЕР 1: ОПИСАНИЕ ОРГАНИЗМА И МЕСТО СБОРА
Несколько образцов губки Theonella swinhoei были собраны при погружении на Островах Глорьез (северо-запад Мадагаскара, запад Индийского Океана) на глубине 18 метров в ноябре 2003 г. Координаты места сбора образцов являются следующими: широта 11° 34` 995`` с.ш. и долгота 47° 16` 829`` в.д. Дно моря было скалистым и песчаным, и подложка образцов была скалистой.
Описание организма: массивная губка. Верхняя поверхность покрыта несколькими округлыми отверстиями (поры). Поверхность является гладкой и консистенция твердая, однако выдержанные образцы являются хрупкими. Цвет живой губки коричневый и ее внутренность светло-бежевого цвета. Дермальная мембрана равномерно пористая. Данные образцы легко характеризуются посредством скелетных элементов. Скелет образован неправильными узлами стронгилидов, направленных по касательным к поверхности, и помощью малоразветвленных спикул (кремнистая спикула губок неправильной формы). Внутренний скелет состоит из тетразоновых спикул, которые могут быть гладко или слабо покрыты бугорками.
ПРИМЕР 2: ВЫДЕЛЕНИЕ СОЕДИНЕНИЯ А
Замороженный образец (604 г) губки Примера 1 нарезают на кусочки и экстрагируют Н2О (3×500 мл) и затем смесью МеОН:CH2Cl2 (50:50, 3×500 мл). Объединенные органические экстракты концентрируют, получая остаток (7,48 г), который разделяют вакуумной жидкостной хроматографией на Lichroprep RP-18 с градиентом от Н2О:МеОН до CH2Cl2. Соединение А (5,8 мг) выделяют из фракции, элюированной с МеОН, которую очищают с помощью полупрепаративной ВЭЖХ (SymmetryPrep C-18, 7 мкм, 7,8 мм×150 мм, градиент Н2О:CH3CN, УФ-детектирование), получая фракцию, содержащую Соединение А, и которую снова очищают с помощью полупрепаративной ВЭЖХ (SymmetryPrep C-18, 7 мкм, 19 мм×150 мм, градиент Н2О:CH3CN, УФ-детектирование).
Соединение А: MS (ESI)=1362 (M+). MS (APCI)=1345(M+1-H2O)+. 1Н и 13С ЯМР см. Таблицу 1.
Соединение А
| Таблица 1Данные 1Н и 13С ЯМР (CD3OD) соединения А | ||||
| 1 Н, мультиплетность, J=Гц | 13 C | COSY | HMBC | |
| 1/32 | - | 170,7/171,1 | - | - |
| 2 | 5,91, д, 16,0 | 116,1 | H-3 | C-1, C-4 |
| 3 | 7,50, д, 16, 0 | 152,4 | H-2 | C-1, C-2, C-4, 4-Мe, C-5 |
| 4/33 | - | 135,6/129,9 | - | - |
| 4-Мe/33-Мe | 1,86, с/1,89, с | 12,7/13,22 | H-5/H-34 | C-3, 4-Мe, C-5/C-32, C-33, C-34 |
| 5/34 | 6,16, т, 7,0/6,99, т, 6,0 | 140,9/142,1 | 4-Мe, H-6/33-Мe, H-35 | C-3, C-4, C-6, C-7/C-32, 33-Мe, C-35, C-36 |
| 6/35 | 2,44, м/2,38, м | 38,8/38,6 | H-5, H-7/H-34, H-36 | C-4, C-5, C-7/C-33, C-34, C-36 |
| 7/36 | 4,02, м/4,08, м | 68,4/67,8 | H-6, H-8/H-35, H-37 | C-8/C-37 |
| 8/37 | 1,38, м/1,80, мa | 41,58/41,63b | H-7, H-9/H-36, H-38 | - |
| 9/38 | 4,49, д, 10,5 | 70,60/70,64с | H-8/H-37, H-40 | C-10/C-39 |
| 10/39 | 5,68, м | 131,1 | H-11, H-13/H-40, H-41 | C-9, C-11, C-12/C-38, C-40, C-41 |
| 11/40 | 5,83, м | 125,05/125,20d | H-10, H-12/H-38, H-39 | C-10/C-39 |
| 12/41 | 2,00, м | 32,37/32,44е | H-11, H-13/H-39, H-42 | C-10, C-11/C-39, C-40 |
| 13/42 | 3,57, м | 65,5/65,7f | H-10, H-12, H-14/H-41, H-43 | - |
| 14/43 | 1,58, м/1,82, мg | 37,1/37,4h | H-13, H-15/H-42, H-44 | C-13/C-42 |
| 15/44 | 3,78, м | 79,04/79,05i | H-14/H-43 | -/C-45 |
| 15-ОМе/44-ОМе | 3,33, с | 57,1/57,2j | - | C-15/- |
| 16/45 | 1,58, м | 43,6/43,8k | 16-Мe/45-Мe | C-15, C-18, C-19/C-47, C-48 |
| 1б-Ме/45-Ме | 0,84, д, 5,5/0,86, д, 5,5l | 9,05/9,40m | H-16/H-45 | C-15, C-16, C-17/C-46, C-44, C-45 |
| 17/46 | 3,65, м/3,66, м11 | 73,8/74,2° | H-18/H-47 | - |
| 18/47 | 1,62, м/1,68, мp | 39,0/39,2кв. | H-17, H-19/H-46, H-48 | C-19/C-48 |
| 19/48 | 3,94, м | 70,9/70,8r | H-18/H-47 | - |
| 20/49 | 1,90, м | 40,2/40,5 | H-21, 20-Мe/H-50, 49-Мe | C-21/C-50 |
| 20-Ме/49-Ме | 0,92, д, 7,5/0,95, д, 7,5с | 9,4/9,5t | H-20/H-49 | С-19, С-20, С-21/С-48, С-49, С-50 |
| 21/50 | 5,41, м | 76,5/76,0 | H-20/H-49 | С-19, С-20, С-22, 22-Ме, С-23, С-32/С-1, С-48, С-49, 51-Мe, C-51, С-52 |
| 22/51 | 2,03, м | 38,5/38,3 | 22-Мe/51-Мe | 22-Ме, С-23/51-Ме, С-52 |
| 22-Ме/51-Ме | 0,97, м | 10,1/9,9 | H-22/H-51 | С-22, С-23/С-51, С-52 |
| 23/52 | 3,13, дд, 2,0, 8,0 | 77,7/77,6U | - | - |
| 24/53 | 1,73, м | 34,7 | 24-Мe/53-Мe | - |
| 24-Ме/53-Ме | 0,98, д, 7,0/0,99, д, 7,0v | 18, 0/18,1w | H-24/H-53 | С-24, С-25/С-53, С-54 |
| 25/54 | 1,23, м/1,43, мx | 25,30/25,35 | H-26/H-55 | С-24, С-26/С-53, С-55 |
| 26/55 | 1,94, м | 30,0 | H-25, H-27/Н-54, Н-56 | С-24, С-29/С-53, С-58 |
| 27/56 | 4,01, м | 73,03/73,06y | Н-26, Н-28/Н-57, Н-55 | - |
| 28/57 | 1,52, м/1,88, мz | 36,1 | Н-27, Н-29/Н-56, Н-58 | С-26, С-27, С-29, С-ЗО/С-55, С-56, С-58, С-59 |
| 29/58 | 3,62, м | 74,5 | Н-28, Н-ЗО/Н-57, Н-59 | - |
| 29-ОМе/58-ОМе | 3,36, с | 55,6 | - | С-29/С-58 |
| 30/59 | 1,11, кв., 12,5/2,03, мaz | 40,0 | Н-29, Н-31/Н-58, Н-60 | С-28, С-29, С-31/С-57, С-58, С-60 |
| 31/60 | 3,76, м | 66,0 | Н-30/Н-59 | - |
| 31-Ме/О-Ме | 1,21, д, 6,5 | 22,1 | - | С-29, С-30, С-31/С-58, С-59, С-60 |
| a-az верхний индекс в ячейке означает, что значения химического сдвига могут быть взаимозаменяемыми. |
ПРИМЕР 3: БИОЛОГИЧЕСКИЙ АНАЛИЗ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ
Анализ противоопухолевой активности позволяет обнаруживать выделения или соединения с цитотоксической активностью (клеточной гибелью) или цитостатической активностью (ингибирование роста) в in vitro культурах опухолевых клеток человеческого происхождения.
ЛИНИИ КЛЕТОК
| Название | № В Американской коллекции типовых культур | Виды | Ткани | Характеристики |
| А549 | CCL-185 | Человек | Легкое | “NSCL” рак легкого |
| НТ29 | НТВ-38 | Человек | Толстая кишка | Аденокарцинома толстой кишки, аденокарцинома молочной железы |
| MDA-MB-231 | HTB-26 | Человек | Молочная железа | Her2/neu+ (плевральный выпот) |
ИССЛЕДОВАНИЯ ИНГИБИРОВАНИЯ КЛЕТОЧНОГО РОСТА С ПОМОЩЬЮ КОЛОРИМЕТРИЧЕСКОГО АНАЛИЗА
Измерение клеточного роста in vitro проводилось с помощью колориметрического анализа с сульфородомином В (SRB) (следуя адаптации, ранее описанного способа Philip Skehan и др. 1990, J. Natl. Cancer Inst., 82:1107-1112).
В данном типе анализа используется 96-луночные микроплашки культур (Mosmann, 1983, Faircloth, 1988). Большинство использованных линий клеток получено из Американской коллекции типовых культур (АТСС) и от различных типов человеческих опухолей.
Культуры клеток поддерживались в культурной среде DMEM (с добавлением 10% эмбриональной бычий сыворотки (FBS), 1% пенициллин/стрептомицин 1% глутамин) при 37°С, 5% СО2 и 98% влажности.
Для анализов, клетки трипсинизируются и высеваются в 96-луночные микроплашки при различной концентрации в зависимости от линии клеток и инкубируются в течение 24 часов в активной среде без ингредиента с целью их стабилизации. Затем культуры обрабатываются (конечная концентрация изменяется в зависимости от типа анализа) носителем (DMSO:DMEM, 1:1) или активным ингредиентом. После 48 часов экспонирования активному ингредиенту противоопухолевый эффект измеряют посредством указанного ранее SRB способа, который по существу состоит из: фиксации клеток 1% раствором глутарового альдегида (30 минут, комнатная температура), промывки фиксированных клеток фосфатно-буферным солевым раствором (3 промывки, комнатная температура), окрашивания культур 0,4% раствором SRB (30 минут, комнатная температура), промывки красящего агента в 1% уксусной кислоте (3 промывки, комнатная температура), сушки планшетов на воздухе и окончательной экстракции красящего агента Трис-буфером. Количественное измерение анализа проводят с помощью показаний оптической плотности планшетов в спектрофотометрическом планшет-ридере при одной длине волны 490 нм.
Для определения клеточного роста из полученных значений оптической плотности применялся алгоритм (эквивалентный алгоритму, применяемому в программе противоопухолевого скрининга NCI), который позволяет рассчитывать проценты роста по отношению к нулевому времени (начало эксперимента) как в отсутствии, так и в присутствии активного ингредиента в исследовании. Рассчитанные параметры клеточного ответа по отношению к активному ингридиенту являются следующими: GI50=концентрация, вызывающая 50% ингибирования роста, TGI=концентрация, вызывающая полное ингибирование роста (цитостатический эффект) и LC50=концентрация, вызывающая 50% клеточной гибели (цитотоксический эффект).
В Таблице 2 представлены данные биологической активности Соединения А.
| Таблица 2Данные противоопухолевой активности (Молярные) | ||||
| Толстая кишка | Молочная железа | NSCL (легкое) | ||
| HT29 | MDA-MB-231 | A549 | ||
| Соединение А | GI50 | 3,38E-7 | 8,08E-7 | 2,28E-7 |
| TGI | 8,81E-7 | 2,35E-6 | 2,28E-7 | |
| LC50 | 2,20E-6 | 4,77E-6 | 5,29E-7 |
1. Соединение общей формулы I или его фармацевтически приемлемая соль или стереоизомер, где R1-16 являются группами, независимо выбранными из водорода, защищенного или незащищенного гидроксила, C1-C24 алкила, С2-С24 алкенила, =O и ORa, OCORa;X и Y являются C5-C12 алкильными группами, которые замещены одной или несколькими C1-С6 алкильными группами, гидроксильными группами и/или тетрагидропираном, который необязательно может быть замещен алкилом и/или группой ORa;Ra независимо выбирают из водорода и C1-C12 алкила; ипунктирная линия показывает присутствие двойной связи.
2. Соединение по п.1, где R1-7 и R9-15 являются группами, независимо выбранными из водорода, гидроксила, C1-С6 алкила и ORa.
3. Соединение по п.2, где R1-7 и R9-15 являются группами, независимо выбранными из водорода, гидроксила, метила и метокси.
4. Соединение по п.3, где R1, R5, R9 и R13 являются метилом.
5. Соединение по п.3, где R2, R4, R7, R10; R12 и R15 являются гидроксилом.
6. Соединение по п.3, где R3 и R11 являются водородом.
7. Соединение по п.3, где R6 и R14 являются метокси.
8. Соединение по любому из пп.1-7, где R8 и R16 являются =O.
9. Соединение по любому из пп.1-7, где Х и Y являются
10. Соединение по п.8, где Х и Y являются
11. Соединение по п.1, имеющее следующую формулу:
12. Способ получения соединения, определенного по любому из предшествующих пунктов, включающий его экстракцию и выделение из организма вида Theonella swinhoei.
13. Фармацевтическая композиция, обладающая противоопухолевой активностью, содержащая соединение по любому из пп.1-11 или его фармацевтически приемлемую соль или стереоизомер, в смеси с фармацевтически приемлемым эксципиентом или разбавителем.
14. Соединение по п.1 или его фармацевтически приемлемая соль или стереоизомер для применения в качестве лекарственного средства, обладающего противоопухолевой активностью.
15. Применение соединения по любому из пп.1-11 или его фармацевтически приемлемой соли или стереоизомера для получения лекарственного средства, направленного на лечение рака.