Комбинация apo2l/trail и ингибитора egfr для лечения рака, способ in vitro усиления апоптоза и применение комбинации для получения лекарственного средства для лечения рака
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению средств для лечения рака за счет усиления апоптоза, и может быть использовано в медицине. Для усиления апоптоза в клетках млекопитающего используют комбинацию, содержащую эффективное количество полипептида Apo2L/TRAIL и ингибитора EGFR, который представляет собой N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин. Изобретение позволяет эффективно использовать комбинацию для усиления апоптоза, в которой проявляется синергетическая активность Apo2L/TRAIL и ингибитора EGFR. 3 н. и 12 з.п. ф-лы, 12 ил., 1 табл.
Реферат
Родственные заявки
Эта заявка претендует на приоритет заявки США с регистрационным номером 11/061258, поданной 18 февраля 2005 года, содержание которой включено здесь в качестве ссылки.
Область техники, к которой относится изобретение
Данное изобретение относится к способам применения молекул агонистов рецептора гибели и ингибиторов EGFR. Более конкретно, это изобретение относится к способам применения молекул, таких как Аро-2 лиганд/TRAIL или антитела-агонисты DR4 или DR5 и ингибиторы EGFR, для лечения различных патологических нарушений, таких как рак.
Уровень техники
Считается, что контроль количества клеток у млекопитающего определяется отчасти равновесием между пролиферацией клеток и гибелью клеток. Одна форма гибели клеток, иногда называемая некротической гибелью клеток, обычно характеризуется как патологическая форма гибели клеток, происходящая в результате какой-либо травмы или какого-либо клеточного повреждения. В противоположность этому, имеется другая, «физиологическая» форма гибели клеток, которая обычно происходит регулярным или контролируемым образом. Эту регулярную или контролируемую форму гибели клеток часто называют «апоптозом» [см., например, Barr et al., Bio/Technology, 12:487-493 (1994); Steller et al., Science, 267:1445-1449 (1995)]. Апоптотическая гибель клеток природно встречается во многих физиологических процессах, включая эмбриональное развитие и клональную селекцию в иммунной системе [Itoh et al., Cell, 66:233-243 (1991)].
Различные молекулы, такие как фактор-альфа некроза опухолей (“TNF-alpha”), фактор-бета некроза опухолей (“TNF-beta” или “лимфотоксин-альфа”), лимфотоксин-бета (“LT-beta”), лиганд CD30, лиганд CD27, лиганд CD40, лиганд ОХ-40, лиганд 4-1ВВ, лиганд Аро-1 (также называемый Fas-лигандом или CD95-лигандом), лиганд Аро-2 (также называемый Аро-2L или TRAIL), лиганд Аро-3 (также называемый TWEAK), APRIL, лиганд ORG (также называемый лигандом RANK, ODF или TRANCE) и TALL-1 (также называемый BlyS, BAFF или THANK) были идентифицированы как члены семейства цитокинов фактора некроза опухолей (“TNF”) [См., например, Gruss and Dower, Blood, 85:3378-3404 (1995); Schmid et al., Proc. Natl. Acad. Sci., 83:1881 (1986); Dealtry et al., Eur. J. Immunol., 17:689 (1987); Pitti et al., J. Biol. Chem., 271:12687-12690 (1996); Wiley et al., Immunity, 3:673-682 (1995); Browning et al., Cell, 72:847-856 (1993); Armitage et al., Nature, 357:80-82 (1992), WO 97/01633 published January 16, 1997; WO 97/25428 published July 17, 1997; Marsters et al., Curr. Biol., 8:525-528 (1998); Chicheportiche et al., Biol. Chem., 272:32401-32410 (1997); Hahne et al., J. Exp. Med., 188:1185-1190 (1998); WO98/28426 published July 2, 1998; WO98/46751 published October 22, 1998; WO/98/18921 published May 7, 1998; Moore et al., Science, 285:260-263 (1999); Shu et al., J. Leukocyte Biol. 65:680 (1999); Schneider et al., J. Exp. Med., 189:1747-1756 (1999); Mukhopadhyay et al., J. Biol. Chem., 274:15978-15981 (1999)]. Сообщалось, что среди этих молекул TNF-α, TNF-β, лиганд CD30, лиганд 4-1ВВ, лиганд Аро-1, лиганд Аро-2 (Аро2L/TRAIL) и лиганд Аро-3 (TWEAK) участвуют в апоптотической гибели клеток.
Аро2L/TRAIL был идентифицирован несколько лет назад как член TNF-семейства цитокинов [см., например, Wiley et al., Immunity, 3:673-682 (1995); Pitti et al., J. Biol. Chem., 271:12687-12690 (1996); US Patent 6284236, issued September 4, 2001]. Полноразмерная нативная последовательность полипептида Аро2L/TRAIL человека является имеющим длину в 281 аминокислоту трансмембранным белком Типа II. Некоторые клетки могут продуцировать природную растворимую форму этого полипептида посредством ферментативного отщепления внеклеточного района этого полипептида [Mariani et al., J. Cell. Biol., 137:221-229 (1997)]. Кристаллографические исследования растворимых форм Аро2L/TRAIL выявляют гомотримерную структуру, сходную со структурами TNF и других родственных белков [Hymowitz et al., Molec. Cell, 4:563-571 (1999); Hymowitz et al., Biochemistry, 39:633-644 (2000)]. Однако было обнаружено, что Аро2L/TRAIL, в отличие от других членов TNF-семейства, имеет уникальный структурный признак, заключающийся в том, что три остатка цистеина (в положении 230 каждой субъединицы в гомотримере) вместе координируют атом цинка и что связывание цинка является важным для стабильности и биологической активности тримера. [Hymowitz et al., выше; Bodmer et al., J. Biol. Chem., 275:20632-20637 (2000)].
В литературе сообщалось, что Аро2L/TRAIL может играть роль в модуляции иммунной системы, в том числе при аутоиммунных заболеваниях, таких как ревматоидный артрит [см., например, Thomas et al., J. Immunol., 161:2195-2200 (1998); Johnsen et al., Cytokine, 11:664-672 (1999); Griffits et al., J. Exp. Med., 189:1343-1353 (1999); Song et al., J. Exp. Med., 191:1095-1103 (2000)].
Сообщалось также, что растворимые формы Аро2L/TRAIL индуцируют апоптоз в различных раковых клетках in vitro, в том числе в опухолях ободочной кишки, легкого, молочной железы, предстательной железы, мочевого пузыря, почки, яичников и головного мозга, а также в меланоме, лейкозе и множественной миеломе [см., например, Wiley et al., выше; Pitti et al., выше; Rieger et al., FEBS Letters, 427:124-128 (1998); Ashkenazi et al., J. Clin. Invest., 104:155-162 (1999); Walczak et al., Nature Med., 5:157-163 (1999); Keane et al., Cancer Research, 59:734-741 (1999); Mizutani et al., Clin. Cancer Res., 5:2605-2612 (1999); Gazitt, Leukemia, 13:1817-1824 (1999); Yu et al., Cancer Res., 60:2384-2389 (2000); Chinnaiyan et al., Proc. Natl. Acad. Sci., 97:1754-1759 (2000)]. Исследования in vivo в моделях опухоли мыши дополнительно предполагают, что Аро2L/TRAIL, один или в комбинации с химиотерапией или лучевой терапией, может проявлять существенные противоопухолевые действия [см., например, Ashkenazi et al., выше; Walzcak et al., выше; Gliniak et al., Cancer Res., 59:6153-6158 (1999); Chinnayan et al., выше; Roth et al., Biochem. Biophys. Res. Comm., 265:1999 (1999)]. В противоположность многим типам раковых клеток, большинство нормальных типов клеток человека, по-видимому, является устойчивым к индукции апоптоза некоторыми рекомбинантными формами Аро2L/TRAIL [Ashkenazi et al., выше; Walzcak et al., выше]. Jo et al., сообщили, что меченная полигистидином растворимая форма Аро2L/TRAIL индуцировала апоптоз in vitro в нормальных выделенных гепатоцитах человека, но не индуцировала апоптоз в нормальных гепатоцитах не человека [Jo et al., Nature Med., 6:564-567 (2000); см. также Nagata, Nature Med., 6:502-503 (2000)]. Считается, что некоторые рекомбинантные препараты Аро2L/TRAIL могут варьироваться в отношении биохимических свойств и биологических активностей на патологических клетках в сравнении с нормальными клетками, в зависимости, например, от присутствия или отсутствия молекулы-метки, содержания цинка и % содержания тримера [см. Lawrenxe et al., Nature Med., Letter to the Editor, 7:383-385 (2001); Qin et al., Nature Med., Letter to the Editor, 7:385-386 (2001)].
Лиганды TNF-семейства, идентифицированные к настоящему времени, за исключением лимфотоксина-α, являются трансмембранными белками типа II, С-конец которых является внеклеточным. В противоположность этому, большинство рецепторов в семействе TNF-рецепторов (TNFR), идентифицированные к настоящему времени, являются трансмембранными белками типа I. Однако как в семействе TNF-лигандов, так и в семействе TNF-рецепторов гомология, идентифицированная между членами семейств, была обнаружена в основном во внеклеточном домене (“ECD”). Несколько цитокинов TNF-семейства, в том числе TNF-α, лиганд Аро-1 и лиганд CD40, расщепляются протеолитически на поверхности клетки; полученный белок в каждом случае обычно образует гомотримерную молекулу, которая функционирует как растворимый цитокин. Белки семейства TNF-рецепторов также обычно расщепляются протеолитически с высвобождением растворимых ECD рецептора, которые могут функционировать в качестве ингибиторов родственных цитокинов.
Pan et al. описали член семейства TNF-рецепторов, названный “DR4” [Pan et al., Science, 276:111-113 (1997)]. Сообщалось, что этот DR4 содержит цитоплазматический домен гибели, способный участвовать в аппарате суицида клетки. Pan et al. сообщают, что они считают, что DR4 является рецептором для лиганда, известного как лиганд Аро-2 или TRAIL.
В Sheridan et al., Science, 277:818-821 (1997) и Pan et al., Science, 277:815-818 (1997) авторы описывают другую молекулу, которую они считают рецептором для Аро2L/TRAIL [см. также WO 98/51793, опубликованный 19 ноября 1998 года, WO 98/41629, опубликованный 24 сентября 1998 года]. Эта молекула названа DR5 (альтернативно, она была названа также Аро-2; TRAIL-R, TR6, Tango-63, hAPO8, TRICK2 или KILLER [Screaton et al., Curr. Biol., 7:693-696 (1997); Walczak et al., EMBO J., 16:53865387 (1997); Wu et al., Nature Genetics, 17:141-143 (1997); WO 98/35986, опубликованный 20 августа 1998 года; ЕР 870827, опубликованный 14 октября 1998 года; WO 98/46643, опубликованный 22 октября 1998 года; WO 99/02653, опубликованный 21 января 1999 года; WO 99/09165, опубликованный 25 февраля 1999 года; WO 99/11791, опубликованный 11 марта 1999 года]. Сообщалось, что подобно DR4, DR5 содержит цитоплазматический домен гибели и способен сигнализировать апоптоз. Кристаллическая структура комплекса, образуемого между Аро-2L/TRAIL и DR5, описана в Hymoweitz et al., Molecular Cell, 4:563-571 (1000).
Следующую группу недавно идентифицированных членов TNFR-семейства называют «рецепторами-ловушками», которые, как считают, функционируют скорее как ингибиторы, а не как трансдукторы передачи сигналов. Эта группа включает в себя DCR1 (также называемый TRID, LIT или ТRAIL-R3) [Pan et al., Science, 276:111-113 (1997); Sheridan et al., Science, 277:818-821 (1997); McFarlane et al., J. Biol. Chem., 272:25417-25420 (1997); Schneider et al., FEBS Letters, 416:329-334 (1997); Degli-Esposti et al., J. Exp. Med., 186:1165-1170 (1997); и Mongkolsapaya et al., J. Immunol., 160:3-6 (1998)] и DCR2 (также называемый TRUNDD или TRAIL-R4) [Marsters et al., Curr. Biol., 7:1003-1006 (1997); Pan et al., FEBS Letters, 424:41-45 (1998); Degli-Esposti et al., Immunity, 7:813-820 (1997)], оба являющиеся молекулами поверхности клетки, а также OPG [Simonet et al., выше] и DCR3 [Pitti et al., Nature, 396:699-703 (1998)], оба из которых являются секретируемыми, растворимыми белками. Сообщалось, что Аро2L/TRAIL связывает рецепторы, названные DcR1, DcR2 и OPG.
Считается, что Аро2L/TRAIL действует через «рецепторы гибели» DR4 и DR5 поверхности клеток, активируя каспазы, или ферменты, которые проводят внутриклеточную программу гибели клетки [см., например, Salvesen et al., Cell, 91:443-446 (1997)]. После связывания лиганда как DR4, так и DR5 могут запускать апоптоз независимо рекрутингом и активацией инициатора апоптоза, каспазы-8, через содержащую домен гибели адапторную молекулу, называемую FADD/Mort1 [Kischkel et al., Immunity, 12:611-620 (2000); Sprick et al., Immunity, 12:599-609 (2000); Bodmer et al., Nature Cell Biol., 2:241-243 (2000)]. В противоположность DR4 и DR5, рецепторы DcR1 и DcR2 не передают сигнал апоптоза.
В литературе сообщалось о некоторых антителах, которые связываются с рецепторами DR4 и/или DR5. Например, анти-DR4-антитела, направленные на рецептор DR4 и имеющие агонистическую или апоптотическую активность в некоторых клетках млекопитающих, описаны, например, в WO 99/37684, опубликованном 29 июля 1999 года; WO 00/73349, опубликованном 12 июля 2000 года; WO 03/066661, опубликованном 14 августа 2003 года. См. также, например, Griffith et al., J. Immunol., 162:2597-2605 (1999); Chuntharapai et al., J. Immunol., 166:4891-4898 (2001); WO 02/097033, опубликованный 2 декабря 2002 года; WO 03/042367, опубликованный 22 мая 2003 года; WO 03/038043, опубликованный 8 мая 2003 года; WO 03/037913, опубликованный 8 мая 2003 года. Некоторые анти-DR5-антитела были также описаны, см., например, WO 98/51793, опубликованный 8 ноября 1998 года; Griffith et al., J. Immunol., 162:2597-2605 (1999); Ichikawa et al., Nature Med., 7:954-960 (2001); Hylander et al., “An Antibody to DR5 (TRAIL-Receptor 2) Supresses the Growth of Patient Derived Gastrointestinal Tumors Grown in SCID mice”, Abstract, 2d International Congress on Monoclonal Antibodies in Cancers, Aug. 29-Sept. 1, 2002, Banff, Alberta, Canada; WO 03/038043, опубликованный 8 мая 2003 года; WO 03/037913, опубликованный 8 мая 2003 года. Кроме того, были описаны некоторые антитела, имеющие перекрестную реактивность как с рецептором DR4, так и с рецептором DR5 (см., например, Патент США 62252050, выданный 26 июня 2001 года).
В отношении обзора TNF-семейства цитокинов и их рецепторов см. Ashkenazi and Dixit, Science, 281:1305-1308 (1998); Ashkenazi and Dixit, Curr. Opin. Cell Biol., 11:255-260 (2000); Golstein, Curr. Biol., 7:750-753 (1997); Gruss and Dower, выше and Nagata, Cell, 88:355-365 (1997); Locksley et al., Cell, 104:487-501 (2001); Wallac h, “TNF Ligand and TNF/NGF Receptor Families”, Cytokine Research, Academic Press, pages 377-411 (2000).
Рецептор эпидермального фактора роста (EGFR) является членом семейства тирозинкиназы типа 1 рецепторов фактора роста, которые играют решающую роль в клеточном росте, клеточной дифференцировке и клеточном выживании. Активация этих рецепторов обычно происходит посредством связывания специфического лиганда, что приводит к гетеро- или гомодимеризации между членами семейства рецепторов, с последующим автофосфорилированием домена тирозинкиназы. Эта активация запускает каскад внутриклеточных путей передачи сигналов, участвующих как в клеточной пролиферации (путь ras/raf/MAP-киназы), так и в выживании (путь PI3-киназы/Akt). Члены этого семейства, в том числе EGFR и HER2, как предполагалось, непосредственно причастны к клеточной трансформации.
Ряд злокачественных заболеваний человека ассоциированы с отклоняющейся от нормы экспрессией или сверхэкспрессией EGFR и/или сверхэкспрессией его специфических лигандов, например, трансформирующего рост фактора α (Gullick, Br. Med. Bull 1991, 47:87-98; Modijtahedi and Dean, Int. J. Oncol. 1994, 4:277-96; Salomon et al., Crit. Rev. Oncol. Hematol. 195; 19:183-232). Сверхэкспрессия EGFR была ассоциирована с неблагоприятным прогнозом в ряде раковых заболеваний человека, в том числе NSCLC. В некоторых случаях сверхэкспрессия EGFR опухоли коррелировала как с устойчивостью к химическому воздействию, так и с плохим прогнозом (Lei et al., Anticancer Res 1999; 19:221-8; Veale et al., Br J Cancer 1993; 68:162-5).
Сущность изобретения
Данное изобретение обеспечивает способы усиления апоптоза в клетках млекопитающих, предусматривающие контактирование указанных клеток с эффективным количеством агониста рецептора гибели и ингибитора EGFR. Необязательно, агонистом рецептора гибели является полипептид Аро2L/TRAIL.
В других вариантах осуществления обеспечены способы лечения нарушений, таких как рак, у млекопитающего, предусматривающие введение указанному млекопитающему эффективного количества агониста рецептора гибели и ингибитора EGFR.
В следующих вариантах осуществления обеспечены изделия и наборы, содержащие, например, полипептид Аро2L/TRAIL и ингибитор EGFR, применимые для лечения различных патологических нарушений.
В более конкретных вариантах осуществления, но без ограничения ими, обеспечены следующие примерные композиции и способы:
1. Способ усиления апоптоза в одной или нескольких клетках млекопитающего, предусматривающий подвергание указанных клеток действию эффективного количества агониста рецептора гибели и ингибитора EGFR.
2. Способ по п.1, где указанные клетки последовательно подвергают действию агониста рецептора гибели и ингибитора EGFR.
3. Способ по п.1, где указанные клетки подвергают действию ингибитора EGFR перед подверганием действию агониста рецептора гибели.
4. Способ по п.1, где указанный агонист рецептора гибели содержит полипептид Аро2L/TRAIL.
5. Способ по п.1, где указанные клетки одновременно подвергают действию ингибитора EGFR и агониста рецептора гибели.
6. Способ по п.1, где указанным агонистом рецептора гибели является антитело-агонист DR4 или антитело-агонист DR5.
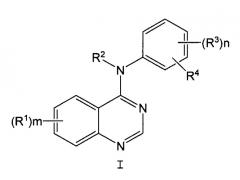
7. Способ по п.1, где указанный ингибитор EGFR имеет общую формулу I
где:
Х означает галоген или гидрокси;
m равно 1, 2 или 3;
каждый R1 независимо выбран из группы, состоящей из водорода, галогена, гидрокси, гидроксиамино, карбокси, нитро, гуанидино, уреидо, циано, трифторметила и -(С1-С4 алкилен)-W-(фенила), где W означает ординарную связь, O, S или NH; или каждый R1 независимо выбран из R9 и С1-С4 алкила, замещенного циано, где R9 выбран из группы, состоящей из R5, -ОR6, -NR6R6, -С(О)R7, -NHOR5, -ОС(О)R6, циано, А и -YR5; R5 означает С1-С4 алкил; R6 означает независимо водород или R5; R7 означает R5, -ОR6 или -NR6R6; А выбран из пиперидино, морфолино, пирролидино, 4-R6-пиперазин-1-ила, имидазол-1-ила, 4-пиридон-1-ила, -(С1-С4 алкилен)(СО2Н), фенокси, фенила, фенилсульфанила, С2-С4 алкенила и -(С1-С4 алкилен)С(О)NR6R6; и Y означает S, SO или SO2; где алкильные радикалы в R5, -ОR6 и -NR6R6 необязательно замещены одним-тремя галогеновыми заместителями и алкильные радикалы в R5, -ОR6 и -NR6R6 необязательно замещены 1 или 2 группами R9, и где алкильные радикалы указанных необязательных заместителей необязательно замещены галогеном или R9, при условии, что два гетероатома не присоединены к одному и тому же атому углерода;
или каждый R1 независимо выбран из -NHSO2R5, фталимидо-(С1-С4)алкилсульфониламино, бензамидо, бензолсульфониламино, 3-фенилуреидо, 2-оксопирролидин-1-ила, 2,5-диоксопирролидин-1-ила и R10-(С2-С4)алканоиламино, где R10 выбран из галогена, -ОR6, С2-С4 алканоилокси, -С(О)R7 и -NR6R6; и где указанные группы R1-NHSO2R5, фталимидо-(С1-С4)алкилсульфониламино, бензамидо, бензолсульфониламино, 3-фенилуреидо, 2-оксопирролидин-1-ил, 2,5-диоксопирролидин-1-ил и R10-(С2-С4)алканоиламино необязательно замещены 1 или 2 заместителями, независимо выбранными из галогена, С1-С4 алкила, циано, метансульфонила и С1-С4 алкокси;
или две группы R1 взяты вместе с атомами углерода, к которым они присоединены, с образованием 5-8-членного кольца, которое включает в себя 1 или 2 гетероатома, выбранных из О, S и N;
R2 обозначает водород или С1-С6 алкил, необязательно замещенный 1-3 заместителями, независимо выбранными из галогена, С1-С4 алкокси, -NR6R6 и -SO2R5;
n равно 1 или 2 и каждый R3 независимо выбран из водорода, галогена, гидрокси, С1-С6 алкила, -NR6R6 и С1-С4 алкокси, где алкильные радикалы указанных групп R3 необязательно замещены 1-3 заместителями, независимо выбранными из галогена, С1-С4 алкокси, -NR6R6 и -SO2R; и
R4 означает азидо или -(этинил)-R11, где R11 означает водород или С1-С6 алкил, необязательно замещенный гидрокси, -ОR6 или -NR6R6.
8. Способ по п.7, где указанным ингибитором EGFR является N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин.
9. Способ по п.7, где указанным ингибитором EGFR является Tarceva™.
10. Способ по п.1, где указанным Аро2L/TRAIL является фрагмент полипептида SEQ ID NO:1.
11. Способ по п.10, где указанный фрагмент Аро2L/TRAIL содержит внеклеточный домен полипептида SEQ ID NO:1.
12. Способ по п.1, где указанным агонистом рецептора гибели является вариант полипептида Аро2L/TRAIL, имеющий по меньшей мере приблизительно 90% идентичность аминокислотной последовательности с внеклеточным доменом SEQ ID NO:1.
13. Способ по п.10, где указанный фрагмент содержит аминокислоты 114-281 SEQ ID NO:1.
14. Способ по п.12, где указанный вариант Аро2L/TRAIL имеет по меньшей мере приблизительно 95% идентичность аминокислотной последовательности с внеклеточным доменом SEQ ID NO:1.
15. Способ по п.13, где указанный фрагмент Аро2L/TRAIL, содержащий аминокислоты 114-281 SEQ ID NO:1, связан с одной или несколькими молекулами полиэтиленгликоля (ПЭГ).
16. Способ лечения пролиферативного нарушения у млекопитающего, предусматривающий введение указанному млекопитающему Аро2L/TRAIL и ингибитора EGFR.
17. Способ по п.16, где указанные Аро2L/TRAIL и ингибитор EGFR вводят одновременно.
18. Способ по п.16, где указанный Аро2L/TRAIL вводят перед указанным ингибитором EGFR.
19. Способ по п.16, где указанный ингибитор EGFR вводят перед указанным Аро2L/TRAIL.
20. Способ по п.1, где указанным пролиферативным нарушением является рак.
21. Способ по п.20, где указанный рак выбран из группы, состоящей из мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака ободочной кишки, колоректального рака и рака поджелудочной железы.
22. Способ по п.21, где указанным раком является рак ободочной кишки, колоректальный рак, мелкоклеточный рак легкого или немелкоклеточный рак легкого.
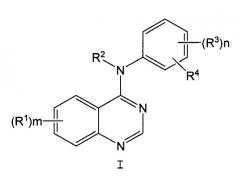
23. Способ по п.16, где указанным ингибитором EGFR является соединение общей формулы I:
где:
Х означает галоген или гидрокси;
m равно 1, 2 или 3;
каждый R1 независимо выбран из группы, состоящей из водорода, галогена, гидрокси, гидроксиамино, карбокси, нитро, гуанидино, уреидо, циано, трифторметила и -(С1-С4 алкилен)-W-(фенила), где W означает ординарную связь, O, S или NH;
или каждый R1 независимо выбран из R9 и С1-С4 алкила, замещенного циано, где R9 выбран из группы, состоящей из R5, -ОR6, -NR6R6, -С(О)R7, -NHOR5, -ОС(О)R6, циано, А и -YR5; R5 означает С1-С4 алкил; R6 означает независимо водород или R5; R7 означает R5, -ОR6 или -NR6R6; А выбран из пиперидино, морфолино, пирролидино, 4-R6-пиперазин-1-ила, имидазол-1-ила, 4-пиридон-1-ила, -(С1-С4 алкилен)(СО2Н), фенокси, фенила, фенилсульфанила, С2-С4 алкенила и -(С1-С4 алкилен)С(О)NR6R6; и Y означает S, SO или SO2; где алкильные радикалы в R5, -ОR6 и -NR6R6 необязательно замещены одним-тремя галогеновыми заместителями и алкильные радикалы в R5, -ОR6 и -NR6R6 необязательно замещены 1 или 2 группами R9, и где алкильные радикалы указанных необязательных заместителей необязательно замещены галогеном или R9, при условии, что два гетероатома не присоединены к одному и тому же атому углерода;
или каждый R1 независимо выбран из -NHSO2R5, фталимидо-(С1-С4)алкилсульфониламино, бензамидо, бензолсульфониламино, 3-фенилуреидо, 2-оксопирролидин-1-ила, 2,5-диоксопирролидин-1-ила и R10-(С2-С4)алканоиламино, где R10 выбран из галогена, -ОR6, С2-С4 алканоилокси, -С(О)R7 и -NR6R6; и где указанные группы R1-NHSO2R5, фталимидо-(С1-С4)алкилсульфониламино, бензамидо, бензолсульфониламино, 3-фенилуреидо, 2-оксопирролидин-1-ил, 2,5-диоксопирролидин-1-ил и R10-(С2-С4)алканоиламино необязательно замещены 1 или 2 заместителями, независимо выбранными из галогена, С1-С4 алкила, циано, метансульфонила и С1-С4 алкокси;
или две группы R1 взяты вместе с атомами углерода, к которым они присоединены, с образованием 5-8-членного кольца, которое включает в себя 1 или 2 гетероатома, выбранных из О, S и N;
R2 означает водород или С1-С6 алкил, необязательно замещенный 1-3 заместителями, независимо выбранными из галогена, С1-С4 алкокси, -NR6R6 и -SO2R5;
n равно 1 или 2 и каждый R3 независимо выбран из водорода, галогена, гидрокси, С1-С6 алкила, -NR6R6 и С1-С4 алкокси, где алкильные радикалы указанных групп R3 необязательно замещены 1-3 заместителями, независимо выбранными из галогена, С1-С4 алкокси, -NR6R6 и -SO2R; и
R4 означает азидо или -(этинил)-R11, где R11 означает водород или С1-С6 алкил, необязательно замещенный гидрокси, -ОR6 или -NR6R6.
24. Способ по п.16, где указанным ингибитором EGFR является N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин.
25. Способ по п.16, где указанным ингибитором EGFR является Tarceva™.
26. Способ лечения раковых клеток, предусматривающий подвергание раковых клеток млекопитающего действию синергического эффективного количества агониста рецептора гибели и ингибитора EGFR.
27. Способ по п.26, где указанным агонистом рецептора гибели является моноклональное антитело против рецептора DR5 или против рецептора DR4.
28. Способ по п.26, где указанным агонистом рецептора гибели является полипептид Аро2/TRAIL.
29. Способ по п.26, где указанные раковые клетки подвергают действию указанного синергического эффективного количества агониста рецептора гибели и ингибитора EGFR in vivo.
30. Способ по п.27, где указанным антителом против рецептора гибели является химерное антитело или гуманизированное антитело.
31. Способ по п.27, где антителом против рецептора гибели является антитело человека.
32. Способ по п.26, где указанным агонистом рецептора гибели является антитело, которое перекрестно реагирует с более чем одним рецептором лиганда Аро-2.
33. Способ по п.26, где указанными раковыми клетками являются клетки рака ободочной кишки, клетки колоректального рака, клетки мелкоклеточного рака легкого или клетки немелкоклеточного рака легкого.
34. Способ по п.26, дополнительно предусматривающий подвергание раковых клеток действию одного или нескольких ингибирующих рост агентов.
35. Способ по п.26, дополнительно предусматривающий подвергание этих клеток действию облучения.
36. Способ по п.27, где указанное анти-DR5-антитело имеет аффинность связывания рецептора DR5 108 М-1 - 1012 М-1.
37. Способ по п.26, где указанный агонист рецептора гибели экспрессируется в рекомбинантной клетке-хозяине, выбранной из группы, состоящей из клетки СНО, клетки дрожжей и E. coli.
38. Способ по п.26, где указанным ингибитором EGFR является Tarceva™.
Краткое описание чертежей
Фиг.1 показывает нуклеотидную последовательность кДНК лиганда Аро-2 человека (SEQ ID NO:2) и ее произведенную аминокислотную последовательность (SEQ ID NO:1). “N” в положении нуклеотида 447 используется для указания, что этим нуклеотидным основанием может быть “T” или “G”.
Фиг.2А и 2В показывают нуклеотидную последовательность кДНК (SEQ ID NO:4) для полноразмерного DR4 человека и ее произведенную аминокислотную последовательность (SEQ ID NO:3). Соответствующие нуклеотидная и аминокислотная последовательности для DR5 человека сообщаются также в Pan et al., Science, 276:111 (1997).
Фиг.3А показывает аминокислотную последовательность из 411 аминокислоты DR5 человека (SEQ ID NO:5), опубликованную в WO 98/51793 19 ноября 1998 года. В данной области известен транскрипционный слайсинговый вариант DR5 человека. Этот сплайсинговый вариант DR5 кодирует аминокислотную последовательность из 440 аминокислот DR5 человека (SEQ ID NO:6), показанную на фиг.3В и 3С, опубликованную в WO 98/35986 20 августа 1998 года.
Фиг.4 показывает соответствующие уровни экспрессии рецепторов (DR4, DR5, EGFR) в клетках Н460 с предобработкой или без предобработки Tarceva™ или Taxol®.
Фиг.5А-5D иллюстрируют действия обработки лигандом Аро-2 и Tarceva™ на различных линиях раковых клеток in vitro.
Фиг.6 иллюстрирует действия обработки лигандом Аро-2 и Tarceva™ на раковых клетках Н460 in vivo.
Подробное описание предпочтительных вариантов
Если нет других определений, предполагается, что все термины данной области и другая научная терминология, используемая здесь, имеют значения, обычно подразумеваемое специалистами с квалификацией в области, к которой относится это изобретение. В некоторых случаях, термины с обычно подразумеваемыми значениями определены здесь для ясности и/или для быстрой ссылки и включение таких определений здесь не должно обязательно пониматься как представляющее существенное отличие от обычно понимаемого в данной области значения. Способы и процедуры, описанные или цитируемые здесь, являются обычно хорошо известными и обычно применяемыми с использованием общепринятой методологии квалифицированными в данной области специалистами, такие как, например, широко применяемые методологии молекулярного клонирования, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual 2nd edition (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. Соответственно, процедуры, включающие в себя применение коммерчески доступных наборов и реагентов, обычно проводят в соответствии с определенными изготовителями протоколами и/или параметрами, если нет других указаний.
Перед описанием данных способов, наборов и их использований должно быть понятно, что это изобретение не ограничивается этой конкретной методологией, этими описанными здесь протоколами, клеточными линиями, видами или родами животных, конструкциями и реагентами, так как они могут, конечно, варьироваться. Должно быть также понятно, что используемая здесь терминология предназначена для цели описания только конкретных вариантов и не предназначена для ограничения объема данного изобретения, который может быть ограничен только прилагаемой формулой изобретения.
Следует отметить, что в данном контексте и в прилагаемой формуле изобретения единственные формы “a”, “аn” и “the” включают в себя и множественные формы, если контекст не диктует ясно другое понимание.
Все упоминаемые здесь публикации включены здесь в качестве ссылки для раскрытия и описания способов и/или материалов, в связи с которыми эти публикации цитируются. Цитируемые здесь публикации приводятся здесь в отношении их раскрытия до даты подачи данной заявки. Ничто здесь не должно рассматриваться как признание того, что авторы этого изобретения не имеют права датировать задним числом эти публикации вследствие более ранней даты приоритета или первой по времени даты изобретения. Кроме того, действительные даты публикации могут отличаться от приведенных дат и требуют независимого подтверждения.
I. Определения
Термины “лиганд Аро-2”, “Apo-2L”, “Apo2L/TRAIL”, “лиганд Apo-2/TRAIL” и “TRAIL” используются здесь взаимозаменяемо для означения полипептидной последовательности, которая включает в себя аминокислотные остатки 114-281, включительно, 95-281, включительно, остатки 92-2181, включительно, остатки 91-281, включительно, остатки 41-281, включительно, остатки 39-281, включительно, остатки 15-281, включительно, или остатки 1-281, включительно, аминокислотной последовательности, показанной на фиг.1 (SEQ ID NO:1), а также биологически активные фрагменты, делеционные, инсерционные или имеющие замены варианты вышеуказанных последовательностей. В одном варианте осуществления, эта полипептидная последовательность содержит остатки 114-281, фиг.1 Аро2L/. Необязательно, чтобы полипептидная последовательность содержала остатки 92-281 или остатки 91-281 фиг.1 (SEQ ID NO:1) Полипептиды Аро-2L могут кодироваться нативной нуклеотидной последовательностью, показанной на фиг.1 (SEQ ID NO:2). Необязательно, кодон, который кодирует остаток Pro119 (фиг.1; SEQ ID NO:2), может быть кодоном “CCT” или “CCG”. Необязательно, эти фрагменты или варианты являются биологически активными и имеют по меньшей мере приблизительно 80% идентичность аминокислотной последовательности, более предпочтительно, по меньшей мере приблизительно 90% идентичность аминокислотной последовательности и, даже более предпочтительно, по меньшей мере приблизительно 95%, 96%, 97%, 98% или 99% идентичность последовательности с любой из вышеуказанных последовательностей. Это определение включает в себя имеющие замены варианты лиганда Аро-2, в которых по меньшей мере одна из их нативных аминокислот заменена другой аминокислотой, например, остатком аланина. Необязательные варианты могут содержать аминокислотную последовательность, которая отличается от полипептидной последовательности лиганда Аро-2 с нативной последовательностью фиг.1 (SEQ ID NO:1) и имеет одну или несколько из следующих аминокислотных замен в положении (положениях) остатков на фиг.1 (SEQ ID NO:1): S96C; S101C; S111C; R170C; K179C. Это определение включает в себя также лиганд Аро-2 с нативной последовательностью, выделенный из источника лиганда Аро-2 или полученный рекомбинантными или синтетическими способами. Лиганд Аро-2 этого изобретения включает в себя полипептиды, называемые лигандом Аро-2 или TRAIL, описанные в WO 97/01633, опубликованном 16 января 1997 года, WO 97/25428, опубликованном 17 июля 1997 года, WO 99/36535, опубликованном 22 июля 1999 года, WO 01/00832, опубликованном 4 января 2001 года, WO 02/09755, опубликованном 7 февраля 2002 года, и WO 00/75191, опубликованном 14 декабря 2000 года. Эти термины используются для означения в общем форм лиганда Аро-2, которые включают в себя мономерные, димерные, тримерные, гексамерные или так называемые олигомерные формы этого полипептида. Все нумерации цитируемых аминокислотных остатков в последовательности Аро-2L используют нумерацию в соответствии с фиг.1 (SEQ ID NO:1), если нет конкретного другого указания. Например, “D203” или “Asp203” означают остаток аспарагиновой кислоты в последовательности, приведенной на фиг.1 (SEQ ID NO:1).
Термин “селективный вариант лиганда Аро-2” относится в данном контексте к полипептиду лиганда Аро-2, который включает в себя одну или несколько мутаций аминокислот в последовательности нативного лиганда Аро-2 и имеет селективную аффинность связывания в отношении либо рецептора DR4, либо рецептора DR5. В одном варианте осуществления, этот вариант лиганда Аро-2 имеет селективную аффинность связывания в отношении рецептора DR4 и включает в себя одну или несколько замен аминокислот в любом из положений 189, 191, 193, 199, 201 или 209 последовательности нативного лиганда Аро-2. В другом варианте осуществления, этот вариант лиганда Аро-2 имеет селективную аффинность связывания в отношении рецептора DR5 и включает в себя одну или несколько замен аминокислот в любом из положений 189, 191, 193, 264, 266, 267 или 269 последовательности нативного лиганда Аро-2.
Предпочтительные селективные варианты лиганда Аро-2 включают в себя одну или несколько мутаций аминокислот и проявляют аффинность связывания в отношении рецептора DR4, которая равна или больше (≥) аффинности связывания лиганда Аро-2 с нативной последовательностью с рецептором DR4, и, даже более предпочтительно, эти варианты лиганда Аро-2 проявляют меньшую аффинность связывания (<) с рецептором DR5, чем аффинность связывания, проявляемая лигандом Аро-2 с нативной последовательностью в отношении DR5. Когда аффинность связывания такого варианта лиганда Аро-2 с рецептором DR4 является приблизительно равной (неизмененной) или большей (увеличенной), в сравнении с лигандом Аро-2 с нативной последовательностью, а аффинность связывания этого варианта Аро-2 с рецептором DR5 является меньшей, или почти элиминированной, в сравнении с лигандом Аро-2 с нативной последовательностью, аффинность связывания этого варианта лиганда Аро-2, для поставленных здесь целей, рассматривается как «селективная» в отношении рецептора DR4. Предпочтительные DR4-селективные варианты лиганда Аро-2 этого изобретения будет иметь по меньшей мере в 10 раз меньшую аффинность связывания в отношении рецептора DR5 (в сравнении с лигандом Аро-2 с нативной последовательностью) и, даже более предпочтительно, будет иметь по меньшей мере в 100 раз меньшую аффинность связывания в отношении рецептора DR5 (в сравнении с лигандом Аро-2 с нативной последовательностью). Соответствующая аффинность связывания варианта лиганда Аро-2 может быть определена и сравнена со свойствами связывания нативного Аро-2L (например, формы 114-281) при помощи анализов ELISA, RIA и/или BIAcore, известных в данной области. Предпочтительные DR4-селективные варианты лиганда Аро-2 этого изобретения будут индуцировать апоптоз по меньшей мере в одном типе клетки млекопитающего (предпочтительно раковой клетке), и такая апоптотическая активность может быть определена известными в данной области способами, такими как анализ с использованием красителей аламарового синего или кристаллического фиолетового. DR4-селективные варианты лиганда Аро-2 могут иметь или могут не иметь измененные аффинности связывания в отношении любого из рецепторов-ловушек для Аро-2L, причем эти рецепторы-ловушки называют в данной области DcR1, DcR2 и OPG.
Следующие предпочтительные селективные варианты лигандов Аро-2 включают в себя одну или несколько аминокислотных мутаций и проявляют аффинность связывания в отношении рецептора DR5, которая равна или больше (≥) аффинности связывания лиганда Аро-2 с нативной последовательностью с рецептором DR5, и, даже более предпочтительно, такие варианты лиганда Аро-2 проявляют меньшую аффинность связывания (<) с рецептором DR4, чем аффинность связывания, проявляемая лигандом Аро-2 с нативной последовательностью в отношении DR4. Когда аффинность связывания такого варианта лиганда Аро-2 с рецептором DR5 является приблизительно равной (неизмененной) или большей (увеличенной), в сравнении с лигандом Аро-2 с нативной последовательностью, а аффинность связывания этого варианта лиганда Аро-2 с рецептором DR4 является меньшей, или почти элиминированной, в сравнении с лигандом Аро-2 с нативной последовательностью, аффинность связывания этого варианта лиганда Аро-2, для поставленных здесь целей, рассматривается как «селективная» в отношении рецептора DR5. Предпочтительные DR5-селективные варианты лиганда Аро-2 этого изобретения будет иметь по меньшей мере в 10 раз меньшую аффинность связывания в отношении рецептора DR4 (в сравнении с лигандом Аро-2 с нативной последовательностью) и, даже более предпочтительно, будет иметь по меньшей мере в 100 раз меньшую аффинность связывания в отношении рецептора DR4 (в сравнении с лигандом Аро-2 с нативной последовательностью). Соответствующая аффинность связывания варианта лиганда Аро-2 может быть определена и сравнена со свойствами связывания нативного Аро-2L (например, формы 114-281) при помощи анализов ELISA, RIA и/или BIAcore, известных в данной области. Предпочтительные DR5-селективные варианты лиганда Аро-2 этого изобретения будут индуцировать апоптоз в по меньшей мере одном типе клетки млекопитающего (предпочтительно раковой клетке), и такая апоптотическая активность может быть определена известными в данной области способами, такими как анализ с использованием красителей аламарового синего или кристаллического фиолетового. DR5-селективные варианты лиганда Аро-2 могут имет