Способ получения замещенных бензофуран-5,6-дикарбонитрилов
Иллюстрации
Показать всеИзобретение относится к способу получения новых замещенных бензофуран-5,6-дикарбонитрилов общей формулы 1:
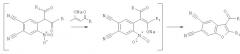
где 1. R=R1=CH3; 2.R=OC2H5, R1=CH3; 3.R=OC2H5, R1=C6H5; 4.R=4-C6H4-CH3, R1=СН3; 5. R=4-С6Н4-ОСН3, R1=CH3; 6. R=4-С6Н4-Сl, R1=CH3; 7. R=2-Tiof, R1=СН3; заключающемуся в том, что 4-бром-5-нитрофталонирил подвергается взаимодействию с натриевыми солями замещенных 1,3-дикарбонильных соединений (натриевые соли замещенных 1,3-дикетонов) при температуре 30-40°С в течение 2-12 ч и мольном соотношении 4-бром-5-нитрофталонитрил:натриевая соль замещенного 1,3-дикетона=1:2, с последующим выливанием реакционной массы в 10 мл холодного раствора 1% соляной кислоты, выделившийся смолистый осадок экстрагируется хлористым метиленом, тщательно промывается водой и хроматографируется на силикагеле, элюент (растворитель) упаривается. Эти соединения могут быть использованы в качестве полупродуктов в синтезе флуоресцентных и биологически активных веществ. Целью изобретения является новый способ синтеза бензофуран-5,6-дикарбонитрилов. 1 табл.
Реферат
Изобретение относится к способу синтеза кислородсодержащих гетероциклических соединений, в частности к получению замещенных бензофуран-5,6-дикарбонитрилов общей формулы
где l. R=R1=СН3;
2. R=ОС2Н5, R1=СН3;
3. R=OC2H5, R1=C6H5;
4. R=4-С6Н4- СН3, R1=СН3;
5. R=4-С6Н4-ОСН3, R1=СН3;
6. R=4-С6Н4-Сl, R,=СН3;
7. R=2-Tiof, R1=СН3;
которые могут быть использованы в качестве полупродуктов в синтезе флуоресцентных и биологически активных веществ.
К заявляемым соединениям относятся:
3-ацетил-2-метил-бензофуран-5,6-дикарбонитрил (1)
этиловый эфир 5,6-дициано-2-метил-бензофуран-3-карбоновой кислоты (2)
этиловый эфир 5,6-дициано-2-фенил-бензофуран-3-карбоновой кислоты (3)
2-метил-3-(4-метилбензоил)-бензофуран-5,6-дикарбонитрил (4)
2-метил-3-(4-метоксибензоил)-бензофуран-5,6-дикарбонитрил (5)
2-метил-3-(4-хлорбензоил)-бензофуран-5,6-дикарбонитрил (6)
2-метил-3-(4-тиофен-2-карбонил)-бензофуран-5,6-дикарбонитрил (7)
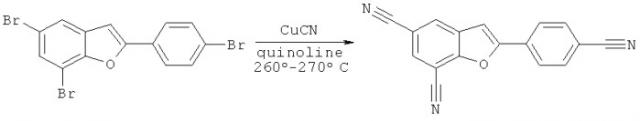
Известен способ получения замещенных бензофурандинитрилов, основанный на замещении атома брома (Br) цианидом меди (CuCN) при кипячении в растворе хинолина в атмосфере азота (R.R.Tidwell, J.D.Geratz, О.Dann, G.Volz, D.Zeh, Hoechst AG Diarylamidine Derivatives with One or Both of the Aryl Moieties Consisting of anIndole or Indole-like Ring, Inhibitors of Arginine-Specific Esteroproteases // J. Med. Chem., 1978, Vol.21, No, 7, p.613-623).
Недостатками известного способа синтеза замещенных бензофурандинитрилов является то, что используемый в качестве реагента цианид меди является токсичным соединением и может загрязнять целевой продукт ионами металла, что не допустимо при использовании бензофурандинитрилов для синтеза фталоцианинов и гексазоцикланов. Также недостатками известного способа синтеза замещенных бензофурандинитрилов является высокая температура реакции (260-270°С), необходимость поддерживать атмосферу инертного газа (азота) и невысокие выходы продуктов реакции.
Также известны способы получения замещенных бензофуранов с другими акцепторными заместителями, основанные, во-первых, на взаимодействии 4-R1-2,6-динитрохлорбензолов с карбанионами β-дикарбонильных соединений (Онысько П.П., Проклина Н.В., Прокопенко В.П., Гололобов Ю.Г. Внутримолекулярное замещение о-нитрогруппы в производных 2,6-динитробензола. // ЖОХ, 1987, Т. 23, вып.3, с.606-610), во-вторых, на основе взаимодействия Х-1-бром-2-йодбензол с β-кетоэфирами с последующим внутримолекулярным формированием связи C-O (Biao Lu, Bao Wang, Yihua Zhang, and Dawei Ma CuI-Catalyzed Domino Process to 2,3-Disubstituted Benzofurans from 1-Bromo-2-Iodobenzenes and β-Keto Esters // J. Org. Chem. 2007, 72, 5337-5341).
Цель изобретения - разработка нового способа синтеза бензофуран-5,6-дикарбонитрилов.
Поставленная цель достигается тем, что в качестве исходных реагентов использовали высокоактивный субстрат 4-бром-5-нитрофталонитрил (БНФН) и натриевые соли 1,3-дикетонов, полученных конденсацией Кляйзена. Взаимодействие указанных реагентов проводят при температуре 30-40°С и мольном соотношении БНФН:натриевая соль 1,3-дикетона=1:2 в течение 2-12 часов в растворе ДМФА и не требует дополнительного использования катализаторов. Затем реакционную массу выливают в 10 мл холодного раствора 1% соляной кислоты. Выделившийся смолистый осадок экстрагируют хлористым метиленом, тщательно промывают водой и хроматографируют на силикагеле. Элюент (растворитель) - хлористый метилен - упаривают, выпавший осадок отфильтровывают и перекристаллизовывают из спирта.
Особенностью данного метода является то, что натриевые соли 1,3-дикетонов использовались не только в качестве реагентов, но и как депротонирующих агентов, поэтому необходим их двукратный мольный избыток. Попытки заменить натриевые соли 1,3-дикетонов другими основаниями (N(C2H5)3, К2СО3, NaOH, CH3ONa) приводили к значительному снижению выхода целевых бензофуранов. В качестве растворителей для проведения данной реакции были использованы ДМСО, ДМФА, ацетонитрил, спирт, однако наилучшие результаты были получены в ДМФА. Необходимо отметить, что при циклизации интермедианта за счет таутомерии двойной связи возможно образование двух изомеров 2-Me или 3-Ac-бензофуранов (4-7), однако реакция протекает стереоселективно и во всех случаях образуется только один изомер. Спектроскопией ЯМР13С было доказано, что метальный заместитель находится в положении 2 (сигнал метильного углерода в области 14-15 м.д.).
где 1. R=R1=CH3;
2. R=ОС2Н5, R1=СН3;
3. R=OC2H5, R1=C6H5;
4. R=4-C6H4- CH3, R1=CH3;
5. R=4-C6H4-OCH3, R1=CH3;
6. R=4-C6H4-Cl, R1=CH3;
7. R=2-Tiof, R1=CH3.
Строение целевых бензофуран-5,6-дикарбонитрилов подтверждено методом ИК-ЯМР Н1, ЯМР С13 спектроскопией и масс-спектрометрией, а чистота продуктов -определением температуры плавления и элементным анализом.
Изобретение иллюстрируется следующими примерами.
Пример 1. 3-Ацетил-2-метил-бензофуран-5,6-дикарбонитрил
К раствору 0,002 моль 4-бром-5-нитрофталонитрила в 3 мл ДМФА прибавляют 0,004 моль натриевой соли 1,3-дикетона и перемешивают при температуре 40°С в течение 2 часов, затем выливают в 10 мл холодного раствора 1% соляной кислоты. Выделившийся смолистый осадок экстрагируют хлористым метиленом, тщательно промывают водой и хроматографируют на силикагеле. Элюент (растворитель) - хлористый метилен - упаривают, выпавший осадок отфильтровывают и перекристаллизовывают из спирта. Получают 0,27 г (61% от теории) 3-ацетил-2-метил-бензофуран-5,6-дикарбонитрила - белый порошок, Тпл. 205-207°С.
Примеры 2-7. Другие бензофуран-5,6-дикарбонитрилы получают аналогично примеру 1. Физико-химические характеристики замещенных бензофуран-5,6-дикарбонитрилов приведены в таблице.
| Пример | R | R1 | Тпл., °С | Выход, % | ЯМР Н1-спектр, δ, м.д., J, Гц | ЯМР С13-спектр, δ, м.д., J, Гц | Масс-спектр m/z | Элементный анализ |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1 | СН3 | СН3 | 205-207 | 61 | 2.66(s., 3Н, Me), 2.87(s., 3H, 2-Me), 8.56(s., 1H, 7-Н), 8.57(s, 1H, 4-Н) | 15.27 (2-Me), 30.75 (3-Ac), 109.67 (C-6), 110.13, 115.99, 116.11 (C≡N), 116.87 (C≡N), 117.72 (4-C), 127.74 (7-C), 130.19 (C-3'), 152.86 (С-7'), 168.09 (C-2), 192 (C=O) | Найдено, % С 69.46; H 3.65;N 12.46. Вычислено, % С 69.64%; Н 3.60; N 12 C13H8N202 | |
| 2 | ОС2Н5 | СН3 | 129-132 | 56 | 1.39 (t., 3H, J=7.0, Et), 2.83 (s., 3H, 2-Me), 4.40 (q, 2H, J=7.0, -CH2-)8.45 (s., 1H, 7-H), 8.62 (s, 1H,4-H). | 13.96 (Et), 14.22 (2-Me), 60.88 (CH2), 108.71 (C-3), 109.73, 110.11, 115.89 (C≡N), 115.97 (C≡N), 117.85, 127.15, 129.83 (C-3'), 152.98 (C-7'), 161.78 (C=O), 168.97 (C-2) | 254, 226, 209, 181, 152, 126, 105, 99, 75, 43 | Найдено, % С 66.05; Н 4.01, N 10.96. Вычислено, % С 66.14; Н 3.96;N 11.02 C14H10N2O3 |
| 3 | 4-С6Н4-ОСН3 | СН3 | 163-166 | 65 | 2.55 (s., 3H, Me), 3.89 (s., 3H, OMe), 7.07 (d, 2H, J=8.8. H5',H3'), 7.80 (d, 2H, J=8.8, H2' H6'), 8.10 (s, 1H, 7-H), 8.56 (s, 1H, 4-H) | 14,84 (2-Me), 55.70 (OMe), 109.66 (C-5), 109.83 (C-6), 114.21 (C-5', C-3'), 116.25 (C≡N), 116.61 (C≡N), 117.95 (C-7), 127.24 (C-4), 130.16 (C-3a), 131.80 (С-2',С-6'), 131.52 (С-1'), 153.43 (C-7a), 163.69 (C-4'), 165.62 (C-2), 187.80 (C=O) | 316, 301, 285, 273, 209, 135, 126, 107, 92, 77, 64, 50. 43 | Найдено, % С 71.95, Н 3.91, N 8.74, Вычислено, % С 72.15, Н 3.82,N 8.86 C19H12N203 |
| 4 | 4-C6H4-СН3 | CH3 | 195-198 | 60 | 2.47(s., 3H, Me'), 2.54 (s., 3Н, 2-Ме), 7.37 (d, 2Н, J=8.0. Н5', Н3'), 7.70 (d, 2Н, J=8.0, Н2', Н6'), 8.09 (s, 1H, 7-Н), 8.54 (s, 1Н, 4-Н) | Найдено, % С 75.87, H 4.08, N 9.25 Вычислено, % С 75.99, Н 4.03, N 9.33, C19H12N202 | ||
| 5 | 4-С6Н4-Cl | СН3 | 208-210 | 59 | 2.55 (s., 3Н, Me), 7.60 (d, 2H,J=8.1. Н5', Н3'), 7.83 d, 2H, J=8.1, H2', Н6'), 8.16 (s, 1Н, 7-Н), 8.56 (s, 1Н, 4-Н) | Найдено, % С 67.36, Н 2.90, N 8.69, Вычислено, % С 67.41, Н 2.83, N 8.73, C18H9ClN2O2 | ||
| 6 | 2-Tiof | СН3 | 170-174 | 53 | 2.68 (s., 3Н, 2-Ме), 7.26 (t, 1 Н, J=3.6, J=4.8, Н-4'), 7.78 (d, 1Н, J=3.6.,H3'), 8.11 (d, 1H, J=4.8, H5'), 8.20 (s, 1H, 7-H), 8.55 (s, 1H, 4-H) | 292, 276, 263, 259, 247, 231, 209, 180, 152, 126, 121, 101, 91, 83, 75,45 | Найдено, % С 65.57, Н 2.89, N 9.44 Вычислено, % С 65.74, Н 2.76, N 9.58. C16H8N2O2S | |
| 7 | ОС2Н5 | С6Н5 | 187-190 | 69 | 1.34(t., 3Н, J=7.0, Et), 2.83(s., 3H, 2-Ме), 4.38(q, 2Н, J=7.0, -CH2), 7,58(t, 2H, J=7.7, Ph), 7.64(t, 1Н, J=7.7, Ph), 8.00(d, 2H, J=7.7, Ph), 8.52(s., 1H, 7-H), 8.66(s, 1H, 4-H) | 13.76(Et), 61.23 (CH2), 108.56, 110.28, 110.42, 115.90 (C≡N), 116.03 (C≡N), 118.31, 127.02, 128.34, 128.44, 129.56, 130.78, 131.78, 153.16, 161.39(C=O), 164.21 (C-2) | 244(M+-COOC2H5), 215, 188, 136, 107, 105,94, 88, 77, 63, 51,43 | Найдено, % С 71.93, H 4.04, N 8.62 Вычислено, % С 72.15, H 3.82, N 8.86 C19H12N2O3 |
Способ получения замещенных бензофуран-5,6-дикарбонитрилов общей формулы где 1.R=R1=СН3;
2. R=OC2H5, R1=СН3;
3. R=ОС2Н5, R1=С6Н5
4. R=4-С6Н4-СH3, R1=СН3;
5. R=4-С6Н4-ОСН3, R1=СН3;
6. R=4-С6Н4-Сl, R1=СН3;
7. R=2-Tiof, R1=СН3;заключающийся в том, что 4-бром-5-нитрофталонирил подвергается взаимодействию с натриевыми солями замещенных 1,3-дикарбонильных соединений (натриевые соли замещенных 1,3-дикетонов) при температуре 30-40°С в течение 2-12 ч и мольном соотношении 4-бром-5-нитрофталонитрил: натриевая соль замещенного 1,3-дикетона=1:2, с последующим выливанием реакционной массы в 10 мл холодного раствора 1%-ной соляной кислоты, выделившийся смолистый осадок экстрагируется хлористым метиленом, тщательно промывается водой и хроматографируется на силикагеле, элюент (растворитель) упаривается, выпавший осадок отфильтровывается и перекристаллизовывается из спирта.