Соединения с медицинскими эффектами, обусловленными взаимодействием с рецептором глюкокортикоидов
Иллюстрации
Показать всеИзобретение относится к соединениям, имеющим строение согласно формуле I, где: Х атом азота или углерода; Аr представляет собой фенил или гетероароматический цикл, выбранный из пиразолила, фуранила, тиофенила и изоксазолила; R1 представляет собой водород, галоген, CN или (C1-С4)алкил; R2 представляет собой галоген или необязательно фторированный 1-3 атомами фтора (С1-С3)алкокси; R3 и R5 независимо представляют собой водород, (С1-С4)алкил, (С1-С4)алкокси, (С1-С4)алкенил или гидроксилметил; R4 представляет собой водород, галоген, необязательно фторированный (C1-С4)алкокси или арил(С1-С4)алкокси; R6 представляет собой водород, необязательно фторированный (С1-С4)алкил; каждый R7 независимо представляет собой водород, галоген, необязательно фторированный (C1-С4)алкил или необязательно фторированный 1-3 атомами фтора (C1-С4)алкокси; или к их фармацевтически приемлемым кислотно-аддитивным солям. Также изобретение относится к применению соединений формулы (I) в фармацевтической композиции и для получения лекарственного средства, предназначенных для лечения, цель которого состоит в изменении уровня активности вторичного сигнала после активации рецептора глюкокортикоидов. Технический результат - соединения формулы I для изменения уровня активности вторичного сигнала после активации рецептора глюкокортикоидов. 3 н. и 4 з.п. ф-лы.
Реферат
Настоящее изобретение относится к соединениям, взаимодействующим с рецептором глюкокортикоидных стероидов, и к применению этих соединений для лечения расстройств, связанных со стрессом, депрессии и тревоги.
В организме рецептор глюкокортикоидов (GR) участвует во множестве функций, главным образом тех, которые являются прямым следствием опыта угрожающих и/или опасных событий. В частности, агонисты GR можно использовать для модулирования иммунного ответа. Рецепторы GR также присутствуют в центральной нервной системе, в ткани которой их роль труднее связать с конкретными физиологическими функциями. Тем не менее, сообщалось, что антагонисты полезны в лечении депрессии. Большинство соединений, которые сделаны доступными для терапевтических вмешательств, направленных на рецептор глюкокортикоидов, имеют стероидный скелет, вследствие чего их труднее синтезировать, чем нестероидные соединения, и они нередко менее специфичны в отношении рецептора GR по сравнению с другими хорошо известными ядерными рецепторами, такими как рецептор прогестерона, рецептор андрогенов, рецептор минералокортикоидов или рецептор эстрогенов.
Преимущества заключаются в том, что такие соединения легче синтезировать, и они могут иметь меньше побочных эффектов.
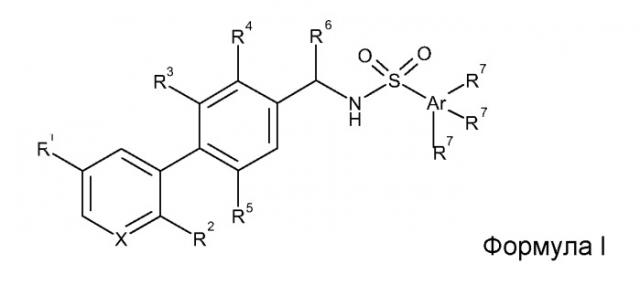
Таким образом, настоящее изобретение делает доступными соединения, чье строение соответствует формуле I
,
где:
X представляет собой атом азота или углерода;
Ar представляет собой бензольный или гетероароматический цикл;
R1 представляет собой водород, галоген, CN или (C1-C4)алкил;
R2 представляет собой водород, галоген или необязательно фторированный (C1-C3)алкокси;
R3 и R5 независимо представляют собой водород, необязательно галогенированный (C1-C4)алкил, необязательно галогенированный (C1-C4)алкокси, необязательно галогенированный арил(C1-C4)алкокси, необязательно галогенированный (C2-C4)алкенил или гидроксилметил;
R4 представляет собой водород, галоген, необязательно галогенированный (C1-C4)алкокси или необязательно галогенированный арил(C1-C4)алкокси;
R6 представляет собой водород, бензил, необязательно замещенный одним галогеном и более, или (C1-C4)алкил,
или R6 представляет собой необязательно галогенированный (C1-C4)алкил; в более конкретном варианте осуществления R6 представляет собой водород или необязательно галогенированный (C1-C4)алкил;
каждый R7 независимо представляет собой водород, галоген, необязательно галогенированный (C1-C4)алкил или необязательно галогенированный (C1-C4)алкокси;
и его фармацевтически приемлемые аддитивные соли.
Другим вариантом осуществления является соединение, определенное выше, за исключением следующего:
Ar представляет собой тиазол, тиофен, изоксазол, фуран или 1H-пиразол;
R1 представляет собой водород, галоген, CN или метил, где предпочтительными галогенами являются фтор или хлор;
R2 представляет собой водород, галоген или необязательно фторированный (C1-C2)алкокси, где предпочтительным галогеном является хлор;
R3 и R5 независимо представляют собой водород, (C1-C3)алкил, бензилокси, (C2-C3)алкенил, гидроксилметил или необязательно фторированный метокси;
R4 представляет собой водород, F, Cl или метокси, и по меньшей мере один из R3, R4 и R5 является водородом;
R6 представляет собой водород или метил;
каждый R7 независимо представляет собой водород, необязательно фторированный метил, необязательно фторированный метокси, F, Cl, бром или циано;
или его фармацевтически приемлемая аддитивная соль.
Другой более специфичный вариант осуществления относится к соединению, которое определено формулой 1, где:
X представляет собой атом азота или углерод;
Ar представляет собой бензольный или гетероароматический цикл;
R1 представляет собой галоген, CN или (C1-C4)алкил;
R2 представляет собой галоген или необязательно фторированный (C1-C3)алкокси;
R3 и R5 независимо представляют собой водород, необязательно галогенированный (C1-C4)алкил, необязательно галогенированный (C1-C4)алкокси, необязательно галогенированный арил(C1-C4)алкокси, необязательно галогенированный (C2-C4)алкенил или гидроксилметил;
R4 представляет собой водород, галоген, необязательно галогенированный (C1-C4)алкокси или необязательно галогенированный арил(C1-C4)алкокси;
по меньшей мере один из R3, R4 или R5 является водородом;
R6 представляет собой водород или метил;
каждый R7 независимо представляет собой галоген, необязательно галогенированный (C1-C4)алкил или необязательно галогенированный (C1-C4)алкокси;
или его фармацевтически приемлемая аддитивная соль.
Использованные термины имеют следующее значение:
Префиксы (C1-C3) или (C1-C4) и так далее имеют обычное значение, ограничивая значение указанной группы до группы, состоящий из 1-3, 1-4 и так далее атомов углерода.
Алкил представляет собой разветвленную или неразветвленную алкильную группу, имеющую 1-6 атомов углерода.
Примеры (C1-C6)алкильных групп включают метил, этил, пропил, изопропил, бутил и третичный бутил.
Алкенил представляет собой разветвленную или неразветвленную алкенильную группу. Примеры (C2-C3)алкенильных групп включают этенил, 1-пропенил и 2-пропенил.
Гетероароматический цикл представляет собой кольцевую структуру с циркулярной делокализованной системой связей, содержащую по меньшей мере один атом азота, кислорода или серы, например пиридил, тиазол, тиофен, изоксазол, фуран, 1Н-пиразол, тиадиазолил, тиенил.
«Галогенированный» означает, что в группе находится один заместитель-галоген и более, например CF3 является галогенированным метилом.
Галоген представляет собой фтор, хлор, бром или йод.
Термин «фармацевтически приемлемая соль» относится к тем солям, которые являются, применительно к введению фармацевтического состава людям или животным, подходящим для применения с точки зрения безопасности и отсутствия раздражения, аллергических реакций и тому подобного, и имеют соразмерное отношение польза/риск. Фармацевтически приемлемые соли известны в данной области техники. Они могут быть получены во время заключительного выделения и очистки соединений по изобретению или отдельно посредством реакции свободного основания с подходящей неорганической кислотой, такой как хлористо-водородная кислота, фосфорная кислота или серная кислота, или с органической кислотой, такой как аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и тому подобное. Кислое соединение может реагировать с органическим или неорганическим основанием, например гидроксидом натрия, гидроксидом калия или гидроксидом лития.
Соединения по изобретению могут использоваться в лечении, которое направлено на изменение уровня активности вторичного сигнала после активации рецептора глюкокортикоидов, главным образом за счет своего действия, вмешивающегося в естественное действие активации рецептора глюкокортикоида. Ядерный рецептор является модулятором генома, причем эта модуляция может быть «включена» или «выключена», или ослабляться рецептором, когда он занят соединением, взаимодействующим с рецептором. Такие препараты предназначены для лечения депрессии, тревоги, особо следует упомянуть посттравматическое стрессовое расстройство, и заболеваний, сопровождающихся патологическими нарушениями в системе гипофиз - кора надпочечников, которые проявляются, например, высокими уровнями кортизола в плазме, или заболеваний, при которых имеется патологическая/дисфункциональная активность GR. Ввиду этих применений изобретение также относится к применению соединения по изобретению для изготовления лекарственного препарата для указанного лечения и для лечения указанных заболеваний или симптомов. Специалисту в данной области техники будет ясно, что это применение предусматривает введение терапевтически эффективного количества соединения по изобретению, необязательно в комбинации с другими применимыми лекарственными средствами, больному, который будет подвергаться лечению. Подразумевается, что количество будет выражаться числом молей или массой свободного основания соединения в фармацевтической композиции.
Методы определения связывания рецептора, также как методы определения биологической активности соединений in vitro и in vivo, известны. В качестве метода in vitro биотехнологически экспрессированный рецептор можно привести в контакт с тестируемым соединением и измерить связывание или стимуляцию, или ингибирование функционального ответа. Для измерения связывания может использоваться изолированный цитозоль, содержащий экспрессированный GR. Могут использоваться соединения с радиоактивной или флюоресцентной меткой. В качестве эталонного соединения может использоваться природный гормон или другие соединения, связывающиеся с рецептором. В качестве альтернативы может исследоваться конкурентное связывание. Специфичность рецептора GR можно определить при тестировании соединения по отношению к рецептору не только глюкокортикоидов, но также и по отношению к другим известным рецепторам, таким как рецептор прогестерона, рецептор андрогенов, рецептор минералокортикоидов и/или рецептор эстрогенов.
Для измерения функционального ответа in vitro изолированная ДНК, кодирующая ген рецептора глюкокортикоидов, предпочтительно рецептор человека, экспрессируется в подходящих клетках-хозяевах. Такая клетка может быть клеткой яичника китайского хомячка (CHO), но подходят и другие клетки. Предпочтительно клетки происходят от млекопитающих.
Способы конструирования клеточных линий, экспрессирующих рекомбинантный рецептор глюкокортикоидов, известны в данной области техники. Экспрессия рецептора достигается за счет экспрессии ДНК, кодирующей желаемый белок. Как известно, теперь доступны экспрессионные системы, которые совместимы с самыми разнообразными хозяевами, включая прокариотических хозяев, таких как бактерии, и эукариотических хозяев, таких как дрожжи, растительные клетки, клетки насекомого, клетки млекопитающего, клетки птицы и тому подобное. Затем клетки, экспрессирующие рецептор, контактируют с тестируемым соединением, чтобы наблюдать модуляцию функционального ответа.
В дополнение к прямому измерению содержания мРНК или белка в клетках, подвергнутых воздействию, могут использоваться клетки, которые в дополнение к трансфекции ДНК, кодирующей рецептор, также трансфицированы второй ДНК, кодирующей репортерный ген, экспрессия которого меняется в ответ на связывание рецептора по отношению к чувствительным элементам промотора конкретного репортерного гена. Такие чувствительные элементы могли бы быть классическими элементами, чувствительными к гормонам, известными в данной области техники и описанными в Beato, M, Chalepakis, G, Schauer, M, Slater, EP (1989) J. Steroid Biochem. 5:737-47, или их можно сконструировать таким способом, чтобы они связывались с новыми чувствительными элементами. В целом, экспрессия репортерного гена может контролироваться любым чувствительным элементом, реагирующим на связывание с рецептором глюкокортикоидов. Подходящими репортерными генами являются, например, LacZ, щелочная фосфатаза, люцифераза светлячка и белок зеленой флюоресценции.
Соединения по изобретению могут связываться с рецептором GR
с аффинностью <10-6 M. Более предпочтительно соединения обладают аффинностью связывания <10-7 M и еще лучше 10-8 M.
Квалифицированный специалист признает, что желаемые значения EC50 зависят от тестируемого соединения. Однако соединение, которое имеет более высокий EC50, чем упомянутое выше, но является высокоселективным по отношению к рецептору GR, может быть даже лучшим соединением с позиции ослабления побочных эффектов.
Введению соединения по изобретению очень поможет изготовление фармацевтических композиций. Поэтому настоящее изобретение также относится к фармацевтической композиции, содержащей соединение по изобретению, смешанное с фармацевтически приемлемым наполнителем, таким как наполнители, описанные в Gennaro et al., Remmington: The Science и Practice of Pharmacy, 20th Edition, Lippincott, Williams и Wilkins, 2000; особенно см. часть 5: фармацевтическое производство. Подходящие наполнители сделаны доступными, например, в Handbook of Pharmaceutical Excipients, 2nd Edition; Editors A. Wade и P.J.Weller, American Pharmaceutical Association, Washington, The Pharmaceutical Press, London, 1994. Смеси соединения по настоящему изобретению и фармацевтически приемлемого наполнителя могут быть спрессованы в твердые дозированные единицы, такие как таблетки, или переработаны в капсулы или суппозитории. Для изготовления дозированных единиц, например таблеток, предусмотрено применение обычных добавок, таких как наполнители, красители и полимерные связующие. В целом, может использоваться любая фармацевтически приемлемая добавка, которая не мешает функции активных соединений. Подходящие наполнители, с которыми фармацевтические композиции могут быть приготовлены и введены, включают лактозу, крахмал, целлюлозу и их производные или их смеси, используемые в подходящем количестве. Обычно путь введения будет представлять собой пероральный прием или введение ректального суппозитория. Другие пути введения препаратов, содержащих соединение по изобретению, могут представлять собой инъекции в вены, подкожное или внутримышечное введение.
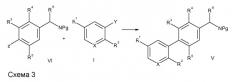
Способы синтеза соединения по настоящему изобретению приведены на схемах ниже и в процедурах, содержащихся в примерах. В каждой из схем группы R и X соответствуют характеру замены, отмеченному в примерах и формуле I. Соединения по настоящему изобретению можно синтезировать, используя методы, известные специалистам в данной области техники.
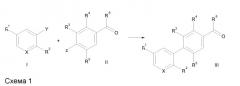
Соединения по настоящему изобретению получают посредством различных реакций кросс-сочетания, опосредованных металлом [Suzuki et al., Chem. Rev., 95: 2457, (1995) и Nicolaou et al. Angew. Chem. Intl. Edn., 44 (29), 4442-4489 (2005)], где реагент I (Y - бороновая кислота, эфир бороновой кислоты, галид, трифлат или другой совместимый партнер сочетания) и реагент II (Z - галид, трифлат, бороновая кислота, эфир бороновой кислоты или другой совместимый партнер сочетания) соединяются, что дает биарилкарбонил, содержащий промежуточные соединения III (схема 1). Реагенты общего строения I и II или имеются в продаже, или их легко получить, используя пути синтеза, которые хорошо документированы в литературе.
Вышеупомянутую реакцию типично проводят путем реагирования подходящего арильного соединения, содержащего бром, йод или трифлат, с производным бороновой кислоты в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0), и основания в растворителе, таком как толуол или диметилформамид.
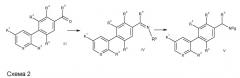
Затем промежуточные биарилкарбонильные производные III превращают в производные биариламинов V через промежуточные производные иминов IV, где R8 - H, арил/алкилсульфинат, простой эфир оксима (схема 2). Реагенты общей формулы III, IV и V или имеются в продаже, или легко доступны посредством способов синтеза, которые хорошо документированы в литературе [Ellman et al., Acc. Chem. Res., 35, 984-995 (2002)].
Соединения общей формулы V также можно получить, начиная с реагентов общей формулы VI и совместимых реагентов общей формулы I, где Y и Z таковы, как указано выше (схема 3). В целом, защищенные азотом производные формулы VI, где, например, NPg - NH2, NHBoc, сульфонамид, фталоил, N-сульфонилимид или имеются в продаже, или легко доступны посредством способов синтеза, которые хорошо документированы в литературе.
Подобные способы также можно использовать для асимметричного синтеза хирального промежуточного соединения типа V посредством, например, восстановления хиральных производных имина типа IV, где R8 = S(O)tBu (энантиомер R или S), как описано Ellman [Ellman et al., Acc. Chem. Res., 35, 984-995 (2002)] (схема 4).
Соединения общей формулы V можно превратить в соединения формулы I по настоящему изобретению с помощью реакции с ацилирующими реагентами, такими как сульфонилхлориды или активированные эфиры сульфокислот (схема 5). Необходимые сульфонилхлориды или активированные эфиры сульфокислот или имеются в продаже, или легко доступны посредством способов синтеза, которые хорошо документированы в литературе.
Вышеупомянутую реакцию типично проводят посредством реакции амина V и арилсульфонилхлорида в растворителе, таком как дихлорметан, и в присутствии органического основания, такого как триэтиламин.
Процедуры синтеза соединений по настоящему изобретению также включают стадии анализа и очистки с использованием таких методов, как колоночная хроматография, флэш-хроматография, тонкослойная хроматография (ТСХ), высокоэффективная жидкостная хроматография (ВЭЖХ), дистилляция и рекристаллизация. Соединения можно охарактеризовать, используя методы, известные в химии, включая спектроскопию ядерного магнитного резонанса (ЯМР) - протонную (1H) ЯМР и ЯМР углерода-13 (13C), инфракрасную (ИК) и ультрафиолетовую (УФ) спектроскопию, элементный анализ, ВЭЖХ и масс-спектроскопию (ЖХМС), удельное вращение ([α]D) и точку плавления (т.пл.).
Некоторые соединения по настоящему изобретению обладают по меньшей мере одним стереогенным атомом углерода, и следовательно, их можно получить в виде чистого энантиомера или диастереомера, или смеси энантиомеров. Способы получения как чистых энантиомеров [Ellman et al., Acc. Chem. Res., 35, 984-995 (2002)], так и рацемических смесей описаны в следующих примерах, то же относится и к хиральной хроматографии рацемической смеси, позволяющей разделить входящие в состав смеси энантиомеры.
Пример 1
[1-(5'-хлор-2'-этоксибифенил-4-ил)этил]амид (R)-5-хлор-1,3-диметил-1H-пиразол-4-сульфоновой кислоты
Суспензию 5-хлор-2-этоксифенилбороновой кислоты (601 мг, 3,0 ммоль), палладия(II) ацетата (33 мг, 0,15 ммоль) и (R)-1-(4-бромофенил)этиламина (295 мг, 1,5 ммоль) в воде (4 мл) нагревали в течение 5 мин до 200°C в высокочастотной электропечи Smithcreator. Реакционную смесь разбавляли дихлорметаном и очищали на StrataTM 5 г/20 мл колонке SCX (элюирование 2M раствором аммиака в метаноле), что дало (R)-1-(5'-хлор-2'-этоксибифенил-4-ил)этиламин (341 мг, 1,2 ммоль, 82%). К раствору 1-(5'-хлор-2'-этоксибифенил-4-ил)этиламина (30 мг, 0,1 ммоль) в дихлорметане (0,75 мл) добавляли триэтиламин (36 мг, 0,35 ммоль) и 5-хлор-1,3-диметил-1H-пиразол-4-сульфонилхлорид (30 мг, 0,13 ммоль) в дихлорметане (0,5 мл). Затем реакционную смесь встряхивали при комнатной температуре в течение 16 ч и гасили уксусной кислотой (200 мкл). Очистка препаративной ЖХМС и удаление растворителя под пониженным давлением давали указанное в заголовке соединение (21 мг, 0,04 ммоль, 40%): 1H ЯМР (400 МГц, ДМСО-d 6): δ 8,25 (д, 1H), 7,32-7,37 (м, 3H), 7,21-7,24 (м, 3H), 7,10 (д, 1H), 4,35 (м, 1H), 4,05 (м, 2H), 2,20 (с, 3H), 1,26-1,35 (м, 6H) м.д.; MS (ESI) m/z: значение [M+H]+.
Пример 2
[1-(2'-метокси-5'-метилбифенил-4-ил)этил]амид (R)-5-хлор-1,3-диметил-1Н-пиразол-4-сульфоновой кислоты
Получали способом, сходным с получением [1-(5'-хлор-2'-этоксибифенил-4-ил)этил]амида (R)-5-хлор-1,3-диметил-1Н-пиразол-4-сульфоновой кислоты (пример 1), используя 2-метокси-5-метилфенилбороновую кислоту и (R)-1-(4-бромфенил)этиламин, что давало (R)-1-(2'-метокси-5'-метилбифенил-4-ил)этиламин, который затем реагировал с 5-хлор-1,3-диметил-1Н-пиразол-4-сульфонилхлоридом. Указанное в заголовке соединение: 1H ЯМР (400 МГц, ДМСО-d 6): δ 8,25 (д, 1H), 7,27 (д, 2H), 7,20 (д, 2H), 7,12 (д, 1H), 7,02 (с, 1H), 6,97 (д, 1H), 4,35 (кв, 1H), 3,72 (с, 3H), 3,55 (с, 3H), 2,28 (с, 3H), 2,20 (с, 3H), 1,33 (д, 3H) м.д.; MS (ESI) m/z: значение [M+H]+.
Пример 3
[1-(2'-трифторметоксибифенил-4-ил)этил]амид (R)-5-метил-2-трифторметилфуран-3-сульфоновой кислоты
Суспензию 2-трифторметоксифенилбороновой кислоты (0,410 г, 2 ммоль), палладия(II) ацетата (22,4 мг, 10 мкмоль) и (R)-1-(4-бромфенил)этиламина (0,200 г, 1 ммоль) в воде (4,5 мл) нагревали в течение 5 мин до 200°C в высокочастотной электропечи Smithcreator. К полученной в результате суспензии добавляли метанол (5 мл), суспензию затем вводили в колонку StrataTM 5 г/20 мл SCX. Примеси вымывали метанолом (5×20 мл) и затем промежуточный амин элюировали 2M раствором аммиака в метаноле (2×20 мл). Растворитель удаляли, что давало (R)-2'-трифторметоксибифенил-4-ил)этиламин в виде маслянистой жидкости. Аликвоту этой маслянистой жидкости (11,2 мг, 40 мкмоль) обрабатывали в течение ночи 5-метил-2-трифторметилфуран-3-сульфонилхлоридом (80 мкмоль, 2 эквивалента) в дихлорметане (1 мл), содержащем диизопропилэтиламин (50 мкл). После этого реакцию гасили, добавляя уксусную кислоту (500 мкл), и желаемый продукт выделяли обращенно-фазовой ВЭЖХ (ZORBAX SB-C18 PrepHT 21,2×100 мм) с элюированием линейным градиентом ацетонитрил/вода (0,1% TFA). Затем фракции, содержащие продукт, выпаривали, что давало указанное в заголовке соединение (13,4 мг) в виде прозрачной стекловидной массы: 1H ЯМР (400 МГц, ДМСО-d 6): δ 8,5 (д, 1H), 7,6-7,4 (м, 4H), 7,3 (с, 4H), 7,1 (с, 1H), 4,5 (м, 1H), 2,33 (с, 3H), 1,38 (д, 3H) м.д.; MS (ESI) m/z: 492,1 [M-H]-.
Пример 4
[1-(5'-фтор-2'-метоксибифенил-4-ил)этил]амид (R)-1,3,5-триметил-1H-пиразол-4-сульфоновой кислоты
Палладия ацетат (56 мг, 0,25 ммоль) добавляли к смеси 5-фтор-2-метоксифенилбороновой кислоты (850 мг, 5,0 ммоль) и (R)-1-(4-бромфенил)этиламина (500 мг, 2,5 ммоль) в воде (20 мл). Эту смесь нагревали в течение 5 мин до 200°C в высокочастотной электропечи Smithcreator и затем разбавляли метанолом (200 мл). Смесь очищали на колонке SCX (20 г), используя 2M раствор аммиака в метаноле, чтобы элюировать промежуточный амин. Выпаривание растворителей при пониженном давлении давало (R)-1-(5'-фтор-2'-метоксибифенил-4-ил)этиламин в виде смолы (580 мг, 2,37 ммоль, 96,6%). Триэтиламин (41,1 мкл, 0,295 ммоль) и 1,3,5-триметил-1H-пиразол-4-сульфонила хлорид (20,5 мг, 0,0984 ммоль) добавляли к раствору (R)-1-(5'-фтор-2'-метоксибифенил-4-ил)этиламина (20 мг, 0,082 ммоль) в дихлорметане (1 мл) и полученный в результате раствор встряхивали в течение ночи. Реакционную смесь промывали насыщенным раствором бикарбоната натрия (500 мкл), слой дихлорметана отделяли, сушили над сульфатом магния и растворитель выпаривали. Очистка препаративной ЖХМС и удаление растворителя при пониженном давлении давали указанное в заголовке соединение (13,8 мг, 0,033 ммоль, 40%): 1H ЯМР (400 МГц, CDCl3): δ 7,37, 7,14 (a/b, 4H), 7,02-6,87 (м, 3H), 4,68 (м, 1H), 4,48 (т, 1H), 3,78 (с, 3H), 3,55 (с, 3H), 2,35 (с, 3H), 2,22 (с, 3H), 1,50 (д, 3H) м.д.; MS (ESI) m/z: 417 [M+H]+.
Пример 5
(R)-3,4-дифтор-N-[1'-(5'-фтор-2'-метоксибифенил-4-ил)этил]бензолсульфонамид
Смесь (R)-1-(4-бромфенил)этиламина (0,10 г, 0,5 ммоль), 5-фтор-2-метоксифенилбороновой кислоты (0,17 г, 1 ммоль) и палладия(II) ацетата (0,011 г, 0,05 ммоль) нагревали в течение 5 мин до 200°C в высокочастотной электропечи Smithcreator. Затем смесь очищали на колонке SCX, промывали дихлорметаном/метанолом и промежуточной амин элюировали, используя 1M раствор аммиака в метаноле (50 мл). Выпаривание растворителей при пониженном давлении давало (R)-1-(5'-фтор-2'-метоксибифенил-4-ил)этиламин. К раствору (R)-1-(5'-фтор-2'-метоксибифенил-4-ил)этиламина (0,25 г, 0,1 ммоль) в дихлорметане (1 мл) добавляли триэтиламин (0,025 г, 0,25 ммоль) и 2,4-дифторфенилсульфонила хлорид (0,043 г, 0,2 ммоль). Раствор перемешивали в течение ночи и затем гасили уксусной кислотой (0,5 мл). Очистка препаративной ЖХМС и удаление растворителя при пониженном давлении давали указанное в заголовке соединение: 1H ЯМР (400 МГц, ДМСО): δ 8,58 (д, 1H), 7,64 (кв, 1H), 7,30-6,98 (м, 9H), 4,44 (дкв, 1H), 3,74 (с, 3H), 1,36 (д, 3H) м.д.; MS (ESI) m/z: значение [M+H]+.
Пример 6
N-(5'-фтор-2,2'-диметоксибифенил-4-илметил)-4-метоксибензолсульфонамид
К перемешиваемому раствору 4-гидрокси-3-метоксибензальдегида (2 г, 14,7 ммоль) в дихлорметане (20 мл) медленно добавляли трифторметансульфоновый ангидрид (4,5 г, 17,64 ммоль) и пиридин (1,5 мл, 14,7 ммоль) при 0°C в атмосфере азота. Раствор перемешивали в течение 16 ч при температуре окружающей среды, добавляли взвесь воды и льда и затем экстрагировали дихлорметаном. Объединенные экстракты сушили над безводным сульфатом натрия, и растворитель выпаривали. Остаток подвергали флэш-хроматографии на силикагеле с элюированием смесью 4:1 гептан/этилацетат и растворитель выпаривали, что давало 4-формил-2-метоксифениловый эфир трифторметансульфоновой кислоты (3,5 г) в виде бесцветной маслянистой жидкости. К перемешиваемому раствору 4-формил-2-метоксифенилового эфира трифторметансульфоновой кислоты (3,5 г, 12,3 ммоль) в тетрагидрофуране (50 мл) добавляли 5-фтор-2-метоксифенилбороновую кислоту, лития хлорид (0,05 г, 1,18 ммоль), 2M натрия карбонат (14 мл) и тетракис(трифенилфосфин)палладий(0) (0,22 г, 0,18 ммоль). Реакционную смесь нагревали в колбе с обратным холодильником в течение 5 дней, затем концентрировали при пониженном давлении. Концентрат растворяли в этилацетате, промывали водой, сушили над сульфатом натрия, и растворитель выпаривали. Остаток подвергали флэш-хроматографии на силикагеле с элюированием смесью 5:1 гептан/этилацетат и растворитель выпаривали, что давало 5'-фтор-2,2'-диметоксибифенил-4-карбальдегид (2,65 г) в виде желтой маслянистой жидкости. К перемешиваемому раствору 5'-фтор-2,2'-диметоксибифенил-4-карбальдегида (2,65 г, 9,16 ммоль) в пиридине (50 мл) добавляли метоксиламина гидрохлорид (0,474 г, 10,1 ммоль) при температуре окружающей среды в атмосфере азота. Реакционную смесь перемешивали в течение 16 ч. После испарения пиридина при пониженном давлении остаток растворяли в дихлорметане, промывали водой и сушили над безводным сульфатом натрия. Испарение растворителя и последующая очистка на колонке SCX при элюировании метанолом давало 5'-фтор-2,2'-диметоксибифенил-4-карбальдегид-O-метилоксим (1,05 г) в виде маслянистой жидкости. Перемешиваемый раствор 5'-фтор-2,2'-диметоксибифенил-4-карбальдегид-O-метилоксима (0,182 г, 0,63 ммоль) и 10% палладия на активированном угле в этаноле (10 мл) и 2M хлористо-водородной кислоты (5 капель) дегазировали при температуре окружающей среды, затем продували водород при атмосферном давлении в течение 16 ч в герметизированном сосуде. После этого реакционную смесь фильтровали через дикалит и выпаривали. Остаток подщелачивали до pH 11 водным раствором натрия карбоната, экстрагировали дихлорметаном и сушили над безводным сульфатом натрия. Выпаривание растворителя давало C-(5'-фтор-2,2'-диметоксибифенил-4-ил)метиламин (0,27 г) в виде смолы. К перемешиваемому раствору C-(5'-фтор-2,2'-диметоксибифенил-4-ил)метиламина в дихлорметане (5 мл) добавляли 4-метоксибензолсульфонила хлорид (0,03 г, 0,12 ммоль) и триэтиламин (0,034 мл, 0,24 ммоль). Реакционную смесь перемешивали в течение 16 ч. Добавляли воду и смесь фильтровали через гидрофобный фильтр, затем подвергали флэш-хроматографии на колонке SCX с элюированием метанолом. Очистка препаративной ЖХМС и удаление растворителя при пониженном давлении давали указанное в заголовке соединение (0,01 г) в виде смолы: MS (ESI) m/z: 432,3 [M+H]+.
Пример 7
4-хлор-N-(2,5'-диметил-2'-метоксибифенил-4-илметил)бензолсульфонамид
Получали способом, сходным со способом получения N-(5'-фтор-2,2'-диметоксибифенил-4-илметил)-4-метоксибензолсульфонамида (пример 6), начиная с 4-формил-2-метилфенилового эфира трифторметансульфоновой кислоты и 2-метил-5-метоксифенилбороновой кислоты. Указанное в заголовке соединение: 1H ЯМР (400 МГц, CDCl3): 7,78-7,81 (д, 2H), 7,46-7,48 (д, 2H), 7,10 (д, 1H), 7,15 (д, 1H), 7,00 (д, 2H), 6,87 (с, 1H), 6,85 (д, 2H), 4,65-4,67 (м, 1H), 4,15-4,2 (д, 2H), 3,71 (с, 3H), 2,31 (с, 3H), 2,06 (с, 3H) м.д.; MS (ESI) m/z: 438,0 [M+Na]+.
Пример 8
(R)-N-{1-[4-(2-этоксипиридин-3-ил)фенил]этил}-2-трифторметоксибензолсульфонамид
К раствору (R)-1-(4-бромфенил)этиламина (1,0 г, 5 ммоль) в метаноле (10 мл) добавляли натрия гидрокарбонат (1,26 г, 15,0 ммоль) и ди-трет-бутилдикарбонат (1,2 г, 5,5 ммоль). Реакционную смесь облучали ультразвуком 4 ч. Растворитель выпаривали и остаток распределяли между этилацетатом и водой. Органическую фазу промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении, что давало трет-бутиловый эфир (R)-[1-(4-бромфенил)этил]карбаминовой кислоты (1,8 г, 6,0 ммоль, 120%) в виде белого твердого вещества. К раствору трет-бутилового эфира (R)-[1-(4-бром-фенил)этил]карбаминовой кислоты (0,73 г, 2,4 ммоль) в 1,2-диметоксиэтане (10 мл) добавляли тетракис(трифенилфосфин)палладий (0,14 г, 0,12 ммоль), 2-хлорпиридин-3-бороновую кислоту (0,77 г, 4,9 ммоль) и 2M натрия карбонат. Реакционную смесь нагревали с обратным холодильником в течение 16 ч и растворитель удаляли при пониженном давлении. Остаток распределяли между этилацетатом и водой. Органическую фазу промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель удаляли при пониженном давлении. Остаток подвергали хроматографии на силикагеле с элюированием смесью 3:1 гептан/этилацетат и растворитель удаляли при пониженном давлении, что давало трет-бутиловый эфир (R)-{1-[4-(2-хлорпиридин-3-ил)фенил]этил}карбаминовой кислоты (0,56 г, 1,7 ммоль, 71%) в виде не совсем белого твердого вещества. Смесь трет-бутилового эфира (R)-{1-[4-(2-хлорпиридин-3-ил)фенил]этил}карбаминовой кислоты (100 мг, 0,3 ммоль), натрия этоксида (61 мг, 0,9 ммоль) и тетрагидрофурана (5 мл) нагревали с обратным холодильником в атмосфере аргона 16 ч. Растворитель выпаривали и остаток очищали хроматографией на колонке SCX (элюирование 2M раствором аммиака в метаноле), что давало (R)-1-[4-(2-этоксипиридин-3-ил)фенил]этиламин (66 мг, 0,27 ммоль, 90%) в виде желтой смолы. К раствору (R)-1-[4-(2-этоксипиридин-3-ил)фенил]этиламина (13 мг, 0,05 ммоль) в дихлорметане (1 мл) добавляли триэтиламин (17 мг, 0,16 ммоль), а затем - 2-(трифторметокси)бензолсульфонила хлорид (17 мг, 0,065 ммоль). Реакционную смесь перемешивали 16 ч и растворитель выпаривали при пониженном давлении. Сырой продукт помещали в диметилсульфоксид (1 мл) и очищали препаративной ЖХМС. Растворитель выпаривали при пониженном давлении, что давало указанное в заголовке соединение (6 мг, 0,013 ммоль, 26%). 1H ЯМР (400 МГц, ДМСО-d 6): δ 8,42 (д, 1H), 8,13 (дд, 1H), 7,81 (дд, 1H), 7,63 (м, 2H), 7,39 (м, 4H), 7,24 (д, 2H), 7,05 (м, 1H), 4,48 (кв, 1H), 4,36 (кв, 2H), 1,35 (д, 3H), 1,29 (т, 3H) м.д.; MS (ESI) m/z: 467 [M+H]+.
Пример 9
N-(2-этокси-2'-метокси-5'-метилбифенил-4-илметил)-2-трифторметоксибензолсульфонамид
Получали способом, сходным со способом получения N-(5'-фтор-2,2'-диметоксибифенил-4-илметил)-4-метоксибензолсульфонамида (пример 6), начиная с 4-формил-2-этоксифенилового эфира трифторметансульфоновой кислоты и 2-метил-5-метоксифенилбороновой кислоты. Указанное в заголовке соединение: MS (ESI) m/z: 500,0 [M+H]+.
Пример 10
[1-(5'-фтор-2'-метоксибифенил-4-ил)этил]амид (R)-2,5-диметилфуран-3-сульфоновой кислоты
Триэтиламин (41,1 мкл, 0,295 ммоль), затем 2,5-диметил-3-фурансульфонила хлорид (19,1 мг, 0,0982 ммоль) добавляли к раствору 1-(5'-фтор-2'-метоксибифенил-4-ил)этиламина (20 мг, 0,082 ммоль) в дихлорметане (1 мл) и полученный в результате раствор встряхивали при комнатной температуре в течение ночи. Реакционную смесь промывали насыщенным раствором бикарбоната натрия (500 мкл) и органическую фазу отделяли, сушили над безводным сульфатом магния и растворитель выпаривали. Сырой продукт очищали препаративной ЖХМС. Растворитель выпаривали при пониженном давлении, что давало указанное в заголовке соединение (3,9 мг, 0,0097 ммоль, 11,8%). 1H ЯМР (400 МГц, CDCl3): δ 7,40, 7,23 (a/b, 4H), 7,05-6,88 (м, 3H), 5,99 (с, 1H), 4,67 (м, 1H), 4,55 (м, 1H), 3,78 (с, 3H), 2,35 (с, 3H), 2,17 (с, 3H), 1,52 (д, 3H) м.д.; MS (ESI) m/z: 426 [M+Na]+.
Пример 11
[1-(5'-фтор-2'-метоксибифенил-4-ил)этил]амид (R)-1-метил-3-трифторметил-1H-пиразол-4-сульфоновой кислоты
Получали способом, сходным со способом получения [1-(5'-фтор-2'-метоксибифенил-4-ил)этил]амида (R)-2,5-диметилфуран-3-сульфоновой кислоты (пример 10), начиная с 1-метил-3-(трифторметил)-1H-пиразол-4-сульфонилхлорида и 1-(5'-фтор-2'-метоксибифенил-4-ил)этиламина. Указанное в заголовке соединение: 1H ЯМР (400 МГц, CDCl3): δ 7,40, 7,16 (a/b, 4H), 7,05-6,88 (м, 3H), 4,89 (м, 1H), 4,60 (т, 1H), 3,80 (с, 3H), 3,72 (с, 3H), 1,52 (д, 3H) м.д.; MS (ESI) m/z: 480 [M+Na]+.
Пример 12
[1-(5'-фтор-2'-метоксибифенил-4-ил)этил]амид (R)-2,5-дихлортиофен-3-сульфоновой кислоты
Получали способом, сходным со способом получения [1-(5'-фтор-2'-метоксибифенил-4-ил)этил]амида (R)-2,5-диметилфуран-3-сульфоновой кислоты (пример 10), начиная с 2,5-дихлор-3-тиофенсульфонила хлорида и 1-(5'-фтор-2'-метоксибифенил-4-ил)этиламина. Указанное в заголовке соединение: 1H ЯМР (400 МГц, CDCl3): δ 7,40, 7,18 (a/b, 4H), 7,05-6,88 (м, 4H), 5,05 (д, 1H), 4,60 (м, 1H), 3,78 (с, 3H), 1,54 (д, 3H) м.д.; MS (ESI) m/z: 482 [M+Na]+.
Пример 13
[1-(5'-фтор-2'-метоксибифенил-4-ил)этил]амид (R)-1,3-диметил-1H-пиразол-4-сульфоновой кислоты
Получали способом, сходным со способом получения [1-(5'-фтор-2'-метоксибифенил-4-ил)этил]амида (R)-2,5-диметилфуран-3-сульфоновой кислоты (пример 10), начиная с 1,3-диметил-1H-пиразол-4-сульфонила хлорид и 1-(5'-фтор-2'-метоксибифенил-4-ил)этиламина. Указанное в заголовке соединение: 1H ЯМР (400 МГц, CDCl3): δ 7,41, 7,20 (a/b, 4H), 7,39 (с, 1H), 7,05-6,88 (м, 3H), 4,70 (д, 1H), 4,55 (м, 1H), 3,78 (с, 3H), 3,69 (с, 3H), 2,33 (с, 3H), 1,52 (д, 3H) м.д.; MS (ESI) m/z: 404 [M+H]+.
Пример 14
{1-[4-(2-метоксипиридин-3-ил)фенил]этил}амид (R)-4-бромтиофен-3-сульфоновой кислоты
2M водный раствор натрия карбоната (3,25 мл, 6,50 ммоль) добавляли к смеси 2-метоксипиридин-3-бороновой кислоты (994 мг, 6,50 ммоль), трет-бутилового эфира (R)-[1-(4-бромфенил)этил]карбаминовой кислоты (650 мг, 2,16 ммоль) и тетракис(трифенилфосфин)палладия(0) (125 мг, 0,108 ммоль) в 1,2-диметоксиэтане (27 мл). Смесь нагревали до 95°C в течение 16 ч в атмосфере азота. Растворитель выпаривали и остаток распределяли между этилацетатом и водой. Органическую фазу дважды промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель выпаривали. Полученную в результате смолу подвергали хроматографии на силикагеле с элюированием смесью гептан/дихлорметан и растворитель выпаривали, что давало трет-бутиловый эфир (R)-{1-[4-(2-метоксипиридин-3-ил)фенил]этил}карбаминовой кислоты (593 мг, 1,71 ммоль, 83,5%) в виде кристаллического твердого вещества. К раствору трет-бутилового эфира (R)-{1-[4-(2-метоксипиридин-3-ил)фенил]этил}карбаминовой кислоты (645 мг, 1,97 ммоль) в дихлорметане (6,45 мл) по каплям добавляли трифторуксусную кислоту (6,45 мл, 86,8 ммоль) в атмосфере азота при 0°C. После перемешивания в течение 1 ч при 0°C растворитель выпаривали. Добавляли метанол (20 мл) и смесь вводили в колонку Strata™ 5 г/20 мл SCX. Промежуточный амин элюировали 2M раствором аммиака в метаноле. Растворитель выпаривали, что давало (R)-1-[4-(2-метоксипиридин-3-ил)фенил]этиламин в виде смолы (425 мг, 1,86 ммоль, 94,6%). Указанное в заголовке соединение затем получали способом, сходным со способом получения [1-(5'-фтор-2'-метоксибифенил-4-ил)этил]амида (R)-2,5-диметилфуран-3-сульфоновой кислоты (пример 10), используя 4-бром-3-тиофенсульфонила хлорид и 1-[4-(2-метоксипиридин-3-ил)фенил]этиламин. Указанное в заголовке соединение: 1H ЯМР (400 МГц, CDCl3): δ 8,17 (д, 1H), 7,56 (д, 1H), 7,41, 7,20 (a/b, 4H), 7,38 (м, 1H ), 6,99-6,92 (м, 2H), 5,27 (д, 1H), 4,60 (м, 1H), 3,97 (с, 3H), 1,54 (д, 3H) м.д.; MS (ESI) m/z: 453 [M+H]+.
Пример 15
N-[2,2,2-трифтор-1-(5'-фтор-2'-метоксибифенил-4-ил)этил]-2-трифторметоксибензолсульфонамид
К раствору 4-бромбензальдегида (3,06 г, 16,5 ммоль) в толуоле (60 мл) добавляли 5-фтор-2-метоксифенилбороновую кислоту (3,10 г, 18,2 ммоль), 2M раствор натрия карбоната (16,5 мл) и тетракис(трифенилфосфин)палладий(0) (1 г, 0,86 ммоль). Раствор нагревали с обратным холодильником в течение 48 ч, затем охлаждали до температуры окружающей среды, промывали водой, насыщенным солевым раствором и сушили над безводным сульфатом натрия. Выпаривание растворителя давало остаток, которые подвергали флэш-хроматографии на силикагеле с элюированием смесью 1:1 этилацетат/гептан. Выпаривание растворителя давало 5'-фтор-2'-метоксибифенил-4-карбальдегид (2,63 г) в виде кристаллического твердого вещества